Перейти к:
Эффективность и безопасность комбинации валсартан+сакубитрил в лечении гипертонической болезни у взрослых: результаты проспективного рандомизированного исследования
https://doi.org/10.30895/2312-7821-2025-504
Резюме
ВВЕДЕНИЕ. Препарат валсартан+сакубитрил (комбинация ингибитора неприлизина и блокатора рецептора ангиотензина II (БРА)) обеспечивает эффективное снижение артериального давления (АД) и имеет потенциал для улучшения метаболических параметров организма. Однако, несмотря на наличие этого класса лекарственных средств в клинических рекомендациях, конкретные условия назначения данного препарата пациентам с артериальной гипертензией четко не определены, что свидетельствует о необходимости его более детального изучения.
ЦЕЛЬ. Оценить эффективность, безопасность, влияние на общие клинические исходы и качество жизни пациентов комбинации валсартан+сакубитрил, применяемой для лечения артериальной гипертонии в амбулаторных условиях.
МАТЕРИАЛЫ И МЕТОДЫ. Открытое проспективное лонгитюдное исследование с активным контролем «Эффективность комбинации валсартан+сакубитрил в лечении гипертонической болезни: результаты проспективного исследования» проведено на базе ГАУЗ ТО «Городская поликлиника № 12» (г. Тюмень) в период с 01.10.2022 по 31.03.2025. На 1 этапе исследования (n=550) период наблюдения — 3 мес., на 2 этапе (n=160) — 1 год. Контроль показателей АД проводили при включении в исследование, в конце 1 этапа, затем через 3, 6, 12 мес. терапии. На 1 этапе пациенты были разделены на 4 группы: ингибитор ангиотензинпревращающего фермента (иАПФ) + диуретик (n=189), иАПФ + блокатор кальциевых каналов (БКК) (n=121), БРА + диуретик (n=119), БРА+БКК (n=121). На 2 этапе пациенты, не достигшие целевого уровня АД ≤140/90 мм рт. ст. (n=160), были рандомизированы в 2 группы: исследовательская (n=80), терапия препаратами валсартан+сакубитрил + диуретик/БКК, и контрольная (n=80), терапия тройной комбинацией БРА+диуретик+БКК или иАПФ+диуретик+БКК.
РЕЗУЛЬТАТЫ. На 2 этапе исследования через 3 мес. терапии доля пациентов, достигших целевого уровня АД, составила 93% в исследовательской группе против 83% в контрольной; через 6 мес. — 94 против 88%, через 12 мес. — 99 против 98% соответственно. Среднесуточные уровни систолического и диастолического давления через 3 мес. лечения также были статистически значимо ниже (p<0,05) в исследовательской группе, чем в контрольной. Применение комбинации валсартан+сакубитрил оказало положительное влияние на снижение пиковых систолического, диастолического, пульсового АД и индекса времени гипертензии (p<0,001). Через 6 мес. различия между группами по уровню снижения всех оцениваемых показателей (по данным суточного мониторирования АД) сохранялись (p<0,001). Только через 12 мес. терапии пациенты в контрольной группе достигли сопоставимого с исследовательской группой снижения оцениваемых показателей, статистически значимые различия между группами не были выявлены. Качество жизни пациентов (оценка по опроснику EQ-5D) через 12 мес. наблюдения было выше в исследовательской группе, чем в контрольной: средний балл 0,82±0,08 против 0,69±0,10 (изменение +0,17 против +0,05; p<0,05). Все выявленные нежелательные реакции при применении комбинации валсартан+сакубитрил были предсказуемыми, различия по частоте прекращения лечения между группами не достигали статистической значимости.
ВЫВОДЫ. Комбинация валсартан+сакубитрил продемонстрировала эффективность и безопасность при лечении гипертонической болезни и может быть рекомендована в качестве второй линии терапии при неэффективности двухкомпонентных схем антигипертензивной терапии первой линии.
Ключевые слова
Для цитирования:
Засорина М.А., Волкова С.Ю. Эффективность и безопасность комбинации валсартан+сакубитрил в лечении гипертонической болезни у взрослых: результаты проспективного рандомизированного исследования. Безопасность и риск фармакотерапии. 2025;13(4):452-466. https://doi.org/10.30895/2312-7821-2025-504
For citation:
Zasorina M.A., Volkova S.Yu. Valsartan+Sacubitril Efficacy and Safety in Hypertensive Disease in Adults: A Prospective Randomised Control Trial. Safety and Risk of Pharmacotherapy. 2025;13(4):452-466. (In Russ.) https://doi.org/10.30895/2312-7821-2025-504
ВВЕДЕНИЕ
Артериальная гипертония (АГ) является одним из наиболее распространенных хронических заболеваний. По данным Всемирной организации здравоохранения, в период с 1990 по 2021 г. распространенность АГ среди взрослых в возрасте 30–79 лет в мире увеличилась с 650 млн до 1,28 млрд человек1. АГ является основным фактором риска развития сердечно-сосудистых заболеваний, инсультов и хронической болезни почек2. Поэтому актуальна разработка эффективных стратегий лечения этого заболевания [1–3].
Стандартные схемы медикаментозного лечения АГ включают различные классы антигипертензивных препаратов: ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов ангиотензина (БРА), диуретики, блокаторы кальциевых каналов (БКК), однако при их применении не всегда удается достичь адекватного контроля артериального давления (АД) или избежать развития нежелательных реакций [3][4]. В связи с этим выбор антигипертензивных средств с учетом индивидуальных особенностей пациентов и их реакции на лечение остается сложной задачей для практикующих врачей [3][4].
В последнее десятилетие внимание медицинского сообщества привлек препарат валсартан+сакубитрил, который представляет собой комбинацию антагониста рецепторов ангиотензина II валсартана и ингибитора нейропептидилитического фермента сакубитрила3. Этот надмолекулярный комплекс обеспечивает эффективное снижение АД и имеет потенциал для улучшения метаболических параметров организма, что делает его перспективной альтернативой традиционным гипотензивным препаратам для пациентов, нуждающихся в контроле АГ [5–7].
Успех в лечении АГ во многом зависит от возможности достижения и удержания АД в целевом диапазоне неопределенно долго, обеспечения приверженности пациента к терапии и контроля развития возможных нежелательных реакций. В амбулаторной практике комбинированный препарат валсартан+сакубитрил позволяет достичь быстрого и стойкого снижения АД [7]. Препарат валсартан+сакубитрил, в число показаний к применению которого входит лечение гипертонической болезни4, в 2024 г. был включен в клинические рекомендации по АГ5 как представитель нового класса антигипертензивных средств (ангиотензиновых рецепторов и неприлизина ингибиторы, АРНИ). Однако условия, при котором АРНИ является препаратом выбора в лечении АГ, в этом документе подробно не описаны, что свидетельствует о необходимости более детального изучения данного препарата, в том числе в российской популяции.
Цель работы — оценить эффективность, безопасность, влияние на общие клинические исходы и качество жизни пациентов комбинации валсартан+сакубитрил, применяемой для лечения артериальной гипертонии в амбулаторных условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование «Эффективность комбинации валсартан+сакубитрил в лечении гипертонической болезни» (открытое проспективное лонгитюдное наблюдение с активным контролем) выполнено на базе ГАУЗ ТО «Городская поликлиника № 12» (г. Тюмень) в период с 01.10.2022 по 31.03.2025. Набор пациентов осуществляли с октября 2022 по март 2024 г. Проведение исследования одобрено этическим комитетом ФГБОУ ВО ТюмГМУ Минздрава России (протокол заседания от 22.05.2024 № 121).
Дизайн исследования. Исследование проводили в 2 этапа: 1 этап — открытое проспективное исследование, длительность 3 мес., 2 этап — рандомизированное перекрестное исследование, длительность 12 мес. Критерии включения на 1 этапе: пациенты, впервые обратившиеся с симптомами АГ к врачу-терапевту или врачу-кардиологу. Критерии невключения на 1 этапе: 1) лица старше 80 лет (в связи с рекомендациями о монотерапии6); 2) пациенты с другими сердечно-сосудистыми заболеваниями (нарушения ритма сердца по типу фибрилляции предсердий, АВ-блокады 2–3-й степени, частые наджелудочковые и желудочковые экстрасистолии, наджелудочковые и желудочковые тахикардии, хроническая неадекватная синусовая тахикардия); 3) установленная ишемическая болезнь сердца (ИБС); 4) хроническая сердечная недостаточность (ХСН) с фракцией выброса левого желудочка <40% (в связи с наличием показаний для применения препарата валсартан+сакубитрил вне рамок лечения АГ).
Всем пациентам выполняли скрининговые исследования при включении в испытание, по истечении 3 мес. терапии (при переводе на 2 этап исследования): 1) сбор анамнеза; 2) объективный осмотр; 3) суточное мониторирование артериального давления, СМАД (полифункциональный монитор «Кардиотехника-07-АД-3») с оценкой среднесуточного систолического (САД) и диастолического (ДАД) артериального давления, пикового САД и ДАД за сутки, пульсового давления, индекса времени гипертензии (методика измерения АД в течение суток: для оценки дневного АД измерения каждые 30 мин., для оценки ночного времени измерения 1 раз в час); 4) анкетирование пациентов о качестве жизни (опросник оценки качества жизни Европейской группы качества жизни EuroQol EQ-5D).
На 1 этапе исследования пациенты получали первую линию стандартной терапии гипертонической болезни согласно клиническим рекомендациям7. Ежемесячно до истечения 1 этапа исследования (3 мес.) пациенты наблюдались у врача-терапевта, дозировку препаратов корректировали по необходимости до максимально возможной. Всего было запланировано два визита после назначения лечения для контроля дневника АД и коррекции дозировок при необходимости, а также для отслеживания нежелательных реакций. По истечении 1 этапа исследования (3 мес.) всем пациентам были проведены скрининговые исследования для выявления лиц, которым необходим переход на вторую ступень терапии и 2 этап исследования.
Критерии включения на 2 этапе: пациенты, не достигшие целевого уровня АД ≤140/90 мм рт. ст. на препаратах первой линии согласно клиническим рекомендациям. Критерии невключения на 2 этапе: 1) аналогичные критериям на 1 этапе; 2) симптоматические (вторичные) артериальные гипертензии; 3) беременность (в том числе планируемая); 4) возраст менее 18 лет; 5) двухсторонний стеноз почечных артерий; 6) непереносимость компонентов комплекса валсартан+сакубитрил; 7) тяжелая почечная (скорость клубочковой фильтрации (СКФ) <15 мл/мин/1,73 м²) и печеночная недостаточность (класс С по классификации Чайлда–Пью).
Критерии исключения на 2 этапе: 1) развитие ИБС (доказанная ангиографически); 2) ХСН (обновление клинических рекомендаций в 2024 г.8); 3) впервые возникшая фибрилляция предсердий; 4) хроническая болезнь почек с СКФ <30 мл/мин/1,73 м².
На 2 этапе исследования пациенты вслепую методом конвертов были рандомизированы в две группы: исследовательская и контрольная. Пациенты в исследовательской группе получали комбинацию валсартан+сакубитрил и диуретик или антагонист кальция. Пациенты в контрольной группе получали стандартную терапию препаратами второй линии лечения гипертонической болезни: иАПФ или БРА + диуретик + антагонист кальция9. Все пациенты ежемесячно наблюдались у врача-терапевта, при необходимости проводили коррекцию дозировки препаратов до максимально возможной. Четырехкомпонентные схемы антигипертензивной терапии не допускались, так как не входили в дизайн исследования. Каждые 3 мес. пациентам проводили скрининговые исследования для выявления лиц, не соответствующих критериям включения.
Характеристика пациентов. В исследование были включены 550 пациентов, впервые обратившихся с АГ и находящихся под амбулаторным наблюдением врача-терапевта и врача-кардиолога (табл. 1, а также табл. 2, опубликована на сайте журнала10).
Таблица 1. Демографические показатели, степени и стадии артериальной гипертензии пациентов с артериальной гипертензией, включенных в исследование (n=550)
Table 1. Demographic profile, degrees and arterial hypertension stages of patients included in the study (n=550)
|
Параметр Parameter |
Значение Value |
|
Общее число пациентов, чел. A total number of patients, pers. |
550 |
|
Мужчины, чел. (%) Men, pers. (%) |
219 (40) |
|
Женщины, чел. (%) Women, pers. (%) |
331 (60) |
|
Средний возраст мужчин, лет Mean age in men, years |
49±4 |
|
Средний возраст женщин, лет Mean age in women, years |
53±3 |
|
Средний возраст всей группы на 1 этапе, лет Average group age at stage 1, years |
51±7 |
|
Распределение по возрастным категориям Distribution by age groups 18–39 лет, чел. (%) 18–39 years, pers. (%) |
29 (5,3) |
|
40–60 лет, чел. (%) 40–60 years, pers. (%) |
353 (64,2) |
|
старше 61 г., чел. (%) Older than 61 years, pers. (%) |
168 (30,5) |
|
Уровень систолического артериального давления (САД) до начала исследования, мм рт. ст. Systolic blood pressure prior to the study, mmHg |
150±10 |
|
Уровень диастолического артериального давления (ДАД) до начала исследования, мм рт. ст. Diastolic blood pressure prior to the study, mmHg |
97±6 |
|
Распределение по степени гипертензии Distribution by hypertension grade I степень гипертензии, чел. (%) 1st grade, pers. (%) |
260 (47,3) |
|
II степень гипертензии, чел. (%) 2nd grade, pers. (%) |
167 (30,4) |
|
III степень гипертензии, чел. (%) 3rd grade, pers. (%) |
123 (22,4) |
|
Распределение по стадиям гипертонической болезни Distribution by hypertension stage I стадия, чел. (%) 1st stage, pers. (%) |
367 (66,7) |
|
II стадия, чел. (%) 2nd stage, pers. (%) |
183 (33,3) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Среднесуточный уровень САД до начала исследования составил 150±10 мм рт. ст., среднесуточный уровень ДАД — 97±6 мм рт. ст. Пациенты с 1 степенью АГ — 260 человек, со 2 степенью — 167, с 3 степенью — 123. По результатам обследования пациентов с 1 стадией гипертонической болезни — 367 человека, со 2 стадией — 183 человека. Пациентов с 3 стадией гипертонической болезни и наличием ассоциированных заболеваний в исследование не включали.
Острое нарушение мозгового кровообращения / транзиторная ишемическая атака (ОНМК/ТИА) и сахарный диабет являются ассоциированными заболеваниями при гипертонической болезни, их наличие, как правило, указывает на 3 стадию АГ. Однако в данном исследовании у этих пациентов ранее (до момента включения в исследование) не отмечалось повышения АД. Сахарный диабет 1 типа выявлен у 25% (61 чел.) всех пациентов. Этиология ОНМК/ТИА у всех пациентов была известна: васкулиты — 8 (34,8%) человек, врожденные аневризмы сосудов головного мозга — 7 (30,4%), артериовенозные мальформации — 4 (17,4%), наследственные тромбофилии — 4 (17,4%).
Медикаментозная терапия. На 1 этапе исследования всем пациентам была назначена стандартная терапия артериальной гипертонии11: иАПФ + диуретик получали 189 (35%) человек, иАПФ + БКК — 121 (22%) человек, БРА + диуретик — 119 (21%) человек, БРА + блокатор кальциевых каналов — 121 (22%) человек. Все пациенты получали препараты в виде фиксированной комбинации по одной таблетке. Пациенты также продолжали получать терапию сопутствующей патологии согласно рекомендациям профильных специалистов (табл. 3, опубликована на сайте журнала12).
Группа иАПФ + диуретик: периндоприл+индапамид 2,5+0,625 мг — 18 (3,3%) пациентов, периндоприл+индапамид 5+1,25 мг — 66 (12 %), периндоприл+индапамид 10+2,5 мг — 22 (4%), лизиноприл+индапамид 5+1,5 мг — 11 (2%), лизиноприл+индапамид 10+1,5 мг — 51 (9,3%), лизиноприл+индапамид 20+1,5 мг — 21 (3,8%). Из данной группы исключены 4 человека: 3 случая — возникновение острого коронарного синдрома (ОКС) без подъема сегмента ST, проведение коронароангиографии и диагностирование ангиографически верифицированной ИБС, 1 — впервые выявленная фибрилляция предсердий на фоне тиреотоксикоза, после восстановления ритма пациент наблюдается у эндокринолога до достижения эутиреоза.
На 2 этап исследования из этой группы переведены ввиду недостижения целевого уровня АД при приеме препарата в максимальной терапевтической дозе 12 (2,2%) пациентов, получавших периндоприл+индапамид 10+2,5 мг, и 16 (2,9%) получавших лизиноприл+индапамид 20+1,5 мг.
Группа иАПФ + антагонист кальция: периндоприл+амлодипин 5+5 мг — 10 (1,8%) человек, периндоприл+амлодипин 5+10 мг — 22 (4%), периндоприл+амлодипин 10+5 мг — 12 (2,2%), периндоприл+амлодипин 10+10 мг — 33 (6%), лизиноприл+амлодипин 10+5 мг — 12 (2,2%), лизиноприл+амлодипин 20+10 мг — 32 (5,8%). Из данной группы исключены 5 человек: 2 — возникновение ОКС без подъема сегмента ST, диагностирование ангиографически верифицированной ИБС, 1 — выявление злокачественного образования, длительная госпитализация в онкологический диспансер, полихимиотерапия, 1 человек — летальный исход (не сердечно-сосудистая смерть), 1 человек — летальный исход вследствие острого нарушения мозгового кровообращения.
На 2 этап исследования из этой группы переведены ввиду недостижения целевого уровня АД при приеме препарата в максимальной терапевтической дозе 22 (4%) пациента, получавших периндоприл+амлодипин 10+10 мг, и 28 (5%) — лизиноприл+амлодипин 20+10 мг.
Группа БРА + диуретик: лозартан+гидрохлортиазид 50+12,5 мг — 25 (4,5%) человек, лозартан+гидрохлортиазид 100+25 мг — 33 (6%), валсартан+гидрохлортиазид 80+12,5 мг — 22 (4%), валсартан+гидрохлортиазид 160+25 мг — 39 (7%). Из данной группы исключены 7 человек: 5 — возникновение ОКС без подъема сегмента ST, диагностирование ангиографически верифицированной ИБС, 2 — дебют ревматоидного артрита и длительное отсутствие ремиссии.
На 2 этап исследования из этой группы переведены ввиду недостижения целевого уровня АД при приеме препарата в максимальной терапевтической дозе 24 (4,4%) пациента, получавших лозартан+гидрохлортиазид 100+25 мг, 30 (5,45%) человек — валсартан+гидрохлортиазид 160+25 мг.
Группа БРА + антагонист кальция: лозартан+амлодипин 50+5 мг — 15 (2,7%) человек, лозартан+амлодипин 50+10 мг — 11 (2%), лозартан+амлодипин 100+10 мг — 32 (5,8%), валсартан+амлодипин 80+5 мг — 20 (3,6%), валсартан+амлодипин 80+10 мг — 18 (3,3%), валсартан+амлодипин 160+10 мг — 25 (4,5%). Из данной группы исключены: 3 человека — возникновение ОКС без подъема сегмента ST, диагностирование ангиографически верифицированной ИБС, 3 человека — отзыв добровольного информированного согласия, 1 человек — летальный исход вследствие тромбоэмболии легочной артерии.
На 2 этап исследования из этой группы переведены ввиду недостижения целевого уровня АД при приеме препарата в максимальной терапевтической дозе 20 (4,4%) пациентов, получавших лозартан+амлодипин 100+10 мг, 14 (2,5%) человек — валсартан+амлодипин 160+10 мг.
Всего на 2 этап исследования было переведено 160 человек. Из них 74 (46%) мужчины, средний возраст 51,0±7,8 года, и 86 (54%) женщин, средний возраст 58,0±7,4 года. Из них 23 (14,4%) пациента в возрасте 18–39 лет, 69 (43,1%) — 40–60 лет, 68 (42,5%) — старше 61 года. Пациенты были разделены вслепую методом конвертов на 2 группы (контрольная и исследуемая) по 80 человек в каждой.
В контрольной группе пациенты получали стандартную терапию второй линии лечения АГ согласно клиническим рекомендациям (иАПФ или БРА + диуретик + БКК): амлодипин+индапамид+периндоприл 10+2,5+10 мг или амлодипин+валсартан+гидрохлортиазид 10+25+160 мг. В исследуемой группе пациенты получали терапию препаратом валсартан+сакубитрил 100 мг 2 раза/сут + диуретик или БКК с постепенным увеличением дозы при необходимости до максимально допустимой терапевтической: индапамид 2,5 мг, гидрохлортиазид 25 мг, амлодипин 10 мг. Дозу исследуемых препаратов снижали, если их применение в максимальной терапевтической дозе приводило к развитию серьезных нежелательных реакций.
При переводе на 2 этап исследования среднесуточные уровни АД составляли: в контрольной группе САД 155±12 мм рт. ст., ДАД 96±6 мм рт. ст.; в исследуемой группе САД 154±13 мм рт. ст., ДАД 97±8 мм рт. ст. (p>0,05).
Конечные точки и исходы. Первичными конечными точками 1 этапа считали результаты исследования офисного АД, домашнего мониторирования артериального давления (ДМАД) и СМАД через 3 мес. после начала исследования. Контроль СМАД проводили всем пациентам независимо от показателей офисного АД и ДМАД.
Конечные точки 1 этапа исследования: 1) недостижение индивидуальных целевых уровней АД ≤140/90 мм рт. ст. и/или резистентность к двойной стандартной комбинации; 2) возникновение ХСН и других ассоциированных заболеваний (ИБС, фибрилляция предсердий и другие нарушения ритма сердца, тяжелые ОНМК с потерей функции самообслуживания, хроническая болезнь почек с СКФ <30 мл/мин/1,73 м²); 3) госпитализация в связи с развитием гипертонического криза; 4) достижение критериев исключения; 5) летальный исход (смерть от всех причин; сердечно-сосудистая смерть; внезапная смерть).
Первичными конечными точками 2 этапа исследования считали результаты офисного АД, ДМАД и СМАД через 3, 6 и 12 мес. после начала 2 этапа соответственно. Контроль СМАД проводили всем пациентам независимо от показателей офисного АД и ДМАД.
Конечные точки исследования: 1) аналогичные критериям на 1 этапе; 2) резистентность к комбинации валсартан+сакубитрил; 3) развитие серьезных нежелательных реакций на фоне приема комбинации валсартан+сакубитрил.
Основные исходы: госпитализация по поводу острой сердечной недостаточности, гипертонического криза или смерть от сердечно-сосудистых причин. Вторичные исходы: возникновение ХСН, снижение фракции выброса левого желудочка менее 40% по данным эхокардиографии, развитие ассоциированных с АГ заболеваний и, как следствие, необходимость коррекции терапии, добавление антиангинальных препаратов, бета-адреноблокаторов, неэффективность комбинации валсартан+сакубитрил.
Статистический анализ. Данные пациентов вносили в базу данных в формате Exсel. Соответствие распределения исследуемой выборки закону нормального распределения оценивали согласно критерию Колмогорова–Смирнова. Результаты представлены в виде среднего (М) и стандартного отклонения (SD) в случае нормального распределения количественных признаков. При анализе количественных показателей, имеющих нормальное распределение, в несвязанных группах использовали t-критерий Стьюдента, для показателей, имеющих распределение, отличное от нормального, — критерий Манна–Уитни. Для сравнения связанных переменных применяли критерий Вилкоксона; качественных показателей в несвязанных группах — критерий χ-квадрат и точный критерий Фишера; зависимых данных — критерий МакНимара. При сравнении более двух групп применяли поправку на множественные сравнения Бонферрони. Значимыми считали различия при уровне значимости p<0,05. Статистическую обработку данных проводили с помощью пакета статистических программ IBM SPSS Statistics 26.0.
РЕЗУЛЬТАТЫ
Участники
С октября 2022 по март 2024 г. были отобраны 160 пациентов, нуждающихся в переходе на вторую ступень терапии АГ в связи с недостижением целевого уровня АД. В конце исследования (март 2025 г.) смертельные и несмертельные исходы были известны для всех, кроме 1 пациента, который отозвал согласие. Между группами отсутствовали статистически значимые различия по полу, возрасту, уровню АД, клиническим и лабораторно-инструментальным характеристикам. Продолжительность наблюдения составила 12 мес. в каждой группе (рис. 1).
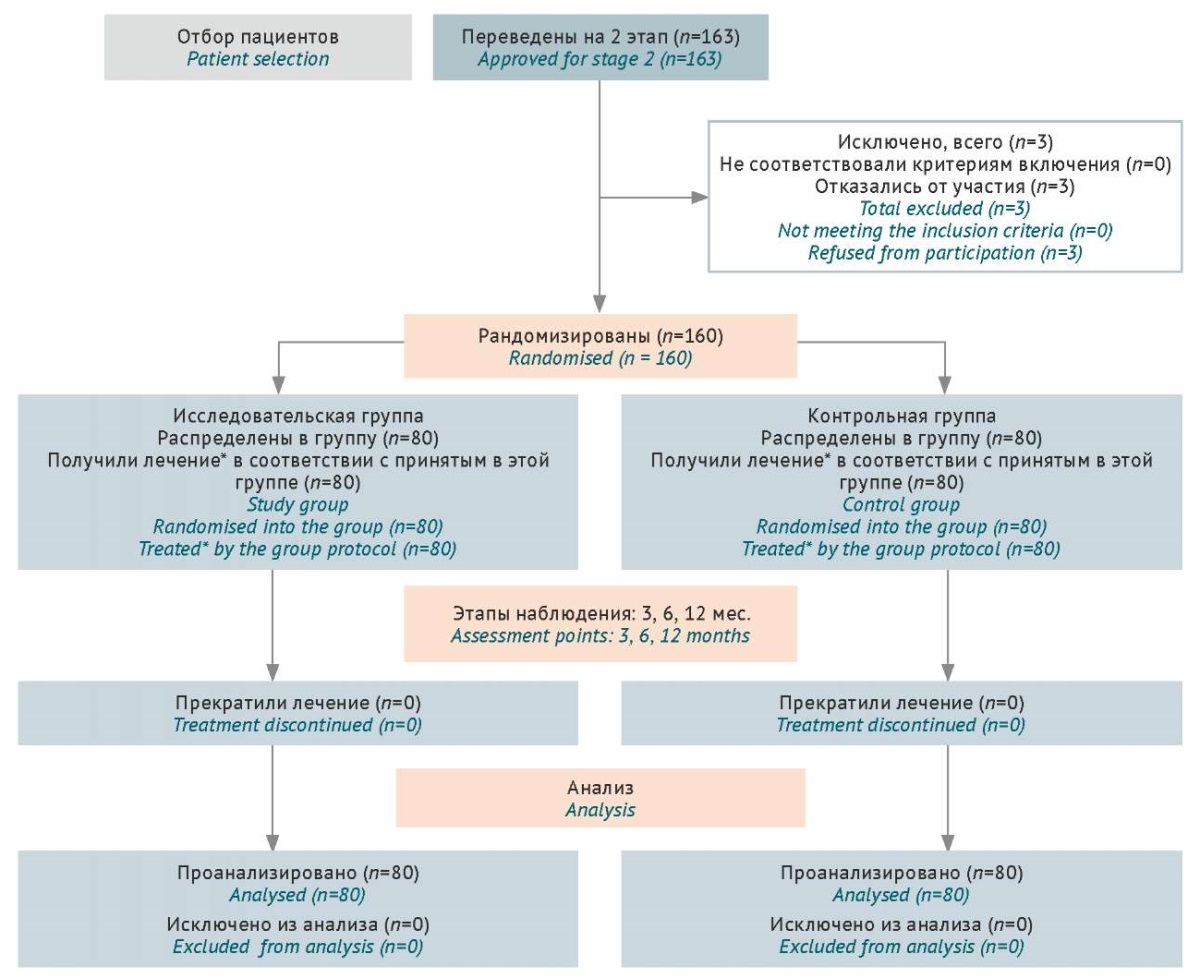
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Дизайн 2 этапа исследования с распределением участников по группам. *Лечение в исследовательской группе: валсартан+сакубитрил + антагонист кальция / диуретик; в контрольной группе: блокатор ренин-ангиотензин-альдостероновой системы + антагонист кальция + диуретик
Fig. 1. Study design for stage 2 with group allocation. *Study group: valsartan+sacubitril + calcium antagonist / diuretic; control group: renin-angiotensin-aldosterone system blocker + calcium antagonist + diuretic
Эффективность
В исследовательской группе у пациентов, получавших препарат валсартан+сакубитрил (n=80), было зафиксировано 6 первичных событий (3 госпитализации по поводу гипертонического криза, 2 госпитализации по поводу острого коронарного синдрома, 1 смерть от сердечно-сосудистых причин), а у пациентов в контрольной группе (n=80) — 9 первичных событий (5 госпитализаций по поводу гипертонического криза, 3 госпитализации по поводу острого коронарного синдрома, 1 смерть от сердечно-сосудистых причин) (p=0,111).
Результаты оценки СМАД показали, что в группе препарата валсартан+сакубитрил целевого уровня АД ≤140/90 мм рт. ст. через 3 мес. терапии достигли 74 (93%) пациента, через 6 мес. — 75 (94%) пациентов, а через 12 мес. у 79 (99%) пациентов достигнут уровень АД <140/90 мм рт. ст., а у 70 (87%) пациентов уровень АД не превышал 130/80 мм рт. ст.
В контрольной группе целевого уровня АД ≤140/90 мм рт. ст. через 3 мес. исследования достигли 66 (83%) пациентов, через 6 мес. — 71 (88%), через 12 мес. — 77 (98%), а у 59 (74%) пациентов уровень АД не превышал 130/80 мм рт. ст. (p<0,05) (рис. 2).

Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Уровень контроля артериального давления в исследовательской (валсартан+сакубитрил + антагонист кальция / диуретик, n=80) и контрольной (блокатор ренин-ангиотензин-альдостероновой системы + антагонист кальция + диуретик, n=80) группах пациентов
Fig. 2. Blood pressure control, test group (valsartan+sacubitril + calcium antagonist / diuretic, n=80) and control group (renin-angiotensin-aldosterone system blocker + calcium antagonist + diuretic, n=80)
Применение комбинации валсартан+ сакубитрил через 3 мес. после начала терапии обеспечило более эффективное снижение среднесуточного САД (в среднем на 20,21±4,25 мм рт. ст., p<0,05) от исходного уровня по сравнению со стандартной гипотензивной терапией в контрольной группе (17,11±3,11 мм рт. ст., p<0,05). При сравнении данных среднесуточного ДАД выявлена аналогичная тенденция: для комбинации валсартан+сакубитрил снижение составило 9,13±1,12 мм рт. ст. (p<0,05), для стандартной терапии — 7,24±1,01 мм рт. ст. (p<0,05) (рис. 3, опубликован на сайте журнала13).
По данным СМАД, пиковое САД в группе валсартан+сакубитрил со 178±15 мм рт. ст. снизилось до 152±10 мм рт. ст. (p<0,001), в то время как в контрольной группе — со 175±15 мм рт. ст. до 157±11 мм рт. ст. (–26±6 мм рт. ст. (p<0,001) и –18±4 мм рт. ст. (p<0,001) соответственно). Пиковое ДАД в группе валсартан+сакубитрил снизилось со 105±15 мм рт. ст. до 94±6 мм рт. ст., а в контрольной группе — со 105±15 мм рт. ст. до 96±5 мм рт. ст. (–11 мм рт. ст. (p<0,001) и –9 мм рт. ст. (p<0,001) соответственно) (рис. 3, опубликован на сайте журнала14).
Разница в среднесуточном пульсовом АД на момент начала исследования составляла 56±15 мм рт. ст. в группе валсартан+сакубитрил и 58±12 мм рт. ст. в контрольной группе (p=0,35). Через 3 мес. исследования разница снизилась до 42±5 мм рт. ст. в группе валсартан+сакубитрил (p<0,05) и 46±4 мм рт. ст. в контрольной группе (p<0,05) (рис. 3, опубликован на сайте журнала15).
Индекс времени гипертензии на момент начала исследования составлял 59±9% в группе валсартан+сакубитрил (p<0,001) и 61±10% в контрольной группе (p<0,001), в том числе ночное время гипертензии 55±9% (p<0,001) и 56±9% (p<0,001) соответственно. Через 3 мес. исследования индекс времени гипертензии снизился до 22±6% (p<0,001) в исследовательской группе и до 27±4% в контрольной (p<0,001), в том числе ночное время гипертензии 12±9% и 15±6% соответственно (p<0,005 для 3 мес. для обеих групп) (рис. 4).
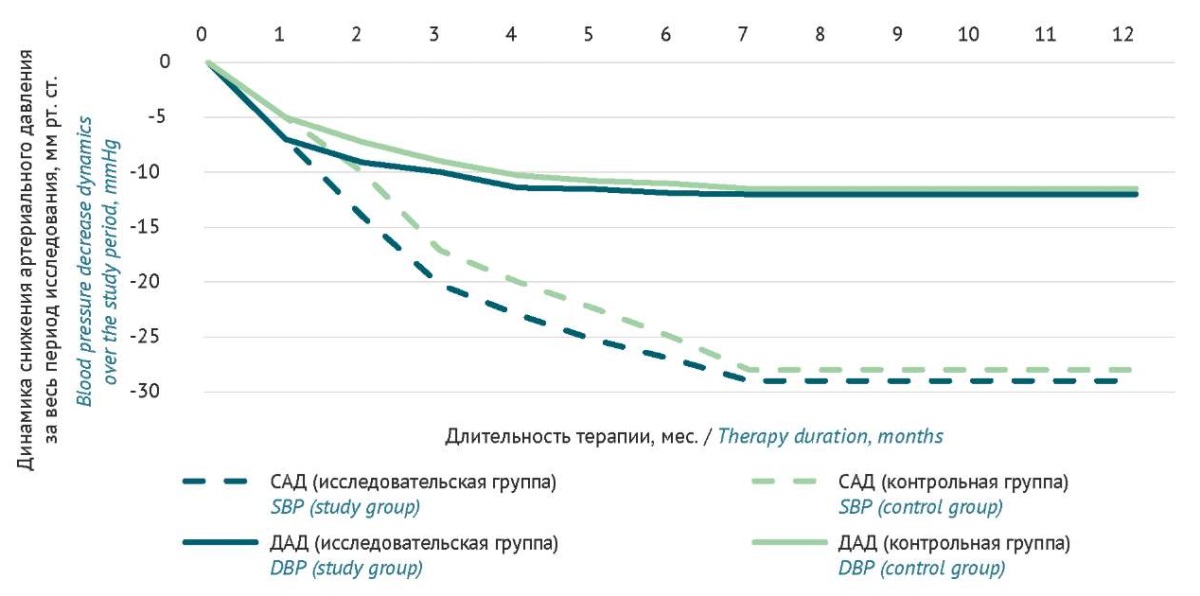
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 4. Параметры суточного мониторинга артериального давления за весь период наблюдения в исследовательской (валсартан+сакубитрил + антагонист кальция / диуретик, n=80) и контрольной (блокатор ренин-ангиотензин-альдостероновой системы + антагонист кальция + диуретик, n=80) группах пациентов. САД — среднесуточное систолическое артериальное давление, ДАД — среднесуточное диастолическое артериальное давление
Fig. 4. Parameters of 24-hour blood pressure monitoring for the entire study period of the test group (valsartan+ sacubitril + calcium antagonist / diuretic, n=80) and control group (renin-angiotensin-aldosterone system blocker + calcium antagonist + diuretic, n=80) of patients. SBP, average 24-hour systolic blood pressure; DBP, average 24-hour diastolic blood pressure
Через 6 мес. после начала 2 этапа исследования разница АД у пациентов в исследовательской и контрольной группах уменьшилась. Среднесуточное САД в группе валсартан+сакубитрил снизилось на 25,3±2,0 мм рт. ст. и составило в среднем 135±11 мм рт. ст. (p<0,001), тогда как в контрольной группе — на 22,4±12,0 мм рт. ст. (среднее значение 137±10 мм рт. ст.) (p<0,001), различие между группами было статистически значимым (p<0,001) (рис. 4 , а также рис. 5, опубликован на сайте журнала16).
Среднесуточное ДАД у пациентов в исследовательской группе снизилось на 11,4±6,0 мм рт. ст., составив в среднем 85±7 мм рт. ст. (p<0,001), тогда как в контрольной группе снижение составило 10,3±7,0 мм рт. ст., среднее значение ДАД составило 86±6 мм рт. ст. (p<0,001); различие также было статистически значимым (p<0,001) (рис. 4 , а также рис. 5, опубликован на сайте журнала17).
Степени снижения пульсового среднесуточного АД, как и суточного пикового ДАД, в группах существенно не различались (p>0,05). Снижение пикового суточного САД в группе валсартан+сакубитрил составило 29±12 мм рт. ст. (p<0,001), в контрольной группе — 26±13 мм рт. ст. (p<0,001), без статистически значимого различия между группами (рис. 5, опубликован на сайте журнала18).
Через 12 мес. после начала 2 этапа исследования статистически значимых различий по результатам оценки СМАД у пациентов в исследовательской и контрольной группах не выявлено (рис. 4, а также рис. 6, опубликован на сайте журнала19).
У пациентов, получавших препарат валсартан+сакубитрил, через 12 мес. отмечено улучшение качества жизни: средний балл по результатам анкетирования по опроснику EQ-5D в исследуемой группе увеличился с 0,65±0,10 до 0,82±0,08 (p<0,001), тогда как в контрольной группе изменения были менее выраженными (с 0,64±0,09 до 0,69±0,10, p<0,001), разница между группами статистически значима (p<0,05) (табл. 4).
Таблица 4. Результаты оценки качества жизни у пациентов по опроснику EQ-5D в исследовательской (валсартан+сакубитрил + антагонист кальция / диуретик, n=80) и контрольной (блокатор ренин-ангиотензин-альдостероновой системы + антагонист кальция + диуретик, n=80) группах
Table 4. Quality of life dynamics in patients according to EQ-5D questionnaire in the study group (valsartan+sacubitril + calcium antagonist/diuretic, n=80) and control group (renin-angiotensin-aldosterone system blocker + calcium antagonist + diuretic, n=80)
|
Временнáя точка Time point |
Группа Group |
Оценка качества жизни, балл (M±SD) Quality of life, scores (M±SD) |
Изменение к исходному уровню, балл Change compared to baseline, scores |
Уровень значимости p Significance, p |
|
|
внутри группы in the group |
между группами between the groups |
||||
|
3 месяца 3 months |
Исследовательская Study group |
0,72±0,09 |
+0,07 (0,65 → 0,72) |
<0,001 |
<0,05 |
|
Контрольная Control group |
0,66±0,10 |
+0,02 (0,64 → 0,66) |
=0,08 |
||
|
6 месяцев 6 months |
Исследовательская Study group |
0,78±0,08 |
+0,13 (0,65 → 0,78) |
<0,001 |
<0,05 |
|
Контрольная Control group |
0,69±0,09 |
+0,05 (0,64 → 0,69) |
<0,01 |
||
|
12 месяцев 12 months |
Исследовательская Study group |
0,82±0,08 |
+0,17 (0,65 → 0,82) |
<0,001 |
<0,05 |
|
Контрольная Control group |
0,69±0,10 |
+0,05 (0,64 → 0,69) |
<0,001 |
||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. M — среднее; SD — стандартное отклонение.
Note. M, mean; SD, standard deviation.
Таким образом, полученные результаты свидетельствуют о статистически значимой эффективности препарата валсартан+сакубитрил в снижении АД и улучшении качества жизни пациентов с АГ по сравнению с эффективностью стандартной терапии в течение первых 3 мес. после начала лечения. Через 6 и 12 мес. наблюдения статистически значимых различий эффективности медикаментозной терапии для снижения АД в исследовательской группах и контрольной не наблюдалось.
Безопасность
После рандомизации на 2 этапе исследования 3 (3,7%) пациента в группе валсартан + сакубитрил и 5 (6,3%) в контрольной группе прекратили прием препарата из-за развития нежелательных реакций (p=0,479).
На заключительном визите (через 12 мес. после начала терапии) 82,0% пациентов, продолжающих лечение в группе валсартан+сакубитрил, принимали препарат в максимальной терапевтической дозе (100 мг 2 раза/сут) по сравнению с 85,1% пациентов в контрольной группе (p=0,449). У пациентов в группе валсартан+сакубитрил чаще наблюдались признаки гипотонии в результате проведенного лечения, чем у пациентов контрольной группы: 4 (5%) человека vs 1 (1,25%) (p=0,059).
Подтвержденных случаев развития аллергических реакций не наблюдалось ни в одной группе пациентов. Наиболее частыми нежелательными реакциями были: головокружение — у 5 (6,25%) пациентов в исследуемой группе и у 4 (5%) в контрольной (p=0,695); головная боль — у 3 (3,75%) пациентов в каждой группе (p=1,0); кашель — у 2 (2%) пациентов в контрольной группе, в то время как в исследуемой группе не отмечен (p=0,5). Все выявленные реакции были предсказуемыми. Во всех случаях развития нежелательных реакций и прекращения терапии различия между группами не достигали статистической значимости.
ОБСУЖДЕНИЕ
На данный момент в доступной литературе не было обнаружено информации о рандомизированных контролируемых исследованиях (РКИ) препарата валсартан+сакубитрил при АГ, имеющих проспективный дизайн, полностью совпадающий с дизайном проведенного исследования. В имеющихся работах основное внимание уделено применению комбинации валсартан+сакубитрил при сердечной недостаточности со сниженной или сохраненной фракцией выброса [5][6]. Во многих исследованиях сравнивают терапию препаратом АРНИ с монотерапией препаратами из групп блокаторов ренин-ангиотензин-альдостероновой системы [8][10][13]. В частности, в рамках изучения сердечной недостаточности терапию препаратом валсартан+сакубитрил рассматривали как альтернативную для пациентов с ХСН со сниженной фракцией выброса, а не как изначальную стратегию контроля АД у пациентов без ХСН [5–7]. Поэтому возможность провести сравнение опубликованных данных с результатами проведенного исследования ограничена.
Тем не менее выявлено несколько статей и метаанализов, посвященных эффективности и безопасности препарата валсартан+сакубитрил в контексте антигипертензивной терапии у пациентов без клинических признаков сердечной недостаточности, в которых дизайн клинических исследований частично сопоставим с дизайном данного исследования.
В проведенном нами исследовании через 3 мес. терапии комбинацией валсартан + сакубитрил 93% пациентов достигли целевого уровня АД ≤140/90 мм рт. ст., что статистически значимо превосходило данный показатель у пациентов контрольной группы (83%). Аналогичные результаты были получены в рандомизированном двойном слепом исследовании D.G. Cheung и соавт. (2018) [8] с участием 376 пациентов с эссенциальной гипертензией, в котором терапия комбинацией валсартан+сакубитрил обеспечила выраженное снижение офисного и амбулаторного среднесуточного САД по сравнению с олмесартаном (p<0,001). В частности, снижение офисного САД через 8 нед. терапии составило –14,2 мм рт. ст. при применении комбинированного препарата против –10,0 мм рт. ст. в группе монотерапии, что свидетельствует о более выраженной гипотензивной активности комбинации валсартан+сакубитрил.
Снижение среднесуточного САД и пиковых значений АД уменьшает риск развития сердечно-сосудистых событий и способствует улучшению прогноза у пациентов с АГ [14]. В проведенном исследовании уровень среднесуточного САД через 3 мес. терапии комбинацией валсартан+сакубитрил снизился на 20,21±4,25 мм рт. ст., что значительно превосходило этот показатель в контрольной группе (17,11±3,11 мм рт. ст.). В исследовании D.G. Cheung и соавт. [8]: снижение амбулаторного САД на фоне применения этой комбинации при эссенциальной гипертензии достигало 4,3 мм рт. ст., а офисного — 14,2 мм рт. ст., что подтверждает ее преимущество для контроля АД по сравнению с другими изученными препаратами.
Особое значение имеет динамика пиковых значений АД: уменьшение степени суточных колебаний АД способствует снижению риска гипертензивных кризов и ишемических осложнений [14]. В проведенном нами исследовании пиковое САД (по данным СМАД) у пациентов, получавших валсартан+сакубитрил, снизилось со 178±15 до 152±10 мм рт. ст., а пиковое ДАД — со 105±15 до 94±6 мм рт. ст. Аналогичные результаты получены B. Williams и соавт. [10] в многоцентровом двойном слепом РКИ, в котором оценивали эффективность АРНИ по сравнению с олмесартаном у 454 пациентов в возрасте ≥60 лет. Снижение пикового САД достигало 12,6 мм рт. ст. (p=0,01), а через 1 год наблюдения разница между группами АРНИ и олмесартана уже не выявлялась, что говорит о стабильности гипотензивного эффекта комбинации валсартан+сакубитрил при длительном применении.
При оценке терапии препаратом валсартан+сакубитрил в проведенном нами исследовании через 3 мес. выявлено значительное снижение пульсового АД и индекса времени гипертензии как в дневное, так и в ночное время (p<0,005), что важно для профилактики развития левожелудочковой гипертрофии и сосудистых осложнений. Полученные данные согласуются с результатами проведенного J.L. Izzo и соавт. [9] многоцентрового двойного слепого исследования с 7 параллельными группами, в котором участвовали 907 пациентов с легкой и умеренной систолической гипертензией. У пациентов, получавших валсартан+сакубитрил, отмечали уменьшение массы левого желудочка, что подчеркивает потенциальную кардиопротективную роль данной комбинации.
Случаев госпитализации по поводу гипертонического криза, острого коронарного синдрома (первичные клинические исходы), а также случаев летального исхода в проведенном исследовании было меньше при применении комбинации валсартан+сакубитрил, чем на фоне стандартной терапии (6 против 9), однако статистическая значимость различий не достигнута (p=0,111). Полученные данные согласуются с результатами других исследований эффективности и безопасности этой комбинации. Так, в рандомизированном двойном слепом перекрестном исследовании сравнительной эффективности комбинации валсартан+сакубитрил и монотерапии валсартаном при АГ у 72 пациентов в течение 4 нед., проведенном T.D. Wang и соавт. [12], частота неблагоприятных исходов в группах была сопоставима. Однако при применении АРНИ наблюдалась тенденция к меньшему количеству таких нежелательных реакций, как головокружение, головная боль, кашель, но результаты не достигли статистической значимости. J.G. Wang и соавт. [13] описали результаты оценки эффективности и безопасности препарата валсартан+сакубитрил в сочетании с амлодипином в сравнении с монотерапией амлодипином в мультицентровом двойном слепом исследовании в параллельных группах с активным контролем с участием 266 пациентов с систолической гипертензией. Через 8 нед. лечения пациенты, получавшие комбинацию валсартан+сакубитрил с амлодипином, отмечали значимое снижение САД по сравнению с группой монотерапии (−13,9 против −0,8 мм рт. ст., p<0,001), а также меньшее количество нежелательных явлений (20,0 против 21,3%, p>0,05).
Безопасность терапии комбинацией валсартан+ сакубитрил, важнейший аспект для клинической практики, также подтверждена в проведенном нами исследовании. Уровень нежелательных реакций в группах препарата валсартан+сакубитрил и стандартной терапии был сопоставим (около 3–6%); наиболее частыми были головокружения и головная боль, характерные для блокаторов ренин-ангиотензин-альдостероновой системы [12, 13]. Важным моментом, выявленным в исследовании, являлось более частое развитие гипотонии у пациентов, получавших валсартан+сакубитрил в максимальной терапевтической дозе, по сравнению с получавшими стандартную терапию (5 против 1,25%), хотя различия не достигли статистической значимости. Эти данные свидетельствует о необходимости мониторинга АД при применении комбинации валсартан+сакубитрил и титрования дозы препарата при начале терапии.
Частота развития нежелательных реакций в проведенном нами исследовании отличается от данных метаанализа Y. Zhang и соавт. [9], обобщившего результаты 9 РКИ с участием 5474 пациентов с эссенциальной гипертензией. При применении препарата валсартан+сакубитрил в дозе 400 мг 1 раз/сут нежелательные явления были выявлены в 20,4% случаев, тогда как при монотерапии олмесартаном (20 мг/сут) — в 33,1%, валсартаном (160 мг/сут) — 54,4%, валсартан+сакубитрил в дозе 200 мг 1 раз/сут — 74,1%. Такие различия могут быть обусловлены большой выборкой РКИ в метаанализе. Отметим, что в ряде исследований валсартан+сакубитрил назначался в максимальной терапевтической дозировке 1 раз/сут, хотя в инструкции по его медицинскому применению рекомендуется его применение 2 раза/сут с постепенной титрацией дозы до максимальной терапевтической20. При этом по данным источника [9] среди нежелательных явлений не были отмечены возникновение кашля и реакций гиперчувствительности, выявленные в других исследованиях. Полученные результаты могут быть связаны как с особенностями популяции пациентов (в 2 из 9 РКИ включали только пожилых пациентов, в остальных возраст пациентов не был указан), так и со стратегией дозирования препарата.
В российской литературе обнаружено только описание результатов РКИ комбинации валсартан+сакубитрил в рамках лечения АГ, проведенного А.С. Рязановым и соавт. [15] на небольшой выборке пациентов. В группу валсартан+сакубитрил (200 мг) были включены 44 пациента, группу валсартана (160 мг) — 46. Снижение офисного САД в группах через 12 мес. терапии составило 14,68±9,33 против 6,17±4,81 мм рт. ст. соответственно (p=0,007). Динамика снижения АД была менее выраженной по сравнению с данными, полученными в проведенном нами исследовании, что может быть обусловлено выборкой пациентов с более низким уровнем АД на момент включения в исследование (офисное АД 156,9±9,42 и 157,1±10,11 соответственно).
Обобщая результаты проведенного исследования и опубликованные результаты РКИ, можно сделать вывод об эффективности комбинации валсартан+сакубитрил в снижении как офисных, так и амбулаторных показателей АД у пациентов с АГ различной степени. Особенно важно, что применение препарата ассоциировано с уменьшением пиковых значений АД (стабилизацией суточных колебаний), которые являются серьезным фактором риска развития сердечно-сосудистых осложнений. Также подчеркнем необходимость индивидуализации терапии: у пациентов с предрасположенностью к гипотонии следует соблюдать осторожность при назначении комбинации в высоких дозах.
В целом результаты проведенного исследования подтверждают и высокую эффективность, и приемлемый профиль безопасности препарата валсартан+сакубитрил как компонента комплексной терапии АГ, особенно у пациентов с высоким риском сердечно-сосудистых событий или недостаточной эффективностью стандартных схем лечения. Их использование может способствовать не только достижению целевых уровней АД, но и снижению риска развития органных повреждений за счет стабилизации суточных колебаний давления и уменьшения пульсового давления.
Необходимо учитывать, что длительность наблюдения в проведенном исследовании ограничена одним годом. Для оценки влияния на сердечно-сосудистую смертность требуется более длительный период наблюдения и крупные популяционные исследования.
ЗАКЛЮЧЕНИЕ
Результаты проведенного проспективного рандомизированного клинического исследования подтвердили эффективность и безопасность комбинации валсартан+сакубитрил, применяемой при лечении АГ. Применение комбинации валсартан+сакубитрил позволило снизить уровень АД и повысить качество жизни пациентов. Эффективность комбинации валсартан+сакубитрил в течение первых 3 мес. после начала лечения статистически значимо превышала эффективность стандартной терапии АГ, проводимой в соответствии с клиническими рекомендациями: БРА или иАПФ + диуретик + БКК. В последующий период наблюдения (до 12 мес.) отмечалось сопоставимое снижение среднесуточных значений САД, ДАД и индекса времени гипертензии у пациентов, получавших комбинацию валсартан+сакубитрил и стандартное лечение. Безопасность препарата валсартан+сакубитрил сопоставима с таковой при стандартной терапии АГ.
Полученные результаты сопоставимы с данными исследований, проведенных за рубежом, и подтверждают целесообразность использования АРНИ в рутинной клинической практике при АГ. Данная терапия может быть рекомендована в качестве второй линии при неэффективности двухкомпонентных схем антигипертензивной терапии первой линии.
Дополнительная информация. Таблицы 2, 3, рисунки 3, 5, 6 размещены на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2025-504-annex
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: М.А. Засорина — концепция работы, написание текста рукописи, формулировка выводов; С.Ю. Волкова — участие в формулировке выводов, утверждение окончательной версии рукописи для публикации.
Соответствие принципам этики. Проведение наблюдательного исследования одобрено локальным этическим комитетом «ФГБОУ ВО ТюмГМУ», г. Тюмень (протокол от 22.05.2024 № 121).
Благодарности. Авторы выражают признательность сотрудникам отделений ГАУЗ ТО «Городская поликлиника № 12», в которых проводился набор пациентов в исследование.
Additional information. Tables 2, 3, and figures 3, 5, 6 are published on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2025-504-annex
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Maria A. Zasorina conceptualised the study, drafted the manuscript, and formulated the conclusions. Svetlana Yu. Volkova participated in formulating the conclusions and approved the final version for publication.
Ethics approval. The protocol of this observational clinical study was approved by the local ethics committee of Tyumen State Medical University, Tyumen (protocol No. 121 of 22.05.2024).
Acknowledgements. The authors express their gratitude to the staff of departments that recruited patients, namely State Autonomous Healthcare Institution of Tyumen Region “City Polyclinic No. 12”.
1. https://www.who.int/ru/news/item/25-08-2021-more-than-700-million-people-with-untreated-hypertension
2. Global Status Report on Noncommunicable Diseases 2014. WHO; 2014. https://www.emro.who.int/noncommunicable-diseases/publications/global-status-report-on-ncds.html
3. Entresto (sacubitril/valsartan). EMA/275352/2023; EMEA/H/C/004062. EMA; 2023.
4. https://grls.rosminzdrav.ru/
5. Артериальная гипертензия у взрослых. Клинические рекомендации. Минздрав России; 2024.
6. Там же.
7. Артериальная гипертензия у взрослых. Клинические рекомендации. Минздрав России; 2020.
8. Артериальная гипертензия у взрослых. Клинические рекомендации. Минздрав России; 2024.
9. Там же.
10. https://doi.org/10.30895/2312-7821-2025-504-annex
11. Артериальная гипертензия у взрослых. Клинические рекомендации. Минздрав России; 2020.
12. https://doi.org/10.30895/2312-7821-2025-504-annex
13. https://doi.org/10.30895/2312-7821-2025-504-annex
14. https://doi.org/10.30895/2312-7821-2025-504-annex
15. https://doi.org/10.30895/2312-7821-2025-504-annex
16. https://doi.org/10.30895/2312-7821-2025-504-annex
17. https://doi.org/10.30895/2312-7821-2025-504-annex
18. https://doi.org/10.30895/2312-7821-2025-504-annex
19. https://doi.org/10.30895/2312-7821-2025-504-annex
20. https://grls.rosminzdrav.ru/
Список литературы
1. Zeng W, Tomlinson B. Options for patients with out-of-control blood pressure: After all avenues have been exhausted. Expert Rev Cardiovasc Ther. 2024;22(9):459–70. https://doi.org/10.1080/14779072.2024.2401875
2. Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: a report of the American College of Cardiology / American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2018;71(19):e127–e248. https://doi.org/10.1016/j.jacc.2017.11.006
3. Yusuf S, Joseph P, Rangarajan S, et al. Modifiable risk factors, cardiovascular disease, and mortality in 155 722 individuals from 21 high-income, middle-income, and low-income countries (PURE): a prospective cohort study. Lancet. 2020;395(10226):795–808. https://doi.org/10.1016/s0140-6736(19)32008-2
4. Jhund PS, Claggett B, Packer M, et al. Independence of the blood pressure lowering effect and efficacy of the angiotensin receptor neprilysin inhibitor, LCZ696, in patients with heart failure with preserved ejection fraction: an analysis of the PARAMOUNT trial. Eur J Heart Fail. 2014;16(6):671–7. https://doi.org/10.1002/ejhf.76
5. Vader JM, Givertz MM, Starling RC, et al. Tolerability of sacubitril/valsartan in patients with advanced heart failure: Analysis of the LIFE trial run-in. JACC Heart Fail. 2022;10(7):449–56. https://doi.org/10.1016/j.jchf.2022.04.013
6. Lund LH, Savarese G, Venkateshvaran A, et al. Eligibility of patients with heart failure with preserved ejection fraction for sacubitril/valsartan according to the PARAGON-HF trial. ESC Heart Fail. 2022;9(1):164–77. https://doi.org/10.1002/ehf2.13705
7. Böhm M, Young R, Jhund PS, et al. Systolic blood pressure, cardiovascular outcomes and efficacy and safety of sacubitril/valsartan (LCZ696) in patients with chronic heart failure and reduced ejection fraction: results from PARADIGM-HF. Eur Heart J. 2017;38(15):1132–43. https://doi.org/10.1093/eurheartj/ehw570
8. Cheung DG, Aizenberg D, Gorbunov V, et al. Efficacy and safety of sacubitril/valsartan in patients with essential hypertension uncontrolled by olmesartan: a randomized, double-blind, 8-week study. J Clin Hypertens (Greenwich). 2018;20(1):150–8. https://doi.org/10.1111/jch.13153
9. Zhang Y, Zhao X, Huang H, Li M. Network meta-analysis of sacubitril/valsartan for the treatment of essential hypertension. Clin Res Cardiol. 2023;112(7):855–67. https://doi.org/10.1007/s00392-022-02120-0
10. Williams B, Cockroft JR, Kario K, et al. Effects of sacubitril/valsartan versus olmesartan on central hemodynamics in the elderly with systolic hypertension: The PARAMETER study. Hypertension. 2017;69(3):411–20. https://doi.org/10.1161/HYPERTENSIONAHA.116.08556
11. Izzo JL Jr, Zappe DH, Jia Y, et al. Efficacy and safety of crystalline valsartan/sacubitril (LCZ696) compared with placebo and combinations of free valsartan and sacubitril in patients with systolic hypertension: The RATIO study. J Cardiovasc Pharmacol. 2017;69(6):374–81. https://doi.org/10.1097/FJC.0000000000000485
12. Wang TD, Tan RS, Lee HY, et al. Effects of sacubitril/valsartan (LCZ696) on natriuresis, blood pressures, and NT-proBNP in saltsensitive hypertension. Hypertension. 2017;69(1):32–41. https://doi.org/10.1161/HYPERTENSIONAHA.116.08484
13. Wang JG, Yukisada K, Sibulo A Jr, et al. Efficacy and safety of sacubitril/valsartan (LCZ696) add-on to amlodipine in Asian patients with systolic hypertension uncontrolled with amlodipine monotherapy. J Hypertens. 2017;35(4):877–85. https://doi.org/10.1097/HJH.0000000000001219
14. Flack JM, Nasser SA. Benefits of once-daily therapies in the treatment of hypertension. Vasc Health Risk Manag. 2011;7:777–87 https://doi.org/10.2147/vhrm.s17207
15. Рязанов АС, Мельникова ЛВ, Макаровская МВ, Кечина ОВ. Эффективность сакубитрила/валсартана по сравнению с валсартаном у пациентов с артериальной гипертензией.Артериальная гипертензия. 2024;30(2):198–206. https://doi.org/10.18705/1607-419X-2024-2375
Об авторах
М. А. ЗасоринаРоссия
Засорина Мария Андреевна
ул. Одесская, д. 54, г. Тюмень, 625023
С. Ю. Волкова
Россия
Волкова Светлана Юрьевна, д-р мед. наук, доцент
ул. Одесская, д. 54, г. Тюмень, 625023
Дополнительные файлы

|
1. Таблицы 2, 3, рисунки 3, 5, 6 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(401KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Засорина М.А., Волкова С.Ю. Эффективность и безопасность комбинации валсартан+сакубитрил в лечении гипертонической болезни у взрослых: результаты проспективного рандомизированного исследования. Безопасность и риск фармакотерапии. 2025;13(4):452-466. https://doi.org/10.30895/2312-7821-2025-504
For citation:
Zasorina M.A., Volkova S.Yu. Valsartan+Sacubitril Efficacy and Safety in Hypertensive Disease in Adults: A Prospective Randomised Control Trial. Safety and Risk of Pharmacotherapy. 2025;13(4):452-466. (In Russ.) https://doi.org/10.30895/2312-7821-2025-504
JATS XML





































