ОСНОВНАЯ ИНФОРМАЦИЯ О ЖУРНАЛЕ
«Безопасность и риск фармакотерапии» – научно-практический рецензируемый журнал открытого доступа, выпускаемый в печатной и онлайн-версиях, единственный в России, полностью посвященный данной тематике. Основан в 1994 году.
Цель журнала: освещение научных достижений и практического опыта в области обеспечения безопасности лекарственных средств и снижения рисков фармакотерапии.
Целевая аудитория. Предназначен для специалистов практического здравоохранения, клинических фармакологов и врачей других специальностей, провизоров, специалистов экспертных учреждений, уполномоченных по фармаконадзору и специалистов по фармаконадзору фармацевтических компаний и организаций, сотрудников центров доклинических и клинических исследований, регуляторных и контрольно-надзорных органов в сфере обращения лекарственных средств, научно-исследовательских институтов, преподавателей, студентов и соискателей медицинских и фармацевтических вузов. Более подробная информация – в разделе «Цели и тематика».
Учредитель: ФГБУ «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации.
Периодичность: 4 раза в год.
Импакт-фактор: двухлетний импакт-фактор РИНЦ (2024) - 0,826.
Редколлегия. Географическое представительство:
- 3 континента
- 10 стран
- 17 городов
Рецензирование:
- Двойное слепое
- Минимум 2 рецензента на рукопись
Основные метрики журнала:
- 14 дней в среднем от подачи до первого решения
- 151 день в среднем от подачи до публикации в Интернете
- 23% приглашенных авторов
- 63% доля принятия рукописей
- 37 тыс. загрузок PDF в 2023 г.
Плата за публикацию: бесплатно.
Индексация. Входит в Scopus (Accepted Titles May 2025), Перечень ВАК (категория К1), Russian Science Citation Index, РИНЦ, DOAJ seal. Информация об индексации в других российских и международных базах доступна в разделе Индексирование.
Регистрация. Свидетельство о регистрации средства массовой информации ПИ № ФС77-82932 от 14 марта 2022 г.
Подписка. Подписной индекс в каталоге Пресса России – 57940, Урал-Пресс – 57940.
Текущий выпуск
ГЛАВНАЯ ТЕМА: ТОНКОЕ ИСКУССТВО ВРАЧЕВАНИЯ ДУШИ: КАМО ГРЯДЕШИ?
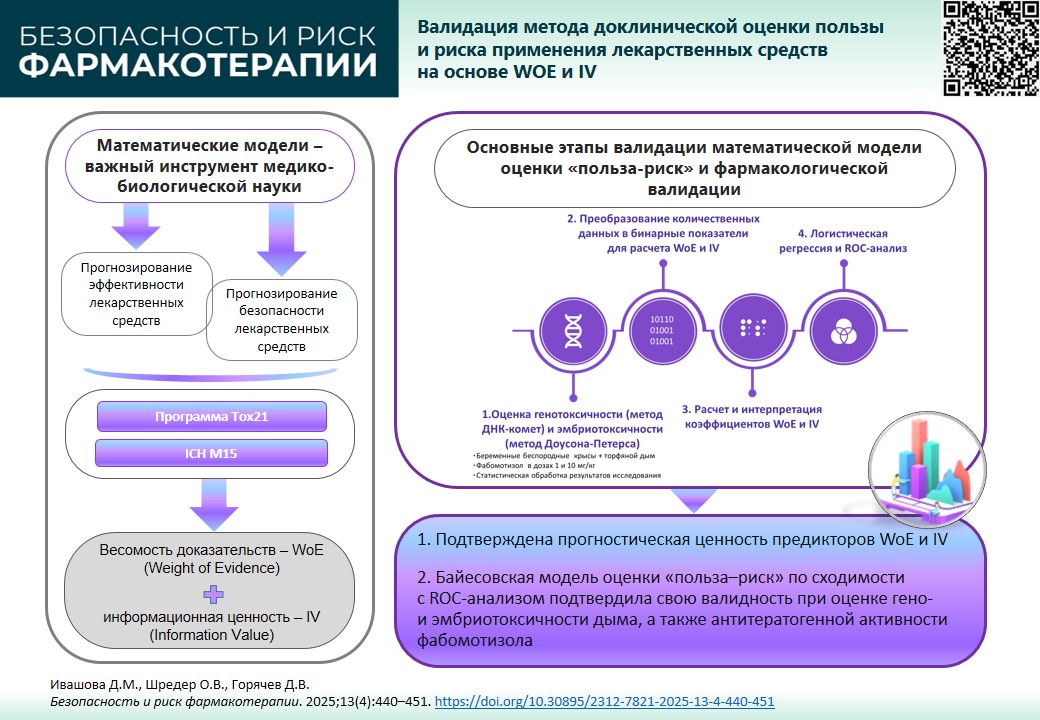
ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
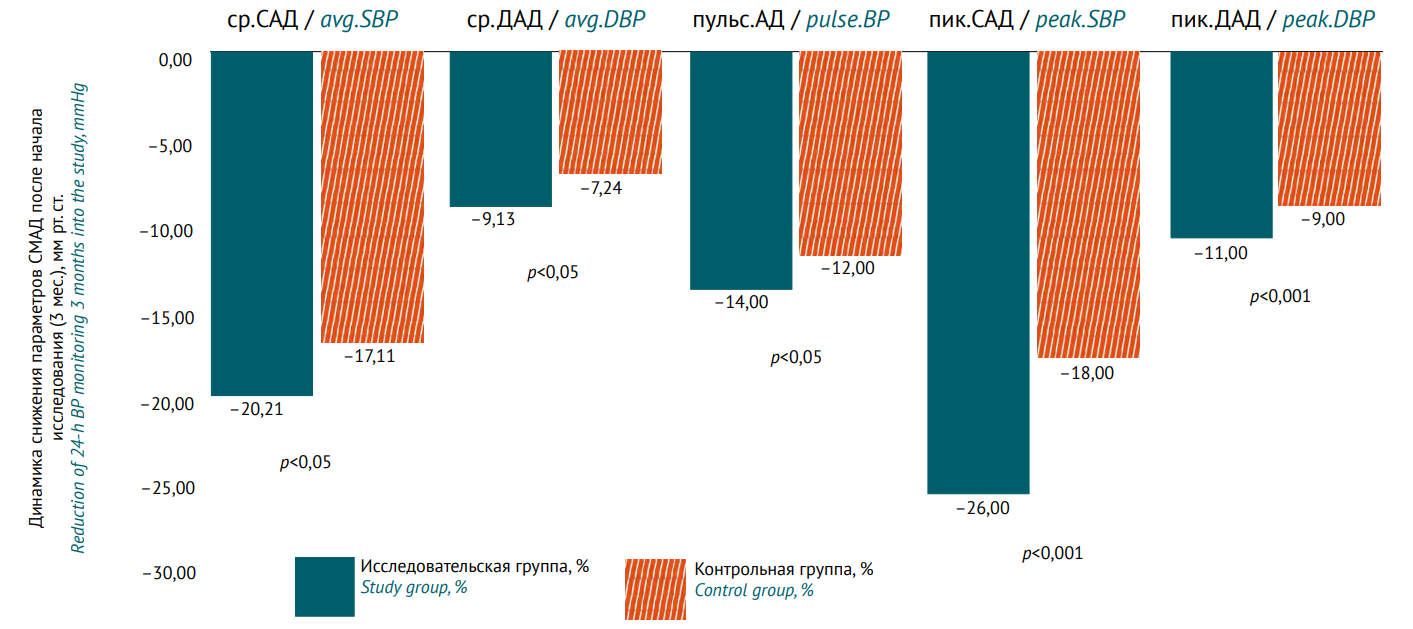
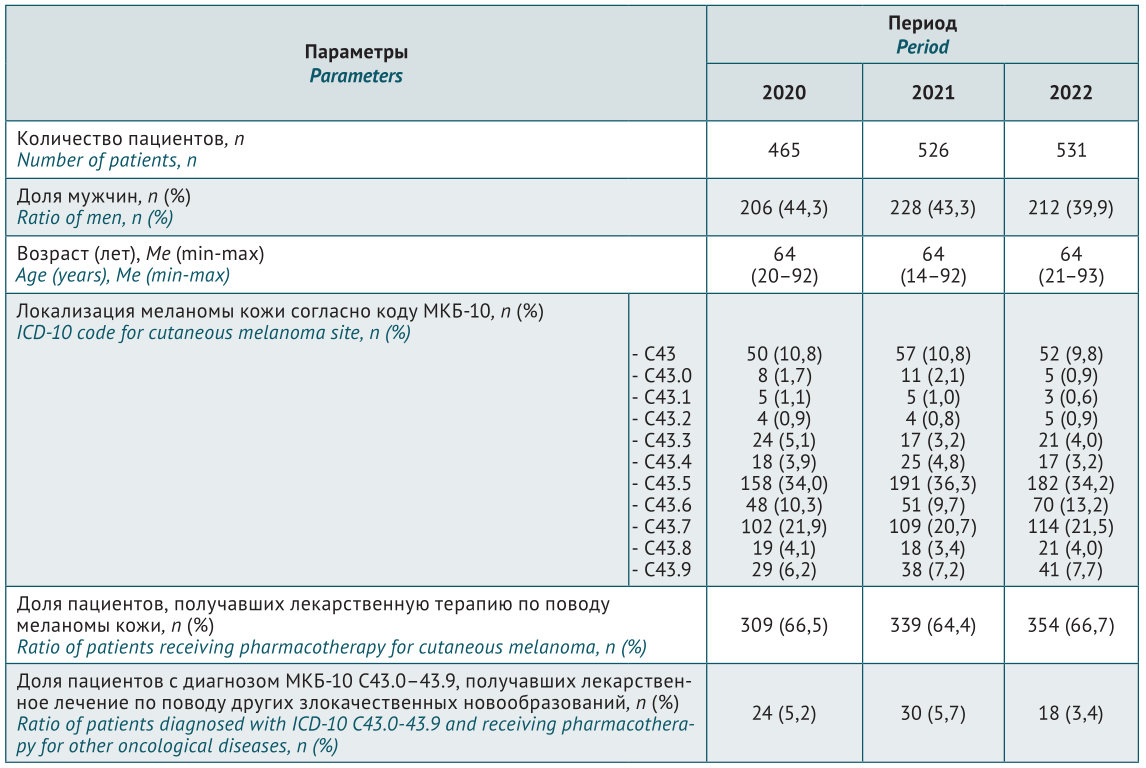
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Объявления
2025-12-05
На сайте ВОЗ опубликован новый документ «Глобальная стратегия интеллектуального фармаконадзора»
ВОЗ опубликовала документ «Глобальная стратегия интеллектуального фармаконадзора» (The global smart pharmacovigilance strategy). Стратегия ВОЗ задает рамки для построения и усиления национальных систем мониторинга безопасности с учетом разных уровней развития здравоохранения.
| Еще объявления... |