ОРИГИНАЛЬНЫЕ СТАТЬИ
ВВЕДЕНИЕ. Фармаконадзор обеспечивает безопасность препаратов благодаря постоянному мониторингу, и все же осведомленность фармацевтических работников остается недостаточной. Широко применяемый антацид ранитидин был изъят из обращения во всем мире в 2020 г. из-за примеси N-нитрозодиметиламина (НДМА), потенциального канцерогена. Несмотря на официальное изъятие ранитидина из обращения, сохраняется вероятность его необоснованного применения в практике. В этих условиях актуальной задачей становится оценка уровня профессиональной осведомленности фармацевтических работников.
ЦЕЛЬ. Выявление проблем системы фармаконадзора аптечных организаций Ливии и направлений ее совершенствования на примере оценки осведомленности работников аптек о безопасности ранитидина и причинах его изъятия из обращения.
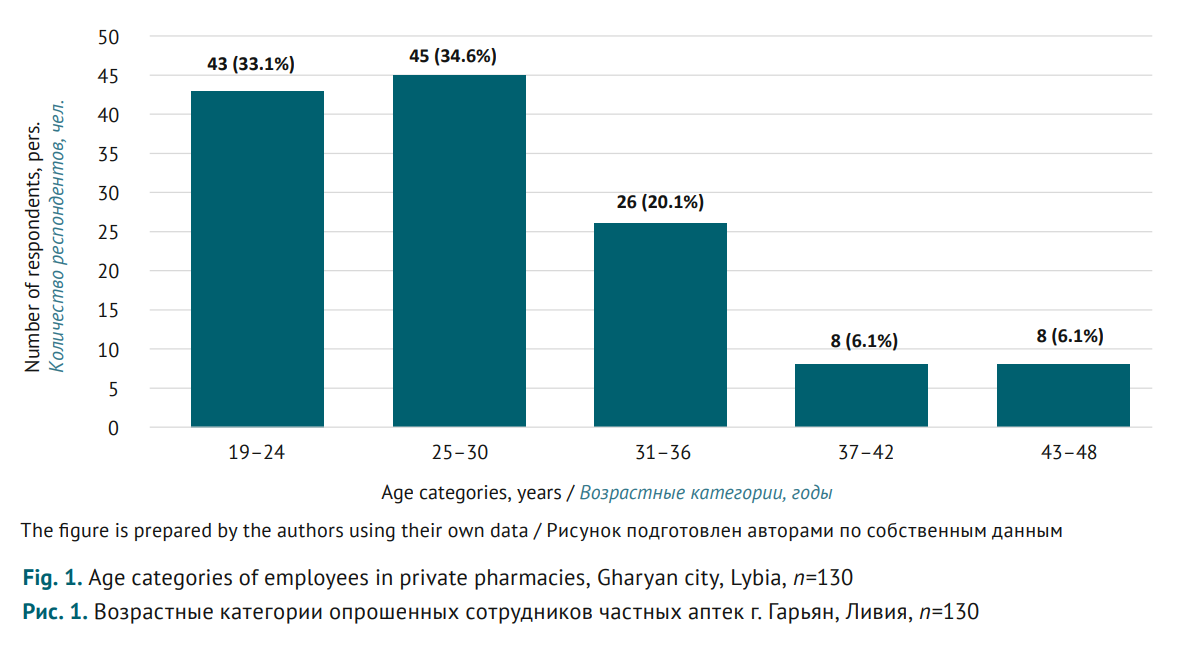
МАТЕРИАЛЫ И МЕТОДЫ. Поперечное исследование проводили с января по март 2023 г. среди 130 сотрудников аптек г. Гарьян (Ливия). Использовали структурированный опросник, имеющий три раздела: 1) демографические данные (возраст, пол, специализация, стаж); 2) базовые знания о фармаконадзоре (6 вопросов с ответами «Да/Нет»); 3) осведомленность об изъятии ранитидина из обращения (6 вопросов «Да/Нет»). Данные анализировали с помощью описательной статистики.
РЕЗУЛЬТАТЫ. Результаты проведенного опроса показали, что почти треть участников (36,2%) не знакомы с термином «фармаконадзор», более двух третей (63,8%) не знали о существовании Центра фармаконадзора в Ливии. Это противоречит ответам респондентов о фармаконадзорных мероприятиях: 78,5% указали, что проходили обучение по фармаконадзору, 81,5% знали о специальных бланках отчетности, которые нужно заполнять при выявлении побочного действия лекарственных препаратов, а 16,2% ранее готовили такие отчеты. О случаях отзыва лекарственных препаратов из-за связанных с ними рисков были осведомлены 55,4% участников. В то же время 79,2% респондентов указали, что ранитидин можно приобрести в аптеке, 30,8% неверно относили ранитидин, блокатор Н2-гистаминовых рецепторов, к антигистаминным препаратам. Источником канцерогенных примесей в препарате 61,5% респондентов считали загрязнения при производстве, и только 36,1% ответили, что примеси также могут образоваться вследствие неправильного хранения.
ВЫВОДЫ. Выявленные критические пробелы в знаниях о системе фармаконадзора и безопасности ранитидина обусловливают необходимость целенаправленного обучения сотрудников ливийских аптек и более активного законодательного урегулирования процедуры изъятия лекарственных препаратов из обращения.
ОБЗОРЫ
ВВЕДЕНИЕ. Ламотриджин (ЛТД) — один из наиболее часто назначаемых противоэпилептических препаратов второго поколения. Препарат имеет низкий тератогенный потенциал, однако обладает генетически и метаболически детерминированными нейротоксическим, гепатотоксическим, дерматотоксическим эффектами и в некоторых случаях может вызвать полиорганную недостаточность. Понимание механизмов действия ЛТД с учетом фармакогеномики и фармакометаболомики, определяющих особенности его метаболизма, транспорта и элиминации у конкретного пациента позволит обеспечить индивидуализацию терапии и повысить ее безопасность.
ЦЕЛЬ. Разработка подхода к терапии ламотриджином эпилепсии и других неврологических и психических заболеваний с учетом фармакогеномики и фармакометаболомики для снижения риска нейротоксичности препарата.
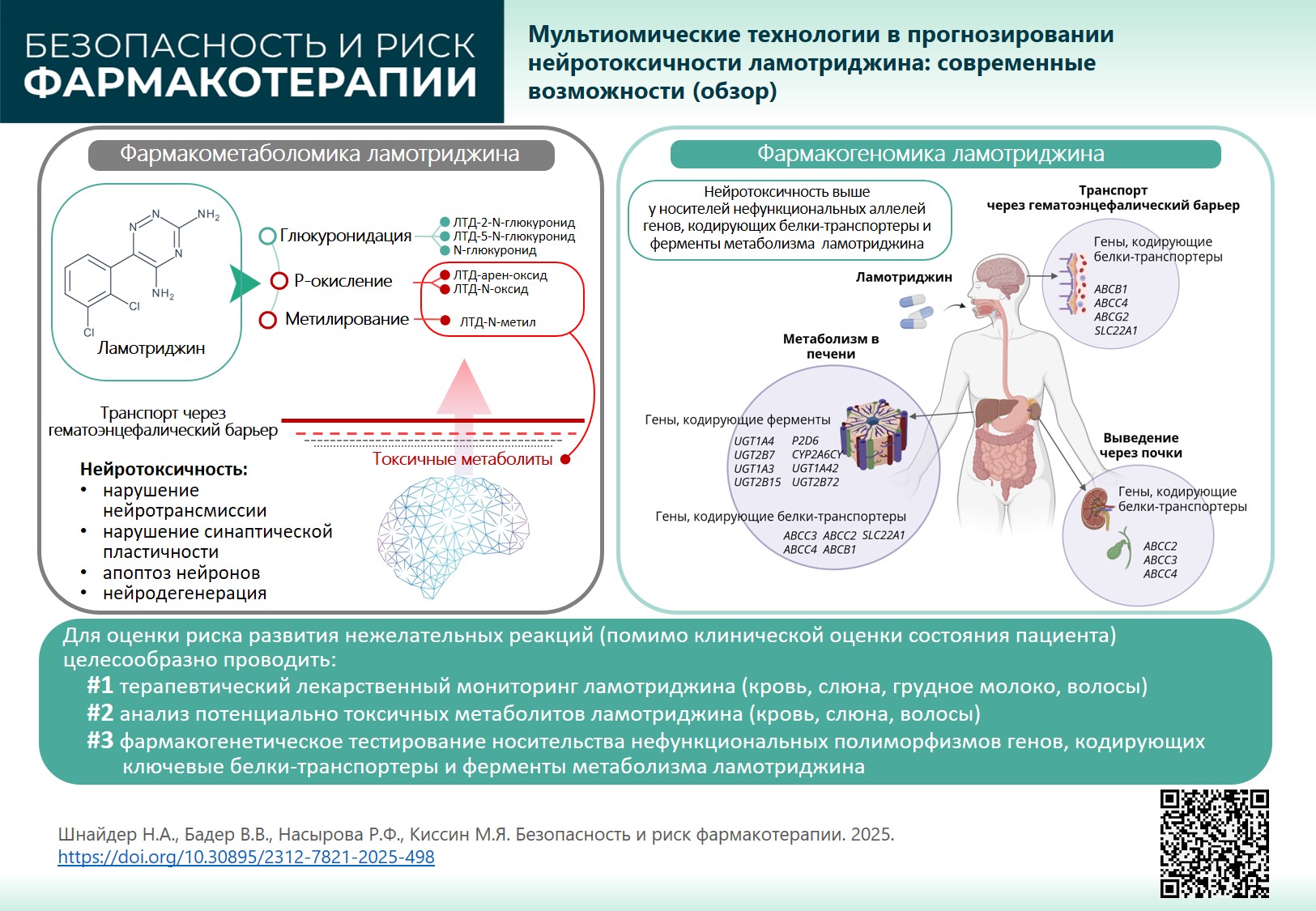
ОБСУЖДЕНИЕ. Метаболизм ЛТД осуществляется в печени глюкуронидацией (основной путь) и Р-окислением (второстепенный путь). В результате образуются как нейтральные, так и токсические (реактивные) метаболиты ЛТД, которые могут длительно циркулировать в крови, проникать через поврежденный гематоэнцефалический барьер у пациентов с терапевтически резистентными эпилептическими приступами и оказывать нейротоксический эффект, запуская или поддерживая механизмы нейродегенерации: нарушение нейротрансмиссии, синаптической пластичности, апоптоз нейронов. Большое значение в нейротоксичности ЛТД играют транспортные белки, участвующие в эффлюксе (выведении) токсических метаболитов из головного мозга в системный кровоток, а также из гепатоцитов в желудочно-кишечный тракт с желчью и через почки с мочой. Генетически детерминированное замедление эффлюкса препарата через гематоэнцефалический барьер (фармакогеномика) повышает нейротоксический потенциал ЛТД.
ВЫВОДЫ. Для оценки риска ЛТД-индуцированных нежелательных реакций наряду с клинической оценкой состояния пациента целесообразно проводить: 1) терапевтический лекарственный мониторинг (кровь, волосы, слюна, грудное молоко); 2) анализ потенциально токсичных метаболитов (кровь, слюна, волосы); 3) фармакогенетическое тестирование носительства нефункциональных полиморфизмов генов, кодирующих ключевые белки-транспортеры и ферменты, участвующие в метаболизме ЛТД. Внедрение результатов фармакогенетического и фармакометаболического тестирования в клиническую практику эпилептолога позволит снизить риск нейротоксичности ЛТД.
ВВЕДЕНИЕ. Важным этапом разработки лекарственных средств является оценка информации о безопасности уже зарегистрированных лекарственных препаратов (ЛП). Регуляторными органами и отдельными исследовательскими группами созданы и поддерживаются базы данных (БД) нежелательных реакций (НР) при применении ЛП. Сведения, агрегированные в таких БД, могут использоваться для создания справочных и обучающих наборов данных для экспериментальных и in silico исследований. Упростить выбор БД, релевантных для целей конкретного исследования, позволит предварительная оценка и систематизация представленной в них информации.
ЦЕЛЬ. Оценка возможности применения открытых баз данных для исследования безопасности лекарственных средств.
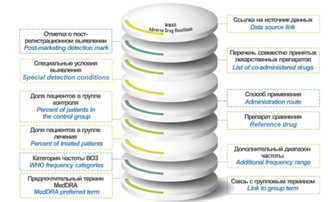
ОБСУЖДЕНИЕ. Изучены 11 БД с открытым доступом, содержащих сведения о НР ЛП: FAERS, DAEN, MedEffect Canada, EudraVigilance, VigiBase, SIDER, MetaADEDB, ADReCS-Target, T-ARDIS, OnSIDES, WWAD. Различия БД обусловлены прежде всего используемыми источниками информации: спонтанные сообщения (FAERS, DAEN, MedEffect Canada, EudraVigilance, VigiBase), инструкции по медицинскому применению ЛП и официальные документы (SIDER, OnSIDES, WWAD), научные публикации (ADReCS-Target) и другие открытые веб-ресурсы (MetaADEDB, T-ARDIS). Все рассмотренные БД могут быть использованы для информационной поддержки и анализа профиля безопасности ЛП. При проведении доклинических исследований, в частности для создания используемых в in silico методах обучающих выборок, полезны SIDER, MetaADEDB, ADReCS-Target, OnSIDES и WWAD. Генерация гипотез о возможных механизмах возникновения НР, поиск новых направлений репозиционирования ЛП могут быть осуществлены с помощью ADReCS-Target, WWAD и T-ARDIS благодаря представленной в них дополнительной информации о фармацевтических субстанциях и молекулярных мишенях. Использование методов автоматизированного анализа текстов без тщательной последующей ручной проверки при построении БД, таких как ADReCS-Target, T-ARDIS, OnSIDES и MetaADEDB, ограничивает их применение для задач, требующих высокой степени достоверности анализируемой информации.
ВЫВОДЫ. Рассмотренные БД НР могут служить ценным инструментом для решения широкого круга медико-биологических задач. При выборе БД, релевантной для конкретного исследования, необходимо учитывать принципы, лежащие в основе ее создания, поскольку различия в источниках и методах аннотирования могут влиять на достоверность результатов.
ISSN 2619-1164 (Online)