Перейти к:
Сравнительная доклиническая оценка безопасности, противогрибковой активности и фармакокинетики препаратов сертаконазола для наружного применения
https://doi.org/10.30895/2312-7821-2023-358
Резюме
ВВЕДЕНИЕ. В связи с высоким распространением грибковых заболеваний кожи актуально расширение ассортимента лекарственных препаратов для наружного применения, содержащих сертаконазол.
ЦЕЛЬ РАБОТЫ. Проведение доклинических исследований по сравнительному изучению безопасности, противогрибковой активности и фармакокинетики препарата Сертаверин® шампунь лекарственный 2% (АО «ВЕРТЕКС», Россия) и зарегистрированных в Российской Федерации препаратов Сертамикол® раствор для наружного применения 2% (Гленмарк Фармасьютикалз Лтд, Индия) и Низорал® шампунь лекарственный 2% (Янссен Фармацевтика НВ, Бельгия).
МАТЕРИАЛЫ И МЕТОДЫ. При изучении токсических свойств препараты наносили самцам и самкам аутбредных крыс накожно в течение 28 сут в дозах 0,5 и 1,5 мл на животное. Оценку фармакокинетики проводили на половозрелых самцах крыс при однократном нанесении двух готовых лекарственных форм сертаконазола (шампунь и раствор) в одной дозе (препарат Низорал® не использован при оценке фармакокинетики, поскольку содержит иное действующее вещество — кетоконазол). Определение минимальной подавляющей концентрации выполнено методом серийных микроразведений в широком диапазоне концентраций.
РЕЗУЛЬТАТЫ. Препараты не оказали существенного токсического влияния на организм лабораторных животных при многократном накожном нанесении в течение 28 дней. В плазме крови обнаружены незначительные концентрации сертаконазола, он интенсивно распределялся в сильно васкуляризированный орган — печень и орган-мишень — кожу (в месте нанесения). Относительная биодоступность сертаконазола из лекарственной формы в виде шампуня по отношению к лекарственной форме раствор для наружного применения в тканях печени составила около 30%, в тканях кожи (в месте нанесения) — около 363%. По ингибирующему действию в отношении штаммов Malassezia furfur Сертаверин® сопоставим с субстанцией сертаконазол. Минимальная подавляющая концентрация составила ≤16–64 мкг/мл (в пересчете на действующее вещество).
ВЫВОДЫ. Препарат Сертаверин® благодаря синергическому двойному механизму действия, широкому антимикотическому спектру действия, липофильным свойствам молекулы и низкой системной абсорбции может являться более эффективной и безопасной альтернативой существующим на фармацевтическом рынке лекарственным препаратам для терапии кожных заболеваний волосистой части головы.
Ключевые слова
Для цитирования:
Косман В.М., Карлина М.В., Вавилова В.А., Боровкова К.Е., Крышень К.Л., Марченко Н.В., Копатько С.А., Сычкова И.В., Каргопольцева Д.Р., Макарова М.Н., Макаров В.Г. Сравнительная доклиническая оценка безопасности, противогрибковой активности и фармакокинетики препаратов сертаконазола для наружного применения. Безопасность и риск фармакотерапии. 2024;12(1):83-98. https://doi.org/10.30895/2312-7821-2023-358
For citation:
Kosman V.M., Karlina M.V., Vavilova V.A., Borovkova K.E., Kryshen K.L., Marchenko N.V., Kopatko S.A., Sychkova I.V., Kargopoltseva D.R., Makarova M.N., Makarov V.G. Comparative Preclinical Evaluation of the Safety, Antifungal Activity, and Pharmacokinetics of Sertaconazole Products for External Use. Safety and Risk of Pharmacotherapy. 2024;12(1):83-98. (In Russ.) https://doi.org/10.30895/2312-7821-2023-358
Введение
Себорейный дерматит представляет собой хроническое воспалительное заболевание, характеризующееся гиперпродукцией сальных желез и изменением состава кожного сала, наличием эритематозно-сквамозных очагов на коже [1]. Себорейный дерматит является одной из актуальных проблем дерматовенерологии, учитывая широкое распространение дерматоза у лиц трудоспособного возраста, постоянный рост заболеваемости, хроническое рецидивирующее течение, отсутствие эффективных методов терапии, продолжающееся изучение механизмов развития [2]. В качестве возможных причин, способствующих возникновению заболевания, рассматривают генетические и метаболические факторы, а также влияние внешней среды. При неблагоприятных условиях происходит нарушение барьерной функции кожи и сальных желез, в частности, организм утрачивает способность контролировать рост питироспоровых грибов, и их количество значительно увеличивается. Изучение видового состава дрожжеподобных грибов рода Malassezia spp. при себорейном дерматите показало, что из очагов выделяются почти все виды, чаще всего M. furfur, M. globosa, M. sympodialis, M. restricta, M. obtusa, M. slooffiae [3–5]. Сертаконазол — противогрибковое средство, производное имидазола и бензотиофена с широким спектром действия. Препарат оказывает как фунгистатическое, так и фунгицидное действие при применении в терапевтических дозах [5]. Азоловая структура препятствует синтезу эргостерина — одного из основных компонентов мембраны грибковой клетки (фунгистатическое действие), а бензотиофен провоцирует разрыв плазматической мембраны грибковой клетки, что приводит к ее гибели (фунгицидное действие). Показано также, что сертаконазол блокирует диморфную трансформацию грибов [4]. Активен в отношении патогенных грибов Candida spp. (в том числе C. albicans, C. tropicalis), Pityrosporum orbiculare (Malassezia spp.), дерматофитов (Trichophyton и Microsporum), возбудителей инфекций кожи и слизистых оболочек (грамположительные штаммы стафило- и стрептококков)1 [6]. В различных формах для наружного применения препараты сертаконазола исследуют с начала 1990-х годов ХХ века и до настоящего времени.
Фармакологическая активность сертаконазола показана как в исследованиях in vitro [7–9], так in vivo [6][10][11]. Ассортимент лечебных косметических средств и препаратов, содержащих сертаконазол, постоянно расширяется за счет создания новых лекарственных форм с этим действующим веществом, например безводного геля, гидрогеля с наночастицами и др. [9][12]. В связи с высоким распространением грибковых заболеваний, в том числе кожных дерматитов, кандидозов и различных дерматомикозов, актуально расширение ассортимента противогрибковых лекарственных средств, выбор удобных для применения форм и создание эффективных и безопасных препаратов этой фармакологической группы.
Цель работы — проведение доклинических исследований по сравнительному изучению безопасности, противогрибковой активности и фармакокинетики препарата Сертаверин® шампунь лекарственный 2% (АО «ВЕРТЕКС», Россия) и зарегистрированных в Российской Федерации препаратов Сертамикол® раствор для наружного применения 2% (Гленмарк Фармасьютикалз Лтд, Индия) и Низорал® шампунь лекарственный 2% (Янссен Фармацевтика НВ, Бельгия).
В задачи исследования входило:
- выявление наиболее чувствительных систем и органов при многократном накожном нанесении тестируемого препарата в сравнении с зарегистрированными препаратами;
- установление возможности обратимости вызываемых повреждений;
- разработка и валидация методик количественного определения действующего вещества (сертаконазола) в биопробах (плазме крови, тканях и органах) лабораторных животных (крыс);
- сравнительное изучение фармакокинетики исследуемых препаратов на крысах при однократном местном применении и расчет фармакокинетических параметров;
- анализ минимальной подавляющей концентрации (МПК) препарата Сертаконазол, шампунь лекарственный 2% (АО «ВЕРТЕКС», Россия) в сравнении с субстанцией сертаконазол (Гленмарк Фармасьютикалз Лтд, Индия).
Материалы и методы
Тест-система. В экспериментах in vivo по изучению токсических свойств использованы крысы аутбредные (линии Wistar), половозрелые самцы и самки массой 214 г ± 10%; в экспериментах по изучению фармакокинетики — крысы аутбредные самцы массой 300 г ± 10% (питомник АО «НПО «ДОМ ФАРМАЦИИ»). Работа была рассмотрена на биоэтической комиссии (БЭК) АО «НПО «ДОМ ФАРМАЦИИ» и одобрена для проведения (протокол БЭК от 13.04.2018 № 2.23/18, БЭК от 18.04.2018 № 1.24/18).
Животных содержали в стандартных условиях в соответствии с Директивой 2010/63/ EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях, и в соответствии с санитарно-эпидемиологическими правилами СП 2.2.1.3218-14.
Стандартный корм животные получали ad libitum, кроме случаев, когда животные были лишены корма на 16 ч перед забором крови и эвтаназией. Доступ к воде не был ограничен на протяжении всего эксперимента.
Исследуемые препараты. Препараты с международным непатентованным названием (МНН) сертаконазол исследованы в виде двух готовых лекарственных форм (ГЛФ) для наружного применения — шампуня лекарственного (является новой лекарственной формой для данного действующего вещества2) и раствора для наружного применения, зарегистрированного в Российской Федерации в качестве лекарственного препарата для медицинского применения. При оценке противогрибковой активности в качестве препарата сравнения вместо раствора для наружного применения выбрана субстанция сертаконазола для исключения влияния вспомогательных веществ, входящих в состав данной ГЛФ. Дополнительно в исследованиях безопасности использован препарат сравнения с другим действующим веществом той же фармакологической группы (МНН кетоконазол), имеющий аналогичную с тестируемым препаратом лекарственную форму (шампунь лекарственный). Рассматриваемые исследования являются частью комплексных работ по доклиническому изучению нового лекарственного препарата на основе сертаконазола, которые были необходимы для его разработки и регистрации.
Тестируемый препарат: Сертаверин® шампунь лекарственный 2% (МНН сертаконазол), АО «ВЕРТЕКС», Россия.
В качестве препаратов сравнения были использованы:
- Сертамикол® раствор для наружного применения 2% (МНН сертаконазол), Гленмарк Фармасьютикалз Лтд, Индия (изучение токсических свойств и фармакокинетики);
- Низорал® шампунь лекарственный 2% (МНН кетоконазол), Янссен Фармацевтика НВ, Бельгия (изучение токсических свойств);
- Сертаконазол субстанция, Гленмарк Фармасьютикалз Лтд, Индия (изучение противогрибковой активности).
В качестве плацебо использовали смесь вспомогательных веществ, входящих в состав препарата Сертаверин® шампунь лекарственный 2%, АО «ВЕРТЕКС», Россия.
Способ применения. Использовано наружное (накожное) нанесение препаратов крысам, аналогичное применению в клинической практике. Исследуемые вещества наносили равномерно на предварительно освобожденный от шерсти участок кожи размером 2×2 см, составляющий примерно 10% общей площади поверхности тела животного. После нанесения исследуемых препаратов на эту область накладывали повязки для предотвращения попадания препаратов в желудочно-кишечный тракт животных3. Время экспозиции составляло 30 мин, после чего препараты смывали. По мере необходимости в ходе исследования удаление шерсти проводили повторно.
За один раз на поверхность кожи тестируемый препарат и препараты сравнения наносили в объеме не более 0,5 мл/животное (максимальный объем препаратов, который может быть нанесен на подготовленный участок кожи).
Дизайн исследования по оценке безопасности. Дизайн исследования был построен с учетом современных норм биоэтики и соблюдения основных принципов 3R (Replacement, Reduction, Refinement: замещение, сокращение, улучшение) с использованием минимального количества животных [13].
Для оценки безопасности, включавшей изучение общетоксических свойств и местнораздражающего действия, было сформировано 6 групп животных по 10 самцов и 10 самок в каждой.
Животные 1-й группы получали плацебо тестируемого препарата в дозе 1,5 мл/животное (нанесение 3 раза/сут по 0,5 мл/ животное), 2-й группы — тестируемый препарат Сертаверин® в дозе 0,5 мл/ животное (1 раз/сут), 3-й группы — тестируемый препарат Сертаверин® в дозе 1,5 мл/ животное (нанесение 3 раза/ сут по 0,5 мл/животное), 4-й группы препарат сравнения Сертамикол® в дозе 0,5 мл/животное (1 раз/сут), 5-й группы — препарат сравнения Сертамикол® в дозе 1,5 мл/ животное (нанесение 3 раза/сут по 0,5 мл/ животное), 6-й группы — препарат сравнения Низорал® в дозе 1,5 мл/животное (нанесение 3 раза/сут по 0,5 мл/ животное).
Препараты наносили животным в течение 28 сут, период отсроченного наблюдения составил 14 сут. Поскольку у животных, получавших плацебо и препараты Сертаверин® и Низорал®, были зарегистрированы признаки местнораздражающего действия, было принято решение о снижении доз. С 10 сут эксперимента группы, получавшие исследуемые препараты в дозе 0,5 мл/животное (группы 2 и 4), стали получать препараты 1 раз/сут в объеме 0,1 мл/животное; группы, получавшие исследуемые препараты в дозе 1,5 мл/животное (группы 3, 5 и 6) и плацебо (группа 1) — 0,3 мл/животное 1 раз/сут. После восстановления кожных покровов с 15 сут эксперимента животные стали получать препараты в изначально запланированных дозах, но был изменен режим нанесения шампуней и плацебо (ограничено время экспозиции до 30 мин) и введена дополнительная манипуляция по смыву препаратов через 30 минут после нанесения.
На протяжении всего эксперимента осуществляли еженедельный осмотр животных, взвешивание.
Локомоторную активность животных изучали на 28 сут эксперимента — и на 42 сут для регистрации отсроченных влияний. Горизонтальную и вертикальную активности животных изучали в автоматизированной установке «Мак-2» (Санкт-Петербург, Россия) в течение 15 мин.
На 28 и 42 сут эксперимента животным проводили клинический анализ крови на гематологическом анализаторе Mythic 18 Vet (Orphee, Швейцария). Определяли количество эритроцитов, уровень гемоглобина, гематокрит, количество лейкоцитов, количество тромбоцитов, лейкоцитарную формулу.
Биохимические показатели крови на 29 и 43 сут эксперимента определяли на биохимическом анализаторе Random Access А-25 (BioSystems, Испания) с использованием реагентов фирмы BioSystems (Испания) и в соответствии с инструкциями производителя. Оцениваемые параметры в сыворотке крови: трансаминазы (аланининовая (Ед/л) и аспарагиновая (Ед/л)), креатинин (мкмоль/л), мочевина (ммоль/л), альбумин (г/л), щелочная фосфатаза (Ед/л), общий белок (г/л), триглицериды (ммоль/л), холестерин (ммоль/л), отношение альбумины/глобулины (расчетные значения), общий билирубин (мкмоль/л), глобулин (расчетные значения), глюкоза (ммоль/л).
Эвтаназию крыс осуществляли с помощью СО2-камеры с последующим обескровливанием полостей сердца. Эвтаназию 50% животных из каждой группы осуществляли на 29 сут эксперимента по окончании нанесения препаратов, оставшихся животных каждой группы — на 43 сут.
Патоморфологическое исследование. После эвтаназии животных тщательно обследовали на предмет внешних патологических признаков. Органы, извлеченные при некропсии, взвешивали. Было проведено гистологическое исследование следующих органов: аорта, сердце, трахея, легкие с бронхами, тимус, желудок, тонкая кишка, толстая кишка, поджелудочная железа, печень, селезенка, почки, мочевой пузырь, надпочечники, семенники (самцы), яичники (самки), подчелюстные лимфатические узлы, щитовидная железа, головной мозг, участок кожи с подлежащими тканями в месте нанесения.
Для оценки местнораздражающего действия в ходе клинических наблюдений и осмотров отмечали все отклонения во внешнем виде наружных кожных покровов в месте нанесения препаратов. При патоморфологическом исследовании в ходе проведения некропсии визуально регистрировали отклонения во внешнем виде наружного кожного покрова и подлежащих мягких тканей в области нанесения препаратов. Далее проводили гистологическое исследование тканей, непосредственно контактировавших с исследуемыми объектами.
Дизайн исследования фармакокинетики. Для оценки сравнительной фармакокинетики тестируемого препарата Сертаверин® и препарата сравнения Сертамикол® животные были распределены в 2 группы по 50 животных (10 подгрупп по числу временны́х точек по 5 животных в каждой подгруппе, распределение проведено методом модифицированной блочной рандомизации [14][15]). Препарат Низорал® шампунь лекарственный не был использован в данной части исследования, так как содержит иное действующее вещество (МНН кетоконазол). Нанесение препаратов крысам проведено в одинаковой дозе (максимально возможной для однократного нанесения данному виду животных) 0,5 мл препарата (10 мг действующего вещества) каждому животному, однократно, на предварительно освобожденный от шерсти участок кожи размером 2×2 см. Согласно рекомендациям4 для сравнительной оценки фармакокинетики двух препаратов или ГЛФ с одним действующим веществом достаточно изучения в одной терапевтической дозе.
Образцы крови отбирали из полостей сердца в процессе эвтаназии. Эвтаназию осуществляли с помощью СО2-камеры. После эвтаназии у животных были отобраны образцы печени и кожи в месте нанесения. Отбор биообразцов осуществляли на временных точках до нанесения (0 мин), через 15, 30, 45 мин, 1, 2, 4, 6, 8 и 24 ч после применения.
Определение содержания сертаконазола в биологических образцах (плазма крови крыс) выполнено методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с ультрафиолетовым (УФ) детектированием с использованием предварительно разработанной методики. Анализ выполнен с использованием колонки Luna C18(2) 4,6×150 мм (размер частиц сорбента 5 мкм) с предколонкой (3 мм), заполненной тем же сорбентом (Phenomenex, США), в изократическом режиме элюирования смесью 0,03% раствора трифторуксусной кислоты и ацетонитрила в соотношении 50:50, скорость подачи элюента 1 мл/мин, дозируемый объем проб 20 мкл, длина волны детектирования 225 нм; температура термостата колонок 40±1°С. Подготовка проб к анализу включала осаждение белков плазмы крови ацетонитрилом (в объемном соотношении 1:3) с последующей заменой растворителя. Органы (печень) предварительно гомогенизировали (с водой очищенной в соотношении 1:1), ткани (кожу в месте нанесения) измельчали ножницами и обрабатывали в ультразвуковой ванне при температуре 40°С 30 мин (с водой очищенной в соотношении 1:1), затем также очищали осаждением ацетонитрилом с последующей заменой растворителя. Биоаналитические методики были валидированы в соответствии с рекомендациями5 в диапазоне концентраций от 0,06 до 93 мкг/мл (плазма крови) и от 0,02 до 90 мкг/г (органы и ткани на примере печени) по показателям: селективность, нижний предел количественного определения (НПКО), калибровочный диапазон, точность и прецизионность. По всем валидационным параметрам получены удовлетворительные результаты, что свидетельствовало о возможности дальнейшего использования методик для изучения фармакокинетики препаратов на крысах.
Изучение противогрибкового действия. Изучение противогрибковой активности было проведено в тесте по определению МПК методом серийных микроразведений в питательном бульоне6. В качестве тест-системы использовали эталонный штамм Malassezia furfur (Robin) Baillon (ATCC® 46265™) и 4 клинических изолята Malassezia furfur из коллекции музея лаборатории микробиологии АО «НПО «ДОМ ФАРМАЦИИ». Работа была рассмотрена на заседании биоэтической комиссии (БЭК) АО «НПО «ДОМ ФАРМАЦИИ» и одобрена для проведения (протокол БЭК от 06.06.2018 № 1.34/18).
Перед началом исследования подготавливали питательные среды из сухих сред промышленного производства в соответствии с инструкцией изготовителя с добавлением необходимых компонентов (табл. 1).
Таблица 1. Питательные среды для постановки теста
по определению минимальной подавляющей концентрации
Table 1. Culture media for minimum inhibitory concentration determination
Питательная среда и добавки к ней Culture medium and additives | Цель использования питательной среды Purpose of culture media |
Сабуро бульон (НИЦФ, Россия) с добавлением Твин 60 (Industria Chimica Panzeri S.r.l., Италия), глицерина («ЛенРеактив», Россия) и масла оливкового (IDEAL, Испания) Sabouraud broth (Research Centre for Pharmacotherapy, Russia) with Tween 60 (Industria Chimica Panzeri S.r.l., Italy), glycerol (LenReagent, Russia) and olive oil (IDEAL, Spain) | Активация тест-штаммов Activation of test strains |
Сабуро агар (Merck, Германия) с добавлением селективных добавок: глицерин, глицерин моностеарат (Musim Mas, Индонезия), Твин 60 (Industria Chimica Panzeri S.r.l., Италия), оливковое масло, желчь (НИЦФ, Россия) Sabouraud 2% glucose agar (Merck, Germany) with selective additives: glycerol, glycerol monostearate (Musim Mas, Indonesia), Twin 60 (Industria Chimica Panzeri S.r.l., Italy), olive oil, bile (Research Centre for Pharmacotherapy, Russia) | Пересев тест-штаммов Passage of test strains |
Среда RPMI-1640 («БиолоТ», Россия), содержащая 0,165 М буфера 3-[N-морфолино] пропансульфоновой кислоты (MOPS) («ПанЭко», Россия), 0,5% Твин 60, 2% олеиновой кислоты (Sinar Mas, Индонезия) RPMI-1640 medium (BioloT, Russia) containing 0.165 M 3-[N-morpholino] propanesulfonic acid buffer (MOPS) (PanEco, Russia), 0.5% Tween 60, 2% oleic acid (Sinar Mas, Indonesia) | Постановка теста в 96-луночных планшетах Testing in 96-well plates |
mLN-агар, приготовленный из компонентов: пептон (НИЦФ, Россия), глюкоза (Weifang Shengtai Medicine Co, Ltd., Китай), экстракт дрожжевой (НИЦФ, Россия), желчь, глицерин, глицерин моностеарат, Твин 60, оливковое масло, агар (Laboratorios Conda, S.A., Испания), вода очищенная mLN-agar prepared from the following components: peptone (Research Centre for Pharmacotherapy, Russia), glucose (Weifang Shengtai Medicine Co., Ltd, China), yeast extract (Research Centre for Pharmacotherapy, Russia), bile, glycerol, glycerol monostearate, Twin 60, olive oil, agar (Laboratorios Conda, S.A., Spain), purified water | Контроль посевной дозы инокулята Inoculum dose control |
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Для определения МПК методом серийных микроразведений использовали следующие концентрации Сертаверина® и субстанции сертаконазола: 128, 64, 32, 16, 8, 4, 2, 1, 0,5, 0,25, 0,125, 0,0625, 0,03125, 0,01562, 0,00781, 0,0039, 0,00195, 0,00097 мкг/мл. Серийные двойные разведения исследуемых объектов готовили в день постановки теста, полученные растворы вносили в лунки 96-луночных планшетов, после чего подготавливали инокулюмы тест-штаммов. Инокулюм готовили путем растворения колоний тест-штаммов в стерильной дистиллированной воде для получения суспензии с концентрацией клеток от 5,0×10³ до 5,0×10⁴ КОЕ/мл. Планшеты инокулировали в течение 30 мин стандартизованной суспензией инокулюма в целях сохранения концентрации жизнеспособных клеток. В каждую лунку, содержащую 100 мкл разведенного в бульоне исследуемого объекта, добавляли в равном объеме суспензию тест-штамма.
Для подтверждения внесенного количества клеток тест-штаммов в планшеты из инокулюма делали десятикратные разведения с последующим высевом на чашки Петри с mLN-агаром. Далее инокулированные планшеты и чашки Петри убирали в термостат на инкубацию. Планшеты инкубировали при температуре 35±2°С в течение 18–20 ч, чашки Петри — в течение 4–7 сут при температуре 35°С.
Рост Malassezia furfur в микропланшетах оценивали визуально при достаточном росте испытуемого организма и спектрофотометрически7 при длине волны 565 нм с использованием планшетного спектрофотометра Xmark (Bio-Rad, США).
Сравнение противогрибкового действия тестируемого препарата с препаратами сравнения не входило в задачи исследования.
Анализ данных. Для всех данных исследования безопасности была применена описательная статистика: данные проверены на соответствие закону нормального распределения (по критерию Шапиро–Уилка), рассчитаны среднее значение и стандартная ошибка среднего (M±m) или медиана и квартильный размах (Me(Q1;Q3)). Для оценки межгрупповых различий данных с признаками нормального распределения был использован однофакторный дисперсионный анализ (ANOVA) с последующим межгрупповым сравнением post hoc с использованием теста Тьюки. Для оценки данных, не подчиняющихся закону нормального распределения, был применен критерий Краскела–Уоллиса.
Фармакокинетические параметры (максимальная концентрация Сmax, время достижения максимальной концентрации Тmax, площадь под кривой «концентрация–время» AUC, среднее время удерживания MRT, период полувыведения T1/2 и показатель скорости всасывания Сmax/AUCt) рассчитаны внемодельным методом статистических моментов [16] с использованием приложения PKSolver для Microsoft Office Excel. Для статистической оценки различий между фармакокинетическими параметрами был применен двухвыборочный t-тест для средних.
МПК исследуемых препаратов должна соответствовать лунка с наименьшей их концентрацией без признаков видимого роста микроорганизма (прозрачный бульон). Прозрачность бульона была оценена визуально в проходящем свете и спектрофотометрическим методом при длине волны 565 нм. Данные МПК представляли в виде индивидуальных значений по каждому тест-штамму и тестируемому объекту отдельно и в виде медианы и квартильного размаха (Me(Q1;Q3)). Различия определяли с помощью непараметрического U-критерия Манна–Уитни.
Различия были определены при уровне значимости p=0,05. Статистический анализ выполнен с помощью программного обеспечения Statistica 10.0 (StatSoft, США).
Результаты и обсуждение
Оценка безопасности
Оценка безопасности включала сравнительное изучение местнораздражающего и общетоксического действия.
За весь период эксперимента случаев гибели животных не зарегистрировано. Результаты клинического наблюдения показали, что нанесение тестируемого препарата Сертаверин®, препарата сравнения Низорал® и нанесение плацебо тестируемого препарата привело к развитию признаков местнораздражающего действия начиная со 2–3 сут эксперимента (отмечалось покраснение в месте нанесения с последующим развитием экскориаций и эрозивных повреждений кожных покровов). В группах животных, получавших препарат сравнения Сертамикол® в дозе 1,5 мл/животное, признаки местнораздражающего действия отмечены в единичных случаях начиная с 8 сут эксперимента, в группе с дозой 0,5 мл/животное — с 13 сут эксперимента. Развитие признаков местнораздражающего действия сопровождалось изменением поведения животных, наблюдалась агрессия и повышение реакции на раздражители. В связи с этим дозы для нанесения были снижены с 10 сут эксперимента. Изменение режима дозирования способствовало постепенному снижению частоты и выраженности кожной реакции, выраженность поведенческих изменений также снижались. К 15 сут эксперимента наблюдали восстановление кожных покровов, после которого животные стали получать препараты в изначально запланированных дозах, но было ограничено время их экспозиции до 30 мин и введена дополнительная манипуляция по смыву препаратов (через 30 мин после нанесения). Такая схема в большей степени соответствовала планируемому способу клинического применения исследуемых препаратов и позволила нивелировать проявление указанных выше нежелательных эффектов. К окончанию периода нанесения препаратов (на 28 сут эксперимента) повреждения кожных покровов наблюдали у 20% самцов и 40–50% самок в группах, получавших тестируемый препарат и препарат сравнения Низорал® в дозе 1,5 мл/животное, у 10% животных групп, получавших препарат сравнения Сертамикол® в дозе 0,5 мл/животное, и у 20–30 % животных — в дозе 1,5 мл/животное. То есть к окончанию курса нанесения препаратов отличий в частоте встречаемости признаков местнораздражающего действия между группами, получавшими сравниваемые препараты в эквивалентных дозах, не отмечалось, что подтвердилось и данными гистологического анализа. По окончании периода отсроченного наблюдения признаки местнораздражающего действия наблюдали в единичных случаях только у самок, получавших исследуемые препараты в максимальной дозе.
Оценка динамики массы тела показала, что в течение первой недели нанесений в группах самцов и самок, получавших тестируемый препарат Сертаверин® в дозе 1,5 мл/животное, наблюдалось замедление положительной динамики массы тела относительно группы контроля и группы, получавшей Сертамикол® в эквивалентной дозе. В группе, получавшей Низорал® в дозе 1,5 мл/животное, отмечена аналогичная тенденция, не достигшая статистической значимости. К 14 сут эксперимента и далее (в том числе и в период отсроченного наблюдения) в группах самцов и самок, получавших тестируемый препарат в дозе 1,5 мл/животное, динамика массы тела нормализовалась, отличий между животными, получавшими препараты в эквивалентных дозах, а также отличий экспериментальных групп от группы, получавшей плацебо, не отмечалось.
Исследуемые препараты не оказали влияния на локомоторную активность экспериментальных животных как непосредственно по окончании периода введения, так и в период отсроченного наблюдения.
Не отмечено влияния препаратов на параметры, оцениваемые при клиническом и биохимическом анализах крови. Статистически значимых отличий между самцами и самками, получавшими препараты в эквивалентных дозах, за весь период эксперимента выявлено не было.
По результатам патоморфологического исследования как на 29, так и на 43 сут эксперимента патологических изменений внутренних органов, связанных с действием исследуемых препаратов, не обнаружено. Выявленный в двух случаях поствоспалительный фиброз кожи встречался у животных в группах, получавших исследуемые препараты в максимальной дозе. Исследуемые препараты в результате многократного накожного нанесения оказали сопоставимое частично обратимое в период отсроченного наблюдения местнораздражающее действие.
Полученные данные указывают на необходимость обязательного соблюдения рекомендуемого режима дозирования тестируемого препарата.
Исследование фармакокинетики
Разработка и валидация биоаналитических методик. Сертаконазол — 1-[ 2-[(7-Хлорбензо[b]тиен-3-ил)метокси]-2-(2,4-дихлорфенил)этил]-1H-имидазол, противогрибковое лекарственное средство (рис. 1).
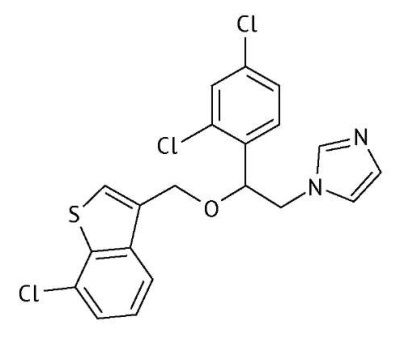
Рис. 1. Структурная формула сертаконазола
Fig. 1. Structural formula of sertaconazole
Для определения сертаконазола в различных объектах оптимально применение ВЭЖХ с использованием обращенно-фазовых сорбентов, УФ- или масс-спектрометрического детектирования и подвижных фаз, состоящих из ацетонитрила или метанола и водных буферных растворов с низкими значениями рН [17–19]. Хроматографические условия и процедура пробоподготовки оптимизированы с учетом экспериментальных возможностей конкретной лаборатории. Основные валидационные параметры разработанных методик представлены в таблице 2.
Таблица 2. Валидационные параметры методики определения сертаконазола
в биоматериале крыс
Table 2. Validation parameters of the analytical procedure for sertaconazole assay
in rat biological materials
Параметр Parameter | Значение Value | |
Плазма крови Blood plasma | Гомогенат печени Liver homogenate | |
Калибровочный диапазон Calibration range | 0,06–93 мкг/мл (μg/mL) | 0,02–90 мкг/г (μg/g) |
Уравнение регрессии* Regression equation* | Y = 79830X+1749 | Y = 86944X–407 |
Коэффициент корреляции r Correlation coefficient r | 0,9998 | 0,9989 |
НПКО LLOQ | 0,06 мкг/мл (μg/mL) | 0,02 мкг/г (μg/g) |
Точность / Accuracy, % | ||
93 мкг/мл (μg/mL); 90 мкг/г (μg/g) | 1,1 | 2,8 |
50 мкг/мл (μg/mL); 50 мкг/г (μg/g) | 3,1 | 1,7 |
0,18 мкг/мл (μg/mL); 0,08 мкг/г (μg/g) | 0,9 | 1,8 |
0,06 мкг/мл (μg/mL); 0,02 мкг/г (μg/g) | 19,5 | 1,5 |
Прецизионность / Precision, %** | ||
93 мкг/мл (μg/mL); 90 мкг/г (μg/g) | 1,1 | 1,3 |
50 мкг/мл (μg/mL); 50 мкг/г (μg/g) | 1,2 | 2,6 |
0,18 мкг/мл (μg/mL); 0,08 мкг/г (μg/g) | 2,6 | 6,4 |
0,06 мкг/мл (μg/mL); 0,02 мкг/г (μg/g) | 5,8 | 5,6 |
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Примечание. НПКО — нижний предел количественного определения.
* Y — площадь пика сертаконазола, X — концентрация сертаконазола,
мкг/мл для плазмы крови, мкг/г для гомогенатов органов тканей.
** Указаны значения для плазмы крови; для органов и тканей.
Note. LLOQ, lower limit of quantification.
* Y, sertaconazole peak area, X, sertaconazole concentration
(µg/mL for blood plasma, µg/g for tissue organ homogenates).
** Values for blood plasma; values for organs and tissues.
По всем критериям получены удовлетворительные результаты, подтвердившие возможность дальнейшего использования биоаналитических методик для изучения фармакокинетики препаратов сертаконазола.
Оценка фармакокинетики. В рамках сравнительного исследования фармакокинетики были изучены два препарата с МНН сертаконазол, представляющие собой различные ГЛФ для наружного применения: шампунь лекарственный (тестируемый препарат Сертаверин®) и раствор для наружного применения (препарат сравнения Сертамикол®).
После однократного нанесения исследуемых препаратов в плазме крови обнаружены незначительные концентрации сертаконазола, близкие к нижнему пределу количественного определения (НПКО) используемой биоаналитической методики (рис. 2А). Полученные результаты не позволили провести расчет фармакокинетических параметров. Эти результаты согласуются с данными литературы о низкой или отсутствующей системной биодоступности сертаконазола при наружном применении8 [4].
Однако сертаконазол быстро поступал в печень (рис. 2B) и ткани кожи (рис. 2C), уже через 15 мин было установлено значимое увеличение концентрации сертаконазола во всех биообразцах тканей. После введения препарата сравнения Сертамикол® наблюдали значительно более интенсивный (среднее значение Сmax составило 4,78±0,39 мкг/г) подъем концентрации сертаконазола в печени крыс, чем после введения тестируемого препарата Сертаверин® (среднее значение Сmax составило 1,15±0,17 мкг/г).

Рис. 2. Кривые «концентрация–время» изменения содержания сертаконазола
в плазме крови (А), печени (B) и коже в месте нанесения (C)
после однократного наружного нанесения препаратов
Сертаверин® шампунь лекарственный 2% (T)
и Сертамикол® раствор для наружного применения 2% (R)
в дозе 0,5 мл/животное в линейных координатах
(количество животных n=5, среднее арифметическое и стандартное отклонение X ± Sx)
Fig. 2. Concentration–time curves for sertaconazole
in plasma (A), liver (B), and skin at the application site (C)
after single topical application of Sertaverin® 2% shampoo (T)
and Sertamicol® 2% solution for external use (R)
at a dose of 0.5 mL per animal, in linear coordinates
(number of animals, n=5; mean and standard deviation, X ± Sx)
В коже крыс наблюдали несколько менее интенсивный подъем концентрации сертаконазола (среднее значение Сmax составило 52,61±13,71 мкг/г) после нанесения препарата сравнения, чем после введения тестируемого препарата (среднее значение Сmax составило 88,97±0,23 мкг/г). Максимальную концентрацию действующего вещества в печени наблюдали через 0,75–2 ч после нанесения, в коже — через 0,5–1 ч после нанесения. К 8 ч эксперимента после нанесения препарата в печени было обнаружено около 5–6% от максимальной концентрации сертаконазола; в тканях кожи — около 10–15% от максимальной концентрации сертаконазола; к 24 ч после нанесения препарата сертаконазол не был обнаружен ни в одной пробе печени крыс, в пробах кожи — менее 7% от максимальной концентрации.
Основные параметры, характеризующие степень проникновения сертаконазола в ткани печени и кожу (в месте нанесения), приведены в таблице 3.
Таблица 3. Основные показатели,
характеризующие степень проникновения сертаконазола в печень и кожу
после однократного наружного нанесения тестируемого препарата
Сертаверин® шампунь лекарственный 2% (T)
и препарата сравнения Сертамикол® раствор для наружного применения 2% (R)
в дозе 0,5 мл/животное, мкг/г (количество животных n=5)
Table 3. Main parameters of sertaconazole penetration to the liver and skin
after a single topical application of Sertaverin® 2% medicated shampoo (test product, T)
and Sertamicol® 2% solution for external use (reference product, R)
at a dose of 0.5 mL/animal (number of animals, n=5)
Препарат Product | Биоматериал Biological material | Показатели Parameters | |||
Сmax, мкг/г Сmax, μg/g | AUС0-24, ч×мкг/г AUС0-24, h×μg/g | MRTТ, ч MRTТ, h | Т1/2, ч Т1/2, h | ||
T | Печень / liver | 1,1±0,4 | 3,0±1,5 | 3,6±1,0 | 2,1±0,8 |
R | Печень / liver | 4,8±0,9 | 9,7±2,9 | 2,4±1,2 | 1,4±0,8 |
T | Кожа / skin | 89,0±0,5 | 395,9±134,2 | 10,0±6,9 | 7,8±4,9 |
R | Кожа / skin | 52,6±30,7 | 109,0±67,2 | 5,9±3,0 | 4,7±1,4 |
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Примечание. Данные представлены в формате X ± Sx —
среднее арифметическое и стандартное отклонение;
Сmax — максимальная концентрация;
AUC — площадь под кривой «концентрация–время» в интервале дозирования 0–24 ч;
MRT — среднее время удерживания; T1/2 — период полувыведения.
Note. Data are presented as X ± Sx (mean concentration and standard deviation).
Сmax, maximum concentration; AUC, area under the curve;
MRT, mean retention time; T1/2, half-life time.
На основании полученных данных сделано заключение о том, что проникновение сертаконазола в ткани печени после нанесения ГЛФ в форме раствора примерно в 3 раза интенсивнее, чем после нанесения ГЛФ в форме шампуня (различия статистически значимы, р<0,05). Это может свидетельствовать о меньшей системной доступности сертаконазола в форме шампуня, что является преимуществом в случае лекарственных форм для наружного применения. Для параметров MRT и T1/2 для тканей печени для двух исследованных препаратов различия статистически не значимы (р>0,05).
Проникновение сертаконазола в ткани кожи после нанесения ГЛФ в форме раствора примерно в 4 раза менее интенсивное, чем после нанесения ГЛФ в форме шампуня (различия статистически значимы, р<0,05). Это согласуется с высказанным выше предположением о преимуществе использования шампуня по сравнению с раствором. Для параметров MRT и T1/2 для тканей кожи для двух исследованных препаратов различия статистически не значимы (р>0,05).
При сопоставлении данных, полученных для двух типов биоматериала (ткани печени и ткани кожи), установлено, что уровень максимальных концентраций сертаконазола в тканях кожи (50–90 мкг/г) значительно выше, чем в печени (1–5 мкг/г); среднее время удержания (6–10 ч) и период полувыведения (5–8 ч) в тканях кожи выше, чем в тканях печени (2,4–3,6 ч и 1,4–1,7 ч соответственно). Относительная биодоступность сертаконазола из ГЛФ в виде шампуня по отношению к ГЛФ в виде раствора для наружного нанесения в тканях печени составила около 30%, в тканях кожи (в месте нанесения) — около 363%. Таким образом, полученные результаты свидетельствовали о более низкой системной доступности и более высокой относительной биодоступности в месте нанесения (тканях кожи) препарата в форме шампуня по сравнению с ГЛФ в виде раствора, и, следовательно, о потенциальных преимуществах новой для данного действующего вещества лекарственной формы в клинической практике.
Отметим, что после наружного применения исследованных препаратов были обнаружены сравнительно низкие концентрации действующего вещества в плазме крови и сравнительно высокие его концентрации в печени. Это может свидетельствовать не только о наличии системной доступности сертаконазола при наружном применении, но также и о сравнительно быстром его распределении в органы. Поэтому, планируя дизайн эксперимента по сравнительному изучению фармакокинетики лекарственных средств для наружного применения, целесообразно включать оценку не только системной биодоступности (то есть анализ содержания действующего вещества в плазме крови) и в месте применения (как рекомендовано9), но и в наиболее васкуляризированных органах, чаще всего отвечающих за метаболизм и выведение (например, в печени и, возможно, в почках).
Противогрибковое действие
Результаты оценки противогрибкового действия представлены в таблице 4.
Таблица 4. Результаты оценки минимальной подавляющей концентрации
сертаконазола в лекарственных средствах
Table 4. Results of minimum inhibitory concentration determination
for sertaconazole medicinal products
Тест-штамм Malassezia furfur Test strain Malassezia furfur | Минимальная подавляющая концентрация, мкг/мл (в пересчете на действующее вещество) Minimum inhibitory concentration, μg/mL (on the active substance basis) | |
Сертаверин® шампунь 2% Sertaverin® 2% shampoo | Сертаконазол субстанция Sertaconazole active substance | |
1 | 32 | 32 |
2 | 32 | 16 |
3 | 16 | 64 |
4 | 64 | 64 |
АТСС 46265 | 32 | 32 |
Me (Q1;Q3) | 32 (32;32) | 32 (32;64) |
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Примечание. Me(Q1;Q3) — медиана и квартильный размах.
Note. Me(Q1;Q3), median and interquartile range.
Препарат Сертаверин® в виде ГЛФ проявил схожую активность с субстанцией сертаконазола в отношении Malassezia furfur, таким образом, вспомогательные вещества, входящие в состав лекарственной формы шампунь, не изменили антимикробную активность сертаконазола.
Для препарата Сертаверин® шампунь лекарственный 2% и субстанции сертаконазол значения МПК в отношении эталонного штамма M. furfur (ATCC 46265) и 4-х клинических изолятов M. furfur составили от 16 до 64 мкг/мл, что соответствовало данным литературы (МПК для сертаконазола — 52 мкг/мл [20]).
Можно ожидать высокую терапевтическую эффективность лекарственного препарата Сертаверин®, шампунь лекарственный 2% (АО «ВЕРТЕКС», Россия) при применении в клинической практике, поскольку 1 мл шампуня содержит 20 мг (20 000 мкг) действующего вещества, что более чем в 300 раз превышает МПК.
При проведении клинических исследований целесообразно предусмотреть дизайн с использованием лабораторно-диагностических методов по оценке локомоторной активности, биохимических показателей «печеночных проб» как органа-мишени для накопления препарата, а также оценки раздражающего действия в месте нанесения препарата у человека.
Выводы
- При накожном нанесении в течение 28 сут исследуемые препараты по результатам оценки общетоксических свойств не оказали существенного токсического влияния на организм лабораторных животных (крыс). Изменения в поведении животных (агрессия, повышение реакции на раздражители) развились на фоне повреждений кожных покровов, степень выраженности изменений была сопоставима между группами, получавшими тестируемый препарат Сертаверин® и препарат сравнения Низорал®в эквивалентных дозах. Исследуемые препараты в результате многократного накожного нанесения оказали сопоставимое частично обратимое в период отсроченного наблюдения местнораздражающее действие.
- После однократного нанесения препаратов Сертаверин®и Сертамикол® в плазме крови обнаружены незначительные концентрации сертаконазола; сертаконазол интенсивно распределялся в сильно васкуляризированный орган — печень, и орган-мишень — кожу в месте нанесения. Проникновение сертаконазола в ткани печени после нанесения ГЛФ в форме шампуня примерно в 3 раза меньше, чем после нанесения ГЛФ в форме раствора, что может свидетельствовать о меньшей системной доступности сертаконазола в форме шампуня, следовательно, более низких рисках развития системных побочных эффектов. Проникновение сертаконазола в ткани кожи после нанесения ГЛФ в форме шампуня примерно в 4 раза более интенсивное, чем после нанесения ГЛФ в форме раствора, что также является преимуществом в случае лекарственных форм для наружного применения.
- Сертаверин®, шампунь лекарственный 2%, сопоставим по ингибирующему действию с субстанцией сертаконазола, МПК ≤16–64 мкг/мл (в пересчете на действующее вещество).
Таким образом, препарат Сертаверин®, шампунь лекарственный 2% (АО «ВЕРТЕКС», Россия), благодаря синергическому двойному механизму действия (фунгицидному и фунгистатическому), широкому антимикотическому спектру действия, липофильным свойствам молекулы, а также низкой системной абсорбции и интенсивному накоплению в месте нанесения может являться эффективной и безопасной альтернативой существующим на фармацевтическом рынке лекарственным препаратам для терапии кожных заболеваний волосистой части головы, вызванных дрожжеподобными микроорганизмами Malassezia spp., в частности себорейного дерматита.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: В.М. Косман — разработка и валидация биоаналитической методики, проведение анализа фармакокинетических параметров, написание текста рукописи; М.В. Карлина — обсуждение результатов оценки фармакокинетики; В.А. Вавилова — координация планирования и выполнения исследовательской работы, сбор, анализ и интерпретация данных, обсуждение результатов оценки общетоксического и местнораздражающего действия; К.Е. Боровкова — оценка противогрибкового действия; К.Л. Крышень — обсуждение результатов оценки противогрибкового действия; Н.В. Марченко — идея, критический анализ дизайна исследования и редактирование текста рукописи; С.А. Копатько — идея исследования; И.В. Сычкова — критический анализ дизайна исследования; Д.Р. Каргопольцева — анализ данных литературы и редактирование текста рукописи; М.Н. Макарова — критический пересмотр содержания рукописи; В.Г. Макаров — критический пересмотр содержания и утверждение окончательного варианта рукописи для публикации.
Соответствие принципам этики. Все исследования были выполнены в соответствии с рекомендациями Директивы 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях. Проведение исследований было одобрено на заседании биоэтической комиссии (БЭК) АО «НПО «ДОМ ФАРМАЦИИ», протоколы заседаний БЭК от 13.04.2018 № 2.23/18, БЭК от 18.04.2018 № 1.24/18.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Vera M. Kosman developed and validated the bioanalytical assay, analysed pharmacokinetic parameters, and drafted the manuscript. Marina V. Karlina discussed the pharmacokinetics study results. Valeria A. Vavilova coordinated study planning and research activities; collected, analysed, and interpreted data; discussed the general toxicity and local tolerance testing results. Kristina Е. Borovkova evaluated the antifungal effect. Kirill L. Kryshen discussed the results of the antifungal effect assessment. Natalia V. Marchenko elaborated the study idea, critically analysed the study design, and edited the manuscript. Svetlana A. Kopatko elaborated the study idea. Irina V. Sychkova critically analysed the study design. Dilara R. Kargopoltseva analysed literature and edited the manuscript. Marina N. Makarova critically revised the manuscript. Valery G. Makarov critically revised the manuscript and approved the final version for publication.
Ethics approval. All the experiments were performed according to the recommendations of Directive 2010/63/EU of the European Parliament and of the Council of 22.09.2010 on the protection of animals used for scientific purposes. The studies were approved by the Bioethics Committee of the research-and-manufacturing company “HOME OF PHARMACY” (Approval No. 2.23/18 of 13.04.2018; Approval No. 1.24/18 of 18.04.2018).
1. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=2296c5fd-1c02-4987-8996-b6abcca26ae2
2. В настоящее время препарат Сертаверин® шампунь лекарственный 2% (АО «ВЕРТЕКС», Россия) зарегистрирован в Российской Федерации (РУ № ЛП-008238 от 09.03.2022).
3. ГОСТ 32642-2014. Методы испытания по воздействию химической продукции на организм человека. Определение токсичности при повторном/многократном накожном поступлении. 28/21-дневный тест.
Test No. 410: Repeated Dose Dermal Toxicity: 21/28-day Study. OECD Guidelines for the Testing of Chemicals, Section 4. OECD: OECD Publishing, Paris; 1981. https://doi.org/10.1787/9789264070745-en
4. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012. C. 845–55.
5. ICH Q2A. Text on validation of analytical procedures. ICH harmonised tripartite guideline. Geneva; 1994.
ICH Q2B. Validation of analytical procedure: methodology. ICH harmonised tripartite guideline. Geneva; 1996.
Bioanalytical method validation. Guidance for industry. FDA; 2018.
Guideline on bioanalytical method validation. EMEA/CHMP/EWP192217/2009. EMA; 2011.
6. ГОСТ Р ИСО 16256-2015 «Клинические лабораторные исследования и диагностические тест-системы in vitro. Референтный метод для тестирования активности in vitro антимикробных препаратов в отношении дрожжевых грибов, вызывающих инфекционные заболевания».
7. ГОСТ Р ИСО 16256-2015 «Клинические лабораторные исследования и диагностические тест-системы in vitro. Референтный метод для тестирования активности in vitro антимикробных препаратов в отношении дрожжевых грибов, вызывающих инфекционные заболевания».
8. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f80c25e1-4aac-40d9-be7c-93d9201196bb&t=
9. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012. C. 845–55.
Список литературы
1. Peyrí J, Lleonart M, the Spanish Group of the SEBDERM Study. Clinical and therapeutic profile and quality of life of patients with seborrheic dermatitis. Actas Dermosifiliogr. 2007;98(7):476–82 (In Spanish). https://doi.org/10.1016/s1578-2190(07)70491-2
2. Kim GK. Seborrheic dermatitis and malassezia species: How are they related? J Clin Aesthet Dermatol. 2009;2(11):14–7. PMID: 20725575
3. Agut J, Palacín C, Salgado J, Casas E, Sacristán A, Ortiz JA. Direct membrane-damaging effect of sertaconazole on Candida albicans as a mechanism of its fungicidal activity. Arzneimittelforschung. 1992;42(5A):721–4. PMID: 1627191
4. Farré M, Ugena B, Badenas JM, Márquez M, Roset P, Ortiz JA. Pharmacokinetics and tolerance of sertaconazole in man after repeated percutaneous administration. Arzneimittelforschung. 1992;42(5A):752–4. PMID: 1627199
5. Матушевская ЕВ, Свирщевская ЕВ. Топические формы сертаконазола в терапии грибковых заболеваний гладкой кожи. Вестник дерматологии и венерологии. 2014;(5):106–11. https://doi.org/10.25208/0042-4609-2014-90-5-106-111
6. Pedragosa R, González B, Martín M, Herrero E, Roset P, Márquez M, et al. Therapeutic efficacy and safety of the new antimycotic sertaconazole in the treatment of cutaneous dermatophytosis. Arzneimittelforschung. 1992;42(5A):760–3. PMID: 1627202
7. Carrillo-Muñoz AJ, Tur-Tur C, Giusiano G, Marcos-Arias C, Eraso E, Jauregizar N, Quindós G. Sertaconazole: an antifungal agent for the topical treatment of superficial candidiasis. Expert Rev Anti Infect Ther. 2013;11(4):347–58. https://doi.org/10.1055/s-0031-1296869
8. Alomar C, Bassas S, Casas M, Crespo V, Ferrándiz C, Fonseca E, et al. Multi-centre double-blind trial on the efficacy and safety of sertaconazole 2% cream in comparison with miconazole 2% cream on patients suffering from cutaneous mycoses. Arzneimittelforschung. 1992;42(5A):767–73. https://doi.org/10.1016/j.diagmicrobio.2006.04.006
9. Pfaller MA, Sutton DA. Review of in vitro activity of sertaconazole nitrate in the treatment of superficial fungal infections. Diagn Microbiol Infect Dis. 2006;56(2):147–52. https://doi.org/10.1016/j.diagmicrobio.2006.04.006
10. Manian M, Madrasi K, Chaturvedula A, Banga AK. Investigation of the dermal absorption and irritation potential of sertaconazole nitrate anhydrous gel. Pharmaceutics. 2016;8(3):21. https://doi.org/10.3390/pharmaceutics8030021
11. Susilo R, Korting HC, Strauss UP, Menke G, Schuster O, Menke A. Rate and extent of percutaneous absorption of sertaconazole nitrate after topical administration. Arzneimittelforschung. 2005;55(6):338–42. https://doi.org/10.1055/s-0031-1296869
12. Tavakoli N, Taymouri S, Saeidi A, Akbari V. Thermosensitive hydrogel containing sertaconazole loaded nanostructured lipid carriers for potential treatment of fungal keratitis. Pharm Dev Technol. 2019;24(7):891–901. https://doi.org/10.1080/10837450.2019.1616755
13. Russell WMS, Burch RL. The principles of humane experimental technique. London: Methuen and Co; 1959.
14. Bland JM. An introduction to medical statistics. New York: Oxford University Press; 2000.
15. Altman DG, Bland JM. How to randomise. BMJ. 1999;319(7211):703–4. https://doi.org/10.1136/bmj.319.7211.703
16. Zhang Y, Huo M, Zhou J, Xie S. PKSolver: an add-in program for pharmacokinetic and pharmacodynamic data analysis in Microsoft Excel. Comput Methods Programs Biomed. 2010;99(3):306–14. https://doi.org/10.1016/j.cmpb.2010.01.007
17. Mandlik SK, Siras SS. RP-HPLC method development and validation for the estimation of sertaconazole nitrate in bulk and tablet dosage form. Int J Chemtech Res. 2017;10(1):573–80.
18. Rizk M, Toubar SS, El-Alamin MMA, Azab MMM. Micellar liquid chromatographic determination of sertaconazole and terconazole in bulk, pharmaceutical dosage forms and spiked human plasma. Bul Fac Pharm Cairo Univ. 2014;52(1):155–64. https://doi.org/10.1016/j.bfopcu.2014.03.002
19. Wang Y, Pang L, Wu M, Ou N. A validated LC-MS/ MS method for determination of sertaconazole nitrate in human plasma. J Chromatogr B Analyt Technol Biomed Life Sci. 2009;877(31):4047–50. https://doi.org/10.1016/j.jchromb.2009.09.032
20. Van Gerven F, Odds F.C. The anti-Malassezia furfur activity in vitro and in experimental dermatitis of six imidazole antifungal agents: bifonazole, clotrimazole, flutrimazole, ketoconazole, miconazole and sertaconazole. Mycoses. 1995;38(9–10):389–93. https://doi.org/10.1111/j.1439-0507.1995.tb00070.x
Об авторах
В. М. КосманРоссия
Косман Вера Михайловна, канд. фарм. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
М. В. Карлина
Россия
Карлина Марина Валерьевна, канд. биол. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
В. А. Вавилова
Россия
Вавилова Валерия Александровна
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
К. Е. Боровкова
Россия
Боровкова Кристина Евгеньевна
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
К. Л. Крышень
Россия
Крышень Кирилл Леонидович, канд. биол. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Н. В. Марченко
Россия
Марченко Наталья Владимировна, канд. фарм. наук
дорога в Каменку, д. 62, лит. А, Санкт-Петербург, 197350
С. А. Копатько
Россия
Копатько Светлана Александровна
дорога в Каменку, д. 62, лит. А, Санкт-Петербург, 197350
И. В. Сычкова
Россия
Сычкова Ирина Викторовна
дорога в Каменку, д. 62, лит. А, Санкт-Петербург, 197350
Д. Р. Каргопольцева
Россия
Каргопольцева Дилара Рафаэлевна
дорога в Каменку, д. 62, лит. А, Санкт-Петербург, 197350
М. Н. Макарова
Россия
Макарова Марина Николаевна, д-р мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
В. Г. Макаров
Россия
Макаров Валерий Геннадьевич, д-р мед. наук, профессор
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Дополнительные файлы
Рецензия
Для цитирования:
Косман В.М., Карлина М.В., Вавилова В.А., Боровкова К.Е., Крышень К.Л., Марченко Н.В., Копатько С.А., Сычкова И.В., Каргопольцева Д.Р., Макарова М.Н., Макаров В.Г. Сравнительная доклиническая оценка безопасности, противогрибковой активности и фармакокинетики препаратов сертаконазола для наружного применения. Безопасность и риск фармакотерапии. 2024;12(1):83-98. https://doi.org/10.30895/2312-7821-2023-358
For citation:
Kosman V.M., Karlina M.V., Vavilova V.A., Borovkova K.E., Kryshen K.L., Marchenko N.V., Kopatko S.A., Sychkova I.V., Kargopoltseva D.R., Makarova M.N., Makarov V.G. Comparative Preclinical Evaluation of the Safety, Antifungal Activity, and Pharmacokinetics of Sertaconazole Products for External Use. Safety and Risk of Pharmacotherapy. 2024;12(1):83-98. (In Russ.) https://doi.org/10.30895/2312-7821-2023-358
JATS XML





































