Перейти к:
Доклиническая оценка безопасности противоопухолевых препаратов на основе живых непатогенных энтеровирусов
https://doi.org/10.30895/2312-7821-2024-415
Резюме
ВВЕДЕНИЕ. Создание новых препаратов на основе непатогенных штаммов энтеровирусов, обладающих онкотропными и онколитическими свойствами, является одним из современных и безопасных подходов к комплексному лечению онкологических заболеваний и профилактике постоперационного метастазирования. Необходимый этап доклинических исследований — изучение фармакологической безопасности лекарственных препаратов.
ЦЕЛЬ. Изучение общетоксического (при однократном и многократном введении), местнораздражающего действия, фармакологической безопасности и пирогенности как этапа регистрационных доклинических исследований безопасности препаратов на основе непатогенных штаммов энтеровирусов ЖЭВ4, ЖЭВ7, ЖЭВ8, ЖЭВ14 и Russo.
МАТЕРИАЛЫ И МЕТОДЫ. Препараты представляли собой высокоочищенные энтеровирусы групп А, В, С, выращенные в культуре клеток Vero, титр вируса: 2×107–5×108 ЦПД50/мл (ЦПД50 — цитопатогенная доза вируса, лизирующая 50% клеток); растворитель — изотонический раствор натрия хлорида. Исследование безопасности препаратов проводили на 220 мышах BALB/c и 440 крысах линии Wistar обоего пола, 18 кроликах самцах породы «Советская шиншилла». Препараты вводили внутривенно в дозах 1×105 и 1×106 ЦПД50/особь однократно или в течение 90 суток 1 раз в неделю при исследовании токсичности при многократном введении в вышеуказанных дозах. Клинико-лабораторные, патоморфологические исследования проводили на 45 и 91 сутки эксперимента. Статистическую обработку результатов осуществляли с использованием пакета статистических программ GraphPad Prism 8.0 (GraphPad Software, Inc., США).
РЕЗУЛЬТАТЫ. Установлено, что после однократного введения мышам и крысам каждого из пяти препаратов на основе энтеровирусов не наблюдалось летальности, отмечалась позитивная динамика набора массы тела, не было выявлено макроскопических и микроскопических патологических изменений мозга, селезенки, печени, почек, легких, места введения. При многократном введении в изученных дозах препараты не вызвали функциональных изменений со стороны органов и систем. Все изучаемые показатели находились в пределах физиологической нормы для самцов и самок крыс. При гистологическом исследовании не отмечалось каких-либо патологических изменений, специфического цитолитического и/или цитопатического вирусного действия. Местнораздражающее действие отсутствовало. Все исследуемые препараты не обладали пирогенным эффектом.
ВЫВОДЫ. Результаты проведенных доклинических исследований продемонстрировали безопасность противоопухолевых препаратов ЖЭВ4, ЖЭВ7, ЖЭВ8, ЖЭВ 14 и Russo на основе живых непатогенных энтеровирусов.
Ключевые слова
Для цитирования:
Сивак К.В., Стосман К.И., Калинина Е.Ю., Любишин М.М., Оршанская Я.Р., Саватеева-Любимова Т.Н., Казакова С.Б., Федосеева Д.М., Назаров А.С., Радион Е.И., Юдин С.М., Кескинов А.А., Макаров В.В., Юдин В.С., Желтухин А.О., Воробьев П.О., Кочетков Д.В., Ильинская Г.В., Липатова А.В., Чумаков П.М. Доклиническая оценка безопасности противоопухолевых препаратов на основе живых непатогенных энтеровирусов. Безопасность и риск фармакотерапии. 2024;12(4):444-462. https://doi.org/10.30895/2312-7821-2024-415
For citation:
Sivak K.V., Stosman K.I., Kalinina E.Yu., Lyubishin M.M., Orshanskaya Ya.R., Savateeva-Lyubimova T.N., Kazakova S.B., Fedoseeva D.M., Nazarov A.S., Radion E.I., Yudin S.M., Keskinov A.A., Makarov V.V., Yudin V.S., Zheltukhin A.O., Vorobyev P.O., Kochetkov D.V., Ilyinskaya G.V., Lipatova A.V., Chumakov P.M. Preclinical Safety Assessment of Antineoplastic Agents Based on Live Non-Pathogenic Enteroviruses. Safety and Risk of Pharmacotherapy. 2024;12(4):444-462. (In Russ.) https://doi.org/10.30895/2312-7821-2024-415
ВВЕДЕНИЕ
Несмотря на значительный прогресс в борьбе со злокачественными новообразованиями, поиск эффективных и более безопасных методов лечения, вызывающих селективную гибель опухолевых клеток, все еще остается актуальным. Основными методами лечения рака являются хирургическая резекция опухолей, химиотерапия и лучевая терапия, имеющие как преимущества, так и серьезные побочные эффекты. Лекарственная таргетная химиотерапия более предпочтительна, но ее возможности ограничены не только токсичностью противоопухолевых средств, но и лекарственной устойчивостью опухолей. Применение онколитических вирусов, представляющих собой класс терапевтических средств, которые позволяют эффективно разрушать злокачественные трансформируемые клетки (онколиз), не затрагивая здоровые ткани организма, является одним из перспективных методов профилактики метастазирования после резекции опухолей и лечения онкологических заболеваний [1–3]. Благодаря механизмам, отличным от действия существующих противоопухолевых препаратов, онколитические вирусы расширяют возможности лечения опухолей различных локализаций [4]. С развитием технологий генной инженерии онколитические вирусы стали использоваться в качестве универсальной платформы для разработки новых противоопухолевых стратегий, которые могут применяться как отдельно, так и в сочетании с другими методами лечения [5]. Кроме прямого воздействия на опухолевые клетки онколитические вирусы способны активировать противоопухолевый иммунитет, защиту от ускользания опухолевых клеток от иммунного контроля [6–12].
В качестве одного из наиболее перспективных агентов для противоопухолевой терапии можно рассматривать энтеровирусы человека из семейства Picornaviridae [13, 14]. Многие представители энтеровирусов практически непатогенны для людей, что позволило на их основе создать живые энтеровирусные вакцины (ЖЭВ), которые применялись для профилактики и лечения сезонных вирусных заболеваний за счет феномена интерференции с болезнетворными вирусами [15, 16]. При этом наблюдался позитивный клинический эффект и в отношении злокачественных заболеваний вплоть до полного исчезновения опухоли и метастазов [17–19]. Непатогенные штаммы энтеровирусов человека используют несколько альтернативных клеточных рецепторов для проникновения в клетку, что может определять их способность заражать опухолевые клетки, на которых в достаточном количестве экспрессируется соответствующий рецептор [8].
Ликвидация неопластических клеток может происходить за счет способности онколитических вирусов размножаться в клетках злокачественных опухолей и вызывать их лизис. Онколитические вирусы обладают не только прямой цитотоксической активностью, но и стимулируют иммунные реакции организма хозяина, что приводит к разрушению остаточных злокачественных клеток, а также к установлению прочного противоопухолевого иммунитета и индукции образования интерферона [20]. Онколитические вирусы губительно действуют на устойчивые к апоптозу опухолевые клетки и в связи с этим не имеют перекрестной резистентности к применяемой стандартной противоопухолевой терапии. Есть данные, подтверждающие, что онколитические вирусы вызывают повышение чувствительности опухолевых клеток к химио- и лучевой терапии, а также к ингибиторам контрольных иммунных точек [21–25].
Доклинические и клинические исследования препаратов на основе онколитических вирусов показали высокую эффективность лечения ряда онкологических заболеваний при сравнительно малой токсичности [26]. Однако более перспективным является использование онколитических вирусов как платформы для иммунотерапии злокачественных новообразований. Так, в настоящее время созданы рекомбинантные штаммы онколитических вирусов с целью повышения их онкоселективности и иммуногенности [27–30].
Штаммы онколитических вирусов ЖЭВ4, ЖЭВ7, ЖЭВ14 (энтеровирус В) и ЖЭВ8 (энтеровирус А) ранее испытывались как живые энтеровирусные вакцины, они представляют собой непатогенные энтеровирусные штаммы, выделенные из фекалий здоровых детей в возрасте от 2 до 5 лет [31–33]. Рекомбинантный штамм полиовируса 3 типа Russo (энтеровирус С) был сконструирован на основе вакцинного штамма Сэбина путем замены 5’-концевого регуляторного участка внутренней посадки рибосом на гомологичный сегмент непатогенного энтеровирусного штамма ЖЭВ14. Подобная модификация устраняет присутствующий в полиовирусном геноме участок, способствующий репликации вируса в нейронах, что обеспечивает дополнительную безопасность вируса [34, 35]. Противоопухолевая и репликативная активность этих лекарственных средств была изучена in vitro с помощью титрования на культуре клеток почки обезьяны Vero. Показано, что данные вирусные штаммы обладают способностью активно реплицироваться и оказывать избирательное цитотоксическое (онколитическое) действие на неопластические клетки многих злокачественных заболеваний: глиальных опухолей головного мозга, рака яичника, легкого, молочной железы, толстого кишечника, шейки матки, простаты, почки, желудка, меланомы, мезотелиомы, миеломы, нескольких видов сарком, лимфом и ряда других патологий. При заражении опухолевых клеток вирусным препаратом происходит образование новых вирусных частиц, способных к дальнейшему распространению внутри опухоли с переходом на отдаленные опухолевые очаги (метастазы). Важной активностью препаратов является их способность уничтожать опухоль-инициирующие стволовые клетки, снижая вероятность рецидивов заболевания [36]. Приведенные сведения обосновывают актуальность разработки и проведения регистрационных исследований новых препаратов на основе апатогенных онколитических вирусов в России.
Цель работы — изучение общетоксического действия (при однократном и многократном введении), местнораздражающего действия, фармакологической безопасности и пирогенности как этапа регистрационных доклинических исследований безопасности препаратов на основе непатогенных штаммов энтеровирусов ЖЭВ4, ЖЭВ7, ЖЭВ8, ЖЭВ 14 и Russo.
МАТЕРИАЛЫ И МЕТОДЫ
Изучаемые препараты. Доклиническое исследование безопасности противоопухолевых препаратов на основе непатогенных энтеровирусов ЖЭВ4, ЖЭВ7, ЖЭВ8, ЖЭВ14 и Russo, ранее полученных д.б.н., чл.-корр. РАН П.М. Чумаковым в Институте молекулярной биологии имени В.А. Энгельгардта РАН, было проведено в лаборатории безопасности лекарственных средств ФГБУ «НИИ гриппа им. А.А. Смородинцева». Результаты исследования частично представлены в данной статье.
Штамм ЖЭВ4 — энтеровирус В. Используемые клеточные рецепторы — ITGA2 и ICAM-1. Штамм адаптирован к репликации в клетках HEK293Т и RD. При адаптации отмечено 5 нуклеотидных замен, приводящих к заменам синонимических кодонов без изменения аминокислотной структуры белка. Штамм по нуклеотидному составу наиболее близок вирусу Echo 1, штамм Farouk (79,3% гомологии).
Штамм ЖЭВ7 — энтеровирус В. Используемые клеточные рецепторы — CD55 и FCGRT. Штамм адаптирован к репликации в клетках HEK293Т, NCI-H1299 и RD. При адаптации отмечено 8 нуклеотидных замен, приводящих к заменам синонимических кодонов без изменения аминокислотной структуры белка. Штамм по нуклеотидному составу наиболее близок вирусу Echo 12, штамм Travis (81,27% гомологии).
Штамм ЖЭВ8 — энтеровирус А. Используемые клеточные рецепторы — SCARB2 и CD55. Штамм адаптирован к репликации в клетках HEK293Т, RD и Vero. При адаптации отмечены 3 нуклеотидные замены, приводящие к заменам синонимических кодонов без изменения аминокислотной структуры белка. Штамм по нуклеотидному составу близок вирусу Coxsackie A7, штамм Parker (96,14% гомологии).
Штамм ЖЭВ14 — энтеровирус В. Используемые клеточные рецепторы — CD55 и CXADR. Штамм адаптирован к репликации в клетках HEK293Т и Vero. При адаптации отмечено 4 нуклеотидные замены, приводящие к заменам синонимических кодонов без изменения аминокислотной структуры белка. Штамм по нуклеотидному составу близок вирусу Coxsackie B5, штамм Faulkner (82,47% гомологии) и везикулярному вирусу свиней SVDV (79,12% гомологии).
Штамм Russo — рекомбинантный энтеровирус на основе вакцинного штамма полио 3 (энтеровирус С) и штамма ЖЭВ 14 (энтеровирус В). Используемый клеточный рецептор — PVR/ CD155. Рекомбинантный вирус получен на основе вакцинного штамма полиовируса 3 типа (штамм Sabin). Природный 5’-концевой IRES полиовируса заменен на композитный синтетический IRES, имеющий на 5’-конце 88 нуклеотидный участок IRES полиовируса 3 типа и далее 707 нуклеотидов от IRES вируса Coxsackie B5, и дистальный участок IRES полиовируса 3 типа размером 36 нуклеотидов. Композитный IRES не содержит участок, связывающий трансляционные факторы, необходимые для репликации вируса в клетках нейронального происхождения. Штамм получен путем оживления на матрице синтетической ДНК копии рекомбинантного вируса.
Каждый из 5 препаратов является лекарственным средством для терапии онкологических заболеваний человека в лекарственной форме раствор для внутриопухолевого, внутримышечного и внутривенного введения, а также для введения в область операционной раны после хирургического удаления опухоли.
Препараты представляют собой высокоочищенные живые непатогенные энтеровирусы групп А, В или С. В 2 мл каждого раствора препарата содержится энтеровирус, выращенный в культуре клеток почки обезьяны Vero. Титр вируса: 2×107–5×108 ЦПД50/мл (ЦПД50 — цитопатогенная доза вируса, лизирующая 50% клеток). В качестве вспомогательного вещества (растворителя) использовали изотонический раствор натрия хлорида. Препараты не содержат консерванты, антибиотики, стимуляторы и другие потенциально токсические вещества. Каждый препарат представляет собой бесцветную прозрачную жидкость, хранящуюся при температуре –20±2 °C, расфасованную в стеклянную ампулу, которую непосредственно перед использованием следует разморозить до комнатной температуры и встряхнуть. Стандартизацию препаратов перед исследованием проводили индивидуально для каждого штамма. Титр вируса определяли методом конечного разведения через 24 ч после инфицирования.
Животные. Экспериментальное исследование проводили с соблюдением этических принципов обращения с лабораторными животными в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Протокол исследования был одобрен биоэтической комиссией ФГБУ «НИИ гриппа им. А.А. Смородинцева» (протокол заседания от 12.05.2021 № 41). В работе использовали 220 мышей BALB/c и 440 крыс линии Wistar обоего пола, 18 кроликов самцов породы «Советская шиншилла», полученных из сертифицированного питомника лабораторных животных.
Дизайн исследования. Проведена оценка общетоксических свойств, местнораздражающего действия препаратов, изучена их фармакологическая безопасность (в отношении центральной нервной, сердечно-сосудистой, дыхательной систем, почек, печени и селезенки). Согласно руководству по доклиническому исследованию биотехнологических лекарственных средств1 способ и частота введения должны быть максимально приближены к тем, которые предлагаются для клинического применения. Частота введения препарата лабораторным животным может быть увеличена по сравнению с предлагаемой для человека, чтобы компенсировать более быструю скорость клиренса. В клинической практике предполагается еженедельное или один раз в 2–3 недели введение препаратов в течение 12 недель в зависимости от типа патологии. Согласно проекту инструкции, составленному разработчиком препаратов, эффективная для человека доза — 1×105 ЦПД50. В связи с этим для исследования безопасности на животных было использовано два уровня доз — 1×105 ЦПД50 /особь и в 10 раз ее превышающая (1×106 ЦПД50 /особь).
После рандомизации животные были разделены на группы согласно дизайну эксперимента (табл. 1). Для оценки токсичности при однократном введении было сформировано 11 экспериментальных групп, включающих мышей и крыс (1 группа — плацебо, 10 групп — животные), которым вводили однократно внутривенно препараты в двух дозах 1×105 и 1×106 ЦПД50 / особь. Каждая группа содержала по 10 самцов и 10 самок каждого вида животных. Плацебо (0,9% раствор натрия хлорида) вводили внутривенно в объеме 0,2 мл/особь. Длительность наблюдения за животными составила 14 сут. В течение этого периода регистрировали массу тела, клиническую картину (общее состояние животных, особенности их поведения, интенсивность и характер двигательной активности, наличие судорог, координация движений, тонус скелетных мышц, реакция на тактильные, болевые, звуковые и световые раздражители, частота и глубина дыхательных движений, ритм сердечных сокращений, состояние шерстного и кожного покрова, окраска слизистых оболочек, размер зрачка, положение хвоста, консистенция фекальных масс, окраска мочи), наличие летальности. После эвтаназии (в CO2-боксе для эвтаназии, VetTech Solutions, Великобритания) проводили визуальный осмотр органов. У животных, получавших препараты в максимальной дозе, проводили гистологическое исследование тканей в месте введения препаратов, а также мозга, сердца, почек, печени, легких и селезенки.
При изучении токсичности при многократном введении2 препараты вводили крысам внутривенно в дозах 1×105 и 1×106 ЦПД50/ особь на протяжении 90 сут с интервалом 7 сут. Животные были разделены на 11 групп (1 группа — плацебо, 10 групп — животные, которым вводили препараты в двух разных дозах), каждая из которых содержала по 10 самцов и 10 самок. Оценивали летальность, клиническую картину, массу и температуру тела, потребление корма и воды. Анализ мочи, гематологические и биохимические исследования проводили на 45 и 91 сут после начала исследования. Изучали структуру поведения в тесте «открытое поле» (латентный период, горизонтальные перемещения, вертикальные стойки, количество заглядываний в отверстия, болюсов, время неподвижности, груминг), используя установку «Открытое поле» (ООО «НПК Открытая Наука», Россия). Электрокардиографически (с помощью электронного блока «Поли-Спектр-8/В», Россия) оценивали функциональное состояние сердечно-сосудистой системы (частоту сердечных сокращений, интервалы PQ, QT (QTc), QRS, RR, амплитуду зубцов P, R, T), а также частоту дыхания (пальпаторно).
Анализ крови проводили на автоматическом гематологическом анализаторе Abacus (Diatron, Австрия — Венгрия) и регистрировали следующие показатели: количество эритроцитов, концентрация гемоглобина, гематокрит, среднее содержание гемоглобина в клетке, средняя концентрация гемоглобина в клетке, количество лейкоцитов, лейкоцитарная формула, количество тромбоцитов. Скорость оседания эритроцитов оценивали на анализаторе Ves-Matic 10 (Diesse, Италия).
Биохимические показатели (альбумин, глобулины, общий белок, аланининовая трансаминаза (АЛТ), аспарагиновая трансаминаза (АСТ), щелочная фосфатаза (ЩФ), общий билирубин, глюкоза, общий холестерин, триглицериды (ТАГ), мочевина, креатинин) определяли с помощью готовых наборов для клинической биохимии на автоматическом биохимическом анализаторе KeyLab (BPC BioSed, Италия), электролиты (калий, натрий, хлориды и кальций) — на анализаторе E-Lyte Plus (High Technology Inc., США).
Протромбиновое время, активированное парциальное тромбопластиновое время и фибриноген определяли на гемокоагулометре Coag 4D (Diagon, Венгрия). Протромбиновый индекс и международное нормализованное отношение рассчитывались автоматически на приборе.
Анализ мочи проводили на 45 и 90 сут эксперимента. Для сбора мочи крыс помещали в обменные клетки (Tecniplast, Италия) на 16–24 ч при свободном доступе к питьевой воде. Оценивали объем диуреза, уровень глюкозы, белка, билирубина, уробилиногена, кетонов, рН, плотность, количество лейкоцитов, эритроцитов, наличие слизи. Клинический анализ мочи осуществляли с помощью тест-полосок на анализаторе Aution Eleven 4020 (Arkray, Япония). Уровень белка и креатинина в моче определяли на биохимическом анализаторе URIСКАН-БК («Эйлитон», Россия). Микроскопический анализ мочи осуществляли методом суправитальной окраски с подсчетом клеточных элементов в слайд-планшете при увеличении ×100 и ×400 на светооптическом микроскопе DM1000 (Leica, Германия).
После окончания эксперимента (на 91 сут) проводили патоморфологическое исследование органов (головной мозг, сердце, легкие, тимус, селезенка, костный мозг, печень, почки, надпочечники, желудок, двенадцатиперстная кишка, поджелудочная железа, яички и яичники) и места введения препаратов. Были рассчитаны массовые коэффициенты каждого органа (головного мозга, тимуса, сердца, легких, селезенки, печени, почек, надпочечников, яичек или яичников), представляющие собой отношение массы органа к массе тела животного (мг/г).
Для гистологического исследования ткани фиксировали в 10% забуференном растворе формалина («Биовитрум», Россия) и подвергали стандартной проводке в гистопроцессоре Histo-Tek VP1 (Sakura, Япония) с последующим заключением в парафин. Из парафиновых блоков делали срезы 5 мкм и стандартно окрашивали их гематоксилином и эозином. Препараты исследовали в световом микроскопе Leica DM1000 (Германия).
Пирогенность препаратов изучали на кроликах самцах породы «Советская шиншилла»3. Животные были разделены на 6 групп (1 группа — плацебо, остальные группы — 5 изучаемых препаратов), содержащих по 3 особи каждая (табл. 1). Препараты вводили внутривенно в дозе 1×105 ЦПД50/особь. Измерение температуры проводили с интервалом 30 мин на протяжении 3 ч.
Статистическая обработка данных. Обработку полученных результатов выполняли с использованием пакета статистических программ Prism 8.0 (GraphPad Software, Inc., США). Данные представлены в виде среднего значения (Mean) и его стандартного отклонения (±SD). Проверку на нормальность распределения проводили методом Шапиро–Уилка. Для выявления различий между независимыми группами использовали непараметрические критерии Краскела–Уоллиса, а при попарном сравнении критерии Данна, Бонферрони и считали значимыми при уровне р<0,05.
Таблица 1. Дизайн эксперимента
Table 1. Study design
Тип исследования Study type | Животные Animals | Группа Group | Доза Dose | Количество введений Number of injections | Количество и пол животных в группе Number and sex of animals in the group |
Токсичность при однократном введении Single-dose toxicity | Мыши, крысы Mouse, rat | Плацебо Placebo | 0 | 1 | 10 M + 10 F |
Штаммы ЖЭВ4, ЖЭВ7, ЖЭВ8, ЖЭВ14, Russo LEV4, LEV7, LEV 8, LEV14, Russo | 1×105 ЦПД50 /особь 1×105 CPD50 /animal | 1 | 10 M + 10 F | ||
1×106 ЦПД50 /особь 1×106 CPD50 /animal | 1 | 10 M + 10 F | |||
Токсичность при многократном введении Repeated-dose toxicity | Крысы Rat | Плацебо Placebo | 0 | 13 (1 раз в неделю) 13 (once a week) | 10 M + 10 F |
Штаммы ЖЭВ4, ЖЭВ7, ЖЭВ8, ЖЭВ14, Russo LEV4, LEV7, LEV8, LEV14, Russo | 1×105 ЦПД50 /особь 1×105 CPD50 /animal | 10 M + 10 F | |||
1×106 ЦПД50 /особь 1×106 CPD50 /animal | 10 M + 10 F | ||||
Пирогенность Pyrogen test | Кролики Rabbit | Плацебо Placebo | 0 | 1 | 3 M |
Штаммы ЖЭВ4, ЖЭВ7, ЖЭВ8, ЖЭВ14, Russo LEV4, LEV7, LEV8, LEV14, Russo | 1×105 ЦПД50 /особь 1×105 CPD50 /animal | 1 | 3 M |
Примечание. ЦПД — цитопатогенная доза; ЦПД50 — доза вируса, лизирующая 50% клеток; ЖЭВ — живой энтеровирус; Russo — рекомбинантный энтеровирус; M — самцы; F — самки.
Note. CPD, cytopathogenic dose; CPD50, virus dose causing 50% cell lysis; LEV, live enterovirus; Russo, recombinant enterovirus; M, males; F, females.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка токсичности при однократном введении
При изучении токсичности при однократном введении каждый из препаратов вводили внутривенно мышам и крысам обоего пола в дозах 1×105 и 1×106 ЦПД50/особь с целью регистрации нежелательных реакций, развивающихся в первые дни введения, и признаков токсичности. В течение 14 сут наблюдения у животных не регистрировалось изменений поведенческих реакций, отмечалась позитивная динамика изменения массы тела. Летальность отсутствовала. Клиническая картина у всех экспериментальных животных соответствовала таковой для здоровых особей. Изменений в величине массовых коэффициентов внутренних органов и головного мозга опытных мышей и крыс, получивших препараты в обеих дозах, по сравнению с животными из группы плацебо не было обнаружено.
Макроскопический осмотр мышей и крыс после эвтаназии не выявил внешних повреждений наружных покровов и органов. При гистологическом исследовании патологических изменений, а также специфического цитолитического и/или цитопатического вирусного действия во внутренних органах не было зарегистрировано, местнораздражающее действие отсутствовало.
Оценка токсичности при многократном введении
При оценке токсичности при многократном введении на протяжении всего эксперимента летальности крыс, получавших тестируемые препараты в обеих дозах, не отмечалось. Наблюдение за опытными животными не выявило каких-либо отклонений в их состоянии и поведении. Крысы оставались активными, регулярно потребляли корм и воду. Осмотр каждой особи не выявил слезотечения, саливации, закрытия века, аномалии дыхательных движений, кровоизлияний. Шерстный покров, цвет слизистых оболочек были без особенностей. Судорог, тремора, аномальных движений, нетипичного положения тела отмечено не было. Наблюдалась позитивная динамика изменения массы тела по отношению к фону. Хотя следует отметить, что у крыс, получавших изучаемые препараты, отмечалась небольшая задержка в наборе веса по сравнению с животными в группе плацебо (рис. 1), которую регистрировали в основном у самцов: у особей, получавших ЖЭВ4 в дозе 1×106 ЦПД50/особь, и у животных, получавших ЖЭВ14 в дозе 1×105 ЦПД50/особь, — с 21 сут и до окончания эксперимента; у особей, получавших ЖЭВ8 в обеих дозах и ЖЭВ14 в дозе 1×106 ЦПД50/особь — с 35 сут и до окончания эксперимента. У самок, которым вводили ЖЭВ14 в максимальной изученной дозе, этот эффект наблюдался только на 14 и 21 сут. Все выявленные изменения не выходили за пределы диапазона нормы.
Изучение динамики потребления корма показало наличие положительного прироста данного показателя по отношению к фону у животных из всех тестируемых групп. Наряду с этим нужно отметить статистически достоверное изменение уровня потребления корма у самцов, получавших ЖЭВ4 в обеих дозах и ЖЭВ7 в дозе 1×106 ЦПД50/особь, и сниженный уровень этого показателя у самок, которым вводили все изучаемые препараты, по отношению к группе плацебо (табл. 2). Практически во всех опытных группах отмечался сниженный уровень потребления воды по отношению к группе плацебо (табл. 3). Все выявленные статистически значимые изменения не выходили за пределы диапазона нормы для крыс4.
Оценка фармакологической безопасности
Токсического воздействия тестируемых препаратов на систему терморегуляции, на функциональное состояние центральной нервной системы крыс, оцененное в тесте «Открытое поле», не выявлено. Соотношение актов, составляющих структуру поведенческого паттерна, соответствовало нормальным значениям, присущим здоровым крысам, как на 45 сут эксперимента, так и по окончании введения препаратов.
При электрокардиографическом исследовании было показано, что у всех животных имел место правильный синусный ритм сердцебиения, признаков эктопических аритмий, нарушений внутрисердечной проводимости не наблюдалось. В сердце крыс при гистологическом исследовании не было обнаружено патоморфологических изменений, гистоархитектоника миокарда и стромы соответствовала видовой норме.
Повреждающее действие тестируемых препаратов на функциональное состояние дыхательной системы крыс отсутствовало. Различий между частотой дыхательных движений у особей из всех экспериментальных групп зарегистрировано не было. В легких крыс при гистологическом исследовании не было обнаружено патоморфологических изменений, гистоархитектоника воздухоносного и дыхательного отделов соответствовала видовой норме.
Клинико-лабораторные исследования
Анализ мочи не показал клинически значимых различий между показателями функциональной активности почек у опытных животных и крыс из группы плацебо как в середине эксперимента, так и по окончании введения препаратов. Гистологическое изучение почек не выявило патологических изменений гломерулярно-эндотелиального и тубулоинтерстициального компартмента почечной ткани. Стенки сосудов органа были без признаков склероза, гиалиноза и плазматического пропитывания, капилляры — умеренного кровенаполнения, просветы канальцев — свободные, ровные, очагов воспаления или дистрофии не отмечалось. Все вышеописанное позволило говорить об отсутствии повреждающего действия тестируемых препаратов на функциональное состояние мочевыделительной системы.
Морфологический состав крови (всех ростков кроветворения) и показатели системы плазменного гемостаза (фибриноген и протромбиновый комплекс) животных, получавших препараты, в целом соответствовали физиологической норме для крыс. По окончании введения наблюдались небольшие, но статистически значимые изменения, не выходившие за пределы физиологической нормы и не носившие дозозависимого характера5. В крови самцов, получавших ЖЭВ8 в дозе 1×106 ЦПД50/особь, регистрировалось увеличение абсолютного, но не относительного количества лимфоцитов. При этом процентное соотношение лимфоцитов, средних клеток и гранулоцитов не отличалось от такового в группе плацебо. У самцов, получавших ЖЭВ14 в дозе 1×105 ЦПД50/особь, но не в дозе, превышающей ее, имело место сниженное количество тромбоцитов (табл. 4). Выявленная тромбоцитопения наблюдалась на фоне отсутствия различий в показателях свертываемости крови по отношению к животным из группы плацебо. Кроме этого, в абсолютном выражении количество тромбоцитов у данных животных соответствовало физиологической норме для крыс линии Wistar6.
По окончании введения изучаемых препаратов наблюдались статистически достоверные отличия некоторых биохимических показателей по отношению к плацебо у животных из опытных групп, не выходящие за пределы физиологической нормы7. Результаты эксперимента представлены в таблице 5. Так, у самцов, получавших ЖЭВ8 в дозе 1×105 ЦПД50/особь, но не в дозе, превышающей ее, имело место сниженное содержание общего белка и глобулинов; у самок, получавших ЖЭВ7 в дозе 1×105 ЦПД50/ особь, но не в дозе, превышающей ее, — повышенное содержание глобулинов, а у самцов, получавших этот же препарат в дозе 1×106 ЦПД50/ особь, — увеличенная активность АЛТ; у самцов, получавших ЖЭВ4 в дозе 1×106 ЦПД50/особь, и у самок, получавших ЖЭВ8 также в максимальной дозе, — увеличенное содержание билирубина; у самок, получавших ЖЭВ7 и ЖЭВ8 в дозе 1×105 ЦПД50/особь, и самок, получавших Russo в дозе 1×106 ЦПД50/особь, — сниженное содержание креатинина.
У животных из опытных групп также было выявлено статистически достоверное повышение уровня триглицеридов, не выходившее за пределы диапазона нормы для крыс8. Исключение составили самки, получавшие ЖЭВ8 в максимальной изученной дозе, и самки, которым вводили ЖЭВ14 в обеих дозах, у которых уровень триглицеридов был превышен в 1,5–2,5 раза. В то же время однозначно судить о нарушении липидного профиля не представляется возможным, так как содержание холестерина у животных из данных групп соответствовало норме и составляло 1,76±0,14, 1,78±0,16 и 2,01±0,28 ммоль для ЖЭВ8 в дозе 1×106 ЦПД50/ особь и для ЖЭВ14 в дозах 1×105 и 1×106 ЦПД50/особь соответственно. Истинная гипертриглицеридемия могла быть обусловлена потреблением корма или нарушением всасывания липидов из кишечника, что требует дальнейшего уточняющего изучения.
Различий во влиянии на биохимические показатели, связанные с уровнем дозирования или продолжительностью введения препаратов, не было установлено.
Статистический анализ результатов изучения величины массовых коэффициентов органов свидетельствовал об отсутствии различий между животными из всех экспериментальных групп. Патоморфологическое исследование подтвердило отсутствие дистрофических, атрофических, воспалительных и некробиотических изменений печени, почек и иммунокомпетентных органов. Стенки сосудов печени и почек были без признаков склероза, гиалиноза и плазматического пропитывания, перивазальное пространство — без явлений отека, ткань не содержала непрофильной инфильтрации. Гистоархитектоника всех органов соответствовала видовой норме. Все это позволило утверждать, что выявленные отклонения со стороны белкового, углеводного, липидного, азотистого, пигментного и электролитного обменов веществ не были связаны с морфологическими изменениями внутренних органов. Препараты не проявляли гепатотоксического или нефротоксического действия.
У всех пяти исследуемых препаратов показано отсутствие пирогенного эффекта при внутривенном введении9, так как ни в одной экспериментальной группе суммарное максимальное изменение температуры не превышало 1,2 ºС, а индивидуальное повышение температуры было не больше 0,5 ºС. Так, у животных, получавших ЖЭВ4, ЖЭВ7 и ЖЭВ8, суммарное максимальное изменение температуры в группе составило 0,3 ºС, у кроликов, получавших ЖЭВ14 — 0,2 ºС, а у особей, которым вводили штамм Russo, — 0,6 ºС.
Данные патоморфологического обследования
Макроскопический осмотр наружных покровов, внутренних полостей и органов животных из контрольной и опытных групп как в середине эксперимента, так и по его окончании продемонстрировал типичное строение всех особей, отсутствие внешних повреждений. По результатам микроскопического исследования повреждающего действия препаратов на органы и системы, а также местнораздражающего действия выявлено не было.
Микроскопическое исследование органов гемопоэза не выявило каких-либо патологических изменений. Эритропоэтический островок костного мозга был образован преимущественно полихромными и оксифильными эритробластами. Эритропоэз соответствовал нормобластическому типу. Гранулоцитопоэтические островки были представлены базофильными миелоцитами и метамиелоцитами, лимфоцитарный росток — пролимфоцитами, моноцитарный росток — единичными промоноцитами, тромбоцитопоэтические островки — мегакариоцитами. В клеточном составе коркового вещества тимуса преобладали лимфоциты и плазматические клетки, также определялись апоптотические лимфоциты, макрофаги с базофильными цитоплазматическими включениями. Мозговое вещество было инфильтровано лимфоцитами, макрофагами и эпителиоретикулярными клетками. Белая пульпа селезенки была представлена лимфоидными фолликулами. Красная пульпа содержала эритроциты и большую популяцию моноцитов, макрофагов и плазматических клеток. Таким образом, полученные данные свидетельствуют о том, что гематотоксическое и иммунотоксическое действие у тестируемых препаратов отсутствует.
Большинство онколитических вирусов индуцируют терапевтический эффект без развития тяжелых побочных эффектов, что показано в многочисленных доклинических и клинических исследованиях по изучению токсичности различных препаратов на основе онколитических вирусов, в том числе и из семейства Picornaviridae [37–43].
Полученные нами результаты оценки фармакологической безопасности исследуемых препаратов на основе живых непатогенных энтеровирусов в дозах 1×105 и 1×106 ЦПД50/особь свидетельствуют об отсутствии нефротоксического, гепатотоксического, кардиотоксического действия и негативного влияния на дыхательную систему. Показатели обмена веществ, системы гемостаза, а также морфологический состав крови у животных соответствовали физиологической норме. Все выявленные в ходе эксперимента статистически значимые изменения не выходили за пределы диапазона нормы для самцов и самок крыс. Исключение составил повышенный уровень триглицеридов у самок, получавших ЖЭВ8 в дозе 1×106 ЦПД50/особь, и у самок, которым вводили ЖЭВ14 в обеих изученных дозах, наблюдавшийся на фоне нормального содержания холестерина. Существенные изменения величин массовых коэффициентов органов и их морфологии отсутствовали. Местнораздражающее действие не выявлено. Все тестируемые препараты на основе онколитических штаммов энтеровирусов в изученной дозе не обладали пирогенным эффектом. Доза, не вызвавшая патологических изменений (no observed adverse effect level, NOAEL), составила 1×106 ЦПД50/особь.
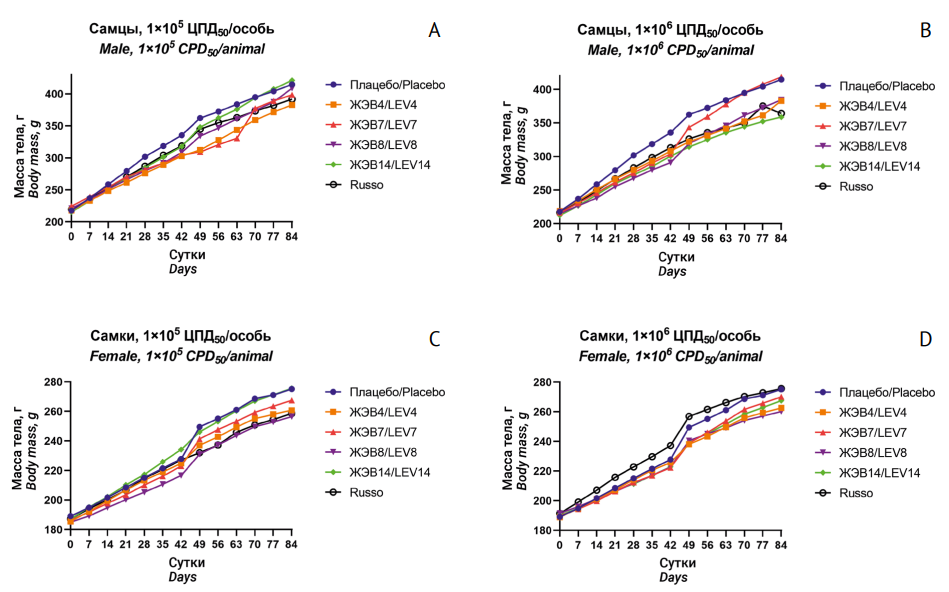
Рис. 1. Динамика изменения массы тела крыс (n=10), получавших препараты на основе живых непатогенных энтеровирусов. А — самцы, 1×105 ЦПД50/особь; В — самцы, 1×106 ЦПД50/особь; С — самки, 1×105 ЦПД50/особь; D — самки, 1×106 ЦПД50/особь. ЦПД50 — доза вируса, лизирующая 50% клеток; ЖЭВ — живой энтеровирус; Russo — рекомбинантный энтеровирус
Fig. 1. Time course of body weight changes in rats (n=10) treated with medicinal products based on live non-pathogenic enteroviruses. А: males, 1×105 CPD50/animal; В: males, 1×106 CPD50/animal; С: females, 1×105 CPD50/animal; D: females, 1×106 CPD50/animal. CPD50, virus dose causing 50% cell lysis; LEV, live enterovirus; Russo, recombinant enterovirus
Таблица 2. Динамика потребления корма крысами при многократном введении препаратов на основе живых непатогенных энтеровирусов (количество животных n=10)
Table 2. Time course of changes in feed consumption in rats (n=10) treated with repeated doses of medicinal products based on live non-pathogenic enteroviruses
Группа Group | Пол Sex | Количество потребляемого крысами корма, г Amount of feed consumed by rats, g | ||||||
Фон Baseline | 21 сутки Day 21 | 35 сутки Day 35 | 49 сутки Day 49 | 63 сутки Day 63 | 77 сутки Day 77 | 84 сутки Day 84 | ||
Плацебо Placebo | M | 18,3±1,3 | 19,4±1,5 | 19,7±1,5 | 21,3±0,9 | 21,6±0,9 | 21,8±0,8 | 22,0±0,8 |
F | 13,3±0,8 | 13,9±0,9 | 19,8±1,5 | 21,1±1,1 | 21,4±1,2 | 21,6±1,2 | 21,7±1,2 | |
ЖЭВ4, 1×105 ЦПД50 /особь LEV4, 1×105 CPD50 / animal | M | 18,4±1,1 | 18,6±1,1* | 19,1±1,1* | 19,9±0,7* | 20,2±0,8* | 20,5±0,7* | 20,7±0,8* |
F | 14,0±1,4 | 14,8±1,3 | 15,1±1,3* | 15,2±1,2* | 15,5±1,2 | 15,7±1,2* | 15,8±1,2* | |
ЖЭВ4, 1×106 ЦПД50 /особь LEV4, 1×106 CPD50 / animal | M | 17,4±1,9 | 17,8±1,9* | 18,2±1,9 | 18,8±2,3 | 19,1±2,3 | 19,3±2,3 | 19,4±2,3 |
F | 14,3±1,4 | 14,9±1,5 | 15,2±1,5* | 15,8±1,7* | 16,1±1,6 | 16,3±1,5 | 16,4±1,5* | |
ЖЭВ7, 1×105 ЦПД50 /особь LEV7, 1×105 CPD50 / animal | M | 17,0±1,6 | 17,8±1,5 | 18,3±1,5* | 19,4±0,8 | 16,3±7,9 | 20,1±0,5 | 20,2±0,5 |
F | 13,8±1,5 | 14,8±2,2 | 15,1±2,1* | 14,3±1,5* | 14,5±1,6 | 14,7±1,5* | 14,9±1,5* | |
ЖЭВ7, 1×106 ЦПД50/особь LEV7, 1×106 CPD50 / animal | M | 18,5±1,6 | 20,0±2,3* | 20,3±2,3 | 21,4±2,1 | 21,5±2,0 | 21,7±2,0 | 22,0±2,1 |
F | 14,0±1,1 | 14,6±1,1 | 14,9±1,1* | 14,9±1,0* | 15,1±1,0 | 15,4±1,0* | 15,5±1,0* | |
ЖЭВ8, 1×105 ЦПД50 /особь LEV8, 1×105 CPD50 / animal | M | 18,1±1,0 | 18,9±1,2 | 19,3±1,2 | 20,4±0,7 | 20,6±0,7 | 20,9±0,7 | 21,1±0,7 |
F | 13,9±1,5 | 14,5±1,7 | 14,7±2,2* | 14,7±1,5* | 14,9±1,4 | 15,2±1,4* | 15,3±1,5* | |
ЖЭВ8, 1×106 ЦПД50 /особь LEV8, 1×106 CPD50 / animal | M | 17,4±1,8 | 17,9±2,8 | 18,2±2,1 | 19,8±1,9 | 20,1±1,9 | 20,4±1,9 | 20,6±1,9 |
F | 14,0±1,1 | 14,5±1,1 | 14,8±1,1* | 15,2±1,6* | 15,3±1,5 | 15,6±1,5* | 15,8±1,4* | |
ЖЭВ14, 1×105 ЦПД50 /особь LEV14, 1×105 CPD50 / animal | M | 17,3±1,9 | 18,3±2,3 | 18,8±3,2 | 20,4±2,5 | 20,6±2,5 | 20,9±2,5 | 21,1±2,6 |
F | 13,3±1,7 | 14,2±1,4 | 14,5±1,3* | 13,6±0,7* | 13,9±0,6 | 14,2±0,6* | 14,4±0,6* | |
ЖЭВ14, 1×106 ЦПД50 /особь LEV14, 1×106 CPD50 / animal | M | 18,0±2,0 | 18,9±2,4 | 19,2±2,6 | 20,7±2,7 | 20,9±2,7 | 21,1±2,6 | 21,3±2,6 |
F | 13,7±1,4 | 14,3±1,5 | 14,6±1,5* | 14,1±1,6* | 14,3±1,6 | 14,6±1,6* | 14,8±1,6* | |
Russo, 1×105 ЦПД50 /особь Russo, 1×105 CPD50 / animal | M | 17,8±1,9 | 18,4±2,2 | 18,6±2,1 | 19,8±2,3 | 20,1±2,3 | 20,4±2,3 | 20,6±2,2 |
F | 17,3±1,6* | 17,9±1,6* | 18,1±1,6* | 19,1±2,0 | 15,7±7,1 | 19,0±2,0* | 19,2±2,0* | |
Russo,1×106 ЦПД50 /особь Russo, 1×106 CPD50 / animal | M | 17,5±1,8 | 18,2±1,9 | 18,4±1,9 | 19,2±2,1 | 19,4±2,2 | 19,7±2,2 | 19,9±2,2 |
F | 14,3±1,4* | 15,2±2,4 | 15,4±2,4* | 15,3±1,5* | 15,6±1,4 | 15,9±1,4* | 16,1±1,5* | |
Примечание. Данные представлены в формате Mean±SD — среднее и стандартное отклонение. M — самцы; F — самки; ЦПД — цитопатогенная доза; ЦПД50 — доза вируса, лизирующая 50% клеток; ЖЭВ — живой энтеровирус; Russo — рекомбинантный энтеровирус.
* Различия статистически значимы (р<0,05) по отношению к плацебо.
Note. The data are presented as Mean±SD (mean value and standard deviation). M, males; F, females, CPD, cytopathogenic dose; CPD50, virus dose causing 50% cell lysis; LEV, live enterovirus; Russo, recombinant enterovirus.
* Asterisks denote statistically significant differences from the placebo (p<0.05).
Таблица 3. Динамика потребления воды крысами при многократном введении препаратов на основе живых непатогенных энтеровирусов (количество животных n=10)
Table 3. Time course of changes in water consumption in rats (n=10) treated with repeated doses of medicinal products based on live non-pathogenic enteroviruses
Группа Group | Пол Sex | Количество потребляемой крысами воды, г Amount of water consumed by rats, g | |||||
Фон Baseline | 35 сутки Day 35 | 49 сутки Day 49 | 63 сутки Day 63 | 77 сутки Day 77 | 84 сутки Day 84 | ||
Плацебо Placebo | M | 27,8±2,1 | 31,6±2,0 | 34,3±0,7 | 35,5±0,7 | 36,7±0,6 | 37,6±0,5 |
F | 23,0±2,7 | 31,6±1,7 | 34,1±1,1 | 35,1±1,0 | 36,8±1,2 | 37,6±1,0 | |
ЖЭВ4, 1×105 ЦПД50 /особь LEV4, 1×105 CPD50 / animal | M | 28,0±1,1 | 30,2±1,6* | 32,2±1,5* | 33,5±1,3 | 35,4±1,5* | 35,1±1,2* |
F | 22,0±2,5 | 26,7±3,1* | 27,0±2,9* | 29,2±2,3* | 31,3±2,1* | 32,3±2,0* | |
ЖЭВ4, 1×106 ЦПД50 /особь LEV 4, 1×106 CPD50 / animal | M | 23,4±3,4* | 27,6±3,0* | 28,8±1,6* | 30,5±1,8* | 32,3±1,7* | 33,7±1,9* |
F | 22,1±2,7 | 27,4±2,6* | 30,2±2,7* | 31,7±2,5* | 33,7±2,6* | 35,0±2,6* | |
ЖЭВ7, 1×105 ЦПД50 /особь LEV7, 1×105 CPD50 / animal | M | 24,2±2,1 | 29,0±2,3* | 30,8±3,0* | 33,6±4,7* | 34,7±4,1 | 35,6±4,0 |
F | 21,4±1,2 | 29,4±2,0 | 32,2±1,6 | 33,1±1,4* | 34,9±1,6* | 36,2±1,3* | |
ЖЭВ7, 1×106 ЦПД50 /особь LEV7, 1×106 CPD50 / animal | M | 25,6±3,0 | 29,8±2,7* | 32,5±2,4 | 33,8±2,0* | 35,3±1,9 | 36,1±1,5 |
F | 23,7±2,8 | 27,3±2,6 | 31,1±1,4 | 32,5±1,0* | 33,6±1,2* | 35,1±1,6 | |
ЖЭВ8, 1×105 ЦПД50 /особь LEV8, 1×105 CPD50 / animal | M | 28,3±2,0 | 32,6±2,2* | 35,9±1,0 | 37,0±0,8* | 38,4±0,8* | 39,2±0,5* |
F | 22,1±2,3 | 26,1±2,5 | 27,5±2,2* | 28,5±2,1* | 30,4±1,9 | 31,5±1,7* | |
ЖЭВ8, 1×106 ЦПД50 /особь LEV8, 1×106 CPD50 / animal | M | 24,9±3,1 | 29,7±2,7* | 31,2±1,8 | 32,3±1,4* | 34,1±1,5* | 35,2±0,9 |
F | 23,6±2,9 | 26,9±3,1 | 30,5±3,1* | 31,2±3,1* | 32,6±3,0* | 34,0±2,7* | |
ЖЭВ14, 1×105 ЦПД50 /особь LEV14, 1×105 CPD50 / animal | M | 24,7±3,3 | 28,2±3,3* | 29,3±2,4 | 30,5±2,6* | 32,3±2,4* | 33,6±1,9* |
F | 21,2±1,3 | 25,4±1,8 | 27,7±1,9* | 29,3±1,8* | 30,4±1,9* | 31,5±1,7* | |
ЖЭВ14, 1×106 ЦПД50 /особь LEV14, 1×106 CPD50 / animal | M | 26,3±3,1 | 29,7±2,8* | 32,1±2,3* | 33,3±2,1* | 34,5±1,9* | 35,7±1,7* |
F | 21,3±1,3 | 25,5±1,7 | 28,5±1,9* | 29,8±2,0* | 31,5±2,1* | 32,3±1,9* | |
Russo, 1×105 ЦПД50 /особь Russo, 1×105 CPD50 / animal | M | 20,0±2,9 | 31,5±2,1 | 33,7±1,2 | 34,9±1,2* | 36,2±0,8 | 36,9±0,8 |
F | 25,3±3,2* | 29,2±2,8 | 30,6±1,3 | 34,2±5,1 | 33,5±1,3 | 34,7±1,0 | |
Russo, 1×106 ЦПД50 /особь Russo, 1×106 CPD50 / animal | M | 24,6±3,3 | 28,2±3,0 | 30,6±1,7 | 31,7±1,9* | 33,6±1,7* | 34,8±1,2* |
F | 22,8±2,9 | 28,0±2,7 | 29,0±1,4* | 31,4±1,4 | 33,4±1,4 | 34,5±1,5 | |
Примечание. Данные представлены в формате Mean±SD — среднее и стандартное отклонение. M — самцы; F — самки; ЦПД — цитопатогенная доза; ЦПД50 — доза вируса, лизирующая 50% клеток; ЖЭВ — живой энтеровирус; Russo — рекомбинантный энтеровирус.
* Различия статистически значимы (р<0,05) по отношению к плацебо.
Note. The data are presented as Mean±SD (mean value and standard deviation). M, males; F, females, CPD, cytopathogenic dose; CPD50, virus dose causing 50% cell lysis; LEV, live enterovirus; Russo, recombinant enterovirus.
* Asterisks denote statistically significant differences from the placebo (p<0.05).
Таблица 4. Гематологические показатели по окончании введения препаратов на основе живых непатогенных энтеровирусов у самцов крыс на 91 сутки эксперимента (количество животных n=5)
Table 4. Haematological parameters of male rats (n=5) upon termination of treatment with medicinal products based on live non-pathogenic enteroviruses on Day 91
Показатель Parameter | Группа Group | ||
Плацебо Placebo | ЖЭВ8, 1×106 ЦПД50 / особь LEV8, 1×106 CPD50 /animal | ЖЭВ14, 1×105 ЦПД50 / особь LEV14, 1×105 CPD50 / animal | |
Лимфоциты, 109/л Lymphocytes, 109/L | 9,20±2,28 | 12,9±1,6* | 10,7±3,6 |
Тромбоциты, 109/л Platelets, 109/L | 781,4±102,2 | 692,6±115,4 | 632,0±55,4* |
Лимфоциты, % Lymphocytes, % | 68,4±7,2 | 65,5±9,0 | 73,9±9,2 |
Средние клетки, % Medium cells, % | 3,06±1,97 | 6,58±4,73 | 5,26±4,68 |
Гранулоциты, % Granulocytes, % | 28,3±7,0 | 28,9±4,9 | 20,8±6,6 |
Протромбиновое время, с Prothrombin time, s | 12,8±1,1 | 12,9±0,8 | 12,8±1,5 |
Протромбиновый индекс, % Prothrombin index, % | 88,8±12,9 | 87,6±8,5 | 90,6±21,1 |
Международное нормализованное отношение (МНО) International normalised ratio | 1,02±0,09 | 1,03±0,07 | 1,02±0,12 |
АЧТВ, с aPTT, s | 29,5±7,8 | 29,6±6,1 | 30,7±8,2 |
Фибриноген, г/л Fibrinogen, g/L | 2,43±0,56 | 2,36±0,40 | 2,36±0,38 |
Примечание. Данные представлены в формате Mean±SD — среднее и стандартное отклонение. ЦПД — цитопатогенная доза; ЦПД50 — доза вируса, лизирующая 50% клеток; ЖЭВ — живой энтеровирус; Russo — рекомбинантный энтеровирус; АЧТВ — активированное частичное тромбопластиновое время.
* Различия статистически значимы (р<0,05) по отношению к плацебо.
Note. The data are presented as Mean±SD (mean value and standard deviation). CPD, cytopathogenic dose; CPD50, virus dose causing 50% cell lysis; LEV, live enterovirus; Russo, recombinant enterovirus; aPTT, activated partial thromboplastin time.
* Asterisks denote statistically significant differences from the placebo (p<0.05).
Таблица 5. Показатели обмена веществ у крыс по окончании введения препаратов на основе живых непатогенных энтеровирусов на 91 сутки эксперимента (количество животных n=5)
Table 5. Metabolism parameters in rats (n=5) upon termination of treatment with medicinal products based on live non-pathogenic enteroviruses on Day 91
Группа Group | Пол Sex | Общий белок, г/л Total protein, g/L | Глобулины, г/л Globulins, g/L | АЛТ, Е/л ALT, U/L | Билирубин, мкмоль/л Bilirubin, μmol/L | ТАГ, ммоль/л Triglycerides, mmol/L | Креатинин, мкмоль/л Creatinine, μmol/L |
Плацебо Placebo | M | 72,8±3,4 | 34,3±4,2 | 75,9±8,7 | 3,66±1,65 | 0,59±0,11 | 76,1±5,7 |
F | 75,4±2,6 | 34,3±3,6 | 89,9±12,9 | 3,82±1,68 | 0,63±0,11 | 79,1±1,8 | |
ЖЭВ4, 1×105 ЦПД50 /особь LEV4, 1×105 CPD50 /animal | M | 68,6±1,9 | 31,2±2,2 | 107,5±13,7 | 5,42±0,41 | 0,98±0,25* | 70,6±2,1 |
F | 75,7±6,0 | 35,9±5,2 | 81,0±10,4 | 5,36±0,52 | 1,37±0,23* | 71,9±5,5 | |
ЖЭВ4, 1×106 ЦПД50 /особь LEV4, 1×106 CPD50 /animal | M | 68,1±6,1 | 31,1±2,2 | 108,8±23,5 | 7,26±1,77* | 1,32±0,57 | 71,3±3,3 |
F | 77,3±3,6 | 36,9±3,1 | 94,2±11,3 | 5,88±2,43 | 1,52±1,02 | 75,3±6,3 | |
ЖЭВ7, 1×105 ЦПД50 /особь LEV7, 1×105 CPD50/animal | M | 74,0±3,7 | 35,3±3,7 | 99,0±13,5 | 4,94±0,80 | 1,12±0,43* | 85,0±3,0 |
F | 81,2±3,8 | 40,3±3,4* | 86,1±14,9 | 5,34±1,20 | 1,18±0,55 | 71,5±1,6* | |
ЖЭВ7, 1×106 ЦПД50 /особь LEV7, 1×106 CPD50 /animal | M | 66,6±4,9 | 28,7±3,9 | 117,8±25,9* | 5,36±0,74 | 0,85±0,30 | 69,5±1,8* |
F | 72,9±4,9 | 33,7±3,7 | 90,0±21,7 | 6,18±2,13 | 0,86±0,31 | 71,1±3,5* | |
ЖЭВ8, 1×105 ЦПД50 /особь LEV8, 1×105 CPD50 /animal | M | 61,0±6,7* | 27,1±2,5* | 68,2±16,8 | 4,18±0,89 | 0,77±0,37 | 69,0±4,0 |
F | 79,9±5,6 | 39,0±3,9 | 73,9±24,1 | 5,64±1,46 | 1,33±0,85 | 74,3±1,5* | |
ЖЭВ8, 1×106 ЦПД50 /особь LEV8, 1×106 CPD50 /animal | M | 69,4±4,1 | 32,1±1,9 | 245,6±40,1 | 3,34±0,62 | 0,57±0,07 | 77,1±3,5 |
F | 76,7±3,6 | 36,3±3,1 | 232,2±28,4 | 7,50±1,80* | 2,39±0,85* | 79,8±6,3 | |
ЖЭВ14, 1×105 ЦПД50 /особь LEV14, 1×105 CPD50 /animal | M | 69,9±2,6 | 31,4±2,9 | 124,8±32,4 | 4,88±0,68 | 1,10±0,18* | 76,5±2,7 |
F | 78,9±2,5 | 37,5±2,5 | 83,7±13,1 | 5,86±1,41 | 1,72±0,43* | 81,9±3,8 | |
ЖЭВ14, 1×106 ЦПД50 /особь LEV14, 1×106 CPD50 /animal | M | 70,4±3,3 | 32,0±2,9 | 134,2±16,4 | 4,42±1,16 | 1,07±0,30* | 72,5±3,8 |
F | 75,8±4,7 | 36,2±3,5 | 91,5±29,1 | 6,62±2,77 | 2,09±0,98* | 77,6±5,4 | |
Russo, 1×105 ЦПД50 /особь Russo, 1×105 CPD50 /animal | M | 71,4±1,7 | 31,8±1,6 | 102,8±16,1 | 5,18±0,48 | 0,88±0,14* | 71,8±3,5 |
F | 75,0±5,2 | 35,6±4,1 | 96,9±15,2 | 4,14±0,90 | 0,78±0,08 | 75,7±3,4 | |
Russo, 1×106 ЦПД50 /особь Russo, 1×106 CPD50 /animal | M | 68,8±1,6 | 34,4±2,5 | 95,2±20,6 | 3,48±0,66 | 0,88±0,14* | 70,7±2,4 |
F | 75,2±4,0 | 35,3±3,3 | 86,3±7,7 | 3,86±0,78 | 0,78±0,08 | 54,2±4,0* |
Примечание. Данные представлены в формате Mean±SD — среднее и стандартное отклонение. M — самцы; F — самки; АЛТ — аланиновая трансаминаза; ТАГ — триглицериды; ЦПД — цитопатогенная доза; ЦПД50 — доза вируса, лизирующая 50% клеток; ЖЭВ — живой энтеровирус; Russo — рекомбинантный энтеровирус.
* Различия статистически значимы (р<0,05) по отношению к плацебо.
Note. The data are presented as Mean±SD (Mean value and standard deviation). M, males; F, females; ALT, alanine transaminase; CPD, cytopathogenic dose; CPD50, virus dose causing 50% cell lysis; LEV, live enterovirus; Russo, recombinant enterovirus.
* Asterisks denote statistically significant differences from the placebo (p<0.05).
ЗАКЛЮЧЕНИЕ
Проведенное экспериментальное доклиническое исследование безопасности новых противоопухолевых препаратов на основе живых непатогенных энтеровирусов штаммов ЖЭВ4, ЖЭВ7, ЖЭВ8, ЖЭВ14 и Russo показало, что их однократное и многократное внутривенное введение мышам и крысам в дозах 1×105 и 1×106 ЦПД50/ особь не приводило к летальному исходу, нарушению структуры поведения, не влияло на величину массовых коэффициентов внутренних органов. Местнораздражающее действие отсутствовало. Не наблюдалось пирогенного эффекта при внутривенном введении всех препаратов в дозе 1×105 ЦПД50/особь. Не выявлено повреждающее воздействие тестируемых препаратов в отношении систем, функции которых критически важны для жизнедеятельности организма (дыхательная, сердечно-сосудистая и центральная нервная система).
При оценке органов и систем, функции которых могут быть временно нарушены вследствие неблагоприятных фармакодинамических эффектов без причинения необратимого вреда (мочевыделительная система, системы крови и обмена веществ), установлено, что в крови самцов, получавших ЖЭВ8 в дозе 1×106 ЦПД50/ особь, регистрировалось увеличение абсолютного, но не относительного, количества лимфоцитов. При этом процентное соотношение лимфоцитов, средних клеток и гранулоцитов не отличалось от такового у животных в группе плацебо. У самцов, получавших ЖЭВ14 в дозе 1×105 ЦПД50/ особь, наблюдалось сниженное количество тромбоцитов. При введении препарата в более высокой дозе такого эффекта не отмечалось. Тромбоцитопения у животных, которым вводили ЖЭВ14 в дозе 1×105 ЦПД50/особь, наблюдалась на фоне отсутствия различий в показателях свертываемости крови по отношению к животным из группы плацебо, при этом в абсолютном выражении количество тромбоцитов у животных данной группы соответствовало физиологической норме.
По окончании введения изучаемых препаратов наблюдались статистически достоверные отличия некоторых биохимических показателей у животных из опытных групп и групп плацебо, не выходящие за пределы физиологической нормы. Так, у самцов, получавших ЖЭВ8 в дозе 1×105 ЦПД50/особь, но не в дозе, ее превышающей, имело место сниженное содержание общего белка и глобулинов; у самок, получавших ЖЭВ7 в дозе 1×105 ЦПД50/особь, но не в дозе, ее превышающей, — повышенное содержание глобулинов, а у самцов, получавших этот же препарат в дозе 1×106 ЦПД50/ особь, — увеличенный уровень АЛТ; у самцов, получавших ЖЭВ4 в дозе 1×106 ЦПД50/особь, и у самок, получавших ЖЭВ8 также в максимальной дозе, — повышенное содержание билирубина; у самок, получавших ЖЭВ7 и ЖЭВ8 в дозе 1×105 ЦПД50/ особь, и самок, получавших Russo в дозе 1×106 ЦПД50/ особь, — сниженная концентрация в крови креатинина. У животных из опытных групп было выявлено статистически значимое повышение уровня триглицеридов (один из показателей липидного обмена), не выходившее за пределы диапазона нормы для крыс. Исключение составили самки, получавшие ЖЭВ8 в максимальной изученной дозе, и самки, которым вводили ЖЭВ14 в обеих дозах. В крови этих животных уровень триглицеридов был выше в 1,5–2,5 раза, в то же время содержание холестерина соответствовало норме. Различий во влиянии на биохимические показатели, связанные с уровнем дозирования или продолжительностью введения препаратов, не было установлено. При этом дистрофические, атрофические, воспалительные и некробиотические изменения печени, почек и иммунокомпетентных органов отсутствовали.
По совокупности полученных результатов все изучаемые препараты являются перспективными для проведения дальнейших исследований.
1 ICH guideline S6 (R1) — preclinical safety evaluation of biotechnology-derived pharmaceuticals. EMA/CHMP/ICH/731268/1998. EMA; 2011.
2 Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 2. М.: Гриф и К; 2012.
3 ОФС.1.2.4.0005.15 Пирогенность. Государственная фармакопея Российской Федерации. XIV изд. Т. 1. М.; 2018.
4 Юшков БГ, Корнева ЕА, Черешнев ВА. Понятие нормы в физиологии и патофизиологии. Физиологические константы лабораторных животных. Екатеринбург: УрО РАН; 2021.
5 Юшков БГ, Корнева ЕА, Черешнев ВА. Понятие нормы в физиологии и патофизиологии. Физиологические константы лабораторных животных. Екатеринбург: УрО РАН; 2021.
Макаров ВГ, Макарова МН, ред. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных. Справочник. СПб: ЛЕМА; 2013.
6 Юшков БГ, Корнева ЕА, Черешнев ВА. Понятие нормы в физиологии и патофизиологии. Физиологические константы лабораторных животных. Екатеринбург: УрО РАН; 2021.
7 Там же.
8 Юшков БГ, Корнева ЕА, Черешнев ВА. Понятие нормы в физиологии и патофизиологии. Физиологические константы лабораторных животных. Екатеринбург: УрО РАН; 2021.
9 ОФС.1.2.4.0005.15 Пирогенность. Государственная фармакопея Российской Федерации. XIV изд. Т. 1. М.; 2018.
Список литературы
1. Глухов АИ, Сивохин ДА, Серяк ДА, Родионова ТС, Камынина МИ. Онколитические вирусы как иммунотерапевтические агенты в лечении злокачественных новообразований. Вестник РАМН. 2019;74(2):108–17. https://doi.org/10.15690/vramn1091
2. de la Nava D, Selvi KM, Alonso MM. Immunovirotherapy for pediatric solid tumors: a promising treatment that is becoming a reality. Front Immunol. 2022;13:866892. https://doi.org/10.3389/fimmu.2022.866892
3. Воробьева ИВ, Жирнов ОП. Современные подходы к лечению рака онколитическими вирусами. Microbiology Independent Research Journal. 2022;9(1):91–112. https://doi.org/10.18527/2500-2236-2022-9-1-91-112
4. Чернякова АП, Бороздина СА. Механизмы действия и клинические эффекты препаратов онколитических аденовирусов, герпесвирусов, реовирусов и вируса кори. Juvenis Scientia. 2020;6(6):6–17. https://doi.org/10.32415/jscientia_2020_6_6_6-17
5. Lin D, Shen Y, Liang T. Oncolytic virotherapy: basic principles, recent advances and future directions. Signal TranSDuct Target Ther. 2023;8(1):156. https://doi.org/10.1038/s41392-023-01407-6
6. Yang L, Gu X, Yu J, Ge Sh, Fan X. Oncolytic virotherapy: from bench to bedside front. Cell Dev Biol. 2021;9:790150. https://doi.org/10.3389/fcell.2021.790150
7. Ramelyte E, Tastanova A, Balázs Z, Ignatova D, Turko P, Menzel U, et al. Oncolytic virotherapy-mediated anti-tumor response: a single-cell perspective. Cancer Cell. 2021;39(3):394–406.e4. https://doi.org/10.1016/j.ccell.2020.12.022
8. Russell SJ, Bell JC, Engeland CE, McFadden G. Advances in oncolytic virotherapy. Commun Med (Lond). 2022;2:33. https://doi.org/10.1038/s43856-022-00098-4
9. Чумаков ПМ. Обеспечат ли онколитические вирусы революцию в онкологии? Вестник РАН. 2019;89(5):475–84. https://doi.org/10.31857/S0869-5873895475-484
10. Shalhout SZ, Miller DM, Emerick KS, Kaufman HL. Therapy with oncolytic viruses: progress and challenges. Nat Rev Clin Oncol. 2023;20(3):160–77. https://doi.org/10.1038/s41571-022-00719-w
11. Rahman MM, McFadden G. Oncolytic viruses: newest frontier for cancer immunotherapy. Cancers (Basel). 2021;13(21):5452. https://doi.org/10.3390/cancers13215452
12. Bommareddy PK, Shettigar M, Kaufman HL. Integrating oncolytic viruses in combination cancer immunotherapy. Nat Rev Immunol. 2018;18(8):498–513. https://doi.org/10.1038/s41577-018-0014-6
13. Malogolovkin A, Gasanov N, Egorov A, Weener M, Ivanov R, Karabelsky A. Combinatorial approaches for cancer treatment using oncolytic viruses: projecting the perspectives through clinical trials outcomes. Viruses. 2021;13:1271. https://doi.org/10.3390/v13071271
14. McCarthy C, Jayawardena N, Burga LN, Bostina M. Developing picornaviruses for cancer therapy. Cancers. 2019;11:685. https://doi.org/10.3390/cancers11050685
15. Леa ТХ, Липатова АВ, Вольская МА, Тихонова ОА, Чумаков ПМ. Состояние сигнального пути JAK/STAT влияет на чувствительность опухолевых клеток к онколитическим энтеровирусам. Молекулярная биология. 2020;54(4):634–42. https://doi.org/10.31857/S0026898420040102
16. Ворошилова МК. Энтеровирусные инфекции человека. М.: Медицина; 1979.
17. Чумаков МП, Ворошилова МК, Анцупова АС, Бойко ВМ, Блинова МИ, Приймяги ЛС и др. Живые энтеровирусные вакцины для экстренной профилактики массовых респираторных заболеваний во время осенне-зимних эпидемий гриппа и острых респираторных заболеваний. Журнал микробиологии, эпидемиологии и иммунобиологии. 1992;69(11–12):37–40. EDN: ZXJVLF
18. Нетесов СВ, Кочнева ГВ, Локтев ВБ, Святченко ВА, Сергеев АН, Терновой ВА и др. Онколитические вирусы: достижения и проблемы. Медицинский алфавит. Эпидемиология и санитария. 2011;(3):26–33. EDN: OXGJHP
19. Ворошилова МК. Вирусологические и иммунологические аспекты применения ЖЭВ при онкологических заболеваниях. В кн.: Полезные для организма непатогенные штаммы энтеровирусов: профилактическое и лечебное их применение. М.: Изд-во Минздрава СССР; 1988. С. 24–9.
20. Чумаков ПМ, Морозова ВВ, Бабкин ИВ, Байков ИК, Нетесов СВ, Тикунова НВ. Онколитические энтеровирусы. Молекулярная биология. 2012;46(5):712–25. https://doi.org/10.1134/S0026893312050032
21. Клаан НК, Акиньшина ЛП, Пронина ТА. Онколитические вирусы в терапии злокачественных новообразований. Российский биотерапевтический журнал. 2018;17(4):6–19. https://doi.org/10.17650/1726-9784-2018-17-4-6-19
22. Chiu M, Armstrong EJL, Jennings V, Foo S, Crespo-Rodriguez E, Bozhanova G, et al. Combination therapy with oncolytic viruses and immune checkpoint inhibitors. Expert Opin Biol Ther. 2020;20(6):635–52. https://doi.org/10.1080/14712598.2020.1729351
23. Martin NT, Bell JC. Oncolytic virus combination therapy: killing one bird with two stones. Mol Ther. 2018;26(6):1414–22. https://doi.org/10.1016/j.ymthe.2018.04.001
24. Ghonime MG, Cassady KA. Combination therapy using ruxolitinib and oncolytic HSV renders resistant MPNSTs susceptible to virotherapy. Cancer Immunol Res. 2018;6(12):1499–510. https://doi.org/10.1158/2326-6066
25. Tanaka R, Goshima F, Esaki S, Sato Y, Murata T, Nishiyama Y, et al. The efficacy of combination therapy with oncolytic herpes simplex virus HF10 and dacarbazine in a mouse melanoma model. Am J Cancer Res. 2017;7(8):1693–703. PMID: 28861325
26. O’Donoghue C, Doepker MP, Zager JS. Talimogene laherparepvec: overview, combination therapy and current practices. Melanoma Manag. 2016;3(4):267–72. https://doi.org/10.2217/mmt-2016-002
27. Zhang S, ed. Progress in cancer immunotherapy. Springer; 2016. https://doi.org/10.1007/978-94-017-7555-7
28. Chiocca EA, Rabkin SD. Oncolytic viruses and their application to cancer immunotherapy. Cancer Immunol Res. 2014;2(4):295–300. https://doi.org/10.1158/2326-6066.CIR-14-0015
29. Shakiba Y, Vorobyev PO, Mahmoud M, Hamad A, Kochetkov DV, Yusubalieva GM, et al. Recombinant strains of oncolytic vaccinia virus for cancer immunotherapy. Biochemistry (Mosc). 2023;88(6):823–41. https://doi.org/10.1134/S000629792306010X
30. Lal G, Rajala MS. Recombinant viruses with other anti-cancer therapeutics: a step towards advancement of oncolytic virotherapy. Cancer Gene Ther. 2018;25(9–10):216–26. https://doi.org/10.1038/s41417-018-0018-1
31. Gromeier M, Nair SK. Recombinant poliovirus for cancer immunotherapy. Annu Rev Med. 2018;69:289–99. https://doi.org/10.1146/annurev-med-050715-104655
32. Voroshilova MK. Interferon-producing enterovirus vaccines (Live enterovirus vaccines, their interfering and interferonogenic activity and their use for prophylaxis of enteroviral and respiratory infections). Crit Rev Clin Lab Sci. 1970;117–8.
33. Voroshilova MK. Potential use of nonpathogenic enteroviruses for control of human disease. Prog Med Virol. 1989;36:191–202. PMID: 2555836
34. Ворошилова МК, Магазаник СС, Чумаков ПМ. Полезные вирусы человека. Актуальные вопросы эпидемиологии, микробиологии и инфекционных заболеваний. Ташкент: Медицина; 1980.
35. Gromeier M, Alexander L, Wimmer E. Internal ribosomal entry site substitution eliminates neurovirulence in intergeneric poliovirus recombinants. Proc Natl Acad Sci USA. 1996;93(6):2370–5. https://doi.org/10.1073/pnas.93.6.2370
36. Gromeier M, Lachmann S, Rosenfeld MR, Gutin PH, Wimmer E. Intergeneric poliovirus recombinants for the treatment of malignant glioma. Proc Natl Acad Sci USA. 2000;97(12):6803–8. . https://doi.org/10.1073/pnas.97.12.6803
37. Soboleva AV, Seryak DA, Gabdrakhmanova AF, Sosnovtseva AO, Le TH, Kochetkov DV, et al. Glioblastoma multiforme stem cells are highly sensitive to some human non-pathogenic enteroviruses. J Pharm Sci Res. 2018:10(4):936–9. https://doi.org/10.5281/zenodo.1285619
38. Lawler SE, Speranza MC, Cho CF, Chiocca EA. Oncolytic viruses in cancer treatment: a review. JAMA Oncol. 2017;3(6):841–49. https://doi.org/10.1001/jamaoncol.2016.2064
39. Pol J, Buque A, Aranda F, Bloy N, Cremer I, Eggermont A, et al. Trial watch — oncolytic viruses and cancer therapy. Oncoimmunology. 2016;5(2):e1117740. https://doi.org/10.1080/2162402x.2015.1117740
40. Warner SG, O’Leary MP, Fong Y. Therapeutic oncolytic viruses: clinical advances and future directions. Curr Opin Oncol. 2017;29(5):359–65. https://doi.org/10.1097/cco.0000000000000388
41. Jia Y, Miyamoto S, Soda Y, Takishima Y, Sagara M, Liao J, et al. Extremely low organ toxicity and strong antitumor activity of miR-34-regulated oncolytic coxsackievirus B3. Mol Ther Oncolytics. 2019;12:246–58. https://doi.org/10.1016/j.omto.2019.01.003
42. Sakamoto A, Inoue H, Miyamoto S, Ito S, Soda Y, Tani K. Coxsackievirus A11 is an immunostimulatory oncolytic virus that induces complete tumor regression in a human non-small cell lung cancer. Sci Rep. 2023;13(1):5924. https://doi.org/10.1038/s41598-023-33126-x
43. Lin D, Shen Y, Liang T. Oncolytic virotherapy: basic principles, recent advances and future directions. Signal TranSDuct Target Ther. 2023;8(1):156. https://doi.org/10.1038/s41392-023-01407-6
Об авторах
К. В. СивакРоссия
Сивак Константин Владимирович, д-р биол. наук
ул. Профессора Попова, д. 15/17, Санкт-Петербург, 197376
К. И. Стосман
Россия
Стосман Кира Иосифовна, канд. биол. наук
ул. Профессора Попова, д. 15/17, Санкт-Петербург, 197376
Е. Ю. Калинина
Россия
Калинина Елена Юрьевна, канд. мед. наук
ул. Профессора Попова, д. 15/17, Санкт-Петербург, 197376
М. М. Любишин
Россия
Любишин Михаил Михайлович, канд. биол. наук
ул. Профессора Попова, д. 15/17, Санкт-Петербург, 197376
Я. Р. Оршанская
Россия
Оршанская Яна Рафаеловна
ул. Профессора Попова, д. 15/17, Санкт-Петербург, 197376
Т. Н. Саватеева-Любимова
Россия
Саватеева-Любимова Татьяна Николаевна, д-р мед. наук, профессор
ул. Профессора Попова, д. 15/17, Санкт-Петербург, 197376
С. Б. Казакова
Россия
Казакова Светлана Борисовна, канд. биол. наук
ул. Профессора Попова, д. 15/17, Санкт-Петербург, 197376
Д. М. Федосеева
Россия
Федосеева Дарья Михайловна, канд. биол. наук
ул. Погодинская, д. 10, стр. 1, Москва, 119121
А. С. Назаров
Россия
Назаров Антон Сергеевич, канд. хим. наук
ул. Погодинская, д. 10, стр. 1, Москва, 119121
Е. И. Радион
Россия
Радион Елизавета Ивановна, канд. биол. наук
ул. Погодинская, д. 10, стр. 1, Москва, 119121
С. М. Юдин
Россия
Юдин Сергей Михайлович, д-р мед. наук
ул. Погодинская, д. 10, стр. 1, Москва, 119121
А. А. Кескинов
Россия
Кескинов Антон Артурович, канд. мед. наук
ул. Погодинская, д. 10, стр. 1, Москва, 119121
В. В. Макаров
Россия
Макаров Валентин Владимирович, канд. биол. наук
ул. Погодинская, д. 10, стр. 1, Москва, 119121
В. С. Юдин
Россия
Юдин Владимир Сергеевич, канд. биол. наук
ул. Погодинская, д. 10, стр. 1, Москва, 119121
А. О. Желтухин
Россия
Желтухин Андрей Олегович, канд. биол. наук
ул. Вавилова, д. 32, Москва, 119991
П. О. Воробьев
Россия
Воробьев Павел Олегович, канд. биол. наук
ул. Вавилова, д. 32, Москва, 119991
Д. В. Кочетков
Россия
Кочетков Дмитрий Владимирович, канд. биол. наук
ул. Вавилова, д. 32, Москва, 119991
Г. В. Ильинская
Россия
Ильинская Галина Владимировна, канд. биол. наук
ул. Вавилова, д. 32, Москва, 119991
А. В. Липатова
Россия
Липатова Анастасия Валерьевна, канд. биол. наук
ул. Вавилова, д. 32, Москва, 119991
П. М. Чумаков
Россия
Чумаков Петр Михайлович, член-корреспондент РАН, д-р биол. наук, профессор
ул. Вавилова, д. 32, Москва, 119991
Дополнительные файлы
Рецензия
Для цитирования:
Сивак К.В., Стосман К.И., Калинина Е.Ю., Любишин М.М., Оршанская Я.Р., Саватеева-Любимова Т.Н., Казакова С.Б., Федосеева Д.М., Назаров А.С., Радион Е.И., Юдин С.М., Кескинов А.А., Макаров В.В., Юдин В.С., Желтухин А.О., Воробьев П.О., Кочетков Д.В., Ильинская Г.В., Липатова А.В., Чумаков П.М. Доклиническая оценка безопасности противоопухолевых препаратов на основе живых непатогенных энтеровирусов. Безопасность и риск фармакотерапии. 2024;12(4):444-462. https://doi.org/10.30895/2312-7821-2024-415
For citation:
Sivak K.V., Stosman K.I., Kalinina E.Yu., Lyubishin M.M., Orshanskaya Ya.R., Savateeva-Lyubimova T.N., Kazakova S.B., Fedoseeva D.M., Nazarov A.S., Radion E.I., Yudin S.M., Keskinov A.A., Makarov V.V., Yudin V.S., Zheltukhin A.O., Vorobyev P.O., Kochetkov D.V., Ilyinskaya G.V., Lipatova A.V., Chumakov P.M. Preclinical Safety Assessment of Antineoplastic Agents Based on Live Non-Pathogenic Enteroviruses. Safety and Risk of Pharmacotherapy. 2024;12(4):444-462. (In Russ.) https://doi.org/10.30895/2312-7821-2024-415
JATS XML





































