Перейти к:
WoE-анализ и ключевые факторы риска при доклинической разработке лекарственных препаратов: обзор
https://doi.org/10.30895/2312-7821-2024-12-4-463-476
Резюме
ВВЕДЕНИЕ. В последние годы в нормативных документах Евразийского экономического союза и Российской Федерации используется понятие «весомость доказательств» (weight of evidence, WoE). Зарубежные регуляторные органы уделяют большое внимание прозрачности данных при документировании и оценке весомости доказательств, что отражено в соответствующих нормативных документах. В то же время не существует единой русскоязычной терминологии, четкого понимания принципов анализа и методики практического применения данного подхода при разработке лекарственных средств и проведении экспертизы результатов доклинических исследований, что требует систематизации информации и подготовки практических рекомендаций по применению WoE-анализа.
ЦЕЛЬ. Анализ нормативных документов и научно-методических источников, освещающих понятие и методы WoE-анализа, для оценки его возможностей и практического применения при разработке лекарственных средств и проведении экспертизы полученных результатов.
ОБСУЖДЕНИЕ. В статье уточняется смысл понятий WoE и WoE-анализ, представленных в документах Международного совета по гармонизации технических требований к фармацевтическим препаратам для использования человеком (ICH), Организации экономического сотрудничества и развития (OECD), Европейского химического агентства (ECHA) и других, с учетом особенностей русскоязычной терминологии. На примере исследований иммунотоксичности, репродуктивной токсичности и канцерогенности представлена классификация ключевых факторов риска, которые необходимо учитывать при оценке весомости доказательств. Анализ этих данных является критически важным для планирования и интерпретации результатов доклинических исследований и проведения экспертизы безопасности лекарственных средств. Приведены примеры WoE-анализа при рассмотрении вопроса о необходимости проведения дополнительных исследований на неполовозрелых животных при разработке препаратов на основе малых молекул и моноклональных антител для применения у детей.
ЗАКЛЮЧЕНИЕ. Рассмотренные алгоритмы и критерии оценки при проведении WoE-анализа могут быть внедрены организаторами и исполнителями доклинических исследований лекарственных средств и применяться при проведении экспертизы лекарственных средств.
Ключевые слова
Для цитирования:
Енгалычева Г.Н., Сюбаев Р.Д. WoE-анализ и ключевые факторы риска при доклинической разработке лекарственных препаратов: обзор. Безопасность и риск фармакотерапии. 2024;12(4):463-476. https://doi.org/10.30895/2312-7821-2024-12-4-463-476
For citation:
Engalycheva G.N., Syubaev R.D. WoE Analysis and Key Risk Factors in Preclinical Development of Medicinal Products: A Review. Safety and Risk of Pharmacotherapy. 2024;12(4):463-476. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-4-463-476
ВВЕДЕНИЕ
Одним из базовых нормативных документов, определяющих требования к объему доклинических исследований безопасности при разработке оригинальных лекарственных препаратов в Евразийском экономическом союзе (ЕАЭС), является «Руководство по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов»1. Этот документ разработан на основе Руководства Международного совета по гармонизации технических требований к фармацевтическим препаратам для использования человеком (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH) M3(R2)2. Данные руководства направлены на обеспечение безопасной, этичной разработки новых лекарственных средств, своевременного проведения клинических исследований, сокращения использования в исследованиях лабораторных животных и других ресурсов в соответствии с принципами 3R: замена (replacement), улучшение (refinement), сокращение (reduction). Для реализации этих принципов предусмотрена возможность не только оптимизации дизайна при проведении отдельных видов доклинических исследований безопасности лекарственных средств, но и в определенных случаях отказ от их проведения. Согласно Решению Коллегии Евразийской экономической комиссии (ЕЭК) от 26.11.2019 № 202 необходимость доклинического изучения, например, иммунотоксичности лекарственного препарата или необходимость проведения исследований на неполовозрелых животных определяется в индивидуальном порядке. Также указаны определенные условия, при которых необходимо обязательное проведение исследований канцерогенности лекарственного препарата.
При оптимизации доклинических исследований безопасности крайне важной становится адекватная оценка пользы и риска лекарственного препарата. В нормативных документах ICH, посвященных доклиническим исследованиям лекарственных средств, рекомендуется применять подход WoE (weight of evidence — весомость доказательств) для обоснования безопасности препарата, а также целесообразности проведения или исключения тех или иных видов токсикологических исследований3. В нормативных документах ЕАЭС, посвященных стратегии проведения доклинических исследований безопасности лекарственных средств, нет указаний на использование WoE-анализа. Понятие «весомость доказательств» используется в Рекомендации Коллегии ЕЭК от 03.10.2023 № 26, рассматривающей оценку особой значимости для здоровья населения лекарственных препаратов4, в Решении Коллегии ЕЭК от 14.01.2020 № 1, посвященном установлению допустимых пределов воздействия на здоровье при производстве лекарственных средств5, а также в ряде ГОСТов6. Общим недостатком документов ЕАЭС и ГОСТов является то, что в них содержится только общая ссылка на WoE-подход, но нет конкретных указаний о том, как проводить оценку весомости доказательств. Таким образом, необходимы практические рекомендации по применению WoE-анализа для обоснования безопасности, которые могут быть использованы при разработке и проведении экспертизы лекарственных средств.
Цель работы — анализ нормативных документов и научно-методических источников, освещающих понятие и методы WoE-анализа, для оценки его возможностей и практического применения при разработке лекарственных средств и проведении экспертизы полученных результатов.
ОСНОВНАЯ ЧАСТЬ
Определение термина «весомость доказательств»: WoE и WoE-анализ
Весомость доказательств — это распространенный термин в научной и нормативной литературе, который чаще всего рассматривается в контексте оценки рисков (risk assessment) [1]. Поскольку по мере доклинической и клинической разработки лекарственного препарата поступает новая информация, которую необходимо учитывать, оценка рисков представляет собой непрерывный процесс7. Анализ сведений из различных источников требует объединения множества фактических данных прежде, чем можно будет сделать выводы. Для оценки информации из нескольких независимых источников при проведении интегративной оценки безопасности, например химических веществ, специалисты по оценке рисков традиционно используют WoE-анализ [2].
Агентство по охране окружающей среды США (Environmental Protection Agency, EPA) впервые представило WoE в качестве компонента оценки риска для здоровья в 1986 г. при анализе канцерогенности и мутагенности химических веществ [2]. В международных нормативных документах по доклиническим исследованиям лекарственных средств также рекомендуется использовать WoE-подходы при оценке риска (документы ICH будут рассмотрены ниже в разделе статьи «Использование WoE-анализа в доклинических исследованиях безопасности лекарственных средств»).
Несмотря на широкое использование понятия WoE, многие авторы указывают на отсутствие консенсуса относительно его значения8 [3, 4] и рекомендаций по проведению WoE-анализа [4, 5]. Для решения данной проблемы были предприняты определенные усилия. В 2018 г. был проведен анализ нормативных документов и источников литературы по применению WoE-подходов для идентификации опасности в интересах французского Агентства по пищевой, экологической и профессиональной гигиене и безопасности (Agency for Food, Environmental and Occupational Health and Safety, ANSES) [4]. В 2019 г. Организация экономического сотрудничества и развития (Organisation for Economic Co-operation and Development, OECD) выпустила руководство, посвященное принципам и ключевым элементам при определении весомости данных при оценке безопасности химической продукции9. Научный комитет по рискам для здоровья и окружающей среды (Scientific Committee on Health and Environmental Risks, SCHEER) в 2018 г. представил пересмотренную версию Меморандума о весомости доказательств и неопределенностях10. В 2019 г. Министерство здравоохранения Канады (Health Canada)11 опубликовало руководство, посвященное основным принципам при рассмотрении весомости доказательств.
Ниже приведена информация из некоторых источников, иллюстрирующая разнообразие в определении WoE.
WoE и систематический обзор — это процессы обобщения, синтеза и интерпретации совокупности доказательств для составления выводов... Эти процессы отличаются от традиционного метода оценки рисков тем, что способствуют использованию и интеграции информации, полученной из всех имеющихся фактических данных, вместо того чтобы сосредотачиваться на одном исследовании [6].
Подход WoE заключается в комплексной оценке информации, позволяющей адекватно учитывать все последствия биологической достоверности и согласованности. Подход WoE — это процесс, с помощью которого специалисты оценивают сильные и слабые стороны информации, чтобы сделать общий вывод, который может быть неочевиден при рассмотрении отдельных данных12.
WoE — основа для обобщения отдельных линий доказательств с использованием методов, которые являются либо качественными (изучение отличительных признаков), либо количественными (измерение аспектов с точки зрения величины), для получения выводов о степени риска [2].
WoE-анализ можно описать как поэтапный процесс/подход к сбору доказательств, оценке, обобщению и взвешиванию их для принятия решения по конкретной постановке проблемы с (заранее) определенной степенью достоверности13.
Подход WoE основан на всесторонней оценке всей совокупности данных, относящихся к канцерогенному потенциалу, которые можно получить из открытых источников и из соответствующих исследований по разработке лекарственных средств14.
WoE: рассмотрение значимости, придаваемой каждой из собранных линий доказательств, для принятия общего решения или вывода. Взвешивание доказательств (weighing of evidence): процесс присвоения весомости собранным доказательствам, основанный на совокупном влиянии достоверности (reliability) и релевантности15.
WoE-анализ (процесс) — использование сильных и слабых сторон собранной информации в качестве основы для заключения, которое может быть неочевидным из отдельных данных16.
WoE — это подход, при котором оценивают информацию из нескольких источников, чтобы решить, есть ли достаточные доказательства в поддержку разработки фармацевтических препаратов для педиатрического применения или же необходимы дополнительные доклинические испытания для решения потенциальных проблем безопасности. Значимость, придаваемая имеющимся доказательствам, зависит от таких факторов, как качество данных, согласованность результатов, характер и серьезность последствий, а также актуальность информации. Подход, основанный на доказательствах, требует использования научных суждений и, следовательно, должен учитывать надежность различных источников данных17.
Согласно информации, размещенной на сайте Европейского химического агентства (European Chemicals Agency, ECHA)18, WoE-подход означает использование информации из нескольких независимых источников, которая должна быть адекватна, структурирована и надежна, а также требует научных суждений. Так, результаты исследований in vivo и in vitro имеют больший вес при принятии решения, чем результаты Q(SAR)-анализа (quantitative structure–activity relationship, количественное отношение «структура–активность»). В качестве независимых источников информации указаны следующие: опубликованная литература, сравнение с химическими аналогами, (Q)SAR-прогнозы, данные исследований in vivo, данные исследований in vitro, эпидемиологические данные (human experience).
В 2019 г. OECD выпустила документ, содержащий руководящие принципы и ключевые элементы для определения весомости доказательств для химической оценки19. Поскольку протоколы OECD традиционно широко используют при проведении доклинических исследований безопасности лекарственных средств, представляется логичным рассмотреть ее подходы к WoE-оценке с точки зрения возможности их использования при оценке рисков применения лекарственных средств.
Терминология и существующие подходы к WoE различаются у разных регуляторных органов, но концептуально они почти всегда соответствуют элементам, представленным на рисунке 1.
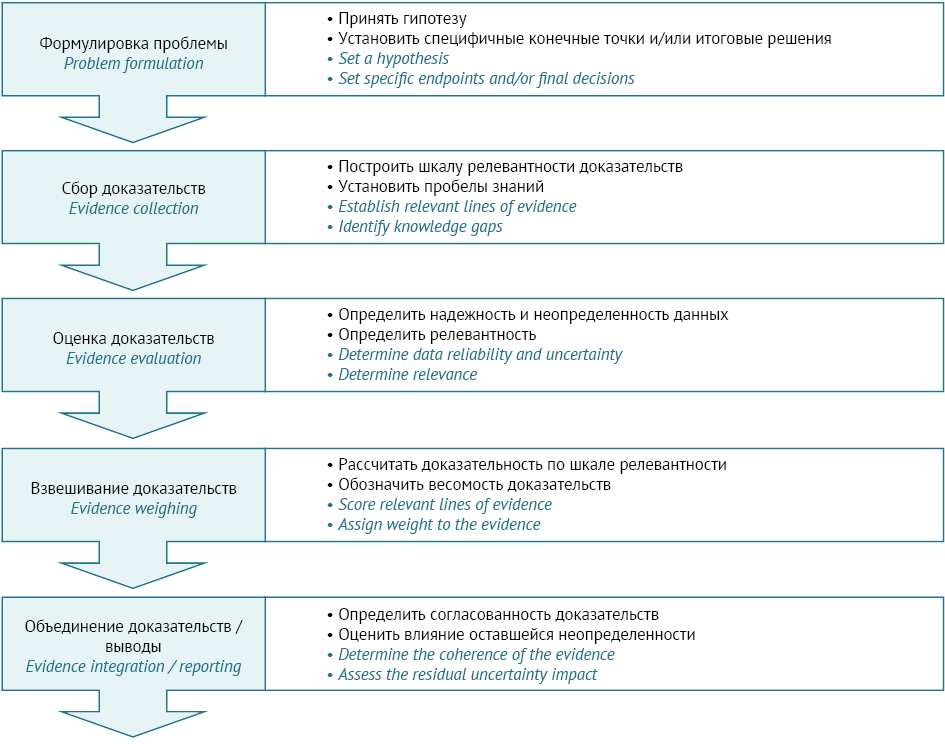
Рисунок адаптирован авторами из руководства OECD № 311 / The figure is adapted by the authors from Test No. 311, OECD
Рис. 1. Ключевые элементы для поэтапной оценки весомости доказательств
Fig. 1. Key elements for a stepwise weight-of-evidence assessment
Количественная оценка весомости доказательств (quantitative weight of evidence, QWoE) включает идентификацию, объективный анализ с использованием заранее выделенных научно обоснованных критериев определения степени весомости результатов всех потенциально важных исследований как с точки зрения их качества, так и значимости для проверки гипотезы [7]. В статье [7] гипотеза понимается как вопрос: «вызывает ли представляющее интерес химическое вещество X неблагоприятные последствия Y при условиях Z». Количественный подход (QWoE) применяется прежде всего в промышленной токсикологии для классификации и маркировки (classification and labelling, C&L) токсикантов, например при присвоении категории для тератогенных и эмбриотоксических веществ [5].
Использование WoE-анализа в доклинических исследованиях безопасности
По данным на 2023 г. термин «весомость доказательств» 18 раз встречался в руководящих документах Управления по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA) — в основном касающихся оценки риска репродуктивной токсичности, иммунотоксичности, генотоксичности, канцерогенности и безопасности лекарственных препаратов для детей20. В документах ICH рекомендуется использовать WoE-анализ при проведении исследований канцерогенности21, репродуктивной токсичности22, иммунотоксичности23, при изучении педиатрических препаратов24. Наиболее полно применение WoE-анализа описано в руководствах ICH, посвященных проведению доклинических исследований канцерогенности25 и безопасности при разработке педиатрических препаратов.
Доклиническая оценка безопасности при разработке препаратов для детей
В руководстве ICH S1126, посвященном доклиническим исследованиям безопасности при разработке педиатрических препаратов, подробно описано применение WoE-анализа при решении вопроса о целесообразности проведения исследований на неполовозрелых животных. Основными ключевыми факторами, весомость которых необходимо оценить, являются:
- возраст пациента;
- влияние препарата на рост и развитие ребенка;
- объем и характер имеющихся данных;
- влияние фармакологической мишени на развитие органов и систем;
- избирательность действия препарата;
- продолжительность применения препарата.
В руководстве ICH S11 приведены примеры WoE-анализа при рассмотрении вопроса о необходимости проведения дополнительных исследований на неполовозрелых животных при разработке препаратов на основе малых молекул (рис. 2–4, опубликованы на сайте журнала27) и моноклонального антитела (рис. 5, опубликован на сайте журнала28).
Рисунок 229 иллюстрирует WoE-анализ гипотетического лекарственного препарата, который представляет собой малую молекулу. Фармакологическая активность препарата хорошо изучена, имеются данные о клинических исследованиях и о доклиническом изучении на взрослых животных (включая токсичность при повторном введении). Вся известная информация не указывает на риск негативного воздействия на развивающиеся органы и системы предполагаемых пациентов — подростков от 12 лет и старше. Поэтому, несмотря на низкую избирательность действия препарата, проведение дополнительных доклинических исследований на неполовозрелых животных признано нецелесообразным.
Рисунок 330 иллюстрирует WoE-анализ гипотетического лекарственного препарата, который представляет собой малую молекулу. Препарат обладает новым механизмом действия и предлагается для долгосрочного применения у новорожденных детей и младенцев. Имеются ограниченные данные о доклинических исследованиях безопасности и о клинических исследованиях I фазы, каких-либо серьезных проблем с безопасностью не выявлено. При этом не исключено влияние препарата на развивающиеся органы и системы, обусловленное механизмом действия. Проведенный WoE-анализ указывает на целесообразность доклинического исследования на неполовозрелых животных с включением в качестве конечных точек целевых развивающихся органов и систем.
Рисунок 431 иллюстрирует WoE-анализ гипотетического лекарственного препарата, который представляет собой малую молекулу с фармакологической мишенью, которая играет важную роль в развитии центральной нервной системы (ЦНС). Препарат предназначен для постоянного применения у детей от 6 лет и старше. Доступны доклинические и клинические данные для взрослых, в том числе адекватно охарактеризовано влияние препарата на прочие развивающиеся системы. Опасения по поводу потенциального воздействия на развитие ЦНС не могут быть решены путем клинически мониторинга и специальной терапии. Анализ WoE требует проведения исследований на ювенильных животных с включением как основных, так и дополнительных конечных точек по оценке влияния на развитие ЦНС.
Рисунок 532 иллюстрирует WoE-анализ гипотетического лекарственного препарата, который представляет собой моноклональное антитело, нацеленное на растворимый цитокин и предназначенное для хронического применения в педиатрии при ревматологических и аллергических заболеваниях (>2 лет). Единственными выявленными эффектами являются обратимое снижение уровня Ig в сыворотке крови и периодические реакции в месте инъекции (как у животных, так и у взрослых пациентов). В расширенном исследовании пре- и постнатального развития на обезьянах воздействие на потомство было сопоставимо с воздействием на самок до 28 сут после рождения, а затем уменьшалось. Результаты Т-клеточно-зависимого гуморального ответа были аналогичны контрольной группе (через 3–6 мес. после рождения). На основании WoE-анализа сделан вывод о нецелесообразности проведения исследований на неполовозрелых животных.
Более подробно ключевые факторы риска и WoE-анализ при проведении доклинических исследований препаратов для детей были рассмотрены ранее [8].
Репродуктивная и онтогенетическая токсичность
В руководстве ICH S5(R3)33, рассматривающем подходы к исследованию репродуктивной токсичности лекарственных препаратов, в разделе, посвященном оценке риска, указано на необходимость проведения WoE-анализа с учетом определенных факторов, установленных в результате изучения токсичности для развития и репродуктивной системы (developmental and reproductive toxicity, DART): пределы экспозиции, наличие зависимости доза–эффект (отмечено, что ее отсутствие в случае фиксации редких пороков развития не является причиной для исключения данного риска), обратимость эффектов, сбивающая с толку родительская токсичность (confounding parental toxicity), межвидовое сходство.
При WoE-анализе репродуктивной токсичности следует учитывать все конечные точки в совокупности, а не рассматривать их изолированно. Одним из примеров оценки WoE является объединение информации из нескольких исследований репродуктивной токсичности на животных, которые по отдельности могут иметь недостатки, не позволяющие всесторонне оценить потенциальные эффекты (например, краткие отчеты, небольшой размер группы, ограниченный диапазон оцениваемых конечных точек, уровни доз или график введения препарата)34.
Для биофармацевтических препаратов, которые не проявляют активности в организме грызунов или кроликов, релевантной моделью для оценки эмбриофетальной токсичности часто являются нечеловекообразные приматы. Проведение исследований на нечеловекообразных приматах достаточно сложно. Так, в литературе указывают на нехватку половозрелых особей, недостаточное аппаратное обеспечение, высокий уровень самопроизвольных абортов у обезьян cynomolgus (Macaca fascicularis), что существенно усложняет интерпретацию полученных данных [9]. В 2019 г. FDA выпустило руководство по изучению репродуктивной токсичности онкологических препаратов35. В разделе «Общие рекомендации» этого документа указано на целесообразность использования WoE-подхода для маркировки препаратов, предназначенных для лечения рака, с учетом риска эмбриотоксичности. Рекомендуется учитывать следующие аспекты.
- Наличие доступной информации о репродуктивной токсичности у человека (например, класс-специфические эффекты известных препаратов).
- Результаты исследований на генетически модифицированных животных или на моделях с фармакологическим ингибированием.
- Данные, полученные с использованием суррогатной молекулы, если биологическая мишень у животных соответствует человеческой.
- Данные литературы о свойствах биологической мишени у человека или животных с учетом экспрессии мишени и ее роли в процессах эмбриофетального развития, а также прочей важной информации (например, роль мишени в развитии плаценты, трансплацентарный перенос, переносимость материнским организмом и др.).
- Использование альтернативных методов (опыты in vitro, ex vivoили эксперименты на видах животных, не являющихся млекопитающими).
В отношении биотехнологических препаратов отмечено, что если результаты WoE-анализа не позволяют оценить риск, достаточным является проведение исследования эмбриотоксичности на одном релевантном виде животных (при его наличии).
Иммунотоксичность
Согласно Решению Коллегии ЕЭК № 202 оценка иммунотоксичности новых лекарственных препаратов проводится на «основе анализа значимости доказательств потенциальной иммунотоксичности». В соответствующем документе ICH M3(R2)36 указано на необходимость проведения оценки иммунотоксичности на основе WoE-обзора (WoE review). Подробно подходы к проведению WoE-анализа изложены в руководстве ICH S837. В данном руководстве также описаны иммуноопосредованные сигналы, которые выявляют при проведении стандартных токсикологических исследований, приведены факторы, которые следует учитывать при анализе весомости доказательств (WoE) при оценке риска потенциальной иммунотоксичности, и приведены примеры дополнительных исследований. Ответственностью заявителя является предоставление в регистрационном досье на лекарственный препарат обзора весомости доказательств. Цель такого обзора — подробный анализ всех ключевых факторов для оценки риска развития иммунотоксических реакций у человека. Если дополнительные исследования иммунотоксичности не проводили, заявитель обязан предоставить обоснование нецелесообразности их проведения.
Канцерогенность
В регионах ICH вопросам проведения исследований канцерогенности уделено большое внимание. Существуют три руководства, посвященные данному виду исследований. Руководство ICH S1A38 рассматривает условия, при которых долгосрочные исследования канцерогенности необходимы. Руководство ICH S1C(R2)39 посвящено выбору доз для проведения исследований канцерогенности. В руководстве ICH S1B(R1)40 обсуждаются вопросы целесообразности и нецелесообразности проведения долгосрочных исследований канцерогенности лекарственных препаратов на двух видах грызунов. Новая редакция руководства ICH S1B(R1) была опубликована в августе 2022 г. Необходимо отметить, что исторически в регионах Европейского союза, Японии и США нормативные документы предусматривали проведение долгосрочных исследований канцерогенности на мышах и крысах. Поскольку эти исследования являются высокозатратными как с точки зрения их стоимости, так и количества экспериментальных животных, задача ICH при подготовке новой редакции руководства ICH S1B состояла в том, чтобы изучить возможность использования критериев доказательности WoE для прогнозирования результатов двухлетнего исследования канцерогенности на крысах. Чтобы определить нормативную осуществимость данного подхода, Рабочая группа экспертов (Expert Working Group, EWG) ICH провела проспективное оценочное исследование (prospective evaluation study), в котором сравнивали результаты WoE-анализа с данными, полученными в двухлетних исследованиях канцерогенности [10]. Пересмотренное руководство ICH S1B(R1) содержит приложение, в котором описан комплексный подход для определения необходимости проведения двухлетних исследований канцерогенности на крысах с учетом результатов WoE-анализа. Выделено шесть факторов риска, которые образуют интегрированную целостную синергетическую систему анализа и оценки канцерогенной безопасности лекарственного препарата [11].
- Целевые биологические эффекты:
- данные о первичной фармакодинамике препарата и его основных метаболитов у человека и крыс;
- информация, полученная с использованием генно-инженерных моделей;
- данные о генотоксичности;
- информация из баз данных о канцерогенности;
- информация о класс-специфических канцерогенных свойствах (при наличии).
- Вторичная фармакодинамика: результаты скрининговых исследований вторичной фармакодинамики исходного лекарственного средства и его основных метаболитов для демонстрации селективности и нецелевого связывания, особенно определяющие риск канцерогенности (например, связывание с ядерными рецепторами).
- Гистопатологические данные: данные гистопатологических исследований, полученные в результате изучения токсичности при повторном введении, с особым упором на 6-месячное исследование на крысах, включая оценку запаса безопасности на основании изучения системной экспозиции в плазме крови исходного лекарственного средства и его основных метаболитов.
- Гормональные эффекты: доказательства гормональных нарушений, включая знания о механизмах действия лекарственных средств на организм и компенсаторных эндокринных реакциях; существенные патоморфологические и микроскопические изменения эндокринных и репродуктивных органов, полученные в результате изучения токсичности при повторном введении; а также соответствующие результаты исследований репродуктивной токсичности (при наличии). В руководстве ICH S1B(R1) разъясняется, что гормональные нарушения, зафиксированные в опытах на крысах, могут включать микроскопические изменения эндокринных или репродуктивных тканей в виде атрофии, гипертрофии и гиперплазии и/или биологически значимые изменения массы эндокринных и репродуктивных органов, которые не являются вторичными по отношению к таким процессам, как стресс или изменение массы тела. Изменения такого рода свидетельствуют о функциональных гормональных нарушениях, даже если изменения уровня гормонов не зафиксированы, и говорят о потенциальном канцерогенном риске, если не доказано обратное на основании результатов изучения их значимости для человека.
- Генотоксичность: результаты изучения с использованием критериев тестирования на генотоксичность. Неоднозначные данные о генотоксичности увеличивают неопределенность в отношении канцерогенного потенциала. Согласно руководству ICH S1B(R1) нужно следовать рекомендациям, изложенным в руководстве ICH S2(R1) по изучению генотоксичности лекарственных препаратов.
- Иммуномодулирующее действие: выраженная иммуносупрессия свидетельствует о риске для человека, который может быть не подтвержден результатами стандартных исследований канцерогенности на крысах и мышах. Руководство ICH S1B(R1) рекомендует следовать рекомендациям, изложенным в руководстве ICH S8 по изучению иммунотоксичности лекарственных препаратов.
WoE-анализ включает всестороннюю оценку всей совокупности данных, относящихся к канцерогенному потенциалу, которые можно получить из открытых источников и из соответствующих исследований лекарственных препаратов. Вышеперечисленных факторов WoE может быть достаточно для того, чтобы сделать вывод о том, будет ли двухлетнее исследование на крысах полезным для оценки канцерогенного риска для человека. Однако в тех случаях, когда один или несколько факторов риска могут быть неубедительными или указывать на возможную канцерогенность, спонсор может провести специальное исследование для устранения неопределенности или повышения значимости выявленного риска для человека41.
Для определения того, будет ли двухлетнее исследование на крысах способствовать оценке канцерогенного риска для человека, следует провести комплексный анализ факторов WoE, описанных выше. Хотя все факторы будут включены в комплексный анализ, относительная важность каждого фактора будет варьировать для каждого конкретного препарата.
WoE-оценка канцерогенного риска лекарственного препарата для человека с целью принятия решения о необходимости проведения двухлетнего исследования канцерогенности представлена на рисунке 6.
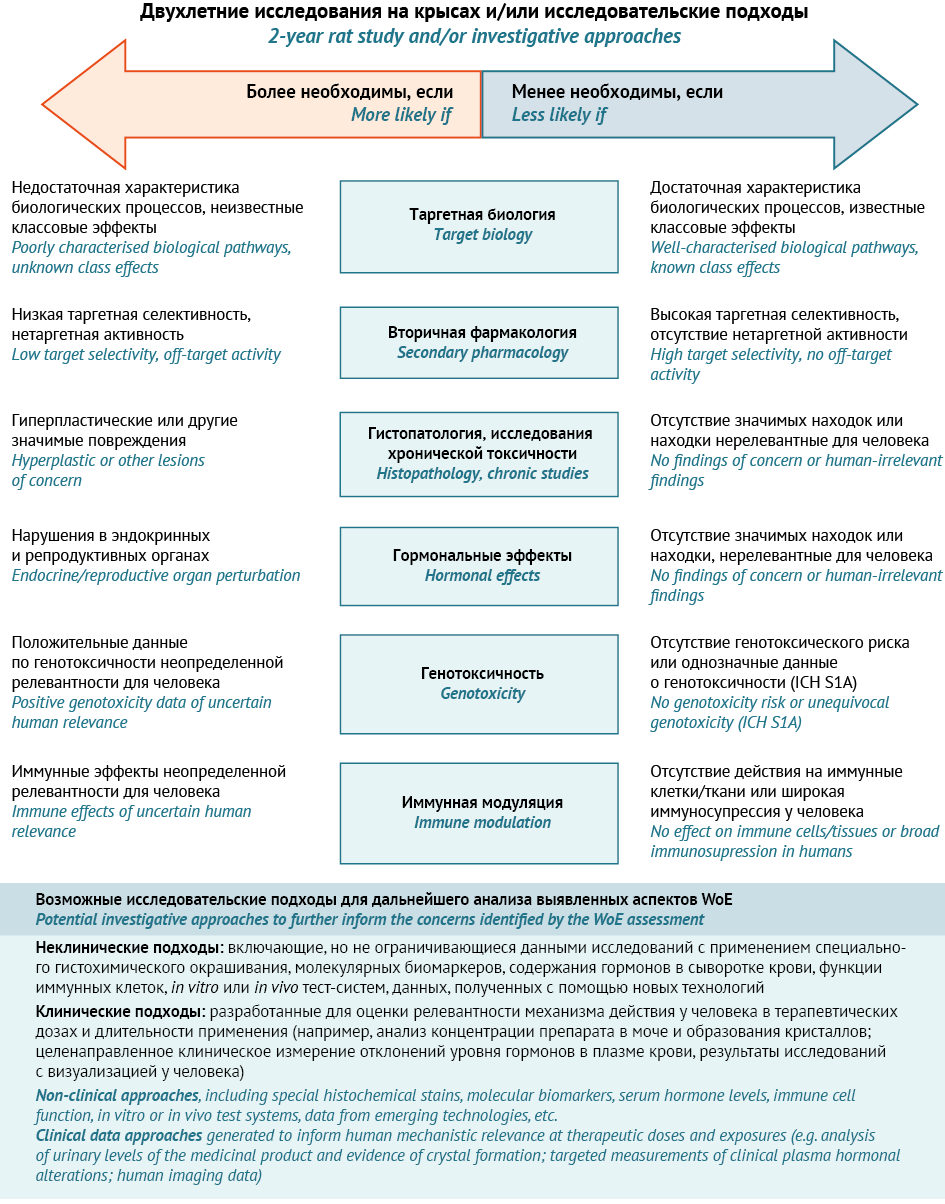
Рисунок адаптирован авторами из руководства ICH S1B(R1) / The figure is adapted by the authors from ICH S1B(R1)
Рис. 6. Ключевые WoE факторы и исследовательские подходы по дальнейшему анализу необходимости проведения 2-летних исследований на крысах для оценки канцерогенного риска у человека
Fig. 6. Key WoE factors and potential investigative approaches to further inform on the value of conducting a 2-year rat study for human carcinogenic risk assessment
Исследования на мышах, особенно на трансгенных особях, являются рекомендуемым компонентом оценки канцерогенности, даже если оценка WoE показывает, что двухлетнее исследование на крысах не принесет пользы. Это объясняется тем, что эксперименты на трансгенных мышах являются альтернативной моделью канцерогенеза, позволяющей оценить канцерогенный риск препарата для человека. Однако исследование на мышах может оказаться неинформативным, если лекарственный препарат может быть канцерогенен для человека, или наоборот, если канцерогенный риск для человека невелик, а воздействие препарата на мышей не является сравнимым с воздействием на человека.
Необходимо подчеркнуть, что окончательное решение о необходимости проведения долгосрочного исследования канцерогенности лекарственного препарата остается за регуляторным органом, выводы которого могут отличаться от выводов разработчиков препарата, что является ожидаемым, учитывая сложность объединения информации различных WoE-факторов [10]. В этой связи например, Швейцарское агентство по терапевтическим продуктам (Swiss Agency for Therapeutic Products, Swissmedic) рекомендует заявителям, которые на основании WoE-анализа делают вывод, что проведение двухлетнего исследования на крысах не позволит получить дополнительную информацию для оценки канцерогенного риска препарата для человека, получать консультативную помощь регуляторных органов. Вместе с запросом на научную консультацию должна быть представлена соответствующая документация, в которой рассматриваются все аспекты проведенного разработчиком WoE-анализа42.
Важно отметить, что даже если в конечном итоге потребуется двухлетнее исследование на крысах, проведенная WoE-оценка обеспечит лучшее понимание конкретных факторов и степени канцерогенного риска для человека, чем это может быть достигнуто с помощью только двухлетнего эксперимента на крысах [11].
WoE-подход указан в качестве новой методологии (new approach methodologies, NAMs), которая предлагается Центром оценки и исследования лекарственных средств (Center for Drug Evaluation and Research, CDER) FDA при доклинической оценке канцерогенного потенциала биотехнологических лекарственных препаратов [12]. WoE-анализ проводится с учетом конкретных биологических особенностей и обычно включает фармакологическую оценку известных лекарственных средств и токсикологические исследования конкретных соединений. Тестирование на генотоксичность для биологических препаратов, как правило, не требуется43 и поэтому не включается в WoE-анализ. При наличии достаточной информации WoE-подход позволяет адекватно оценить канцерогенный потенциал и исключить необходимость проведения дополнительных исследований на грызунах независимо от того, являются ли они релевантным видом животных. Если результаты WoE-анализа подтверждают наличие канцерогенного действия (например, для иммунодепрессантов и факторов роста) или, напротив, не указывают на канцерогенный потенциал, исследования канцерогенности на грызунах, скорее всего, не позволят получить дополнительную информацию и не будут рекомендованы. Предварительное знание целевых рисков играет важную роль при разработке стратегии оценки канцерогенности каждого нового биологического вещества, поскольку неспецифическая активность таких молекул, как правило, считается низкой [12].
Если WoE-анализ недостаточен для четкой оценки канцерогенности, в соответствии с ICH S6(R1) могут быть предложены альтернативные исследования для того, чтобы уменьшить неопределенность или устранить пробелы в данных и более четко информировать о потенциальном риске [11].
Градацию риска, основанную на воздействии на конкретный иммунный путь, можно проиллюстрировать на примере маркировки биотерапевтических препаратов, которые предназначены для модуляции иммунной системы. Так, A.M. Avila и соавт. [12] отмечают, что на упаковку оригинального препарата адалимумаб, который представляет собой ингибитор фактора некроза опухоли (tumour necrosis factor, TNF), нанесено выделенное жирным шрифтом предупреждение о риске развития лимфомы и других злокачественных новообразований (по данным при использовании у человека). В то же время в инструкции по медицинскому применению для препарата устекинумаб, который связывается с субъединицами p40 интерлейкинов IL-12 и IL-23, имеется предупреждение о потенциальном риске злокачественных новообразований, а для препарата секукинумаб, который ингибирует IL-17, — предупреждение о повышенном риске злокачественных новообразований отсутствует [12].
Недостатки WoE-подхода и пути их устранения
Одним из недостатков применения WoE-метода в системе здравоохранения, по мнению некоторых авторов, является субъективизм в определении критериев (факторов) для оценки и при присвоении им определенной степени весомости [13]. Указывается также на необходимость достижения определенного консенсуса для выделения ограниченной группы ключевых факторов для успешного применения WoE-анализа [3].
Необходимо подчеркнуть, что основные ключевые факторы для проведения WoE-оценки безопасности лекарственных препаратов закреплены в нормативных документах, над созданием которых в течение нескольких лет работали специалисты Рабочих групп по внедрению (Implementation Working Group, IWG) в сотрудничестве с экспертами регуляторных органов и представителями промышленности. Более того, учитывая потенциальную возможность получения противоречивых выводов в ходе проспективного исследования, после доработки руководства S1B(R1) было рекомендовано провести тщательный мониторинг внедрения WoE-подхода для выявления любых несоответствий и в дальнейшем обсудить возможности их устранения44.
Документирование WoE-анализа для регуляторных органов
При подготовке регистрационного досье разработчикам рекомендуется систематизировать информацию о проведенном WoE-анализе логическим образом для предоставления регуляторным органам [12]:
- резюме;
- материалы и методы;
- обоснование ключевых факторов, включенных в WoE-анализ;
- описание полученных результатов оценки риска;
- комплексная оценка рисков (выводы).
В статье [12] также подчеркивается, что в некоторых случаях может быть целесообразно в приложениях предоставлять подробную информацию по любому аспекту оценки WoE, включая резюме доклинических исследований, табличные данные, графические данные из баз данных или другую информацию.
ЗАКЛЮЧЕНИЕ
WoE-анализ, основанный на оценке весомости доказательств, — это системный подход, который объединяет качество, надежность, актуальность и согласованность данных для усиления доказательной базы при оценке риска. При проведении WoE-анализа используют информацию из нескольких независимых источников, которая должна быть адекватна, структурирована и надежна, а сам анализ требует научных суждений.
Международные нормативные руководства по доклиническим исследованиям лекарственных средств рекомендуют использовать WoE-анализ при оценке риска и решении вопроса о необходимости проведения дополнительных исследований. В связи с этим использование WoE-анализа для оценки влияния потенциальных факторов риска имеет важное значение для планирования и интерпретации результатов релевантных доклинических исследований и проведения экспертизы безопасности лекарственных средств. Разработчикам лекарственных препаратов рекомендуется систематизировать информацию о проведенном WoE-анализе логическим образом для предоставления регуляторным органам.
Рассмотренные ключевые факторы и алгоритмы оценки риска могут быть внедрены организаторами и исполнителями доклинических исследований, а также использованы при проведении экспертизы результатов доклинических исследований безопасности лекарственных средств. Представленные подходы, кроме того, могут быть использованы для обоснования целесообразности выделения дополнительных факторов риска, которые не описаны в международных нормативных документах.
1 Решение Коллегии Евразийской экономической комиссии от 26.11.2019 № 202 «Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных средств».
2 ICH Topic M3(R2): Non-clinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorisation for Pharmaceuticals. CPMP/ICH/286/95. EMA; 2008.
3 ICH S1B(R1): Testing for Carcinogenicity of Pharmaceuticals. EMA/774371/2022. EMA; 2022.
ICH S11: Nonclinical Safety Testing in Support of Development of Paediatric Pharmaceuticals. EMA/CHMP/ICH/616110/2018. EMA; 2020.
ICH S5(R3) Detection of Reproductive and Developmental Toxicity for Human Pharmaceuticals. EMA/CHMP/ICH/544278/1998. EMA; 2020.
4 Рекомендация Коллегии Евразийской экономической комиссии от 03.10.2023 № 26 «О Руководстве по оценке особой значимости для здоровья населения лекарственных препаратов в целях проведения ускоренной экспертизы при их регистрации».
5 Решение Коллегии Евразийской экономической комиссии от 14.01.2020 № 1 «Об утверждении Руководства по установлению допустимых пределов воздействия на здоровье в целях идентификации рисков при производстве лекарственных средств на общих производственных (технологических) линиях».
6 ГОСТ 32436-2020 Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке острого раздражающего/разъедающего действия на кожу.
ГОСТ 34661-2020 Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке канцерогенной активности.
ГОСТ 34658-2020 Методы испытания по воздействию химической продукции на организм человека. Оценка раздражающего/разъедающего воздействия на глаза.
7 ICH S5(R3) Detection of Reproductive and Developmental Toxicity for Human Pharmaceuticals. EMA/CHMP/ICH/544278/1998. EMA; 2020.
8 Weight of Evidence: General Principles and Current Applications at Health Canada. Health Canada; 2018. https://www.canada.ca/content/dam/hc-sc/documents/services/publications/science-research-data/weight-evidence-general-principles-current-applications/weight-evidence-general-principles-current-applications.pdf
9 OECD Guiding Principles and Key Elements for Establishing a Weight of Evidence for Chemical Assessment. OECD Series on Testing and Assessment, No. 311. OECD; 2019. https://doi.org/10.1787/f11597f6-en
10 Memorandum on weight of evidence and uncertainties — Revision 2018. Scientific Committee on Health, Environmental and Emerging Risks (SCHEER). https://health.ec.europa.eu/system/files/2019-02/scheer_o_014_0.pdf
11 Weight of Evidence Working Group. Weight of Evidence: General Principles and Current Applications at Health Canada. Prepared by the Task Force on Scientific Risk Assessment’s Weight of Evidence Working Group. Health Canada; 2018. https://www.canada.ca/en/health-canada/services/publications/science-research-data/weight-evidence-general-principles-current-applications.html
12 Weight-of-Evidence: Evaluating Results of EDSP Tier 1 Screening to Identify the Need for Tier 2 Testing. USEPA; 2011. https:// www. regulations.gov/document/EPA-HQ-OPPT-2010-0877-0021
13 Weight of Evidence / Uncertainty in Hazard Assessment. ECHA; 2017. https://echa.europa.eu/support/guidance-on-reach-and-clp-implementation/formats
14 ICH S1B(R1): Testing for Carcinogenicity of Pharmaceuticals. EMA/774371/2022. EMA; 2022.
15 OECD Guiding Principles and Key Elements for Establishing a Weight of Evidence for Chemical Assessment. OECD Series on Testing and Assessment, No. 311. OECD; 2019. https://doi.org/10.1787/f11597f6-en
16 ГОСТ 34658-2020 Методы испытания по воздействию химической продукции на организм человека. Оценка раздражающего/разъедающего воздействия на глаза.
17 ICH S1B(R1): Testing for Carcinogenicity of Pharmaceuticals. EMA/774371/2022. EMA; 2022.
18 https://echa.europa.eu/support/registration/how-to-avoid-unnecessary-testing-on-animals/weight-of-evidence
19 OECD Guiding Principles and Key Elements for Establishing a Weight of Evidence for Chemical Assessment. OECD Series on Testing and Assessment, No. 311. OECD; 2019. https://doi.org/10.1787/f11597f6-en
20 Weight-of-Evidence Assessments: Unpacking New Guidance on Carcinogenicity Testing. February 1, 2023.
https://premierconsulting.com/resources/blog/weight-of-evidence-assessments-unpacking-new-guidance-on-carcinogenicity-testing/
21 ICH S1B(R1): Testing for Carcinogenicity of Pharmaceuticals. EMA/774371/2022. EMA; 2022.
22 ICH S5(R3) Detection of Reproductive and Developmental Toxicity for Human Pharmaceuticals. EMA/CHMP/ICH/544278/1998. EMA; 2020.
23 ICH S8 Immunotoxicity Studies for Human Pharmaceuticals. CHMP/167235/2004. EMA; 2006.
24 ICH S11: Nonclinical Safety Testing in Support of Development of Paediatric Pharmaceuticals. ICH; 2020.
25 ICH S1B(R1): Testing for Carcinogenicity of Pharmaceuticals. EMA/774371/2022. EMA; 2022.
26 ICH S11: Nonclinical Safety Testing in Support of Development of Paediatric Pharmaceuticals. EMA/CHMP/ICH/616110/2018. EMA; 2020.
27 https://doi.org/10.30895/2312-7821-2024-12-4-463-476-fig2
https://doi.org/10.30895/2312-7821-2024-12-4-463-476-fig3
https://doi.org/10.30895/2312-7821-2024-12-4-463-476-fig4
28 https://doi.org/10.30895/2312-7821-2024-12-4-463-476-fig5
29 https://doi.org/10.30895/2312-7821-2024-12-4-463-476-fig2
30 https://doi.org/10.30895/2312-7821-2024-12-4-463-476-fig3
31 https://doi.org/10.30895/2312-7821-2024-12-4-463-476-fig4
32 https://doi.org/10.30895/2312-7821-2024-12-4-463-476-fig5
33 ICH S5(R3) Detection of Reproductive and Developmental Toxicity for Human Pharmaceuticals. EMA/CHMP/ICH/544278/1998. EMA; 2020.
34 Guidance on the Biocidal Products Regulation Volume III Human Health — Assessment & Evaluation (Parts B+C). Version 4.0. ECHA; 2017.
35 Oncology Pharmaceuticals: Reproductive Toxicity Testing and Labeling Recommendations. Guidance for Industry. FDA-2017-D-2165. FDA; 2019.
36 ICH M3(R2) Guideline: Guidance on Nonclinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorization for Pharmaceuticals. CPMP/ICH/286/95. EMA; 2008.
37 ICH S8 Immunotoxicity Studies for Human Pharmaceuticals. 2005
38 ICH S1A Guideline on the Need for Carcinogenicity studies of Pharmaceuticals. CPMP/ICH/140/95. EMA; 1996.
39 ICH S1C(R2) Dose Selection for Carcinogenicity studies of Pharmaceuticals. EMEA/CHMP/ICH/383/1995. EMA; 2008.
40 ICH S1B(R1): Testing for Carcinogenicity of Pharmaceuticals. EMA/774371/2022. EMA; 2022.
41 Там же.
42 Swissmedic offers Scientific Advice for Weight-of-Evidence Approach described in the Addendum of ICH Guideline S1B(R1). https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/sm-bietet-scientific-advice-fuer-weight-of-evidence-approach.html
43 ICH S6(R1) Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals. CPMP/ICH/302/95. EMA; 2011. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
44 S1B(R1) Final Concept Paper S1B(R1) Testing for Carcinogenicity of Pharmaceuticals. https://www.ich.org/page/safety-guidelines
Список литературы
1. Meek ME, Boobis A, Cote I, Dellarco V, Fotakis G, Munn S, et al. New developments in the evolution and application of the WHO/IPCS framework on mode of action/species concordance analysis. J Appl Toxicol. 2014;34(1):1–18. https://doi.org/10.1111/j.1539-6924.2005.00699.x
2. Linkov I, Loney D, Cormier S, Satterstrom FK, Bridges T. Weight-of-evidence evaluation in environmental assessment: review of qualitative and quantitative approaches. Sci Total Environ. 2009;407(19):5199–205.https://doi.org/10.1016/j.scitotenv.2009.05.004
3. Weed DL. Weight of evidence: a review of concept and methods. Risk Anal. 2005; 25(6):1545–57. https://doi.org/10.1111/j.1539-6924.2005.00699.x
4. Martin P, Bladier C, Meek B, Bruyere O, Feinblatt E, Touvier M, et al. Weight of evidence for hazard identification: a critical review of the literature. Environ Health Perspect. 2018;126(7):076001. https://doi.org/10.1289/EHP3067
5. Dekant W, Bridges J. A quantitative weight of evidence methodology for the assessment of reproductive and developmental toxicity and its application for classification and labeling of chemicals. Regul Toxicol Pharmacol. 2016;82:173–85. https://doi.org/10.1016/j.yrtph.2016.09.009
6. Ågerstrand M, Beronius A. Weight of evidence evaluation and systematic review in EU chemical risk assessment: foundation is laid but guidance is needed. Environ Int. 2016;92–93:590–6. https://doi.org/10.1016/j.envint.2015.10.008
7. Dekant W, Bridges J. Assessment of reproductive and developmental effects of DINP, DnHP and DCHP using quantitative weight of evidence. Regul Toxicol Pharmacol. 2016;81:397–406. https://doi.org/10.1016/j.yrtph.2016.09.032
8. Енгалычева ГН, Сюбаев РД. Разработка педиатрических препаратов: ключевые факторы риска и программа доклинических исследований. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2023;13(1):14–26. https://doi.org/10.30895/1991-2919-2023-500
9. Hoberman AM, Maki K, Mikashima F, Naota M, Wange RL, Lansita JA, Weis SL. Alternatives to monkey reproductive toxicology testing for biotherapeutics. Int J Toxicol. 2023;42(6):467–79. https://doi.org/10.1177/10915818231200859
10. Bourcier T, McGovern T, Cavaliero T, Ebere G, Nishikawa A, Nishimura J, et al. ICH S1 prospective evaluation study: weight of evidence approach to predict outcome and value of 2-year rat carcinogenicity studies. A report from the Regulatory Authorities Subgroup. Front Toxicol. 2024;6:1353783. https://doi.org/10.3389/ftox.2024.1353783
11. Bassan A, Steigerwalt R, Keller D, Beilke L, Bradley PM, Bringezu F, et al. Developing a pragmatic consensus procedure supporting the ICH S1B(R1) weight of evidence carcinogenicity assessment. Front Toxicol. 2024;6:1370045. https://doi.org/10.3389/ftox.2024.1370045
12. Avila AM, Bebenek I, Bonzo JA, Bourcier T, Davis Bruno KL, Carlson DB, et al. An FDA/CDER perspective on nonclinical testing strategies: classical toxicology approaches and new approach methodologies (NAMs). Regul Toxicol Pharmacol. 2020;114:104662. https://doi.org/10.1016/j.yrtph.2020.104662
13. Vahle JL, Dybowski J, Graziano M, Hisada S, Lebron J, Nolte T, et al. ICH S1 prospective evaluation study and weight of evidence assessments: commentary from industry representatives. Front Toxicol. 2024;6:1377990. https://doi.org/10.3389/ftox.2024.1377990
14. Rosen EM, Ritchey ME, Girman CJ. Can weight of evidence, quantitative bias, and bounding methods evaluate robustness of real-world evidence for regulator and health technology assessment decisions on medical interventions? Clin Ther. 2023;45(12):1266–76. https://doi.org/10.1016/j.clinthera.2023.09.010
Об авторах
Г. Н. ЕнгалычеваРоссия
Енгалычева Галина Нинелевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. Д. Сюбаев
Россия
Сюбаев Рашид Даутович, д-р мед. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы

|
1. Рис. 2. Пример WoE-анализа: обоснование нецелесообразности проведения дополнительных доклинических исследований на неполовозрелых животных для лекарственного препарата с хорошо изученной фармакологической активностью, представляющего собой малую молекулу (по данным ICH S11). Стрелки указывают градиент значимости фактора | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(181KB)
|
Метаданные ▾ | |

|
2. Рис. 3. Пример WoE-анализа: обоснование целесообразности проведения дополнительных доклинических исследований на неполовозрелых животных для лекарственного препарата c новым механизмом действия, представляющего собой малую молекулу. Стрелки указывают градиент значимости фактора | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(180KB)
|
Метаданные ▾ | |

|
3. Рис. 4. Пример WoE-анализа: обоснование целесообразности проведения дополнительных исследований на неполовозрелых животных для лекарственного препарата, представляющего собой малую молекулу, с фармакологической мишенью, которая играет важную роль в развитии центральной нервной системы. Стрелки указывают градиент значимости фактора | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(181KB)
|
Метаданные ▾ | |

|
4. Рис. 5. Пример WoE-анализа: обоснование нецелесообразности проведения дополнительных исследований на неполовозрелых животных для лекарственного препарата, представляющего собой моноклональное антитело. Стрелки указывают градиент значимости фактора | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(169KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Енгалычева Г.Н., Сюбаев Р.Д. WoE-анализ и ключевые факторы риска при доклинической разработке лекарственных препаратов: обзор. Безопасность и риск фармакотерапии. 2024;12(4):463-476. https://doi.org/10.30895/2312-7821-2024-12-4-463-476
For citation:
Engalycheva G.N., Syubaev R.D. WoE Analysis and Key Risk Factors in Preclinical Development of Medicinal Products: A Review. Safety and Risk of Pharmacotherapy. 2024;12(4):463-476. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-4-463-476
JATS XML





































