Перейти к:
Количественное обнаружение сигналов безопасности лекарственных препаратов, применяемых при COVID-19, на основе ретроспективного анализа спонтанных сообщений национальной российской базы фармаконадзора
https://doi.org/10.30895/2312-7821-2023-382
Резюме
АКТУАЛЬНОСТЬ. В период пандемии новой коронавирусной инфекции COVID-19 на фоне увеличения потребления препаратов различных групп возросло количество спонтанных сообщений о нежелательных реакциях при их применении. Поэтому актуальным является проведение анализа этой информации для выявления потенциальных сигналов безопасности.
ЦЕЛЬ. Систематизация и количественная оценка данных национальной базы фармаконадзора Российской Федерации о безопасности лекарственных средств, применяемых при COVID-19.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен ретроспективный анализ данных спонтанных сообщений, поступивших в национальную базу данных по фармаконадзору Российской Федерации за период с 01.01.2020 по 31.12.2022. Выявление сигналов безопасности осуществляли с использованием анализа диспропорциональности.
РЕЗУЛЬТАТЫ. В 873 спонтанных сообщениях, данные о которых размещены на сайте Росздравнадзора в указанный период, содержалась информация о 1636 нежелательных реакциях (НР), развившихся на фоне фармакотерапии COVID-19. В основном НР ассоциировались с применением фавипиравира, гидроксихлорохина и олокизумаба (493, 87 и 85 сообщений соответственно). Среди клинических проявлений НР наиболее частыми были изменения лабораторных и инструментальных показателей — 273 случая (16,7%), нарушения со стороны печени и желчевыводящих путей — 203 (12,4%) и желудочно-кишечные нарушения — 191 (11,6%). Большинство событий — 674 случая (77%) — имели благоприятный исход. С помощью частотного анализа диспропорциональности со стратификацией по показанию COVID-19 нами идентифицировано 23 потенциальных сигнала о диспропорциональности для препаратов азитромицин, дексаметазон, левилимаб, лопинавир+ритонавир, молнупиравир, олокизумаб, тофацитиниб, тоцилизумаб, умифеновир, фавипиравир.
ВЫВОДЫ. Новые сигналы требуют дополнительного изучения описательной части карт-извещений о НР с целью оценки причинно-следственной связи, валидации, приоритизации и клинического осмысления. Отсутствие выявленных сигналов безопасности для препаратов гидроксихлорохин, ремдесивир, барицитиниб, сарилумаб и иммуноглобулин человека против COVID-19 не исключает наличия новых взаимосвязей, которые не удалось обнаружить частотным методом.
Ключевые слова
Для цитирования:
Мишинова С.А., Колбин А.С., Полушин Ю.С., Вербицкая Е.В. Количественное обнаружение сигналов безопасности лекарственных препаратов, применяемых при COVID-19, на основе ретроспективного анализа спонтанных сообщений национальной российской базы фармаконадзора. Безопасность и риск фармакотерапии. 2024;12(1):45-57. https://doi.org/10.30895/2312-7821-2023-382
For citation:
Mishinova S.A., Kolbin A.S., Polushin Yu.S., Verbitskaya E.V. Quantitative Signal Detection for COVID-19 Medicinal Products Based on Retrospective Analysis of Spontaneous Reports from the Russian Pharmacovigilance Database. Safety and Risk of Pharmacotherapy. 2024;12(1):45-57. (In Russ.) https://doi.org/10.30895/2312-7821-2023-382
Введение
Согласно Правилам надлежащей практики фармаконадзора Евразийского экономического союза, фармаконадзор — это система, предназначенная для разработки и внедрения мер по обеспечению контроля всех изменений в оценке соотношения «польза–риск» лекарственных препаратов (ЛП), организуемая как держателями регистрационных удостоверений, так и уполномоченными органами1. В Российской Федерации этими органами являются Росздравнадзор, Центр фармаконадзора ФГБУ «ИМЦЭУАОСМП» Росздравнадзора, 78 территориальных органов Росздравнадзора, 59 региональных центров фармаконадзора и 78 региональных иммунологических комиссий.
Наблюдательные неинтервенционные исследования служат одним из ключевых механизмов существующей системы фармаконадзора, позволяющим провести количественную оценку угрозы безопасности ЛП. Процесс передачи в установленной форме информации о нежелательных реакциях (НР) в уполномоченные органы называется репортированием. В Российской Федерации такие сведения в форме спонтанных сообщений (СС) поступают в базу данных «Фармаконадзор 2.0» Автоматизированной информационной системы (АИС) Росздравнадзора2. В базу данных «Фармаконадзор 2.0» внедрен формат передачи данных по безопасности ЛП Международного совета по гармонизации (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH) — ICH E2B (R3)3. Это позволяет автоматически принимать сообщения из отечественных и зарубежных программных ресурсов по фармаконадзору, поддерживать информационный обмен анонимизированными данными со Всемирной организацией здравоохранения (ВОЗ) в рамках программы международного мониторинга безопасности лекарственных средств. Все поступающие в базу данных СС рассматривают как подозреваемые НР, также учитывают наличие или отсутствие критериев серьезности и оценивают ожидаемость (предвиденность) события4. НР, являющиеся одновременно серьезными и непредвиденными, классифицируются как подозреваемые серьезные непредвиденные НР (СННР; suspected unexpected serious adverse reaction, SUSAR)5.
База данных регулярно проверяется на возможные сигналы безопасности, которые предполагают наличие новой потенциальной причинно-следственной связи или нового аспекта известной взаимосвязи между воздействием ЛП и НР (оценивают частоту развития НР по полу, возрасту, территории проживания пациента, продолжительности, степени тяжести или исходу) [1]. Процесс обнаружения сигналов или «выявление сигнала» (signal detection) включает статистический анализ информации баз данных по фармаконадзору [2].
Пандемия новой коронавирусной инфекции (coronavirus disease 2019, COVID-19) вызвала необходимость внесения значительных изменений в системы здравоохранения на всех уровнях для обеспечения доступа пациентов к необходимым лекарственным средствам. Были приняты беспрецедентные решения о возможности применения различных препаратов для терапии этого заболевания [3]. На этом фоне возросла сообщаемость о случаях развития НР при применении ЛП. Так, по состоянию на 2022 г. база данных «Фармаконадзор 2.0» АИС Росздравнадзора насчитывала 60 000 сообщений, что в 2 раза превысило количество сообщений, зарегистрированных в ней по состоянию на 2019 год6. В связи со столь значительным увеличением количества СС о НР при лечении данной нозологии представляется актуальным провести анализ полученной информации для выявления потенциальных сигналов.
Цель работы — систематизация и количественная оценка данных национальной базы фармаконадзора Российской Федерации о безопасности лекарственных средств, применяемых при COVID-19.
Материалы и методы
Проведен ретроспективный анализ информации СС, размещенных в базе данных «Фармаконадзор 2.0» АИС Росздравнадзора7 за 3 года, в период с 01.01.2020 по 31.12.2022, о НР при применении ЛП со следующими международными непатентованными наименованиями (МНН): азитромицин, барицитиниб, дексаметазон, гидроксихлорохин, лопинавир+ритонавир, олокизумаб, тофацитиниб, умифеновир, сарилумаб, тоцилизумаб, левилимаб, молнупиравир, ремдесивир, иммуноглобулин человека против COVID-19, фавипиравир. Критерием отбора ЛП было включение их в различные версии временных методических рекомендаций по диагностике, профилактике и лечению COVID-198. Критерием включения СС в выборку было наличие в поле «Показание к назначению» подозреваемого ЛП «COVID-19» или различных формулировок данного диагноза: «Ковид-19», «Коронавирусная инфекция 2019 года», «Интерстициальная пневмония, вызываемая коронавирусной инфекцией COVID-19», «Воздействие коронавируса SARS-CoV-2», «НКВИ». При проведении общего анализа карт-извещений о НР или отсутствии терапевтического эффекта ЛП (далее — карта-извещение) не были проанализированы такие данные, как количество сопутствующих препаратов, предпринятые меры, информация об отмене препарата, информация об аллергологическом статусе пациентов, что является ограничением исследования.
Каждое из выявленных событий безопасности было проанализировано на предмет предвиденности и непредвиденности, в качестве референтной информации использовали утвержденные на территории Российской Федерации инструкции по медицинскому применению (ИМП) ЛП9. Описана структура спонтанных сообщений по исходам НР. Для удобства статистической обработки данных использовали медицинский словарь терминов для регуляторной деятельности (Medical Dictionary for Regulatory Activities, MedDRA)10, версия 25.0, с указанием системно-органного класса возникшей реакции.
Для выявления сигналов безопасности использовали небайесовский частотный количественный статистический метод с определением коэффициента отношения шансов репортирования (reporting odds ratio, ROR) и коэффициента пропорциональности репортирования (proportional reporting ratio, PRR). Показатели ROR и PRR были рассчитаны с 95% доверительными интервалами (95% CI). Для показателя PRR были рассчитаны значения критерия χ² Пирсона11 [4][5]. Потенциальные статистические сигналы о безопасности устанавливали на основании следующих критериев: 1) по показателю ROR: нижняя граница 95% CI>1, число случаев ≥2; 2) по показателю PRR: PRR≥2, χ²≥4, число случаев ≥3; нижняя граница 95% CI≥1, число случаев ≥3. Пороговый уровень значимости р по всем критериям принимали равным 0,05. Статистический анализ проводили с использованием Microsoft Excel 2013 (Microsoft Corporation, USA), IBM SPSS Statistics 27.0.
Результаты и обсуждение
За указанный период в базе данных было зарегистрировано 1830 СС, относящихся к вопросам безопасности ЛП, применяемых при COVID-19. В аналитический этап вошло 873 СС. Алгоритм отбора СС и выявления потенциальных сигналов безопасности ЛП представлен на рисунке 1. Каждое СС имело свой уникальный международный регистрационный номер; таким образом, количество СС было равно количеству пациентов. За отчетный период зарегистрировано 1636 НР, так как некоторые CC включали информацию о нескольких НР.
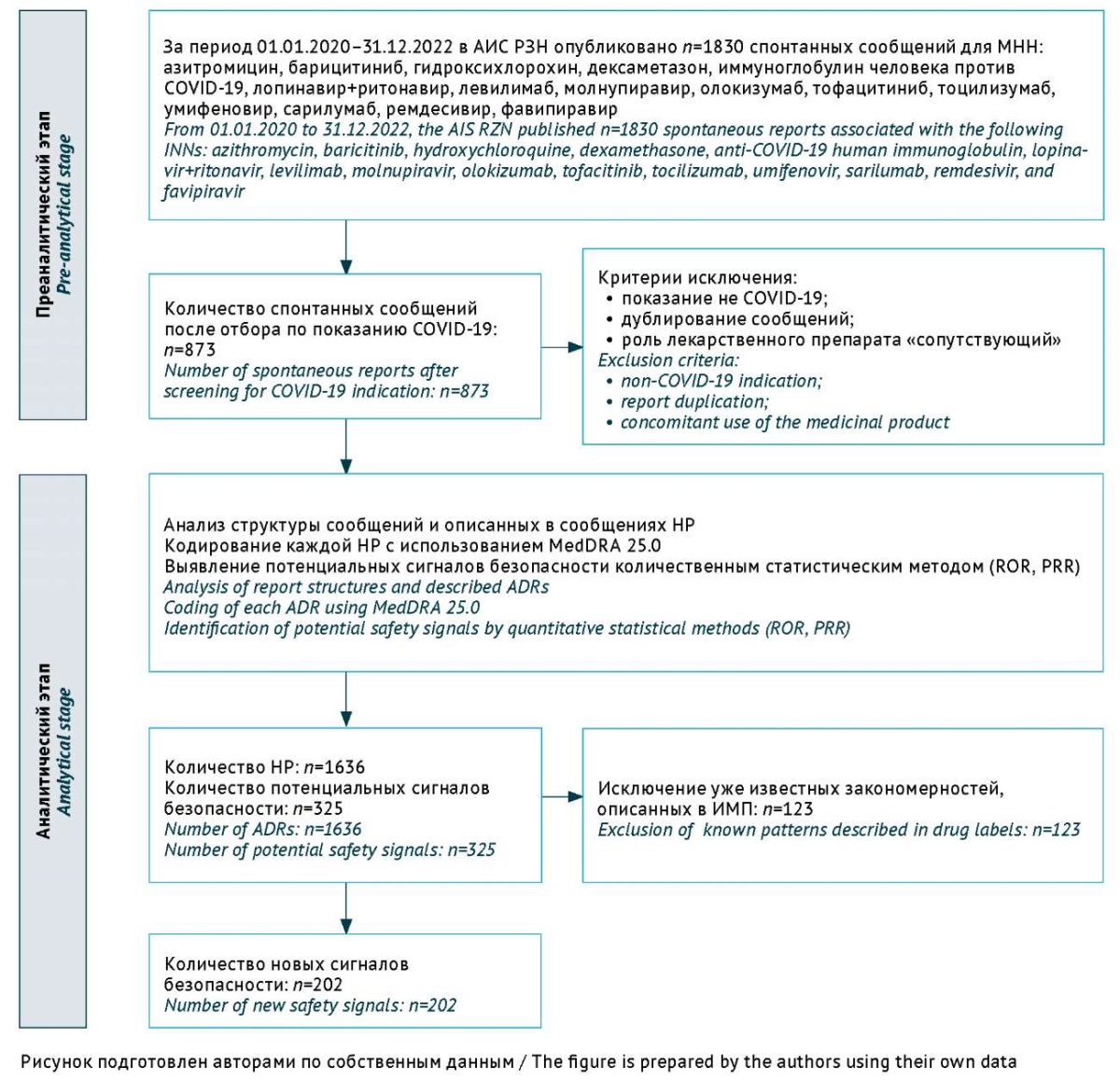
Рис. 1. Алгоритм анализа информации спонтанных сообщений
о применении лекарственных препаратов при COVID-19,
поступивших в национальную российскую базу данных фармаконадзора.
АИС РЗН — автоматизированная информационная система Росздравнадзора;
МНН — международное непатентованное наименование;
НР — нежелательная реакция;
MedDRA — медицинский словарь терминов для регуляторной деятельности
(Medical Dictionary for Drug Regulatory Affairs);
ROR — коэффициент отношения шансов репортирования (reporting odds ratio);
PRR — коэффициент пропорциональности репортирования
(proportional reporting ratio);
ИМП — инструкция по медицинскому применению лекарственного препарата
Fig. 1. Algorithm for analysis of data from spontaneous reports
on the use of medicinal products in patients with COVID-19
submitted to the Russian pharmacovigilance database.
AIS RZN, Automated Information System
of the Federal Service for Surveillance in Healthcare (Roszdravnadzor);
INN, international non-proprietary name;
ADR, adverse drug reaction;
MedDRA, Medical Dictionary for Drug Regulatory Affairs;
ROR, reporting odds ratio; PRR, proportional reporting ratio
Характеристика популяции пациентов, для которой зарегистрированы НР, представлена на рисунке 2. Средний возраст пациентов 62±16 лет. (максимальный — 98 лет, минимальный — 36 нед.). Количество женщин (496 чел., 56%) было больше количества мужчин (367 чел., 42%). В 8 случаях в СС отсутствовала информация о поле пациента, в 16 случаях — о возрасте.
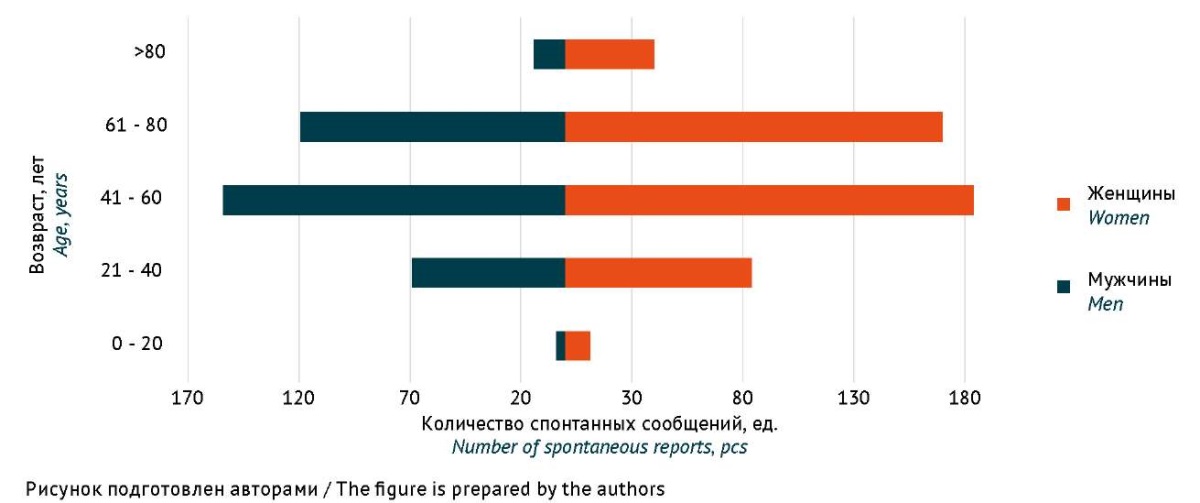
Рис. 2. Демографическая характеристика пациентов (n=873),
у которых возникли нежелательные реакции
при применении лекарственных препаратов для лечения COVID-19
(по данным национальной российской базы фармаконадзора)
Fig. 2. Demographic characteristics of patients (n=873)
who experienced adverse drug reactions
when using medicinal products for COVID-19
(according to the Russian national pharmacovigilance database)
Наибольшее число СС (рис. 3) содержало информацию о НР при применении ЛП с МНН фавипиравир (493 случая, 56%), гидроксихлорохин (87 случаев, 10%) и олокизумаб (85 случаев, 10%).

Рис. 3. Распределение спонтанных сообщений о нежелательных реакциях
при применении лекарственных препаратов для лечения COVID-19,
поступивших в национальную российскую базу фармаконадзора (n=873),
по назначенному препарату
Fig. 3. Distribution of spontaneous reports of adverse reactions
to medicinal products for COVID-19
in the Russian national pharmacovigilance database (n=873)
by prescribed medicinal product
На рисунке 4 представлены тенденции сообщаемости о НР для ЛП, по безопасности которых было получено более 20 сообщений за весь изучаемый период.

Рис. 4. Распределение спонтанных сообщений о нежелательных реакциях
при применении лекарственных препаратов для лечения COVID-19 (n=873)
по дате регистрации в национальной российской базе фармаконадзора
Fig. 4. Distribution of spontaneous reports
of adverse reactions to medicinal products for COVID-19
in the Russian national pharmacovigilance database (n=873)
by report registration date
Возможной причиной регистрации большого числа СС о НР при применении фавипиравира может быть разрешение Министерства здравоохранения Российской Федерации на временное обращение препарата12 и высокие показатели его потребления. Так, только за 2021 г. количество средних поддерживающих суточных доз (defined daily dose, DDD) фавипиравира составило 46 417 274,87, что в 30 раз выше потребления ремдесивира и в 6 раз выше потребления гидроксихлорохина [6].
Результаты анализа распределения наиболее часто встречавшихся клинических проявлений НР в соответствии с системно-органным классом по классификации MedDRA представлены на рисунке 5.

Рис. 5. Распределение нежелательных реакций (n=1636)
при применении лекарственных препаратов для лечения COVID-19
по основным системно-органным классам
медицинского словаря терминов для регуляторной деятельности
(Medical Dictionary for Drug Regulatory Affairs, MedDRA)
по данным национальной российской базы фармаконадзора:
1 — влияние на лабораторные и инструментальные показатели;
2 — нарушения со стороны печени и желчевыводящих путей;
3 — нарушения со стороны желудочно-кишечного тракта;
4 — нарушения со стороны крови и лимфатической системы;
5 — общие нарушения и реакции в месте введения;
6 — иммунные нарушения;
7 — нарушения со стороны дыхательной системы;
8 — нарушения со стороны сосудов;
9 — нарушения со стороны кожи и подкожной клетчатки;
10 — инфекционные и паразитарные заболевания;
11 — нарушения со стороны сердца;
12 — нарушения со стороны нервной системы;
13 — другое
Fig. 5. Distribution of adverse reactions to medicinal products for COVID-19 (n=1,636)
by Medical Dictionary for Drug Regulatory Affairs (MedDRA) System Organ Class
(according to the Russian national pharmacovigilance database):
1, investigations;
2, hepatobiliary disorders;
3, gastrointestinal disorders;
4, blood and lymphatic system disorders;
5, general disorders and administration site conditions;
6, immune system disorders;
7, respiratory, thoracic, and mediastinal disorders;
8, vascular disorders;
9, skin and subcutaneous tissue disorders;
10, infections and infestations;
11, cardiac disorders;
12, nervous system disorders;
13, other
Наиболее частыми клиническими проявлениями НР являлись влияние на лабораторные и инструментальные показатели (273 случая, 17% от общего числа выявленных НР), нарушения со стороны печени и желчевыводящих путей (203 случая, 12%) и желудочно-кишечного тракта (191 случай, 12%).
Структура описанных СС по исходам представлена на рисунке 6. Указания на исход НР представлены в 798 СС (91% случаев). В большинстве СС были зарегистрированы такие исходы, как выздоровление без последствий (341 случай, 39%) и улучшение состояния — (279 случаев, 32%). Реже сообщалось о летальном исходе (125 случаев, 14%) и отсутствии изменений состояния пациента (53 случая, 6%).
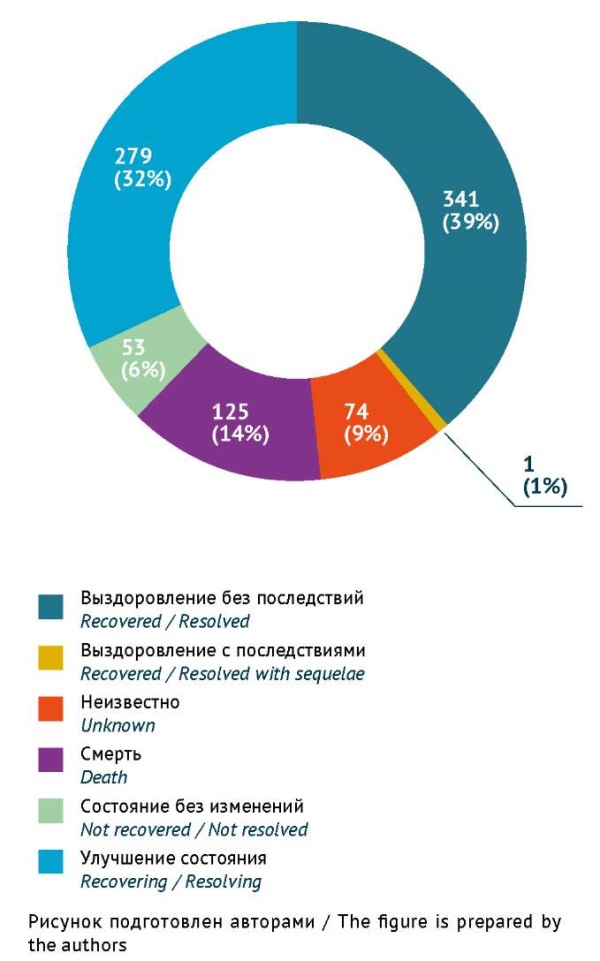
Рис. 6. Структура и количество спонтанных сообщений по исходу нежелательной реакции
при применении лекарственных препаратов для лечения COVID-19
(по данным национальной российской базы фармаконадзора, n=873)
Fig. 6. Structure and number of spontaneous reports
of adverse reactions to medicinal products for COVID-19
in the Russian national pharmacovigilance database (n=873) by outcome
Критериям СННР косвенно соответствовали 507 (31%) реакций из выявленных 1636, среди которых преобладали: дыхательная недостаточность — 33 (2%) случаев, крапивница — 24 (1%), легочная эмболия — 13 (0,8%), аллергический отек — 12 (0,7%). СННР, завершившиеся летальным исходом, были ассоциированы со следующими событиями: дыхательная недостаточность 30 (1,8%) случаев, легочная эмболия — 13 (0,8%), использование продукта по неутвержденным показаниям — 14 (0,8%), острый респираторный дистресс-синдром — 20 (1,2%), сепсис — 5 (0,3%), септический шок — 12 (0,7%), синдром полиорганной недостаточности — 15 (0,9%).
Результаты анализа источников информации о НР, возникающих при применении ЛС для лечения COVID-19, показали, что за весь анализируемый период времени наиболее часто СС поступали от медицинских работников — 342 (39%) случаев (рис. 7). Только в 2021 г. лидерами по количеству СС были держатели регистрационных удостоверений.
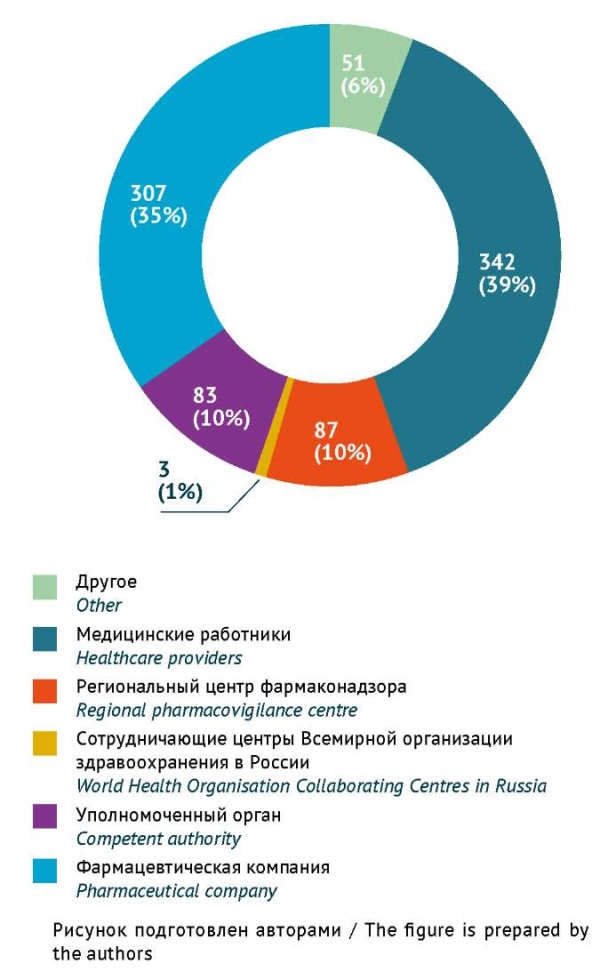
Рис. 7. Структура и количество спонтанных сообщений о нежелательных реакциях
при применении лекарственных препаратов для лечения COVID-19 по типам отправителей
(по данным национальной российской базы фармаконадзора, n=873)
Fig. 7. Structure and number of spontaneous reports
of adverse reactions to medicinal products for COVID-19
in the Russian national pharmacovigilance database (n=873) by reporter type
Результаты выявления потенциальных сигналов безопасности статистическим методом среди пациентов с COVID-19 представлены в таблице 1.
Таблица 1. Результаты выявления потенциальных сигналов безопасности
количественным методом у пациентов с COVID-19
(на основе анализа данных национальной российской базы фармаконадзора)
Table 1. Results of potential signal detection in COVID-19 patients by the quantitative method
(based on the analysis of the Russian pharmacovigilance database)
Международное непатентованное наименование лекарственного препарата International non-proprietary names of medicinal products | Нежелательная реакция Adverse drug reactions | a | b | c | d | χ² | р | ROR | ROR (-) | ROR (+) | PRR | PRR (-) | PRR (+) |
Азитромицин Azithromycin | Крапивница Urticaria | 9 | 47 | 70 | 1509 | 15,930 | <0,0001 | 4,13 | 1,95 | 8,76 | 3,77 | 1,92 | 7,42 |
Дексаметазон Dexamethasone | Дыхательная недостаточность Respiratory failure | 8 | 25 | 16 | 1586 | 120,781 | <0,0001 | 31,72 | 12,44 | 80,89 | 21,48 | 10,81 | 42,68 |
Левилимаб Levilimab | Острый респираторный дистресс-синдром Acute respiratory distress syndrome | 2 | 18 | 32 | 1583 | 6,238 | 0,0130 | 5,50 | 1,22 | 24,69 | 5,23 | 1,26 | 21,66 |
Лопинавир+ритонавир Lopinavir+ritonavir | Применение препарата по неутвержденным показаниям, не предусмотренное инструкцией Off-label use in unapproved indication | 2 | 17 | 32 | 1584 | 6,736 | 0,0090 | 5,82 | 1,29 | 26,27 | 5,54 | 1,33 | 23,04 |
Молнупиравир Molnupiravir | Брадикардия Bradycardia | 1 | 11 | 5 | 1618 | 20,983 | <0,0001 | 29,42 | 3,17 | 272,88 | 24,68 | 3,75 | 162,34 |
Отек легких Pulmonary oedema | 1 | 12 | 5 | 1617 | 19,232 | <0,0001 | 26,95 | 2,92 | 248,35 | 22,63 | 3,47 | 147,67 | |
Олокизумаб Olokizumab | Дыхательная недостаточность Respiratory failure | 17 | 16 | 134 | 1468 | 71,822 | <0,0001 | 11,64 | 5,75 | 23,56 | 10,44 | 5,39 | 20,24 |
Острый респираторный дистресс-синдром Acute respiratory distress syndrome | 18 | 2 | 133 | 1482 | 157,558 | <0,0001 | 100,29 | 23,02 | 436,87 | 88,45 | 20,72 | 377,54 | |
Синдром полиорганной недостаточности Multiple organ dysfunction syndrome | 9 | 5 | 142 | 1479 | 51,051 | <0,0001 | 18,75 | 6,20 | 56,70 | 17,69 | 6,01 | 52,11 | |
Легочная эмболия Pulmonary embolism | 8 | 5 | 143 | 1479 | 42,765 | <0,0001 | 16,55 | 5,34 | 51,25 | 15,72 | 5,21 | 47,46 | |
Отек легких Pulmonary oedema | 11 | 2 | 140 | 1482 | 88,827 | <0,0001 | 58,22 | 12,78 | 265,29 | 54,05 | 12,09 | 241,60 | |
Тофацитиниб Tofacitinib | Легочная эмболия Pulmonary embolism | 4 | 9 | 34 | 1588 | 46,706 | <0,0001 | 20,76 | 6,09 | 70,72 | 18,68 | 6,02 | 58,00 |
Применение препарата по неутвержденным показаниям, не предусмотренным инструкцией Off-label use in unapproved indication | 12 | 7 | 26 | 1590 | 313,376 | <0,0001 | 104,84 | 38,20 | 287,69 | 72,05 | 30,04 | 172,81 | |
Тоцилизумаб Tocilizumab | Дыхательная недостаточность Respiratory failure | 6 | 27 | 42 | 1560 | 27,473 | <0,0001 | 8,25 | 3,24 | 21,05 | 7,35 | 3,18 | 16,96 |
Применение препарата по неутвержденным показаниям, не предусмотренным инструкцией Off-label use in unapproved indication | 4 | 15 | 44 | 1572 | 22,142 | <0,0001 | 9,53 | 3,04 | 29,88 | 8,82 | 3,04 | 25,57 | |
Синдром полиорганной недостаточности Multiple organ dysfunction syndrome | 4 | 10 | 44 | 1577 | 32,566 | <0,0001 | 14,34 | 4,33 | 47,48 | 13,23 | 4,30 | 40,67 | |
Умифеновир Umifenovir | Лекарственное поражение печени Drug-induced liver injury | 4 | 35 | 26 | 1570 | 15,732 | <0,0001 | 6,90 | 2,29 | 20,83 | 6,11 | 2,32 | 16,12 |
Крапивница Urticaria | 3 | 53 | 27 | 1552 | 3,994 | 0,0460 | 3,25 | 0,96 | 11,06 | 3,03 | 1,00 | 9,15 | |
Аллергический ангиоотек Allergic angioedema | 3 | 16 | 27 | 1589 | 20,783 | <0,0001 | 11,03 | 3,04 | 40,10 | 10,03 | 3,09 | 32,61 | |
Фавипиравир Favipiravir | Нейтропения Neutropenia | 18 | 2 | 983 | 632 | 7,063 | 0,0080 | 5,79 | 1,34 | 25,02 | 5,70 | 1,33 | 24,48 |
Лейкопения Leucopenia | 18 | 2 | 983 | 632 | 7,063 | 0,0080 | 5,79 | 1,34 | 25,02 | 5,70 | 1,33 | 24,48 | |
Лимфопения Lymphopenia | 19 | 1 | 982 | 633 | 9,730 | 0,0020 | 12,25 | 1,64 | 91,71 | 12,03 | 1,61 | 89,67 | |
Артериальная гипертензия Arterial hypertention | 30 | 2 | 971 | 632 | 14,545 | <0,0001 | 9,76 | 2,33 | 41,00 | 9,50 | 2,28 | 39,62 |
Таблица подготовлена авторами по собственным данным /
The table is prepared by the authors using their own data
Примечание. a — число пар «интересуемая нежелательная реакция — подозреваемый лекарственный препарат»;
b — число пар «другие нежелательные реакции — подозреваемый лекарственный препарат»;
c — число пар «интересуемая нежелательная реакция — другие лекарственные препараты»;
d — число пар «другие нежелательные реакции — другие лекарственные препараты»;
χ² — значение критерия χ² Пирсона;
p — уровень значимости;
ROR — коэффициент отношения шансов репортирования (odds ratio of reporting);
PRR — коэффициент пропорциональности репортирования (proportionality ratio of reporting);
ROR (–) — нижняя граница 95% доверительного интервала (CI);
ROR (+) — верхняя граница 95% CI;
PRR (–) — нижняя граница 95% CI;
PRR (+) — верхняя граница 95% CI.
Note. a, number of pairs “adverse drug reaction of interest — suspected medicinal product”;
b, number of pairs “other adverse drug reactions — suspected medicinal product”;
c, number of pairs “adverse drug reaction of interest — other medicinal products”;
d, number of pairs “other adverse drug reactions — other medicinal products”;
χ², Pearson’s test value;
p, significance level;
ROR, reporting odds ratio;
PRR, proportional reporting ratio;
ROR (–), lower limit of the 95% confidence interval (CI);
ROR (+), upper limit of the 95% CI;
PRR (–), lower limit of the 95% CI;
PRR (+), upper limit of the 95% CI.
В результате проведенного анализа выделено в совокупности 520 пар «интересуемая НР — подозреваемый ЛП». Критериям статистических сигналов безопасности соответствовали 325 пар «интересуемая НР — подозреваемый ЛП». Из них 202 пары «интересуемая НР — подозреваемый ЛП» оказались новыми (табл. 1, колонка «а»), их сущность и тяжесть не соответствовали информации о НР, содержащейся в ИМП ЛП, зарегистрированного на территории Российской Федерации. С помощью частотного анализа диспропорциональности удалось идентифицировать 23 потенциальных сигнала безопасности для МНН азитромицин, дексаметазон, левилимаб, лопинавир+ритонавир, молнупиравир, олокизумаб, тофацитиниб, тоцилизумаб, умифеновир, фавипиравир.
Обращает на себя внимание сравнительно высокая частота таких НР, как дыхательная недостаточность (ROR=11,64; 95% CI: 5,75–23,56) и острый респираторный дистресс-синдром (ROR=100,29; 95% CI: 23,02–436,87), ассоциированные с применением олокизумаба; артериальная гипертензия (ROR=9,76; 95% CI: 2,33–41,00), нейтропения (ROR=5,79; 95% CI: 1,34–25,02), лейкопения (ROR=5,79; 95% CI: 1,34–25,02) и лимфопения (ROR=12,25; 95% CI: 1,64–91,71) при приеме фавипиравира (табл. 1). Другие выявленные НР хотя и имели статистически значимый ROR>1, но были представлены единичными случаями, что не позволяет сделать однозначные выводы о безопасности ЛП и требует дальнейшего наблюдения.
В то же время при использовании таких количественных показателей необходимо учитывать природу анализируемых данных. СС — это информация, собранная без предварительных гипотез и подходящая для создания гипотез, а не для их проверки. Так как сигнал — это гипотеза, процесс обнаружения сигнала на основе СС — выдвижение гипотезы. Поэтому даже если дальнейшая оценка покажет, что сигнал ложный, это не означает, что его передача была ошибкой [7]. Важно отметить, что сигнал не указывает на прямую причинно-следственную связь между НР и ЛП, а по сути является лишь гипотезой, которая оправдывает необходимость дальнейшей валидации и оценки этого сигнала (signal assessment)13. Регуляторные органы уполномочены провести дополнительное расследование и принять решение о необходимости каких-либо действий, например изменения информации для пациентов, оповещении или предупреждении общественности или изъятия ЛП с фармацевтического рынка [8].
Заключение
Анализ спонтанных сообщений о предполагаемых НР является ценным инструментом для выявления ранее неизвестных рисков безопасности. Использование количественного метода с предварительно установленным порогом для определения комбинаций «интересуемая НР — подозреваемый ЛП» позволяет повысить эффективность процессов обнаружения и определения приоритетности потенциальных сигналов.
Систематизированная и комплексная оценка данных о безопасности ЛП, применяемых при COVID-19, с использованием национальной российской базы фармаконадзора показала, что наибольшее число СС относилось к применению препаратов с МНН фавипиравир, гидроксихлорохин и олокизумаб. Наиболее частым типом НР было влияние на лабораторные и инструментальные данные (16,7%), нарушения со стороны печени и желчевыводящих путей (12,4%) и желудочно-кишечные нарушения (11,6%). Большинство событий (77% случаев) имели благоприятный исход, для 14% пациентов зарегистрированы НР с летальным исходом.
С помощью частотного анализа диспропорциональности со стратификацией по показанию COVID-19 удалось идентифицировать 23 потенциальных сигнала безопасности для МНН азитромицин, дексаметазон, левилимаб, лопинавир+ритонавир, молнупиравир, олокизумаб, тофацитиниб, тоцилизумаб, умифеновир, фавипиравир. Новые сигналы требуют дополнительного изучения описательной части карт-извещений о НР с целью оценки причинно-следственной связи, валидации, приоритизации и клинического осмысления. Отсутствие выявленных сигналов безопасности для МНН гидроксихлорохин, ремдесивир, барицитиниб, сарилумаб и препарата иммуноглобулин человека против COVID-19 не исключает наличия новых взаимосвязей, обнаружение которых частотным методом невозможно в связи с малым числом выявленных случаев развития НР.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: С.А. Мишинова — концепция исследования, написание текста рукописи; А.С. Колбин — концепция исследования, редактирование текста рукописи; Ю.С. Полушин — анализ данных литературы, редактирование текста рукописи; Е.В. Вербицкая — статистический анализ данных.
Соответствие принципам этики. Авторы заявляют, что одобрение комитетом по этике не требовалось, поскольку были проанализированы обезличенные данные спонтанных сообщений, и в исследовании непосредственно не участвовали люди.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Sofya А. Mishinova conseptualised the study and drafted the manuscript. Alexey S. Kolbin conseptualised the study and edited the manuscript. Yury S. Polushin analysed literature data and edited the manuscript. Elena V. Verbitskaya conducted statistical data analysis.
Ethics approval. According to the authors, the analysis was based on previously published anonymised data (spontaneous reports), and the study did not involve direct participation of human subjects. Hence, this study is exempt from ethics approval.
1. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
2. Федеральный закон Российской Федерации от 21.11.2011 № 323-Ф3 «Об основах охраны здоровья граждан Российской Федерации».
3. EMA/CHMP/ICH/287/1995. ICH guideline E2B (R3) on electronic transmission of individual case safety reports (ICSRs) — data elements and message specification — implementation guide. EMA; 2013.
4. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
5. WHO STEPS surveillance manual: the WHO STEPwise approach to chronic disease risk factor surveillance. WHO; 2005. https://apps.who.int/iris/bitstream/handle/10665/43376/9241593830_eng.pdf
6. Горелов КВ. Система фармаконадзора РФ. Доклад на X всероссийской конференции с международным участием «Актуальные вопросы доклинических и клинических исследований лекарственных средств и клинических испытаний медицинских изделий», 25.04.2023, Санкт-Петербург.
7. http://external.roszdravnadzor.ru/?type=logon (авторизованный доступ).
8. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версия 15 (22.02.2022). Министерство здравоохранения Российской Федерации; 2022.
Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версия 6 (24.04.2020). Министерство здравоохранения Российской Федерации; 2020.
9. https://grls.rosminzdrav.ru
10. https://www.meddra.org/how-to-use/support-documentation/english
11. EMA/873138/2011 Rev 1*. Guideline on good pharmacovigilance practices (GVP). Module VI — Management and reporting of adverse reactions to medicinal products (Rev 1, superseded version). EMA; 2014.
12. Постановление Правительства Российской Федерации от 03.04.2020 № 441 «Об особенностях обращения лекарственных препаратов для медицинского применения, которые предназначены для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и для организации оказания медицинской помощи лицам, пострадавшим в результате чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики и лечения заболеваний, представляющих опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов» (ред. от 30.12.2022).
13. What is a signal? https://who-umc.org/signal-work/what-is-a-signal/
Список литературы
1. Журавлева МВ, Романов БК, Городецкая ГИ, Муслимова ОВ, Крысанова ВС, Демченкова ЕЮ. Актуальные вопросы безопасности лекарственных средств, возможности совершенствования системы фармаконадзора. Безопасность и риск фармакотерапии. 2019;7(3):109–19. https://doi.org/10.30895/2312-7821-2019-7-3-109-119
2. Bihan K, Lebrun-Vignes B, Funck-Brentano C, Salem JE. Uses of pharmacovigilance databases: an overview. Therapies. 2020;75(6):591–8. https://doi.org/10.1016/j.therap.2020.02.022
3. Акимкин ВГ, Тутельян АВ, Шулакова НИ, Воронин ЕМ. Пандемия COVID-19: новый виток нарастания антибиотикорезистентности. Инфекционные болезни. 2021;19(3):133–8. https://doi.org/10.20953/1729-9225-2021-3-133-138
4. Bate A, Lindquist M, Edwards IR, Olsson S, Orre R, Lansner A, et al. A Bayesian neural network method for adverse drug reaction signal generation. Eur J Clin Pharmacol. 1998;54(4):315–21. https://doi.org/10.1007/s002280050466
5. Evans SJ, Waller PC, Davis S. Use of proportional reporting ratios (PRRs) for signal generation from spontaneous adverse drug reaction reports. Pharmacoepidemiol Drug Saf. 2001;10(6):483–6. https://doi.org/10.1002/pds.677
6. Мишинова СА, Сыраева ГИ, Колбин АС, Полушин ЮС, Вербицкая ЕВ. Отчет данных российской базы по нежелательным явлениям лекарственных средств, применяемых при новой коронавирусной инфекции (COVID-19), с акцентом на фавипиравир. Клиническая микробиология и антимикробная химиотерапия. 2023;25(1):26–33. https://doi.org/10.36488/cmac.2023.1.26-33
7. Bate A, Evans SJW. Quantitative signal detection using spontaneous ADR reporting. Pharmacoepidemiol Drug Saf. 2009;18(6):427–36. https://doi.org/10.1002/pds.1742
8. Rawlins MD. Spontaneous reporting of adverse drug reactions. II: Uses. Br J Clin Pharmacol. 1988;26(1):7–11. https://doi.org/10.1111/j.1365-2125.1988.tb03357.x
Об авторах
С. А. МишиноваРоссия
Мишинова Софья Андреевна
ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
А. С. Колбин
Россия
Колбин Алексей Сергеевич, д-р мед. наук, профессор
ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
Ю. С. Полушин
Россия
Полушин Юрий Сергеевич, академик РАН, д-р мед. наук, профессор
ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
Е. В. Вербицкая
Россия
Вербицкая Елена Владимировна, канд. биол. наук, доцент
ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
Дополнительные файлы
Рецензия
Для цитирования:
Мишинова С.А., Колбин А.С., Полушин Ю.С., Вербицкая Е.В. Количественное обнаружение сигналов безопасности лекарственных препаратов, применяемых при COVID-19, на основе ретроспективного анализа спонтанных сообщений национальной российской базы фармаконадзора. Безопасность и риск фармакотерапии. 2024;12(1):45-57. https://doi.org/10.30895/2312-7821-2023-382
For citation:
Mishinova S.A., Kolbin A.S., Polushin Yu.S., Verbitskaya E.V. Quantitative Signal Detection for COVID-19 Medicinal Products Based on Retrospective Analysis of Spontaneous Reports from the Russian Pharmacovigilance Database. Safety and Risk of Pharmacotherapy. 2024;12(1):45-57. (In Russ.) https://doi.org/10.30895/2312-7821-2023-382




































