Перейти к:
Лекарственное поражение печени, ассоциированное с антибиотиками, у детей в критических состояниях: проспективное наблюдательное исследование
https://doi.org/10.30895/2312-7821-2023-389
Резюме
ВВЕДЕНИЕ. Лекарственные поражения печени или лекарственно-индуцированные заболевания (ЛИЗ) печени у детей, развивающиеся в том числе при применении антибиотиков, могут стать причиной острой печеночной недостаточности и привести к летальному исходу. Однако в литературе практически не представлены данные о возможности дифференцировки характера поражения ткани печени у детей для своевременной диагностики потенциально жизнеугрожающего состояния — ЛИЗ печени.
ЦЕЛЬ. Описать фенотип ассоциированного с применением антибактериальных препаратов впервые возникшего лекарственного поражения печени у детей в критических состояниях с нозокомиальной инфекцией.
МАТЕРИАЛЫ И МЕТОДЫ. В проспективном наблюдательном исследовании в ГБУЗ «Морозовская ДГКБ ДЗМ» в период с 01.02.2020 по 01.09.2021 проведена оценка распространенности ЛИЗ печени, связанной с применением антибактериальных препаратов, методом глобальных триггеров. В исследование было включено 100 детей в критических состояниях с нозокомиальной инфекцией в возрасте от 0 до 17 лет (44 мальчика, 56 девочек), находившихся на лечении в отделениях реанимации и интенсивной терапии.
РЕЗУЛЬТАТЫ. Проявления гепатотоксичности были выявлены у 19 пациентов, из них у 8 наблюдали отклонения биохимических показателей сыворотки крови, характеризующих функцию печени, а у 11 эти отклонения сопровождались клиническими проявлениями нарушений со стороны печени. Распространенность впервые возникшей гепатотоксичности при применении антибиотиков составила 12,9 случая на 100 000 пациентов детского возраста, а ЛИЗ печени — 7,5 случая на 100 000 детей. На основе анализа медицинской документации и биохимических показателей, определения связи событий по времени появления с клинической картиной у 11 детей был описан фенотип идиосинкразического холестатического гепатита. При применении антибиотиков у детей в критических состояниях было отмечено повышение активности аланиновой трансаминазы до 10 высших пороговых норм (ВПН), уровня билирубина — до 4,45 ВПН, активности гамма-глутамилтрансферазы — до 5 ВПН. Шансы развития впервые возникающего ЛИЗ печени были наиболее высокими при применении тигециклина (OR: 4,07; 95% CI: 1,32–12,50) и меропенема (OR: 1,84; 95% CI: 1,01–3,36). Клинические проявления идиосинкразического холестатического гепатита у 5 пациентов были сопряжены с развитием летального исхода, у 6 пациентов разрешились в течение нескольких недель.
ВЫВОДЫ. Описан фенотип холестатического идиосинкразического поражения печени у детей в критических состояниях, связанного с применением антибиотиков. Требуются дальнейшие исследования для оценки роли фармакогенетических маркеров в развитии ЛИЗ печени, ассоциированного с антибиотиками у детей в критических состояниях, для реализации риск-ориентированного подхода и возможности предотвращения рисков возникновения этого состояния.
Исследование зарегистрировано на платформе ClinicalTrials.gov, идентификатор NCT04141657, дата регистрации 24.10.2019.
Ключевые слова
Для цитирования:
Власова А.В., Шубина Ю.Ф., Сычев Д.А. Лекарственное поражение печени, ассоциированное с антибиотиками, у детей в критических состояниях: проспективное наблюдательное исследование. Безопасность и риск фармакотерапии. 2024;12(2):155-166. https://doi.org/10.30895/2312-7821-2023-389
For citation:
Vlasova A.V., Shubina Yu.F., Sychev D.A. Antibiotic-Associated Drug-Induced Liver Injury in Critically Ill Children: A Prospective Observational Study. Safety and Risk of Pharmacotherapy. 2024;12(2):155-166. (In Russ.) https://doi.org/10.30895/2312-7821-2023-389
ВВЕДЕНИЕ
Лекарственные поражения печени или лекарственно-индуцированные заболевания (ЛИЗ) печени могут стать причиной острой печеночной недостаточности и привести к летальному исходу [1–7]. По данным метаанализа, выполненного в Китае, в мире проведено 279 исследований у 24112 пациентов азиатской и европейской популяций, включая детей, по изучению гепатотоксического действия лекарственных препаратов (ЛП) и механизмов развития ассоциированного с ними ЛИЗ печени [8]. По оценкам популяционных исследований, заболеваемость ЛИЗ печени у взрослых колеблется в пределах 13,9–19,1 случаев на 100 000 населения в год [9], причем у пациентов в возрасте 15–29 лет она составила 9 на 100 000 населения, 70 лет и старше — 41 на 100 000 населения. Авторами исследования высказаны обоснованные сомнения о возрасте пациентов или количестве применяемых ЛП как основных причинах увеличения заболеваемости в возрастном аспекте [9].
Частота развития ЛИЗ печени у детей до настоящего времени не изучена по ряду причин: во-первых, детский возраст включается в оценочные процедуры в составе взрослой популяции при проведении проспективных наблюдательных исследований, во-вторых, существуют различия в определениях и подходах к диагностике данного состояния у разных групп исследователей [4][5]. Имеются лишь отдельные спонтанные сообщения о клинических случаях ЛИЗ печени у младенцев [10].
Причинно-значимыми ЛП, вызывающими ЛИЗ печени, долгое время считались нестероидные противовоспалительные препараты (НПВП) [11][12]. Однако согласно данным американской сети по изучению лекарственно-индуцированного поражения печени у взрослых (Drug Induced Liver Injury Network, DILIN) наиболее распространенной причиной ЛИЗ печени является применение антимикробных препаратов (45,4% случаев) со значительным увеличением их доли в динамике за последние 10 лет [10]. По причинной значимости антибиотики обогнали ЛП для терапии сердечно-сосудистых заболеваний (9,8% случаев), неврологических заболеваний (9,1%), противоопухолевые препараты (5,5%) и НПВП (3,7%) [3][8][13][14]. Европейскими и американскими исследователями было установлено, что среди антимикробных препаратов наиболее часто вызывает развитие ЛИЗ печени препарат амоксициллин+клавулановая кислота [11][15], сходные данные получены в популяционных исследованиях в Индии и других странах восточного региона [1][4].
По мнению M.D. Amin и соавт. [1], развитие ЛИЗ печени у детей связано преимущественно с использованием антимикробных препаратов для системного применения и НПВП. Как показывают наблюдения отдельных исследователей, в Европе ЛИЗ печени является главной причиной острой печеночной недостаточности и, если не удается выполнить трансплантацию печени, приводит к летальному исходу [3]. В 2020 г. в ретроспективном наблюдении при оценке связи развития ЛИЗ печени у детей с применением ЛП методом глобальных триггеров Yu.Y. Cheng и соавт. [7] по данным медицинской документации из 1196 ЛП выделили 12, которые с наибольшей вероятностью вызвали нарушения функции печени, причем половина из них являлась антимикробными препаратами. Информация о роли антибиотиков в развитии ЛИЗ печени у детей очень важна, поскольку в Европе эта группа препаратов наиболее часто применяется у детей в амбулаторных условиях [16]. Риск развития ЛИЗ печени значительно повышается при применении антибиотиков в сочетании с ЛП, оказывающими противосудорожное действие, и ЛП, влияющими на сердечно-сосудистую систему, вследствие лекарственных взаимодействий [17–19].
В настоящее время доступно определение рангов значения рисков гепатотоксичности ЛП на основе базы данных LiverTox1 Совета международных научно-медицинских организаций (Council for International Organizations of Medical Sciences, CIOMS). Однако распространенность и структура нежелательных реакций при применении ЛП у детей в критических состояниях не изучена [20–22].
ЛИЗ печени является диагнозом-исключением всех иных возможных заболеваний: ставится после исключения других причин заболевания печени, оценки временной связи между употреблением ЛП и инициальных клинических проявлений и изменений в биохимических печеночных показателях; также проводится уточнение возможных механизмов повреждения печени для конкретного потенциально значимого ЛП с обязательной оценкой улучшения клинических и биохимических показателей после отмены препарата [1][23][24]. ЛИЗ печени может протекать по двум основных типам: идиосинкразическому и аутоиммунному. При идиосинкразическом поражении печени потенциально значимый ЛП может непосредственно или через активный метаболит повреждать клетки и вызывать быстрое появление ЛИЗ печени. Другие ЛП, напротив, взаимодействуют с тканевыми белками, вызывая иммунный ответ и, как результат, более отсроченные проявления ЛИЗ печени, протекающие с клинической картиной аутоиммунного гепатита [1][20][25][26]. В реальной клинической практике на начальных стадиях поражения органа дифференцировать аутоиммунное поражение от идиосинкразического ЛИЗ печени крайне сложно, и основным фактором, позволяющим их различить, может служить время от момента применения ЛП до появления признаков повреждения печени [10][16][22].
По результатам проведенных исследований, включавших гистологические исследования ткани печени [24], ЛИЗ печени, ассоциированное с антибиотиками, описано как идиосинкразическое поражение, обусловленное сочетанием нескольких переменных: доза ЛП, продолжительность терапии, метаболизм ЛП в печени, липофильность ЛП, а также наличие факторов риска (возраст, пол, генетические полиморфизмы) [11][13][14][27–29].
J.H. Hoofnagle и E.S. Björnsson предложили методологическую основу, позволяющую по изменениям паттерна клинико-биохимических показателей дифференцировать характер поражения ткани печени у взрослых в условиях ограниченных возможностей и недоступности выполнения гистологического исследования печени в реальной клинической практике [29]. Данная методика позволяет подкреплять клинические решения и оценивать динамику поражения печени с целью уменьшения сроков установления диагноза ЛИЗ печени рутинными биохимическими тестами для всех вариантов идиосинкразического и аутоиммунного поражения при ЛИЗ печени. Однако у детей предложенный метод ранее не применялся.
Генетические факторы, вероятно, повышают риск развития ЛИЗ печени: было показано, что наличие аллеля 5701 локуса В главного комплекса гистосовместимости человека (генотипа HLA B*5701) в 80,6 раза повышает шансы развития ЛИЗ печени, вызванного флуклоксациллином [30], тогда как отсутствие данного генотипа HLA имеет 88% отрицательную прогностическую значимость [3][11]. Однако публикаций о значении фармакогенетики для развития ЛИЗ печени у детей, ассоциированной с антибиотиками, в доступной литературе не обнаружено.
Цель работы — описать фенотип ассоциированного с применением антибактериальных препаратов впервые возникшего лекарственного поражения печени у детей в критических состояниях с нозокомиальной инфекцией.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективном наблюдательном исследовании, проводившемся в ГБУЗ «Морозовская ДГКБ ДЗМ» с 01.02.2020 по 01.09.2021, была изучена структура нежелательных реакций (НР), ассоциированных с применением антимикробных ЛП, у 100 детей в возрасте от 0 до 17 лет включительно (44 мальчика, 56 девочек) в критическом состоянии с нозокомиальной инфекцией. Средний возраст детей составил 5,36 ± 5,5 года, значительных различий по полу и возрасту не отмечено. В период с 20.02.2020 до 30.11.2020 на время приема стационаром пациентов с новой коронавирусной инфекцией COVID-19 включение пациентов в исследование было остановлено.
Включение пациентов в исследование проводилось на момент развития инфекции, при этом у 81 ребенка инфекция манифестировала во время пребывания в отделении реанимации и интенсивной терапии (ОРИТ) на фоне течения основного заболевания или состояния после оперативного вмешательства, у 19 детей инфекция, вызванная резистентными возбудителями, стала причиной госпитализации в ОРИТ.
Набор пациентов проводили в трех ОРИТ: для педиатрических соматических пациентов (заведующий отделением д-р мед. наук А.В. Харькин), для хирургических пациентов (заведующий отделением Д.В. Горохов), на базе блока анестезиологии и реанимации отделения экстренной кардиохирургии и интервенционной кардиологии (заведующий отделением д-р мед. наук М.А. Абрамян).
Критериями включения пациентов в исследование были наличие:
- инфекции с факторами риска полирезистентных возбудителей — типы II–IV при стратификации по СКАТ2;
- симптомокомплекса по критериям соответствия нозокомиальной инфекции определенной, вероятной или возможной на основе микробиологических данных по определению Центров по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention, CDC)3и Европейского центра профилактики и контроля заболеваний (European Centre for Disease Prevention and Control, ECDC)4;
- положительных результатов микробиологического исследования биологического материала с выделением этиологически значимого микроорганизма с высоковероятным нозокомиальным происхождением.
Критерии невключения в исследование: наличие новой коронавирусной инфекции COVID-19; наличие онкологических заболеваний; внебольничные инфекции без факторов риска полирезистентных возбудителей — тип I при стратификации по СКАТ; терминальные стадии недостаточности органов и систем как конкурирующие с инфекцией за основной диагноз или состояние. Другие критерии исключения: дети, находящиеся под опекой.
Предыдущая/сопутствующая терапия для включения в исследование значения не имела.
Все пациенты имели показания к применению антимикробных препаратов в соответствии с установленными критериями соответствия стандартному случаю определения нозокомиальной инфекции, вызванной резистентными микроорганизмами, по критериям CDC и ECDC5.
Оценочные процедуры в рамках проспективного наблюдательного протокола. Основой протокола оценочных процедур настоящего исследования безопасности фармакотерапии у детей явились руководящие принципы Европейского агентства по лекарственным средствам (European Medicines Agency, ЕМА) по определению целей, дизайна исследований и методических инструментов для выбора педиатрической дозы [31].
Синдром органной дисфункции у детей в критических состояниях оценивали по адаптированной шкале Paediatric SOFA (paediatric sequential organ failure assessment, pSOFA) [31]. Системный воспалительной ответ оценивали с учетом маркеров системного воспаления в динамике: уровней С-реактивного белка и прокальцитонина в сыворотке крови [17].
Биохимические исследования выполнены на автоматическом биохимическом анализаторе AU 5800 (Beckman Coulter, США) с использованием реагентов и расходных материалов того же производителя.
Для поиска признаков НР был использован метод глобальных триггеров (ГТ) (Global Trigger Tool), разработанный в Институте усовершенствования здравоохранения (Institute for Healthcare Improvement, IHI) [32][33]. Суть метода ГТ заключается в ретроспективном анализе историй болезни с целью выявления особых триггеров — элементов, которые косвенно указывают на наличие НР. Триггерами могут быть, например, изменение дозы ЛП, его внезапная отмена, назначение ЛП — корректора побочных эффектов, проведение дополнительных обследований. В педиатрии используется адаптированный вариант ГТ — алгоритм GAPPS (Global Assessment of Paediatric Patient Safety)6 [33]. Данный вариант алгоритма ГТ апробирован на детском контингенте и рекомендован к практическому применению, в том числе имеется отечественный опыт его применения у подростков [34].
В протокол исследования включены результаты оценки основных показателей жизнедеятельности (масса, рост, частота сердечных сокращений, частота дыхания, систолическое артериальное давление), оценка медицинской истории, результатов полного физикального осмотра с оценкой сопутствующих ранее установленных заболеваний и фармакотерапии препаратами регулярного применения, результаты электрокардиографии в 12 отведениях (при включении в исследование, по показаниям в динамике, измерение интервалов PR, QPS, QT, QTc).
Под понятием «проявление НР» у детей в описании клинической характеристики понимали любые изменения со стороны органов и систем, выявленные по клиническим симптомам или синдромам, результатам лабораторных и инструментальных методов диагностики. Исследователь устанавливал диагноз на основании признаков, симптомов и (или) другой клинической информации. При наличии возможности постановки диагноза с установленной связью с применением фармакотерапии (не для отдельных признаков/симптомов, а для болезни в целом) выявленные нежелательные явления / серьезные нежелательные явления документировали как проявление НР в виде лекарственно-индуцированного заболевания органа/системы.
Триггеры, потребовавшие усиленного биохимического мониторинга и дифференциальной диагностики: аланиновая трансаминаза (АЛТ) ≥3 высших пороговых норм (ВПН), но менее 8 ВПН; билирубин ≥2 ВПН (или более 35% от уровня прямого билирубина); международное нормализованное отношение (МНО) >1,5; фибриноген ≤1,2 г/л; заместительная почечная терапия; судорожный синдром, возникший впервые в жизни; увеличение интервала QT или QTc ≥25%.
Триггеры, потребовавшие отмены предполагаемого значимого препарата: QTc >600 мс или увеличение интервала QT или QTc на 50% и более; симптомы поражения печени или гиперчувствительность; АЛТ ≥8 ВПН; закон Xая: АЛТ ≥3 ВПН и билирубин ≥2 ВПН (>35% прямой) или МНО >1,5 [3][7].
Учитывали оценку связи событий «применение ЛП — развитие НР»: «обоснованная вероятность» связи означает наличие причинной связи с большей вероятностью, чем ее отсутствие. Для определения связи исследователь использовал субъективное клиническое суждение.
Графическое представление результатов настоящего исследования выполнено по методике, предложенной J.H. Hoofnagle и E.S. Björnsson [29], позволяющей оценивать динамику поражения печени на основании анализа динамики биохимических показателей сыворотки крови (АЛТ, щелочной фосфатазы (ЩФ), билирубина общего): каждая точка на кривой представляет собой среднее арифметическое значение показателя у всех 11 пациентов за каждую из 6 недель наблюдения от момента манифестации ЛИЗ печени. Значение показателей сравнивали с ВПН. ВПН билирубина была установлена на уровне 17,1 мкмоль/л [29][35].
Этическая экспертиза. Проведение диссертационного исследования одобрено локальным этическим комитетом ГБУЗ «Морозовская ДГКБ ДЗМ», г. Москва (протокол от 14.11.2019 № 149) и Комитетом по этике научных исследований ФГБОУ ДПО РМАНПО Минздрава России, г. Москва (протокол от 11.08.2022 № 14). Протокол наблюдательного исследования зарегистрирован на международной платформе ClinicalTrials.gov (ClinicalTrials.gov ID: NCT04141657, Unique Protocol ID: 07819001, Official Title: Observational Prospective Multidirectional Study on the Safety of Antimicrobial Pharmacotherapy in Intensive Care Unit (ICU) Children Aged 0–17).
Данная публикация подготовлена в рамках диссертационной работы Власовой А.В., одобренной этическим комитетом ФГБОУ ДПО РМАНПО Минздрава России.
Статистическая обработка данных. Использован пакет компьютерных программ IBM SPSS Statistics v26. Для определения прогностической возможности переменных применяли ROC-анализ. Для сравнения количественных переменных по двум группам при нормальном распределении использовали t-критерий Стьюдента. Различия признавали статистически значимыми на уровне значимости p<0,05. Для оценки выживаемости применялся метод построения кривых выживаемости Каплана–Мейера.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проявления гепатотоксичности, ассоциированной с антибиотиками, были выявлены у 19 из 100 детей, включенных в исследование. У 8 детей отмечались отклонения биохимических показателей сыворотки крови, характеризующих функцию печени, без клинических проявлений, а именно признаки закона Xая: активность АЛТ ≥3 ВПН, но <8 ВПН и уровень билирубина 2 ВПН (прямой билирубин >35%), или МНО >1,5, активность АЛТ ≥3 ВПН или уровень фибриногена ≤1,2 г/л. У 11 пациентов критериями установления ЛИЗ печени явились иктеричность кожных покровов и слизистых на фоне крайней выраженности биохимических отклонений: активность АЛТ ≥8 ВПН, уровень билирубина >2 ВПН (прямой билирубин >35%), МНО>1,5, активность АЛТ ≥3 ВПН, уровень фибриногена ≤1,2 г/л.
Распространенность впервые возникшей гепатотоксичности, ассоциированной с применением антибиотиков у детей, составила 12,9 на 100 000 пациентов, а ЛИЗ печени — 7,5 на 100 000 пациентов.
Для определения фенотипа биохимических отклонений у 11 пациентов, имевших ЛИЗ печени, был проведен анализ всех биохимических показателей суммарно в динамике в течение 6 недель от возникновения клинических и (или) лабораторных проявлений (рис. 1).
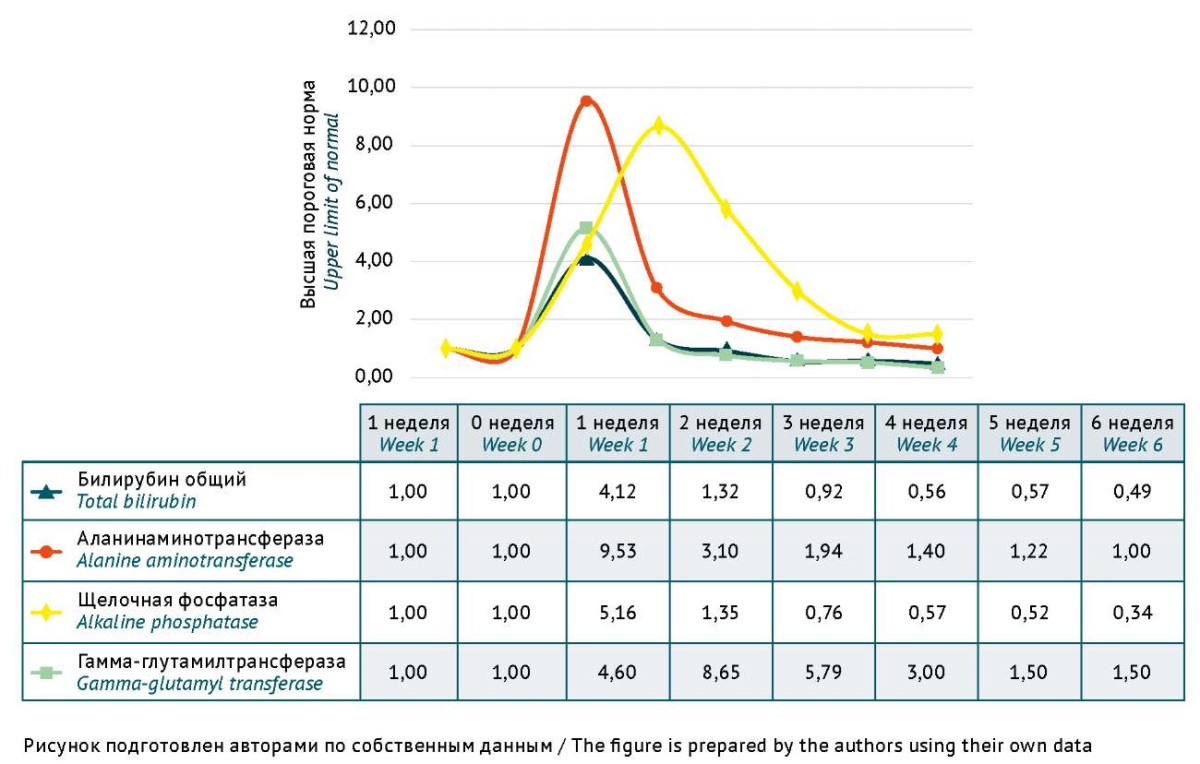
Рис. 1. Фенотип идиосинкразического лекарственно-индуцированного поражения печени (на основании данных биохимического анализа крови у 11 пациентов детского возраста в течение 6 нед.). Каждая точка на кривой представляет собой среднее арифметическое значение показателей за каждую неделю от начала клинических проявлений поражения печени в течение последующих 6 нед. у каждого из 11 пациентов. Результаты определения уровня билирубина общего, активностей аланиновой трансаминазы, гамма-глутамилтрансферазы, щелочной фосфатазы представлены в виде количества высших пороговых норм (ВПН). Для билирубина общего принята ВПН 17,1 мкмоль/л
Fig. 1. Phenotype of idiosyncratic drug-induced liver injury (DILI) based on the findings of liver function tests conducted in 11 paediatric patients for 6 weeks. Each point on the curves represents an arithmetic mean of the test results obtained for each of 11 paediatric patients every week starting from the clinical manifestation of DILI. Total bilirubin levels and activity values of alanine aminotransferase, alkaline phosphatase, and gamma-glutamyl transferase are shown as multiples of upper limits of normal (xULN). For total bilirubin, the upper limit of normal was considered to be 17 μmol/L
У 11 пациентов клиническая картина соответствовала идиосинкразическому холестатическому гепатиту. Кожный зуд и желтуха развивались у детей через 5–7 сут после начала стартовой комбинированной терапии, включающей меропенем или тигециклин. Отмечалось умеренное повышение активности АЛТ до 10 ВПН, увеличение уровня билирубина до 4,45 ВПН и ЩФ до 5,16 ВПН, наиболее выраженные на первой неделе, а также медленное нарастание активности ГГТ — до 5 ВПН на первой неделе и более заметное ее повышение — до 8,65 ВПН — на второй неделе. У 5 пациентов нарушение функции печени привело к летальному исходу, у 6 пациентов — разрешилось в течение нескольких недель после выявления ЛИЗ печени и отмены подозреваемого антибиотика.
При сравнении фенотипа отклонений биохимических показателей сыворотки крови у детей в проведенном нами исследовании с результатами, полученными у взрослых J.H. Hoofnagle и E.S. Björnsson [29], было выявлено, что отличительной особенностью у детей явились менее выраженное повышение уровня билирубина (до 4,45-кратного) по сравнению со взрослыми, у которых уровень билирубина повышался в 10 раз от установленного исследователями уровня 17,1 ммоль/л, и более высокий уровень маркеров холестаза: активность ЩФ 5,16 ВПН и ГГТ от 5 до 8,65 ВПН, что оказалось выше активности ГГТ у взрослых — до 4 ВПН. В целом выявленный у детей фенотип был аналогичен варианту идиосинкразического поражения печени по типу холестатического гепатита у взрослых на фоне применения цефазолина, описанного исследователями ранее [29]. Полученные нами данные согласовывались с описанием особенностей ЛИЗ печени в педиатрической популяции для подростков [27].
Анализ рисков у 11 детей в критических состояниях с нозокомиальной инфекцией, у которых развивалось тяжелое поражение печени при применении антимикробной и сопутствующей терапии, по сравнению с пациентами, не имевшими поражения печени, показал, что само по себе течение инфекции не повлияло на развитие ЛИЗ печени. Результаты статистической оценки рисков сопутствующей терапии показали, что шансы развития ЛИЗ печени у пациентов с инфекцией при применении НПВП в течение 3 сут и более повышались в 1,12 раза, диуретиков — в 1,02 раза, вазопрессоров — в 0,37 раза, а при регулярном применении антиконвульсантов (при их назначении на амбулаторном этапе и продолжении приема в стационаре) — в 0,58 раза (рис. 2). При проведении статистического анализа не удалось получить достоверные данные о влиянии сочетанного применения антиконвульсантов, вазопрессорной, диуретической терапии и НПВП в течение 3 сут и более на развитие ЛИЗ печени для данной популяции пациентов.
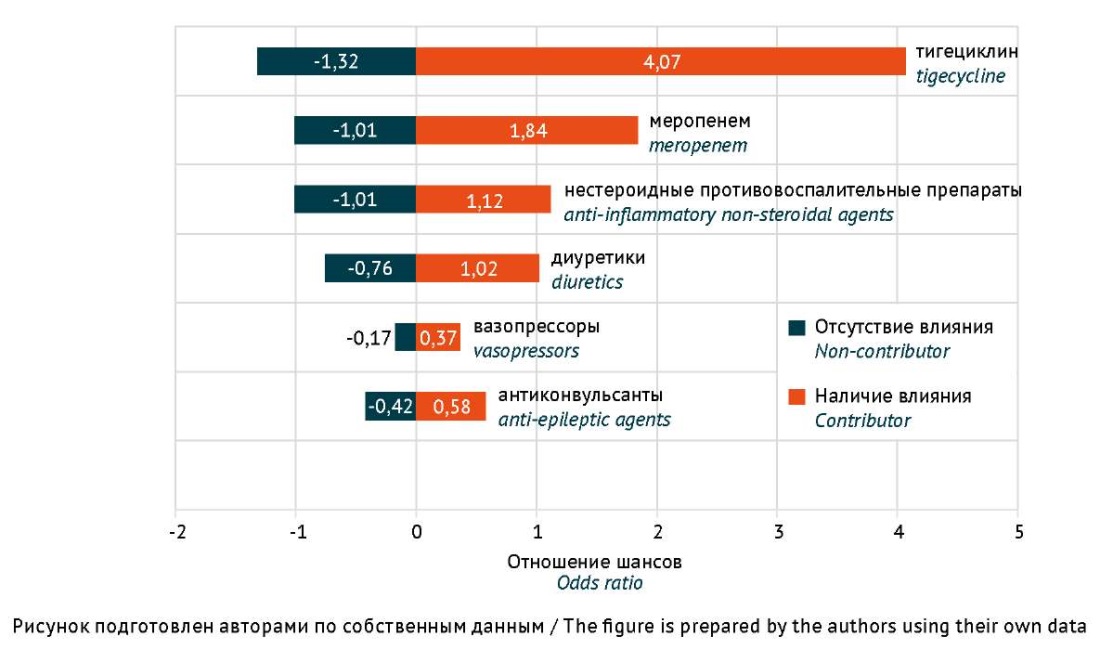
Рис. 2. Оценка влияния рисков лекарственной терапии у 11 пациентов детского возраста с идиосинкразическим лекарственно-индуцированным поражением печени
Fig. 2. Pharmacotherapy risk assessment in 11 paediatric patients with idiosyncratic drug-induced liver injury
При применении антибактериальных препаратов шансы развития ЛИЗ печени (рис. 2) были более выражены при применении тигециклина (отношение шансов (OR): 4,07; 95% доверительный интервал (CI): 1,32–12,50) и меропенема (OR: 1,84; 95% CI: 1,01–3,36).
В настоящем исследовании описана клиническая картина идиосинкразического холестатического гепатита, ассоциированного с применением тигециклина и меропенема. Схожие результаты для меропенема были получены в 2020 г. в ретроспективном исследовании развития ЛИЗ печени у детей с оценкой 1196 потенциально гепатотоксичных ЛП [36]. По данным анализа медицинской документации исследователи обнаружили связь между развитием ЛИЗ печени и применением 6 антимикробных препаратов (в порядке убывания по уровню значимости отношения шансов): ванкомицин, меропенем, ко-тримоксазол, фузидовая кислота, нистатин и флуконазол.
Синдром билиарной обструкции (так называемый синдром исчезающих желчных протоков) при применении меропенема был впервые описан в 2010 г. [23]. В 2021 г. был описан случай клинически значимого острого повреждения печени при введении меропенема: через 3 сут после начала антибиотикотерапии у пациентки развилось смешанное гепатоцеллюлярное и холестатическое поражение печени с желтухой и кожным зудом. По результатам проведенных диагностических исследований все иные возможные причины холестаза у пациентки были исключены. Было предположено меропенем-ассоциированное развитие ЛИЗ печени. После прекращения введения меропенема были отмечены улучшение состояния пациентки, нормализация активности печеночных ферментов и уровня билирубина.
Гепатотоксические свойства тигециклина подтверждены в исследованиях in vitro, однако механизм поражения клеток печени не уточнен [37].
Возможно, выявленные нами особенности фенотипа идиосинкразического холестатического гепатита, ассоциированного с применением тигециклина и меропенема, связаны с тем, что, с одной стороны, объем клеток печени у детей меньше, чем у взрослых [38], с другой — холестаз является защитным механизмом, ограничивающим повреждение клеток печени, и у детей его преобладание над цитолизом становится очевидным. Полученные данные подтверждают защитную роль холестаза при ЛИЗ печени и перекликаются с полученными ранее в исследовании C. Acevedo и соавт. [39].
ОГРАНИЧЕНИЯ ИССЛЕДОВАНИЯ
Анализ клинических случаев развития ЛИЗ печени у детей в критических состояниях проведен на уникальной уязвимой группе пациентов малой выборки. Включение пациентов в исследование было сопряжено со значительными сложностями в связи с необходимостью проведения отбора детей с начальными проявлениями синдрома полиорганной недостаточности, когда сохраняется возможность оценки определенности и приоритетности связи ЛП с развитием лекарственного повреждения печени.
Требуются дополнительные исследования для уточнения особенностей течения ЛИЗ печени у амбулаторных пациентов детского возраста. Следует отметить ограничение в настоящем протоколе исследования возможностей сравнения детской популяции, поскольку имеющиеся скудные данные ранее были получены на группе амбулаторных пациентов [36].
ЗАКЛЮЧЕНИЕ
В настоящем наблюдательном исследовании описана клиническая картина идиосинкразического холестатического гепатита, развившегося при применении тигециклина (OR: 4,07; 95% CI: 1,32–12,50) и меропенема (OR: 1,84; 95% CI: 1,01–3,36) у 11 детей в критических состояниях с нозокомиальной инфекцией. Выявлены особенности фенотипа холестатического идиосинкразического поражения печени у детей в критических состояниях по сравнению с подобным состояния у взрослых, в частности, более низкий уровень билирубина в сыворотке крови при относительно высоких показателях биохимических маркеров холестаза (активность ЩФ и ГГТ) в ответ на введение потенциально гепатотоксичного антибиотика. Можно предположить, что создание условий для выявления группы риска развития ЛИЗ печени у детей в критических состояниях при риск-ориентированном подходе к назначению персонализированной терапии с ограничением применения потенциально гепатотоксичного антибиотика у предрасположенных лиц позволит улучшить результат лечения.
Необходимо проведение дальнейших исследований для выявления фармакогенетических особенностей у пациентов детского возраста с фенотипом холестатического идиосинкразического поражения печени, связанного с применением антибиотиков.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.В. Власова — концепция и дизайн исследования, сбор и обработка материала, анализ данных литературы, формулировка выводов, написание и редактирование текста рукописи; Ю.Ф. Шубина — сбор и обработка данных медицинской документации, проведение статистического анализа, редактирование текста рукописи; Д.А. Сычев — формулировка выводов, утверждение окончательного варианта рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Anna V. Vlasova conceptualised and designed the study, collected and processed the material, analysed literature data, formulated the conclusions, drafted and edited the manuscript. Yuliya F. Shubina collected and processed medical records, conducted the statistical analysis, and edited the manuscript. Dmitry A. Sychev formulated the conclusions and approved the final version of the manuscript for publication.
Соответствие принципам этики. Проведение наблюдательного исследования одобрено локальным этическим комитетом ГБУЗ «Морозовская ДГКБ ДЗМ», г. Москва (протокол от 14.11.2019 № 149) и Комитетом по этике научных исследований ФГБОУ ДПО РМАНПО Минздрава России, г. Москва (протокол от 11.08.2022 № 14). Протокол наблюдательного исследования зарегистрирован на международной платформе ClinicalTrials.gov (ClinicalTrials.gov ID: NCT04141657, Unique Protocol ID: 07819001, Official Title: Observational Prospective Multidirectional Study on the Safety of Antimicrobial Pharmacotherapy in Intensive Care Unit (ICU) Children Aged 0–17).
Благодарности. Авторы выражают признательность сотрудникам отделений, где проводился набор пациентов в исследование, и персонально заведующим отделениями д-ру мед. наук А.В. Харькину, Д.В. Горохову, д-ру мед. наук М.А. Абрамяну.
Ethics approval. The observational clinical study protocol was approved by the local ethics committee of the Morozov Children’s City Clinical Hospital in Moscow (meeting minutes No. 149 of 14 November 2019) and the Research Ethics Committee of the Russian Medical Academy of Continuous Professional Education in Moscow (meeting minutes No. 14 of 11 August 2022). The study protocol is registered at ClinicalTrials.gov (ClinicalTrials.gov ID: NCT04141657, Unique Protocol ID: 07819001, Official Title: Observational Prospective Multidirectional Study on the Safety of Antimicrobial Pharmacotherapy in Intensive Care Unit (ICU) Children Aged 0–17).
Acknowledgments. The authors express their gratitude to the staff of the departments that recruited patients and personally to the heads of these departments, A.V. Kharkin, Dr. Sci. (Med.), D.V. Gorokhov, and M.A. Abramyan, Dr. Sci. (Med.).
1. https://livertox.nih.gov
2. Яковлев СВ, Брико НИ, Сидоренко СВ, Проценко ДН. Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи: Российские клинические рекомендации. М.: Перо; 2018.
3. https://www.cdc.gov/hai/vap/vap.html
4. https://www.ecdc.europa.eu/en/search?s=VAP
5. https://www.cdc.gov/hai/vap/vap.html
https://www.ecdc.europa.eu/en/search?s=VAP
6. Сычев ДА, ред. Полипрагмазия в клинической практике: проблема и решения: учебное пособие для врачей. СПб: Профессия; 2018.
Список литературы
1. Amin MD, Harpavat S, Leung DH. Drug-induced liver injury in children. Curr Opin Pediatr. 2015;27(5):625–33. https://doi.org/10.1097/mop.0000000000000264
2. Lee HH, Ho RH. Interindividual and interethnic variability in drug disposition: polymorphisms in organic anion transporting polypeptide 1B1 (OATP1B1; SLCO1B1). Br J Clin Pharmacol. 2017;83(6):1176–84. https://doi.org/10.1111/bcp.13207
3. Katarey D, Verma S. Drug-induced liver injury. Clin Med (Lond). 2016;16(Suppl. 6):s104–s109. https://doi.org/10.7861/clinmedicine.16-6-s104
4. Anand AC, Nandi B, Acharya SK, Arora A, Babu S, Batra Y, et al. Indian national association for the study of the liver consensus statement on acute liver failure (Part 1): epidemiology, pathogenesis, presentation and prognosis. J Clin Exp Hepatol. 2020;10(4):339–76. https://doi.org/10.1016/j.jceh.2020.04.012
5. Donati M, Motola D. Leone R, Moretti U, Stoppa G, Arzenton E, et al. Liver injury due to amoxicillin vs. amoxicillin/clavulanate: a subgroup analysis of a drug-induced liver injury case-control study in Italy. J Hepatol Gastroint Dis. 2017;3(2):1–5. https://doi.org/10.4172/2475-3181.1000143
6. Teixeira M, Macedo S, Batista T, Martins S, Correia A, Costa Matos L. Flucloxacillin-induced hepatotoxicity-association with HLA-B*5701. Rev Assoc Med Bras (1992). 2020;66(1):12–7. https://doi.org/10.1590/1806-9282.66.1.12
7. Yu Y, Mao YM, Chen CW, Chen JJ, Chen J, Cong WM, et al. CSH guidelines for the diagnosis and treatment of drug-induced liver injury. Hepatol Int. 2017;11(3):221–41. https://doi.org/10.1007/s12072-017-9793-2
8. Zhou Y, Yang L, Liao Z, He X, Zhou Y, Guo H. Epidemiology of drug-induced liver injury in China: a systematic analysis of the Chinese literature including 21789 patients. Eur J Gastroenterol Hepatol. 2013;25(7):825–9. https://doi.org/10.1097/meg.0b013e32835f6889
9. Sgro C, Clinard F, Ouazir K, Chanay H, Allard C, Guilleminet C, et al. Incidence of drug-induced hepatic injuries: a French population-based study. Hepatology. 2002;36(2):451–5. https://doi.org/10.1053/jhep.2002.34857
10. Pinna AP, Locci G, Furno M, Fanni D, Faa G, Nurchi AM. DILI (drug-induced liver injury) in a 9-month-old infant: a rare case of phenobarbital-induced hepatotoxicity. J Pediatr Neonatal Individ Med JPNIM. 2013;2:93–5. https://doi.org/10.7363/020114
11. Sridharan K, Al Daylami A, Ajjawi R, Al Ajooz HA. Drug-induced liver injury in critically ill children taking antiepileptic drugs: a retrospective study. Curr Ther Res Clin Exp. 2020;92:100580. https://doi.org/10.1016/j.curtheres.2020.100580
12. Andrade RJ, Lucena MI, Fernández MC, Pelaez G, Pachkoria K, García-Ruiz E, et al. Drug-induced liver injury: an analysis of 461 incidences submitted to the Spanish registry over a 10-year period. Gastroenterology. 2005;129(2):512–21. https://doi.org/10.1016/j.gastro.2005.05.006
13. Chalasani N, Reddy K, Fontana R, Barnhart H, Gu J, Hayashi P, et al. Idiosyncratic drug-induced liver injury in African-Americans is associated with greater morbidity and mortality compared to Caucasians. Am J Gastroenterol. 2017;112(9):1382–8. https://doi.org/10.1038/ajg.2017.215
14. Björnsson ES. Hepatotoxicity of statins and other lipid-lowering agents. Liver Int. 2017;37(2):173–8. https://doi.org/10.1111/liv.13308
15. deLemos AS, Ghabril M, Rockey DC, Gu J, Barnhart HX, Fontana RJ, et al. Amoxicillin-clavulanate-induced liver injury. Dig Dis Sci. 2016;61(8):2406–16. https://doi.org/10.1007/s10620-016-4121-6
16. Iannelli V. 30 most commonly prescribed pediatric medications. 06.06.2023. https://www.verywellhealth.com/the-30-most-prescribed-drugs-in-pediatrics-2633435
17. Yamaguchi A, Tateishi T, Okano Y, Matuda T, Akimoto Y, Miyoshi T, et al. Higher incidence of elevated body temperature or increased C-reactive protein level in asthmatic children showing transient reduction of theophylline metabolism. J Clin Pharmacol. 2000;40(3):284–9. https://doi.org/10.1177/00912700022008955
18. Pokrajac M, Simić D, Varagić V. Pharmacokinetics of theophylline in hyperthyroid and hypothyroid patients with chronic obstructive pulmonary disease. Eur J Clin Pharmacol. 1987;33(5):483–6. https://doi.org/10.1007/bf00544240
19. Stephens M, Self T, Lancaster D, Nash T. Hypothyroidism: effect on warfarin anticoagulation. South Med J. 1989;82(12):1585–6. PMID: 2595433
20. Ersulo TA, Yizengaw MA, Tesfaye BT. Incidence of adverse drug events in patients hospitalized in the medical wards of a teaching referral hospital in Ethiopia: a prospective observational study. BMC Pharmacol Toxicol. 2022;23(1):30. https://doi.org/10.1186/s40360-022-00570-w
21. Kiguba R, Karamagi C, Bird SM. Incidence, risk factors and risk prediction of hospital-acquired suspected adverse drug reactions: a prospective cohort of Ugandan inpatients. BMJ Open. 2017;7(1):e010568. https://doi.org/10.1136/bmjopen-2015-010568
22. Zed PJ, Haughn C, Black KJL, Fitzpatrick EA, Ackroyd-Stolarz S, Murphy NG, et al. Medication-related emergency department visits and hospital admissions in pediatric patients: a qualitative systematic review. J Pediatr. 2013;163(2):477–83. https://doi.org/10.1016/j.jpeds.2013.01.042
23. Schumaker AL, Okulicz JF. Meropenem-induced vanishing bile duct syndrome. Pharmacotherapy. 2010;30(9):953. https://doi.org/10.1592/phco.30.9.953
24. Doß S, Blessing C, Haller K, Richter G, Sauer M. Influence of antibiotics on functionality and viability of liver cells in vitro. Curr Issues Mol Biol. 2022;44(10):4639–57. https://doi.org/10.3390/cimb44100317
25. Li L-M, Chen L, Deng G-H, Tan W-T, Dan Y-J, Wang R-Q, Chen W-S. SLCO1B1*15 haplotype is associated with rifampin-induced liver injury. Mol Med Rep. 2012;6(1):75–82. https://doi.org/10.3892/mmr.2012.900
26. Ghabril M, Bonkovsky HL, Kum C, Davern T, Hayashi PH, Kleiner DE, et al. Liver injury from tumor necrosis factor-α antagonists: analysis of thirty-four cases. Clin Gastroenterol Hepatol. 2013;11(5):558–64. https://doi.org/10.1016/j.cgh.2012.12.025
27. Breitkreutz J, Boos J. Paediatric and geriatric drug delivery. Expert Opin Drug Deliv. 2007;4(1):37–45. https://doi.org/10.1517/17425247.4.1.37
28. Buch S, Schafmayer C, Voelzke H, Seeger M, Miquel JF, Sookoian SC, et al. Loci from a genome-wide analysis of bilirubin levels are associated with gallstone risk and composition. Gastroenterology. 2010;139(6):1942–51. https://doi.org/10.1053/j.gastro.2010.09.003
29. Hoofnagle JH, Björnsson ES. Drug-induced liver injury — types and phenotypes. N Engl J Med. 2019;381(3):264–73. https://doi.org/10.1056/nejmra1816149
30. Daly AK, Day CP. Genetic association studies in drug-induced liver injury. Semin Liver Dis. 2009;29(4):400–11. https://doi.org/10.1055/s-0029-1240009
31. Manolis E, Musuamba FT, Karlsson KE. The European Medicines Agency experience with pediatric dose selection. J Clin Pharmacol. 2021;61:S22–S27. https://doi.org/10.1002/jcph.1863
32. Власова АВ, Смирнова ЕВ, Горев ВВ, Сычев ДА. Нежелательные реакции детей на антимикробные препараты: ограничения метода спонтанных сообщений и возможности метода глобальных триггеров лекарственно-индуцированных состояний. Фарматека. 2023;30(1–2):18–31. https://doi.org/10.18565/pharmateca.2023.1-2.18-31
33. Classen DC, Resar R, Griffin F, Federico F, Frankel T, Kimmel N, et al. ‘Global Trigger Tool’ shows that adverse events in hospitals may be ten times greater than previously measured. Health Aff (Millwood). 2011;30(4):581–9. https://doi.org/10.1377/hlthaff.2011.0190
34. Иващенко ДВ, Буромская НИ, Савченко ЛМ, Шевченко ЮС, Сычев ДА. Значение метода глобальных триггеров для выявления неблагоприятных событий, связанных с оказанием медицинской помощи в педиатрии. Медицинский совет. 2018;(17):56–65. https://doi.org/10.21518/2079-701X-2018-17-56-65
35. Johnson AD, Kavousi M, Smith AV, Chen M-H, Dehghan A, Aspelund T, et al. Genome-wide association meta-analysis for total serum bilirubin levels. Hum Mol Genet. 2009;18(14):2700–10. https://doi.org/10.1093/hmg/ddp202
36. Yu Y, Nie X, Song Z, Xie Y, Zhang X, Du Z, et al. Signal detection of potentially drug-induced liver injury in children using electronic health records. Front Pediatr. 2020;8:171. https://doi.org/10.3389/fped.2020.00171
37. Jiang T, Huang X, Liu Q, Feng H, Huang Y, Lin J, et al. Risk factors for tigecycline-associated hepatotoxicity in patients in the intensive care units of 2 tertiary hospitals: a retrospective study. J Clin Pharmacol. 2022;62(11):1426–34. https://doi.org/10.1002/jcph.2099
38. Ghanem CI, Gómez PC, Arana MC, Perassolo M, Ruiz ML, Villanueva SS, et al. Effect of acetaminophen on expression and activity of rat liver multidrug resistance-associated protein 2 and P-glycoprotein. Biochem Pharmacol. 2004;68(4):791–8. https://doi.org/10.1016/j.bcp.2004.05.014
39. Acevedo C, Bengochea L, Tchercansky DM, Ouviña G, Perazzo JC, Lago N, et al. Cholestasis as a liver protective factor in paracetamol acute overdose. Gen Pharmacol. 1995;26(7):1619–24. https://doi.org/10.1016/0306-3623(95)00061-5
Об авторах
А. В. ВласоваРоссия
Власова Анна Викторовна, канд. мед. наук, доцент.
4-й Добрынинский пер., д. 1/9, Москва, 119049;
Баррикадная ул., д. 2/1, стр. 1, Москва, 125993
Ю. Ф. Шубина
Россия
Шубина Юлия Федоровна, канд. мед. наук, доцент
4-й Добрынинский пер., д. 1/9, Москва, 119049
Д. А. Сычев
Россия
Сычев Дмитрий Алексеевич, академик РАН, д-р мед. наук, профессор
Баррикадная ул., д. 2/1, стр. 1, Москва, 125993
Дополнительные файлы
Рецензия
Для цитирования:
Власова А.В., Шубина Ю.Ф., Сычев Д.А. Лекарственное поражение печени, ассоциированное с антибиотиками, у детей в критических состояниях: проспективное наблюдательное исследование. Безопасность и риск фармакотерапии. 2024;12(2):155-166. https://doi.org/10.30895/2312-7821-2023-389
For citation:
Vlasova A.V., Shubina Yu.F., Sychev D.A. Antibiotic-Associated Drug-Induced Liver Injury in Critically Ill Children: A Prospective Observational Study. Safety and Risk of Pharmacotherapy. 2024;12(2):155-166. (In Russ.) https://doi.org/10.30895/2312-7821-2023-389




































