Перейти к:
Анализ потребления препаратов с высоким риском развития лекарственного поражения печени при COVID-19
https://doi.org/10.30895/2312-7821-2024-396
Резюме
ВВЕДЕНИЕ. Тяжесть течения COVID-19 коррелирует с риском развития поражения печени, однако в настоящее время результаты исследований указывают на связь нарушения функции печени с использованием различных лекарственных средств в комплексной терапии этого заболевания.
ЦЕЛЬ. Изучить годовой объем потребления препаратов с высоким риском развития лекарственного поражения печени (ВР ЛПП), применяющихся в комплексной терапии при COVID-19, и провести выборочный анализ листов назначений для разработки мероприятий по профилактике развития лекарственных поражений печени.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен АТС/DDD-анализ за 2020, 2021 и 2022 гг. и выборочный анализ 1250 медицинских карт стационарного больного и листов назначений пациентов с СOVID-19, находившихся на лечении в стационаре Волгоградской области, перепрофилированном для лечения СOVID-19. Для генно-инженерных биологических препаратов (ГИБП) и циклофосфамида в связи с невозможностью определения количества установленных суточных доз (DDD) при расчетах объема потребления были использованы средние курсовые дозы (СД). Выделены препараты с ВР ЛПП, которые могут вызывать клинически выраженное поражение печени (по данным базы LiverTox и информации российских клинических рекомендаций) и/ или повышение активности печеночных ферментов у ≥1% пациентов (по данным отчетов о безопасности лекарственных средств).
РЕЗУЛЬТАТЫ. Установлено, что 28% лекарственных препаратов, применявшихся в стационаре в комплексной терапии у пациентов с COVID-19, относятся к препаратам с ВР ЛПП. Суммарный объем потребления препаратов ВР ЛПП составил в 2020, 2021 и 2022 годах 342,3, 425,3 и 402,3 DDD/100 койко-дней соответственно. Для ГИБП, вводимых однократно, и циклофосфамида суммарный объем потребления составил в 2020, 2021 и 2022 годах 3,5, 16,9 и 29,7 СД/100 пролеченных пациентов соответственно. По результатам выборочного анализа 1250 медицинских карт выявлено, что 19,8% (247/1250) пациентов получали одновременно 5 и более препаратов ВР ЛПП, и это повысило риск неблагоприятных межлекарственных взаимодействий с развитием ЛПП. Среди препаратов ВР ЛПП в 2022 г. наиболее часто пациентам назначали омепразол (188,7 DDD/100 койко-дней), нестероидные противовоспалительные средства и парацетамол (54,4 DDD/100 койко-дней), аторвастатин (46,2 DDD/100 койко-дней), левофлоксацин (26,4 DDD/100 койко-дней), цефтриаксон (20,5 DDD/100 койко-дней), фавипиравир (17,3 DDD/100 койко-дней), генно-инженерные биологические препараты (24,0 СД/100 пациентов).
ВЫВОДЫ. Для снижения риска развития ЛПП, в том числе вследствие межлекарственного взаимодействия, у госпитализированных в инфекционные отделения с COVID-19 пациентов требуется ограничить применение гепатотоксичных антибактериальных препаратов, ингибиторов протоновой помпы и нестероидных противовоспалительных средств или рассмотреть возможность назначения препаратов с меньшим риском гепатотоксичности.
Ключевые слова
Для цитирования:
Петров В.И., Рязанова А.Ю., Токарева Н.С. Анализ потребления препаратов с высоким риском развития лекарственного поражения печени при COVID-19. Безопасность и риск фармакотерапии. 2024;12(3):268-284. https://doi.org/10.30895/2312-7821-2024-396
For citation:
Petrov V.I., Ryazanova A.Yu., Tokareva N.S. Analysis of the Consumption of Medicinal Products Associated with a High Risk of Drug-Induced Liver Injury in Patients with COVID-19. Safety and Risk of Pharmacotherapy. 2024;12(3):268-284. (In Russ.) https://doi.org/10.30895/2312-7821-2024-396
ВВЕДЕНИЕ
Повышение активности трансаминаз и других ферментов печени у пациентов с новой коронавирусной инфекцией COVID-19 наблюдается в 32,6–76,3% случаев и может являться следствием репликации вируса SARS-CoV-2 в печени, гипоксемии, полиорганной недостаточности и цитокинового шторма при тяжелом течении COVID-19, а также токсического действия лекарственных препаратов (ЛП) [1–4]. Степень тяжести течения COVID-19 коррелирует с риском развития поражения печени, наблюдаемого у большинства больных, госпитализированных в отделения/палаты реанимации и интенсивной терапии (ОРИТ), и у 1/3 пациентов вне ОРИТ. При патологоанатомическом исследовании печени у пациентов с COVID-19 выявляют дегенерацию гепатоцитов, очаговый некроз с нейтрофильной инфильтрацией и тромбоз мелких сосудов [1]. По данным A. Olry и соавт. [5], все большее число исследований указывает на то, что повышение активности печеночных ферментов может быть связано с использованием ЛП. F. Sodeifian и соавт. [6] провели систематический обзор информации о ЛП, применение которых при COVID-19 сопровождалось развитием лекарственного поражения печени (ЛПП): ремдесивир, фавипиравир, тоцилизумаб, гидроксихлорохин и лопинавир+ритонавир. Результаты некоторых включенных в этот обзор исследований подтвердили прямую роль ЛП (ремдесивир, лопиновир+ритонавир и тоцилизумаб) в нарушении функции печени у пациентов, в то время как данные других исследований не позволили установить, чем вызвано повреждение печени — SARS-CoV-2 или приемом препарата [6].
В настоящее время в развитии ЛПП подтверждена роль более чем 1000 препаратов, пищевых добавок и растительных продуктов, и этот перечень ежегодно продолжает увеличиваться [7]. Известной гепатотоксичностью обладают нестероидные противовоспалительные препараты (НПВП) и антибактериальные препараты, которые широко применяются в инфекционных отделениях для лечения COVID-19, а одновременный прием нескольких гепатотоксичных ЛП может приводить к увеличению частоты повреждения печени вследствие межлекарственного взаимодействия [7]. Фармакоэпидемиологическое исследование потребления ЛП, вызывающих ЛПП у больных COVID-19, позволит оценить риск межлекарственного взаимодействия и разработать мероприятия по рациональному применению таких препаратов и профилактике развития нежелательных реакций (НР).
Цель работы — изучить годовой объем потребления препаратов с высоким риском развития лекарственного поражения печени, применяющихся в комплексной терапии при COVID-19, и провести выборочный анализ листов назначений для разработки мероприятий по профилактике развития лекарственных поражений печени.
МАТЕРИАЛЫ И МЕТОДЫ
Проведена оценка объема и структуры потребления ЛП за 2020, 2021 и 2022 гг. в инфекционном стационаре Волгоградской области, перепрофилированном для лечения пациентов с СOVID-19. Всего в 2020 г. в инфекционном стационаре Волгоградской области было пролечено 3750 пациентов (45315 койко-дней), в 2021 г. — 5130 (58439 койко-дней), в 2022 г. — 1016 (9614 койко-дней). Проведен анализ 1250/9896 (12,6%) медицинских карт стационарного больного (далее — медицинских карт) и листов назначений пациентов с СOVID-19, в исследование были включены медицинские документы всех пациентов, завершивших стационарное лечение в инфекционных отделениях стационара в сентябре–ноябре 2021 г., феврале, марте, сентябре и октябре 2022 г. Анализировали все назначения, результаты лабораторных анализов и инструментальных методов обследования, диагноз, анамнез, наличие осложнений фармакотерапии.
Проведение исследования было одобрено на заседании локального комитета по этике ВолгГМУ (протокол от 24.12.2021 № 2021/085).
Для всех ЛП, применявшихся в стационаре как в комплексной терапии СOVID-19, так и для лечения осложнений этого заболевания и сопутствующих заболеваний у пациентов, проводили поиск информации о возможности развития ЛПП при их применении. Поиск проводили в инструкциях по медицинскому применению ЛП, зарегистрированных на территории Российской Федерации1, в базе данных LiverTox, разработанной Национальным институтом диабета, болезней органов пищеварения и почек (National Institute of Diabetes and Digestive and Kidney Diseases, NIDDK)2, в базах данных о нежелательных реакциях: VigiBase3 ВОЗ и EudraVigilance4 Европейского агентства по лекарственным средствам (European Medicines Agency, EMA). К ЛП с высоким риском развития ЛПП (ВР ЛПП) относили препараты, вызывающие клинически выраженное поражение печени по данным базы LiverTox и согласно российским клиническим рекомендациям5 и/или повышение активности печеночных ферментов у ≥1% пациентов по данным отчетов о безопасности лекарственных средств и инструкций по медицинскому применению ЛП.
Из 139 международных непатентованных наименований (МНН) ЛП, применявшихся в стационаре в 2020–2022 гг. у пациентов с COVID-19 (2020 г. — 117 МНН, 2021 г. — 129 МНН, 2022 г. — 97 МНН), к ВР ЛПП были отнесены 38 (27,3%) МНН, включая комбинированные препараты (амоксициллин+клавулановая кислота, лопинавир+ритонавир, цефоперазон+сульбактам и ко-тримоксазол или сульфаметоксазол+триметоприм): 15 антибактериальных, 4 противовирусных, 4 НПВП, 6 иммуносупрессоров, 7 сердечно-сосудистых ЛП, 1 противогрибковый (флуконазол), 1 ингибитор протонного насоса (омепразол) (табл. 1).
Таблица 1. Лекарственные препараты с высоким риском развития лекарственного поражения печени, назначавшиеся в инфекционном стационаре Волгоградской области в 2020–2022 гг.
Table 1. Medicinal products associated with a high risk of DILI prescribed in an infectious disease hospital in the Volgograd Region in 2020–2022
|
Категория (по классификации LiverTox6) Category (according to the LiverTox Database6) |
Описание категории Category description |
Наименование препарата Medicinal product |
|
А |
Точно установленная причина клинически выраженного поражения печени Well-established cause of clinically apparent liver injury |
ацетилсалициловая кислота* (высокие дозы) / acetylsalicylic acid* (high doses) азитромицин / azithromycin амиодарон* / amiodarone* амоксициллин+клавулановая кислота* / amoxicillin/clavulanate* аторвастатин* / atorvastatin* интерферон бета* / interferon beta* левофлоксацин / levofloxacin линезолид / linezolid парацетамол (ацетаминофен)* / paracetamol (acetaminophen)* сульфаметоксазол* (в комб.) / sulfamethoxazole* (in comb.) |
|
В |
Весьма вероятная причина клинически выраженного поражения печени Likely cause of clinically apparent liver injury |
лизиноприл / lisinopril нифедипин / nifedipine омепразол* / omeprazole* флуконазол* / fluconazole* цефтриаксон / ceftriaxone циклофосфамид / cyclophosphamide ципрофлоксацин / ciprofloxacin эналаприл* / enalapril* |
|
С |
Вероятная причина клинически выраженного повреждения печени Probable cause of clinically apparent liver injury |
кетопрофен* / ketoprofen* метронидазол* / metronidazole* ритонавир (в комб.) / ritonavir (in comb.) тоцилизумаб / tocilizumab триметоприм* (в комб.) / trimethoprim* (in comb.) |
|
D |
Возможная причина клинически выраженного поражения печени Possible cause of clinically apparent liver injury |
лопинавир (в комб.) / lopinavir (in comb.) меропенем / meropenem метопролол* / metoprolol* ремдесивир / remdesivir цефоперазон (в комб.) / cefoperazone (in comb.) цефотаксим / cefotaxime цефтазидим / ceftazidime |
|
Е |
Недоказанная, но предполагаемая причина клинически выраженного повреждения печени Unproven but suspected cause of clinically apparent liver injury |
барицитиниб / baricitinib гентамицин / gentamicin кеторолак* / ketorolac* периндоприл / perindopril сарилумаб / sarilumab сульбактам (в комб.) / sulbactam (in comb.) тигециклин* / tigecycline* эртапенем / ertapenem |
|
Отсутствует Not included |
Лекарственные препараты, отсутствующие в базе данных LiverTox, однако их гепатотоксичность описана в других источниках7 Medicinal products not included in the LiverTox database but described elsewhere as associated with hepatotoxicity 7 |
левилимаб / levilimab олокизумаб / olokizumab фавипиравир / favipiravir |
Таблица составлена авторами / The table is prepared by the authors
* Препарат входит в перечень лекарственных препаратов с высоким риском развития лекарственного поражения печени8.
* The current Russian clinical practice guidelines8 list this medicinal product as associated with a high risk of DILI.
Оценка объема потребления ЛП проведена с помощью АТС/DDD-анализа, предложенного Всемирной организацией здравоохранения (ВОЗ) в качестве международного стандарта9. В основе данной методологии — анатомо-терапевтическо-химическая классификация (Anatomical Therapeutic Chemical Classification System, АТС), единицей измерения является установленная суточная доза ЛП (defined daily dose, DDD). Рассчитаны показатели DDD на 100 койко-дней (DDD/100 койко-дней). Суммарное количество потребленных DDD рассчитывали как отношение количества ЛП к значению DDD, указанному на сайте сотрудничающего центра по методологии лекарственной статистики ВОЗ10. Показатель DDD/100 койко-дней определяли как отношение потребляемых DDD за год, умноженное на 100, к суммарному койко-дню за год11.
Для 5 препаратов ВР ЛПП расчет показателя DDD/100 койко-дней был невозможен: 1) информация об отечественных препаратах олокизумаб и левилимаб отсутствовала на сайте сотрудничающего центра по методологии лекарственной статистики ВОЗ; 2) DDD для тоцилизумаба и сарилумаба рассчитаны для пациентов с ревматоидным артритом; 3) DDD для циклофосфамида невозможно определить из-за особенностей дозирования этого препарата12. Противовоспалительные генно-инженерные биологические препараты (ГИБП) вводились пациентам не ежедневно, а однократно с возможным повторным введением при неэффективности. В связи с этим при расчетах объема потребления ГИБП, а также циклофосфамида были использованы средние курсовые дозы (далее — стандартная доза, СД). Объем потребления этих препаратов рассчитывали по данным амбулаторных карт как отношение количества назначенных СД в течение года к количеству пролеченных пациентов, умноженному на 100.
Среди 329 (26,3%) назначений ГИБП в 1250 проанализированных медицинских картах в 313 случаях (95,1%) их назначали однократно в дозах, рекомендованных при легком (левилимаб, олокизумаб) и среднетяжелом (тоцилизумаб для пациентов весом от 80 кг, сарилумаб) течении COVID-1913. Циклофосфамид не входил во временные методические рекомендации Минздрава России по профилактике, диагностике и лечению COVID-1914, но применялся в реальной клинической практике. Указания по его назначению были в 9 (0,7%) из 1250 проанализированных медицинских картах в средней курсовой дозе (медиана) 1 г (200 мг в первые сутки, затем по 100 мг в течение 8 суток). В связи с тем что циклофосфамид применялся в качестве альтернативы ГИБП [8], для сравнения его потребления с ГИБП рассчитывали отношение количества назначенных СД в течение года к количеству пролеченных пациентов, умноженному на 100.
Статистическая обработка данных осуществлялась с помощью пакета прикладных статистических программ SPSS Statistics и Microsoft Excel. Активность аланиновой трансаминазы (АЛТ) представлена в формате M±m (среднее арифметическое и ошибка среднего арифметического).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В 2020 г. общий общий объем потребления препаратов ВР ЛПП составил 342,2 DDD/100 койко-дней, для ГИБП и циклофосфамида — 3,5 СД/100 пациентов, в 2021 г. — 425,3 DDD/100 койко-дней и 16,9 СД/100 пациентов, в 2022 г. — 402,3 DDD/100 койко-дней и 29,7 СД/100 пациентов (рис. 1, 2). Показатели потребления ЛП, превышающие 100 DDD/100 койко-дней, позволяют предположить высокую частоту одновременного приема нескольких препаратов ВР ЛПП и/или применение их в дозах, превышающих DDD, что подтвердилось при последующем анализе медицинских карт. Анализ листов назначений 1250 пациентов показал, что количество одновременно назначенных препаратов ВР ЛПП одному пациенту в среднем составило 3,2±1,3 (максимальное количество ЛП — 9), 19,8% пациентов (247/1250) получали одновременно 5 и более препаратов ВР ЛПП. По данным медицинских карт этих пациентов максимальные значения активности АЛТ в период госпитализации, как правило, были выше у пациентов, которые получали большее количество препаратов с ВР ЛПП (табл. 2). Однако анализ был проведен нами без учета степени тяжести СOVID-19, влияющего на количество назначенных ЛП, возраста, сопутствующей патологии, длительности госпитализации и кратности измерения активности АЛТ.
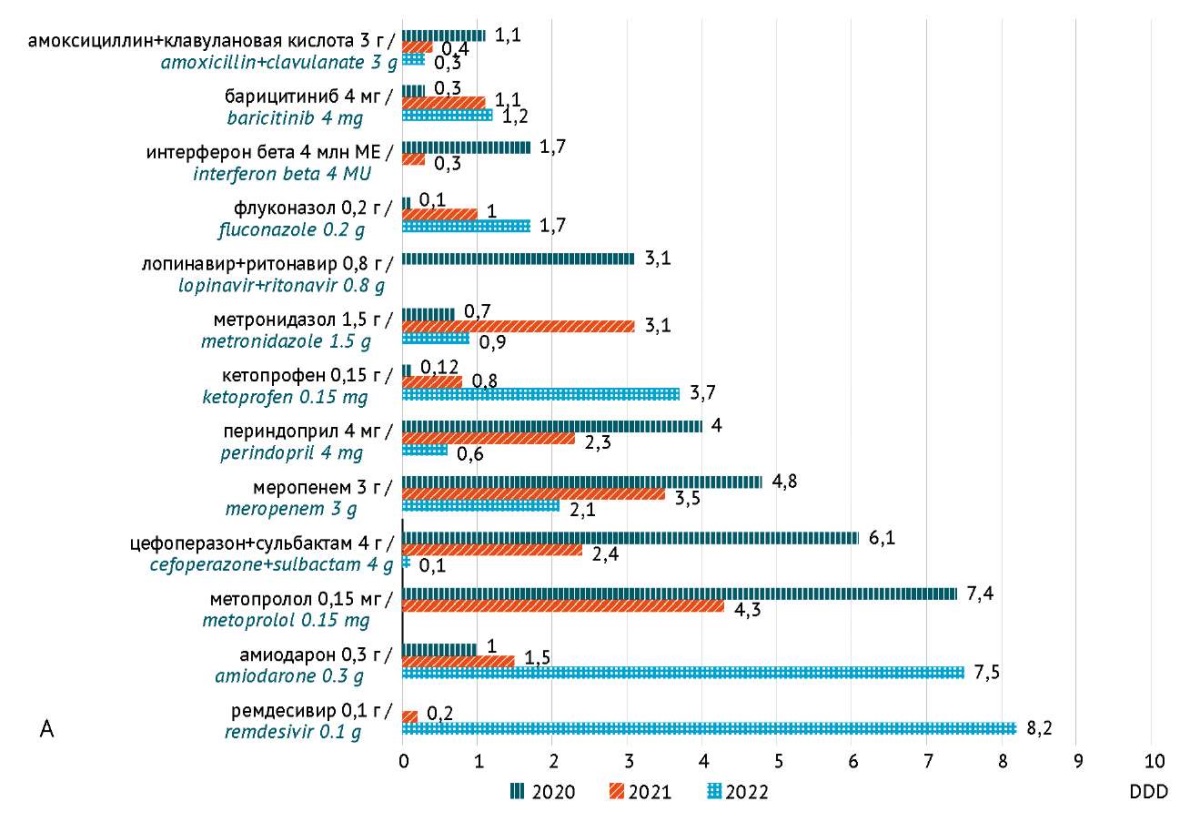
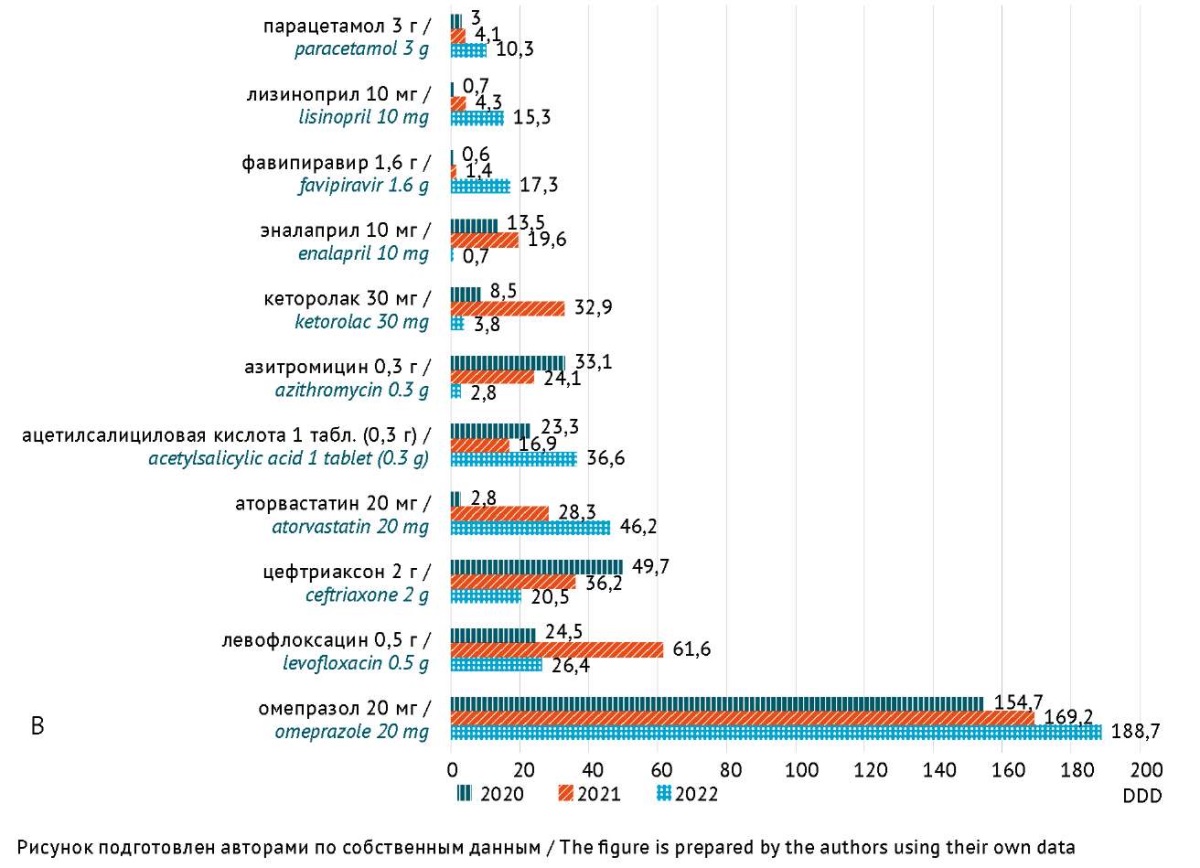
Рис. 1. Объем потребления (количество установленных суточных доз (DDD) на 100 койко-дней) наиболее часто используемых при COVID-19 лекарственных препаратов (А: 1–10 DDD/100 койко-дней; В: >10 DDD/100 койко-дней) с высоким риском развития лекарственного поражения печени, в инфекционном стационаре Волгоградской области в 2020–2022 гг. Лекарственные препараты, объем потребления которых составил <1 DDD/100 койко-дней (цефотаксим, цефепим, цефтазидим, эртапенем, тигециклин, ципрофлоксацин, гентамицин, ко-тримоксазол, нифедипин), не представлены на графике
Fig. 1. Consumption volume (number of DDDs per 100 bed days) of the most commonly used medicinal products (А: 1–10 DDD/100 bed days; В: >10 DDD/100 bed days) associated with a high risk of DILI in COVID-19 patients admitted to an infectious disease hospital in the Volgograd Region in 2020–2022. The chart does not include medicinal products with the consumption volume of <1 DDD per 100 bed days (cefotaxime, cefepime, ceftazidime, ertapenem, tigecycline, ciprofloxacin, gentamicin, co-trimoxazole, and nifedipine)
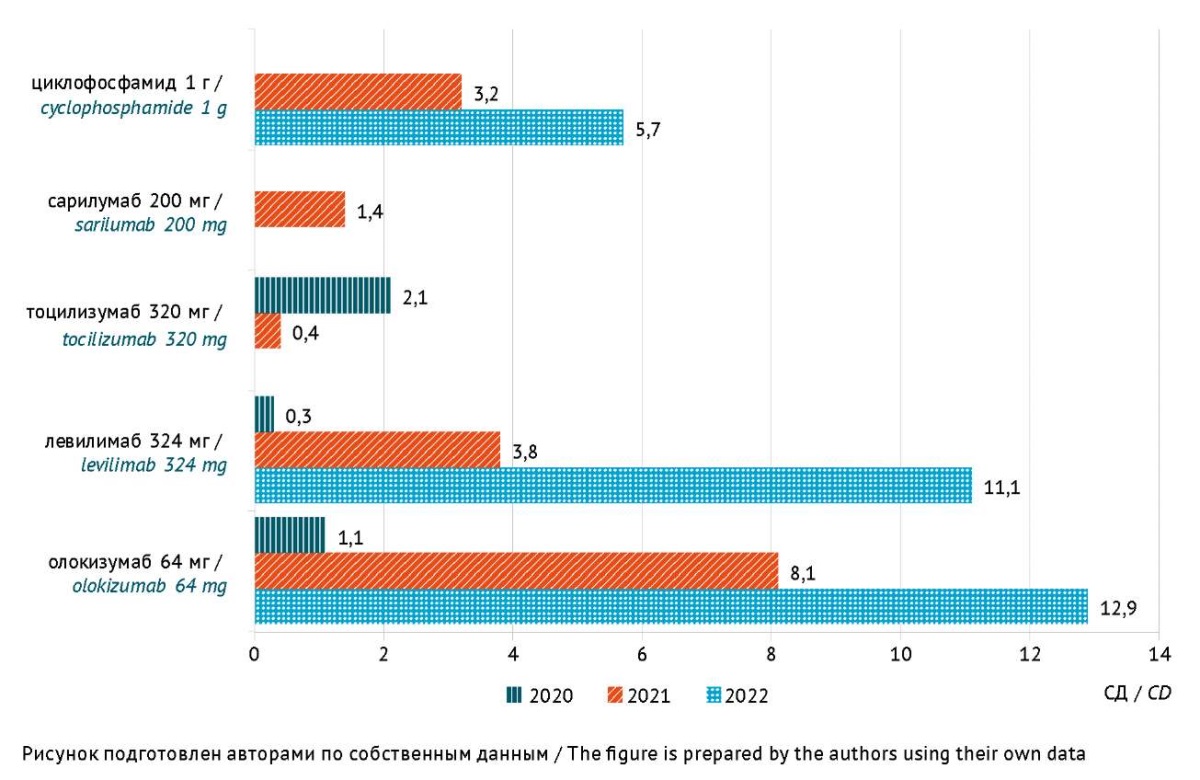
Рис. 2. Объем потребления (количество средних курсовых доз (СД) на 100 пролеченных пациентов) генно-инженерных биологических препаратов и циклофосфамида при COVID-19 в инфекционном стационаре Волгоградской области в 2020–2022 гг.
Fig. 2. Consumption volume (number of average doses delivered over a treatment course (CD) per 100 treated patients) of genetically engineered biologicals and cyclophosphamide in an infectious disease hospital in the Volgograd Region in 2020–2022
Таблица 2. Зависимость активности аланиновой трансаминазы от количества назначенных препаратов с высоким риском развития лекарственного поражения печени у пациентов с COVID-19 (по данным анализа медицинских карт пациентов инфекционного стационара Волгоградской области за период 2020–2022 гг.)
Table 2. Alanine transaminase levels depending on the number of medicinal products with a high risk of drug-induced liver injury prescribed to patients with COVID-19 (according to the analysis of medical records of patients admitted to an infectious disease hospital in the Volgograd Region in 2020–2022)
|
Количество назначенных препаратов ВР ЛПП Number of prescribed medicinal products with a high risk of DILI |
Количество пациентов, чел. (%) Number of patients, pers. (%) |
Максимальная активность АЛТ в период госпитализации, Ед/л* Maximum ALT levels during hospital stay, U/L* |
Количество пациентов с высокой активностью АЛТ, чел. (%) Number of patients with elevated ALT levels, pers. (%) |
Максимальное значение АЛТ, Ед/л Maximum ALT value, U/L |
|
|
>2 верхних границ нормы >2 upper limits of normal |
>5 верхних границ нормы >5 upper limits of normal |
||||
|
0 |
13 (1,0) |
45,0±10,6 |
3 (23,1) |
0 |
115 |
|
1 |
115 (9,2) |
59,6±6,6 |
30 (26,1) |
11 (9,6) |
439 |
|
2 |
318 (25,4) |
77,8±5,7 |
107 (33,6) |
36 (11,3) |
1118 |
|
3 |
335 (26,8) |
67,9±3,9 |
113 (33,7) |
24 (7,2) |
664 |
|
4 |
222 (17,8) |
97,1±8,4 |
99 (44,6) |
33 (14,9) |
1178 |
|
5 |
141 (11,3) |
85,4±10,5 |
56 (39,7) |
13 (9,2) |
1247 |
|
6 |
62 (5,0) |
68,4±7,0 |
22 (35,5) |
5 (8,1) |
251 |
|
7 |
28 (2,2) |
167,9±47,2 |
15 (53,6) |
7 (25,0) |
1076 |
|
8 |
10 (0,8) |
87,1±13,9 |
8 (80,0) |
0 |
144 |
|
9 |
6 (0,5) |
80,2±21,9 |
3 (50,0) |
0 |
150 |
|
Всего Total |
1250 (100,0) |
79,0±2,9 |
456 (36,5) |
129 (10,3) |
1247 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ВР ЛПП — высокий риск развития лекарственного поражения печени; АЛТ — аланиновая трансаминаза.
* Данные представлены в формате среднее арифметическое ± ошибка среднего арифметического (M±m).
Note. DILI, drug-induced liver injury; ALT, alanine transaminase.
* Data are presented as the arithmetic mean ± error of the arithmetic mean (M±m).
Среди всех препаратов ВР ЛПП, назначавшихся пациентам с СOVID-19, в том числе для терапии сопутствующих заболеваний, наиболее часто используемым ЛП был омепразол, его потребление в 2022 г. в 1,9 раза превысило 100 DDD/100 койко-дней. Рекомендуемая стандартная доза омепразола в инструкции по медицинскому применению препарата15 для большинства показаний и DDD, указанная на сайте ВОЗ16, составляет 20 мг/сут. Омепразол получали 1112 (89%) пациентов, большинство из них (864 человека) — в дозе 20 мг 2 раза/сут (перорально 862, парентерально 2), 52 (4,7%) пациента — в дозе 40 мг 2 раза/сут (парентерально) и только 196 (17,6%) в дозе 20 мг/сут (перорально).
Применение омепразола (категория В по классификации LiverTox) вызывает повышение активности печеночных ферментов в плазме крови у 0,1–1% пациентов, лекарственный гепатит (0,01–0,1%) и печеночную недостаточность (<0,1%)17. Для поражения печени, вызванного омепразолом, характерно быстрое начало, склонность к рецидивированию и морфологические изменения в виде очагов острого некроза печени иммуноаллергического генеза. Омепразол интенсивно метаболизируется ферментами цитохрома Р450 и оказывает воздействие на различные звенья метаболизма ЛП, включая дозозависимое ингибирование изофермента CYP2C19 и индукцию изофермента CYP1A2, что может вызывать значимые межлекарственные взаимодействия18. Для снижения риска развития ЛПП и риска взаимодействий при применении омепразола в комплексной фармакотерапии пациентов с СOVID-19 целесообразно ограничить профилактическое применение омепразола либо использовать его в дозе 20 мг/сут.
Антибактериальные препараты были назначены 526 (42,1%) пациентам с СOVID-19, при этом в большинстве случаев применялась комбинированная антибиотикотерапия и/или проводилась смена антибиотикотерапии. По данным литературы, применение антибактериальных препаратов является одной из самых распространенных причин ЛПП в мире [9][10]. Среди антибиотиков самым часто назначаемым препаратом являлся цефтриаксон (категория В по классификации LiverTox), его получали 417 (33%) пациентов. По данным листов назначений, цефтриаксон применялся в дозе 2 г/сут, что соответствовало DDD19. В 2020 г. для цефтриаксона показатели DDD/100 койко-дней составили 49,7, в 2021 г. — 36,2, в 2022 г. — 20,5, что свидетельствует о сокращении потребления цефтриаксона у данной категории пациентов. Цефтриаксон может вызвать развитие билиарного сладжа и псевдолитиаза у 3–46% пациентов за счет кристаллизации его солей в желчи, а также, как и другие препараты группы цефалоспоринов, стать причиной иммуноаллергического холестатического гепатита20.
Вторым по частоте применения среди антибактериальных препаратов был левофлоксацин (категория А по классификации LiverTox), он был назначен в 204 (16%) случаях в дозе 500 мг 2 раза/сут (DDD 500 мг/сут21). В связи с тем что назначенная доза левофлоксацина в 2 раза превышала DDD, мы получили высокие показатели DDD/100 койко-дней, максимум был отмечен в 2021 г. — 61,6 DDD/100 койко-дней. При применении левофлоксацина возможно как гепатоцеллюлярное, так и холестатическое поражение печени, в том числе иммуноаллергического генеза, что приводит к повышению активности печеночных ферментов у 1–10% пациентов и уровня билирубина у 0,1–1,0% пациентов. Описаны также случаи развития острой печеночной недостаточности, в том числе с летальным исходом22.
Потребление азитромицина (категория А по классификации базы данных LiverTox) в 2022 г. составило 2,8 DDD/100 койко-дней и снизилось более чем в 10 раз по сравнению с 2020 г. — 33,1 DDD/100 койко-дней. Во всех случаях азитромицин назначался в дозе 0,5 г/сут при DDD для перорального применения 0,3 г/ сут23. Как и другие макролиды, азитромицин может вызывать холестаз с умеренным воспалением паренхимы печени, некрозом, его применение является известной причиной синдрома исчезновения желчных протоков. Менее распространено гепатоцеллюлярное поражение печени, вызванное азитромицином24, повышение активности печеночных ферментов наблюдается у 0,1–1% пациентов, принимающих азитромицин.
В 2022 г. снизилось по сравнению с 2020 г. потребление таких антибактериальных ЛП, как амоксициллин+клавулановая кислота, цефоперазон+сульбактам, меропенем. В большинстве листов назначений дозы этих ЛП (их применяли только парентерально) соответствовали DDD25. Препарат амоксициллин+клавулановая кислота (категория А по классификации LiverTox) является лидером среди антибактериальных ЛП в мире по частоте не только назначений, но и сообщений о развитии ЛПП [9], но его потребление у пациентов с COVID-19 было низким и только в 2020 г. превысило 1 DDD/100 койко-дней — препарат получали 0,9% (11/1250) пациентов. Применение препарата амоксициллин+клавулановая кислота ассоциировано с развитием поражения печени по гепатоцеллюлярному, холестатическому или смешанному типу преимущественно за счет действия клавулановой кислоты, в качестве ключевого патогенетического механизма гепатотоксичности рассматривается иммуноаллергический [11][12].
Другой антибиотик группы цефалоспоринов цефоперазон+сульбактам (цефоперазон отнесен к категории D, сульбактам — к категории Е по классификации LiverTox) применялся в 7% случаев (87/1250). Частота повышения активности трансаминаз в сыворотке крови при приеме этого препарата составляет 1–10%26.
Меропенем получали 2,6% (33/1250 пациентов), в 2020, 2021 и 2022 гг. — 4,8, 2,5 и 2,1 DDD/100 койко-дней соответственно. Транзиторное повышение активности трансаминаз на фоне применения меропенема (категория D по классификации LiverTox) наблюдается у 1–6% пациентов, однако сообщений о развитии острой печеночной недостаточности вследствие его применения в литературе не обнаружено.
Метронидазол (отнесен к категории С по классификации LiverTox) был назначен в 1,1% случаев (14/1250), его наибольшее потребление зарегистрировано в 2021 г. (3,1 DDD/100 койко-дней). Несмотря на широкое применение метронидазола в мире, сообщения о повышении активности трансаминаз в сыворотке крови, носившем обратимый характер и проявлявшемся незначительными клиническими симптомами, редки. Однако у пациентов, получавших лечение метронидазолом в комбинации с другими антибактериальными препаратами, наблюдались случаи развития печеночной недостаточности, потребовавшей проведения трансплантации печени27.
Антибактериальная терапия не является основой лечения COVID-19, заболевания вирусной этиологии, и должна проводиться только при наличии бактериальной суперинфекции. Сокращение потребления антибактериальных ЛП, которое мы наблюдаем в 2022 г. по сравнению с 2020 г., может выступать в роли одного из факторов снижения риска развития ЛПП и антибиотикорезистентности.
Несмотря на отмеченное сокращение назначения антибактериальных ЛП в стационаре, потребление противогрибкового препарата флуконазол выросло к 2022 г.: препарат получали 4,2% пациентов (52/1250, 0,1, 1,0, и 1,7 DDD/100 койко-дней в 2020, 2021 и 2022 гг. соответственно), что может быть связано с развитием грибковой суперинфекции на фоне потребления иммуносупрессоров. ЛПП, обусловленные флуконазолом (категория В по классификации LiverTox), встречаются редко, но хорошо описаны в литературе. Поражение печени по гепатоцеллюлярному типу возникает, как правило, в течение нескольких первых недель терапии и может сопровождаться признаками гиперчувствительности, такими как лихорадка, сыпь и эозинофилия. Сообщалось о фатальных случаях поражения печени, вызванных флуконазолом, но большинство случаев ЛПП обратимо28. Флуконазол также является умеренным ингибитором некоторых изоферментов цитохрома Р-450 и может вызывать значимые межлекарственные взаимодействия29.
Противовирусные препараты составляют этиотропную терапию COVID-19. Перечень рекомендуемых препаратов этиотропной терапии менялся по мере накопления данных об эффективности существующих и разработке новых препаратов. Среди противовирусных ЛП с ВР ЛПП в 2020 г. для лечения COVID-19 применялся антиретровирусный препарат лопиновир+ритонавир30 (лопинавир — категория D, ритонавир — категория С по классификации LiverTox). Лопиновир+ритонавир вызывает развитие гепатита у 1–10% пациентов31. Применение данной комбинации при COVID-19 не показало ожидаемой эффективности, и препарат был исключен из отечественных и зарубежных рекомендаций [13].
Интерферон бета-1b в составе комбинированной противовирусной терапии входил в ранние версии клинических рекомендаций32 и применялся только в начале пандемии СOVID-19. Сообщалось о случаях серьезного поражения печени вследствие развития аутоиммунного гепатита и молниеносной печеночной недостаточности, требующей трансплантации печени, у пациентов с рассеянным склерозом, получающих терапию интерфероном бета [14]. По информации в инструкции по медицинскому применению препарата33 повышение уровня билирубина в сыворотке крови наблюдается у 1–10% пациентов, лекарственный гепатит и повышение активности печеночных ферментов — у 0,1–1%, печеночная недостаточность — у 0,01–1%.
Среди препаратов этиотропной терапии, рекомендованных в настоящее время для применения в Российской Федерации34, в стационаре по данным листов назначений применялось два — фавипиравир и ремдесивир. Фавипиравир впервые стали применять при лечении COVID-19 в конце 2020 г. (0,6 DDD/100 койко-дней), и к 2022 г. его потребление выросло до 17,3 DDD/100 койко-дней (всего препарат получали 23% (287/1250) пациентов). DDD фавипиравира составляет 1,6 г35, что соответствует поддерживающей дозе при COVID-19 у пациента с массой тела 75 кг и более. Потребление ремдесивира также значительно выросло в 2022 г. по сравнению с 2021 г. — 8,2 и 0,2 DDD/100 койко-дней соответственно (его получали 17,7% (221/1250) пациентов). Ремдесивир назначался всем пациентам в дозе 200 мг в первые сутки, затем по 100 мг/сут до 10 сут (DDD ремдесивира 0,1 г36).
В связи с тем что до пандемии COVID-19 фавипиравир не использовался в клинической практике и применение его в других странах в настоящее время ограничено, в том числе из-за риска тератогенного эффекта37, в базе данных LiverTox отсутствуют сведения об этом препарате. По данным крупного японского наблюдательного исследования значимые изменения биохимических показателей функции печени на фоне терапии фавипиравиром наблюдались у 7,2% пациентов с COVID-19 (182/2532) [15], эта НР по частоте наблюдений оказалась на втором месте после повышения уровня мочевой кислоты в сыворотке крови. В отечественном рандомизированном исследовании эффективности и безопасности фавипиравира при COVID-19 повышение активности АЛТ наблюдалось у 31,5% пациентов (38/108) [16]. В проведенном нами исследовании максимальная за период госпитализации активность АЛТ у пациентов, получавших фавипиравир, составила 74,7±7,2 EД/л; у 28,6% (82/287) пациентов, получавших фавипиравир, активность АЛТ была выше 2 верхних границ нормы (ВГН), а у 8,4% (24/287) — выше 5 ВГН при максимальной 1247 ЕД/л.
Наиболее частой НР при применении ремдесивира (категория D по классификации LiverTox) по информации базы данных по безопасности ЛП ВОЗ — VigiBase (21,2% всех отчетов)38 является повышение активности АЛТ. У здоровых добровольцев, принимавших ремдесивир, повышение активности трансаминаз было выявлено в 14% случаев39. Повышение активности трансаминаз при парентеральном введении ремдесивира, вероятно, вызвано ингибированием митохондриальной РНК-полимеразы и прямым гепатотоксическим действием [17]. Первые случаи использования ремдесивира для лечения COVID-19 были сопряжены с опасениями развития серьезных НР, однако при более широком применении сообщалось лишь о редких случаях выраженного повышения активности АЛТ в сочетании с желтухой — преимущественно у пациентов, которые либо находились в критическом состоянии с полиорганной недостаточностью, сепсисом, либо получали другие потенциально гепатотоксичные препараты, такие как, например, амиодарон. В настоящее время считается, что повышение активности трансаминаз на фоне терапии ремдесивиром носит обратимый характер и редко приводит к тяжелому поражению печени40 [18]. Применение ремдесивира следует прекратить при активности АЛТ ≥5 ВГН41.
В конце 2020 г., первого года пандемии COVID-19, моноклональные антитела к интерлейкинам — ГИБП — стали играть роль доступного инновационного фармакологического средства для борьбы с цитокиновым штормом при прогрессировании системного воспаления и нарастании степени тяжести дыхательной недостаточности42. Потребление ГИБП в стационаре в 2022 г., по данным листов назначений, выросло почти в 7 раз по сравнению с 2020 г. (24,02 и 3,53 СД/100 пациентов соответственно). Большинство ГИБП вводят однократно, при необходимости возможно повторное применение. ГИБП были назначены в 26,3% (329/1250) случаев, из них 14 пациентов получали по 2 ГИБП. Максимальная активность АЛТ за период госпитализации у пациентов, получающих ГИБП, по данным нашего исследования, составила 106,9±5,5 EД/л. У 59,3% (195/329) пациентов, получавших ГИБП, активность АЛТ была выше 2 ВГН и у 16,7% (55/329) — выше 5 ВГН (максимальная — 887 ЕД/л). Такие высокие показатели активности АЛТ у пациентов, получающих ГИБП, могут быть связаны с более тяжелым течением COVID-19.
Тоцилизумаб применялся в 2020 и 2021 гг. (2,1 и 4,0 СД/100 пациентов соответственно), а сарилумаб — только в 2021 г. (1,4 СД/100 пациентов). В предрегистрационных исследованиях повышение активности трансаминаз наблюдалось у 10–50% пациентов с ревматоидным артритом, получавших тоцилизумаб43. Активность АЛТ, как правило, превышала 1–3 ВГН через 2 нед. после каждого введения препаратов тоцилизумаб и сарилумаб и снижалась до исходного уровня через 4 нед., ко времени следующего введения. В некоторых случаях (~1–2%) активность АЛТ превышала 5 ВГН, что требовало отмены этих препаратов, однако это не сопровождалось желтухой и печеночной недостаточностью [19]. После регистрации и выхода тоцилизумаба на фармацевтический рынок стали появляться единичные сообщения о клинически выраженном поражении печени с желтухой, в том числе с летальным исходом по крайней мере в одном случае44 (препарат отнесен к категории С по классификации LiverTox). У пациентов с COVID-19 также сообщалось о повышении активности трансаминаз на фоне терапии тоцилизумабом, не сопровождавшемся развитием желтухи и тяжелой печеночной недостаточности [20][21].
В предрегистрационных клинических исследованиях препарата сарилумаб (категория Е по классификации LiverTox) повышение активности АЛТ >3 ВГН наблюдалось у 4–5% пациентов основной группы по сравнению с 1% пациентов, получавших плацебо. Несмотря на высокую частоту повышения активности печеночных ферментов на фоне терапии сарилумабом, не было выявлено случаев клинически выраженного поражения печени, а большинство случаев повышения активности трансаминаз были обратимы и бессимптомны45.
Отечественные ГИБП олокизумаб и левилимаб были зарегистрированы в Российской Федерации в начале пандемии COVID-19 — в мае и июне 2020 г.46 По данным листов назначений их потребление выросло с 1,1 и 0,3 СД/100 пациентов в 2020 г. до 12,9 и 11,1 СД/100 пациентов в 2022 г. соответственно. Повышение активности АЛТ на фоне терапии олокизумабом и левилимабом возможно у ≥10% пациентов, повышение активности аспарагиновой трансаминазы (АСТ), уровня билирубина — у 1–10%, холелитиаз (олокизумаб) и токсический гепатит (левилимаб) наблюдаются у 0,1–1,0% пациентов47.
Согласно инструкции по медицинскому применению прием олокизумаба следует прекратить при следующих условиях: повышении активности АСТ или АЛТ >8 ВГН вне зависимости от срока, прошедшего после инъекции препарата, уровня общего билирубина и сопутствующей симптоматики; повышении активности АСТ или АЛТ >5 ВГН в течение ≥2 нед. после инъекции независимо от уровня общего билирубина и сопутствующей симптоматики; повышении активности АСТ или АЛТ >3 ВГН и уровня общего билирубина >2 ВГН; повышении уровня АСТ или АЛТ >3 ВГН, сопровождающемся симптомами поражения печени (усталость, тошнота, рвота, болезненность в верхнем правом квадранте живота, лихорадка или сыпь). Прием левилимаба следует прекратить при повышении активности АСТ или АЛТ >5 ВГН, а при активности АЛТ в пределах 3–5 ВГН временно отменить до достижения показателей <3 ВГН. Также при необходимости следует провести коррекцию дозы одновременно принимаемых препаратов, обладающих гепатотоксичным эффектом.
При отсутствии эффекта от введения ГИБП или при недоступности ГИБП в качестве альтернативной терапии системного воспаления или «цитокинового шторма» по жизненным показаниям решением врачебной комиссии пациентам назначали цитостатик циклофосфамид [8]. В качестве стандартной дозы циклофосфамида использовали рассчитанную по данным листов назначений среднюю курсовую дозу (СД) — 1 г. В проведенном нами исследовании потребление циклофосфамида в 2021 г. составило 3,2 СД/100 пациентов, в 2022 г. — 5,7 СД/100 пациентов (0,7% (9/1250) медицинских карт). У 78% пациентов (7/9) активность АЛТ была на уровне 149,0±38,9 ЕД/л, то есть >2 ВГН; у 56% (5/9) пациентов >5 ВГН (максимально 419 ЕД/л). Циклофосфамид оказывает прямое токсическое действие на синусоидальные клетки печени, вызывая их некроз, обструкцию и облитерацию печеночных вен. Повреждающее действие носит дозозависимый эффект, чаще развивается при внутривенном введении и может приводить к развитию острой печеночной недостаточности с летальным исходом48.
Барицитиниб, ингибитор янус-киназ, еще один препарат, снижающий воспалительный ответ у пациентов с COVID-19, назначался небольшому количеству пациентов (1,4% (18/1250) медицинских карт) в дозах, соответствующих DDD49 (0,3, 1,1 и 1,2 DDD/100 койко-дней в 2020, 2021 и 2022 гг. соответственно). В предрегистрационных исследованиях повышение активности трансаминаз наблюдалось у 17% пациентов с ревматоидным артритом, получавших барицитиниб, и у 11%, получавших плацебо. Транзиторное повышение активности трансаминаз редко превышало 3 ВГН и, как правило, не требовало отмены препарата50. Исследования эффективности и безопасности барицитиниба у пациентов с COVID-19 показали, что высокие уровни активности трансаминаз были в большей степени ассоциированы с тяжелым течением заболевания и одновременным приемом других гепатотоксичных препаратов [22].
НПВП известны не только развитием при их применении НР со стороны слизистой оболочки желудочно-кишечного тракта. Препараты этой группы могут вызывать поражения печени, варьирующие от бессимптомного повышения активности трансаминаз и гепатита с желтухой до молниеносной печеночной недостаточности и летального исхода [23]. Суммарное потребление НПВП (ацетилсалициловая кислота, кеторолак, кетопрофен) и антипиретика/анальгетика парацетамола в 2020, 2021 и 2022 гг. составило 34,9, 54,7 и 54,4 DDD/100 койко-дней соответственно.
Отметим, что ацетилсалициловая кислота по данным листов назначений пациентов с COVID-19 назначалась в низких дозах, рекомендованных при ее применении в качестве антиагреганта. У пациентов, получающих длительную терапию ацетилсалициловой кислотой (категория А по классификации LiverTox для высоких доз препарата) в умеренных или высоких дозах, часто наблюдается повышение активности АЛТ в сыворотке крови, которое может сопровождаться умеренным повышением щелочной фосфатазы и билирубина. Тяжелые случаи ЛПП наблюдаются при применении в дозах от 1800 до 3200 мг/сут (>100 мг/кг) и при уровнях салицилатов в плазме крови более 25 мг/ дл. Повышение активности печеночных ферментов на фоне применения ацетилсалициловой кислоты, как правило, протекает бессимптомно, но при приеме в высоких дозах могут возникать тошнота, анорексия, боль в животе и даже признаки энцефалопатии и печеночной дисфункции (гипераммониемия и коагулопатия). В случае приема высоких доз ацетилсалициловой кислоты на фоне системного вирусного заболевания возможно развитие синдрома Рея, связанного с митохондриальной дисфункцией [24].
Частота применения ацетилсалициловой кислоты в проведенном исследовании была довольно низкой (3,9% (49/1250) проанализированных медицинских карт), что не соответствовало высокому уровню потребления препарата по данным выдачи в отделения: 23,3, 16,9 и 36,6 DDD/100 койко-мест в 2020, 2021 и 2022 гг. соответственно при том, что DDD для ацетилсалициловой кислоты как антиагреганта — 1 таблетка независимо от дозы51. Отмеченный уровень потребления препарата предположительно мог быть связан с его ситуационным применением в качестве жаропонижающего средства, не фиксировавшимся в листах назначений.
Кетопрофен (категория С по классификации LiverTox) и кеторолак (категория Е по классификации LiverTox) назначались в качестве жаропонижающих средств и анальгетиков в 3,4% (42/1250) и 3,0% (38/1250) случаях соответственно, но их объем потребления по данным ATC/DDD анализа был выше (0,12, 0,8 и 3,7 DDD/100 койко-дней для кетопрофена, 3,8, 32,9 и 8,5 DDD/100 койко-дней для кеторолака в 2020, 2021 и 2022 гг. соответственно). Данные проспективных исследований показывают, что у 1–2% пациентов, принимавших кетопрофен, и до 1% пациентов, принимавших кеторолак, наблюдалось транзиторное повышение активности трансаминаз, причем эти показатели могут снизиться до нормы даже при продолжении приема препарата. Выраженное повышение активности трансаминаз наблюдается менее чем у 1% пациентов, клинически выраженное повреждение печени с желтухой при приеме кетопрофена встречается очень редко, были опубликованы только сообщения об отдельных случаях52. Механизм повреждения печени на фоне приема этих препаратов неизвестен.
Антипиретик и анальгетик парацетамол (ацетаминофен) назначался в дозе 500 мг или 1000 мг 3 раза/сут (с пометкой в листе назначения «при повышении температуры») в 36,4% (455/1250) случаев в дозах, соответствующих DDD — 3 г53. Потребление препарата составило 3,0, 4,1 и 10,3 DDD/100 койко-дней в 2020, 2021 и 2022 гг. соответственно. Гепатотоксичность парацетамола хорошо изучена, разовая токсическая доза при нормальной функции печени для взрослых составляет 10 г, однако описаны случаи тяжелого поражения печени и при более низких дозах [24–26].
В процессе метаболизма в организме парацетамол преимущественно образует в печени нетоксичные глюкуронатные или сульфатные конъюгаты и выделяется с мочой. Незначительное количество парацетамола метаболизируется через систему цитохрома Р450 с образованием промежуточных продуктов, которые могут быть токсичными, в частности N-ацетил-п-бензохинонимина. Обычно этот промежуточный продукт быстро конъюгируется с восстановленным глутатионом и выводится из организма, однако если уровень глутатиона низкий или этот путь перегружен высокими дозами парацетамола, токсические метаболиты накапливаются и могут повреждать клетки печени. Антидотом при отравлении парацетамолом является ацетилцистеин, предшественник глутатиона [24]. Ацетилцистеин широко применялся у пациентов с COVID-19 в качестве отхаркивающего муколитического средства (46,1% (576/1250) случаев), в том числе внутривенно (58,0% (334/576) случаев), что могло снизить риск развития ЛПП у пациентов, принимающих высокие дозы парацетамола.
Среди сердечно-сосудистых средств, применявшихся у пациентов с COVID-19, препаратами с наиболее изученной гепатотоксичностью являются амиодарон и аторвастатин (отнесены к категории А по классификации LiverTox). По данным проведенного исследования потребление этих препаратов существенно выросло в 2022 г. (амиодарон 7,5 и аторвастатин 46,2 DDD/100 койко-дней в 2022 г., 1,5 и 28,3 DDD/100 койко-дней в 2021 г. и 1,0 и 2,8 DDD/100 койко-дней в 2020 г. соответственно).
Амиодарон, как и ацетилсалициловая кислота, может вызывать синдром Рея у пациентов с вирусной инфекцией. При приеме амиодарона внутрь в низких дозах повышение активности трансаминаз отмечается редко, в основном при длительной терапии, и носит обратимый характер. Внутривенное введение амиодарона (именно этот путь введения использовался наиболее часто у пациентов с COVID-19) способно вызвать более серьезное поражение печени. Важно отметить, что механизм повреждения при внутривенном введении, вероятно, отличается от механизма при приеме внутрь, пациенты с острым повреждением печени после внутривенного применения амиодарона обычно могут переносить пероральную терапию без осложнений [27][28]. Однако повторное введение амиодарона внутривенно обычно сопровождается повторными проявлениями ЛПП54.
Аторвастатин метаболизируется в печени с помощью цитохрома CYР3A4 и выводится с желчью. Умеренное транзиторное повышение активности АЛТ, которое наблюдается у 1–3% пациентов55, связано, вероятно, с ингибированием ферментов печени и накоплением токсических продуктов метаболизма других лекарственных средств. Редкие случаи лекарственного гепатита и печеночной недостаточности при применении этого препарата предположительно имеют аутоиммунный характер [29].
Среди других сердечно-сосудистых средств, применявшихся у пациентов с COVID-19, потенциальной гепатотоксичностью могут обладать ингибиторы ангиотензинпревращающего фермента, метопролол и нифедипин [7].
ЗАКЛЮЧЕНИЕ
Проведенный анализ выявил высокую частоту назначений препаратов с ВР ЛПП при COVID-19 — объем потребления таких ЛП превышал 300 DDD/100 койко-дней в 2020 г. и 400 DDD/100 койко-дней в 2021 и 2022 гг. В 19,8% проанализированных медицинских карт обнаружена информация об одновременном назначении 5 и более препаратов ВР ЛПП. Часть этих препаратов включена в разделы по этиотропной и патогенетической терапии в российских рекомендациях по профилактике, диагностике и лечению COVID-19, применение других ЛП было направлено на лечение осложнений и сопутствующих заболеваний у пациентов с COVID-19. Выявлены случаи применения препаратов ВР ЛПП в дозах, превышающих DDD, указанных на сайте центра по методологии лекарственной статистики ВОЗ. Наиболее часто это было отмечено для омепразола (82,4% назначений) и левофлоксацина (100% назначений).
При применении ЛП с известной гепатотоксичностью, рекомендованных как для лечения COVID-19, так и для терапии сопутствующих заболеваний, в том числе вследствие межлекарственного взаимодействия, необходимо проводить анализ обоснованности назначений. Это позволит ограничить нерациональное и избыточное применение препаратов ВР ЛПП, в первую очередь антибиотиков, НПВП, ингибиторов протоновой помпы, и тем самым снизить риск развития ЛПП. При назначении таких препаратов этиотропной и патогенетической терапии с установленной гепатотоксичностью, как фавипиравир, ремдесивир, олокизумаб, левилимаб, барицитиниб, требуется тщательный контроль печеночных проб, депрескрайбинг других гепатотоксичных препаратов в случае полипрагмазии и изучение целесообразности применения гепатопротекторов. Пациентам, получавшим препараты ВР ЛПП в стационаре, после выписки следует рекомендовать мониторинг печеночных проб на амбулаторном этапе.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: В.И. Петров — дизайн исследования, редактирование и утверждение окончательного варианта рукописи для публикации; А.Ю. Рязанова и Н.С. Токарева — сбор и обработка данных медицинских карт, написание текста рукописи.
Соответствие принципам этики. Исследование проводилось в соответствии с этическими принципами медицинских исследований с участием человека, изложенными в Хельсинкской декларации. Проведение исследования было одобрено на заседании локального комитета по этике ВолгГМУ (протокол № 2021/085 от 24.12.2021).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Vladimir I. Petrov designed the study, edited the manuscript, and approved the final version for publication. Anastasia Yu. Ryazanova and Natalia S. Tokareva collected and processed data from medical records, drafted the manuscript, and approved the final version for publication.
Ethics approval. The study was conducted in accordance with the ethical principles for medical research involving human subjects described in the Declaration of Helsinki. The study was approved by the local ethics committee at the Volgograd State Medical University (Approval No. 2021/085 of 24 December 2021).
1. https://grls.rosminzdrav.ru/
2. LiverTox. Clinical and research information on drug-induced liver injury. https://www.ncbi.nlm.nih.gov/books/NBK547852/
3. https://www.vigiaccess.org/
4. https://www.ema.europa.eu/en/human-regulatory/research-development/pharmacovigilance/eudravigilance
5. Лекарственные поражения печени (ЛПП) у взрослых 2022–2023–2024. Клинические рекомендации. Министерство здравоохранения Российской Федерации; 2022.
6. https://livertox.nih.gov/Phenotypes_lact.html
7. Лекарственные поражения печени (ЛПП) у взрослых 2022–2023–2024. Клинические рекомендации. Министерство здравоохранения Российской Федерации; 2022.
Инструкции по медицинскому применению лекарственных препаратов левилимаб, олокизумаб, фавипиравир. https://grls.minzdrav.gov.ru/
8. Лекарственные поражения печени (ЛПП) у взрослых 2022–2023–2024. Клинические рекомендации. Министерство здравоохранения Российской Федерации; 2022.
9. The ATC/DDD Methodology. https://www.who.int/tools/atc-ddd-toolkit/methodology
10. ATC/DDD Index 2023. http://www.whocc.no/atc_ddd_index/
11. Там же.
12. Там же.
13. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версия 17 (14.12.2022). Министерство здравоохранения Российской Федерации; 2022.
14. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версии 5–17. Министерство здравоохранения Российской Федерации; 2022.
15. Инструкция по медицинскому применению лекарственного препарата омепразол. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=1f929759-b209-4086-8223-ead3658b4df5
16. https://www.whocc.no/atc_ddd_index/?code=A02BC01
17. Инструкция по медицинскому применению лекарственного препарата омепразол. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=1f929759-b209-4086-8223-ead3658b4df5
18. LiverTox. Clinical and research information on drug-induced liver injury. https://www.ncbi.nlm.nih.gov/books/NBK547852/
19. https://www.whocc.no/atc_ddd_index/?code=J01DD04
20. Там же.
21. https://www.whocc.no/atc_ddd_index/?code=J01MA12
22. Инструкция по медицинскому применению лекарственного препарата левофлоксацин. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=32bb468a-b628-493f-ba07-fd3e4820e682
23. https://www.whocc.no/atc_ddd_index/?code=J01FA10
24. LiverTox. Clinical and research information on drug-induced liver injury. https://www.ncbi.nlm.nih.gov/books/NBK547852/
25 https://www.whocc.no/atc_ddd_index/?code=J01DH02
https://www.whocc.no/atc_ddd_index/?code=J01DD12
https://www.whocc.no/atc_ddd_index/?code=J01CA04
https://www.ncbi.nlm.nih.gov/books/NBK548517/
26. Инструкция по медицинскому применению лекарственного препарата цефоперазон+сульбактам. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=9ca9b3c7-68da-4fcc-9318-6f1f5b482098
27. Инструкция по медицинскому применению лекарственного препарата метронидазол. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=a7a880cc-f3b5-414e-af26-58dcd4f2b44d
28. LiverTox. Clinical and Research Information on Drug-Induced Liver Injury. https://www.ncbi.nlm.nih.gov/books/NBK547852/
29. Инструкция по медицинскому применению лекарственного препарата флуконазол. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=a0717ea4-5054-4872-a443-fe4fcf273197
30. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версии 5–7. Министерство здравоохранения Российской Федерации; 2020.
31. Инструкция по медицинскому применению лекарственного препарата лопинавир+ритонавир. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=bacd66ac-4527-41a4-814b-2fd451615da1
32. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версии 5–7. Министерство здравоохранения Российской Федерации; 2020.
33. Инструкция по медицинскому применению лекарственного препарата интерферон бета-1b. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=3c066a97-582e-42aa-81e1-974e737aa445
34. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версия 17 (14.12.2022). Министерство здравоохранения Российской Федерации; 2022.
35. https://www.whocc.no/atc_ddd_index/?code=J05AX27
36. https://www.whocc.no/atc_ddd_index/?code=J05AB16
37. https://www.covid19treatmentguidelines.nih.gov/
38. https://www.vigiaccess.org/
39. Инструкция по медицинскому применению лекарственного препарата ремдесивир. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f7245c50-4c3c-475f-a8d6-84645b10f529
40. LiverTox. Clinical and Research Information on Drug-Induced Liver Injury. https://www.ncbi.nlm.nih.gov/books/NBK547852/
41. Инструкция по медицинскому применению лекарственного препарата ремдесивир. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f7245c50-4c3c-475f-a8d6-84645b10f529
42. https://www.covid19treatmentguidelines.nih.gov/
43 LiverTox. Clinical and research information on drug-induced liver injury. https://www.ncbi.nlm.nih.gov/books/NBK547852/
44. Там же.
45. Там же.
46. https://grls.rosminzdrav.ru/
47. Инструкция по медицинскому применению лекарственного препарата олокизумаб. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=ba173fe9-fa80-4763-9cab-7c7538ab71df
Инструкция по медицинскому применению лекарственного препарата левилимаб. https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=956e39c1-27da-4a27-bc96-bde212beabad
48. LiverTox. Clinical and research information on drug-induced liver injury. https://www.ncbi.nlm.nih.gov/books/NBK547852/
49. https://www.whocc.no/atc_ddd_index/?code=L04AA37
50. LiverTox. Clinical and research information on drug-induced liver injury. https://www.ncbi.nlm.nih.gov/books/NBK547852/
51. https://www.whocc.no/atc_ddd_index/?code=B01AC06
52. LiverTox. Clinical and research information on drug-induced liver injury. https://www.ncbi.nlm.nih.gov/books/NBK548678/
53. https://www.whocc.no/atc_ddd_index/?code=N02BE01
54. Там же.
55. Там же.
Список литературы
1. Xie H, Zhao J, Lian N, Lin S, Xie Q, Zhuo H. Clinical characteristics of non-ICU hospitalized patients with coronavirus disease 2019 and liver injury: a retrospective study. Liver Int. 2020;40(6):1321–6. https://doi.org/10.1111/liv.14449
2. Fan Z, Chen L, Li J, Cheng X, Yang J, Tian C, et al. Clinical features of COVID-19-related liver functional abnormality. Clin Gastroenterol Hepatol. 2020;18(7):1561–6. https://doi.org/10.1016/j.cgh.2020.04.002
3. Yadav DK, Singh A, Zhang Q, Bai X, Zhang W, Yadav RK, et al. Involvement of liver in COVID-19: systematic review and meta-analysis. Gut. 2021;70(4):807–9. https://doi.org/10.1136/gutjnl-2020-322072
4. Pazgan-Simon M, Serafińska S, Kukla M, Kucharska M, Zuwała-Jagiełło J, Buczyńska I, et al. Liver injury in patients with COVID-19 without underlying liver disease. J Clin Med. 2022;11(2):308. https://doi.org/10.3390/jcm11020308
5. Olry A, Meunier L, Délire B, Larrey D, Horsmans Y, Le Louët H. Drug-induced liver injury and COVID-19 infection: the rules remain the same. Drug Saf. 2020;43(7):615–17. https://doi.org/10.1007/s40264-020-00954-z
6. Sodeifian F, Seyedalhosseini ZS, Kian N, Eftekhari M, Najari S, Mirsaeidi M, et al. Drug-induced liver injury in COVID-19 patients: a systematic review. Front Med (Lausanne). 2021;8:731436. https://doi.org/10.3389/fmed.2021.731436
7. Ивашкин ВТ, Барановский АЮ, Райхельсон КЛ, Пальгова ЛК, Маевская МВ, Кондрашина ЭА и др. Лекарственные поражения печени (клинические рекомендации для врачей). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019;29(1):101–31. https://doi.org/10.22416/1382-4376-2019-29-1-101-131
8. Цветов ВМ, Бурашникова ИС, Сычев ДА, Поддубная ИВ. Возможность и перспективы применения препаратов из группы цитостатиков у пациентов с COVID-19 на примере циклофосфамида. Фарматека. 2021;28(1):10–3. https://doi.org/10.18565/pharmateca.2021.1.10-13
9. Björnsson ES. Drug-induced liver injury: an overview over the most critical compounds. Arch Toxicol. 2015;89(3):327–34. https://doi.org/10.1007/s00204-015-1456-2
10. Буеверов АО, Богомолов ПО, Буеверова ЕЛ. Гепатотоксичность антибактериальных препаратов в терапевтической практике. Клиническая микробиология и антимикробная химиотерапия. 2015;17(3):207–16. EDN: UHPUXJ
11. deLemos AS, Ghabril M, Rockey DC, Gu J, Barnhart HX, Fontana RJ, et al. Amoxicillin-clavulanate-induced liver injury. Dig Dis Sci. 2016;61(8):2406–16. https://doi.org/10.1007/s10620-016-4121-6
12. Katarey D, Verma S. Drug-induced liver injury. Clin Med (Lond). 2016;16(Suppl. 6):s104-s109. https://doi.org/10.7861/clinmedicine.16-6-s104
13. Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. A trial of lopinavir–ritonavir in adults hospitalized with severe Covid-19. N Engl J Med. 2020;382(19):1787–99. https://doi.org/10.1056/NEJMoa2001282
14. Fontana RJ, Hayashi P, Bonkovsky HL, Kleiner DE, Kochhar S, Gu J, Ghabril M. Presentation and outcomes with clinically apparent interferon beta hepatotoxicity. Dig Dis Sci. 2013;58(6):1766–75. https://doi.org/10.1007/s10620-012-2553-1
15. Tsuzuki S, Hayakawa K, Dоi Y, Shinozaki T, Uemura Y, Matsunaga N, et al. Effectiveness of favipiravir on nonsevere, early-stage COVID-19 in Japan: a large observational study using the COVID-19 Registry Japan. Infect Dis Ther. 2022;11(3):1075–87. https://doi.org/10.1007/s40121-022-00617-9
16. Руженцова ТА, Чухляев ПВ, Хавкина ДА, Гарбузов АА, Плоскирева АА, Осешнюк РА и др. Эффективность и безопасность применения фавипиравира в комплексной терапии COVID-19 легкого и среднетяжелого течения. Инфекционные болезни: новости, мнения, обучение. 2020;9(4):26–38. https://doi.org/10.33029/2305-3496-2020-9-4-26-38
17. Bjork JA, Wallace KB. Remdesivir; molecular and functional measures of mitochondrial safety. Toxicol Appl Pharmacol. 2021;433:115783. https://doi.org/10.1016/j.taap.2021.115783
18. Петров ВИ, Рязанова АЮ, Привальцева НС, Некрасов ДА. Опыт применения ремдесивира для лечения новой коронавирусной инфекции. Безопасность и риск фармакотерапии. 2022;10(4):365–80. https://doi.org/10.30895/2312-7821-2022-10-4-365-380
19. Emery P, Rondon J, Parrino J, Lin Y, Pena-Rossi C, van Hoogstraten H, et al. Safety and tolerability of subcutaneous sarilumab and intravenous tocilizumab in patients with rheumatoid arthritis. Rheumatology (Oxford). 2019;58(5):849–58. https://doi.org/10.1093/rheumatology/key361
20. Serviddio G, Villani R, Stallone G, Scioscia G, Foschino-Barbaro MP, Lacedonia D. Tocilizumab and liver injury in patients with COVID-19. Therap Adv Gastroenterol. 2020;13:1756284820959183. https://doi.org/10.1177/1756284820959183
21. Ortiz GX, Lenhart G, Becker MW, Schwambach KH, Tovo CV, Blatt CR. Drug-induced liver injury and COVID-19: a review for clinical practice. World J Hepatol. 2021;13(9):1143–53. https://doi.org/10.4254/wjh.v13.i9.1143
22. Jorgensen SCJ, Tse CLY, Burry L, Dresser LD. Baricitinib: a review of pharmacology, safety, and emerging clinical experience in COVID-19. Pharmacotherapy. 2020;40(8):843–56. https://doi.org/10.1002/phar.2438
23. Sriuttha P, Sirichanchuen B, Permsuwan U. Hepatotoxicity of nonsteroidal anti-inflammatory drugs: a systematic review of randomized controlled trials. Int J Hepatol. 2018;2018:5253623. https://doi.org/10.1155/2018/5253623
24. Schrör K. Aspirin and Reye syndrome: a review of the evidence. Paediatr Drugs. 2007;9(3):195–204. https://doi.org/10.2165/00148581-200709030-00008
25. Dart RC, Erdman AR, Olson KR, Christianson G, Manoguerra AS, Chyka PA, et al. Acetaminophen poisoning: an evidence-based consensus guideline for out-of-hospital management. Clin Toxicol (Phila). 2006;44(1):1–18. https://doi.org/10.1080/15563650500394571
26. Park BK, Dear JW, Antoine DJ. Paracetamol (acetaminophen) poisoning. BMJ Clin Evid. 2015;2015:2101. PMID: 26479248
27. Tsuda T, Tada H, Tanaka Y, Nishida N, Yoshida T, Sawada T, et al. Amiodarone-induced reversible and irreversible hepatotoxicity: two case reports. J Med Case Rep. 2018;12(1):95. https://doi.org/10.1186/s13256-018-1629-8
28. Babatin M, Lee SS, Pollak PT. Amiodarone hepatotoxicity. Curr Vasc Pharmacol. 2008;6(3):228–36. https://doi.org/10.2174/157016108784912019
29. Pelli N, Setti M, Ceppa P, Toncini C, Indiveri F. Autoimmune hepatitis revealed by atorvastatin. Eur J Gastroenterol Hepatol. 2003;15(8):921–4. https://doi.org/10.1097/00042737-200308000-00014
Об авторах
В. И. ПетровРоссия
Петров Владимир Иванович, академик РАН, д-р мед. наук, профессор
Площадь Павших Борцов, д. 1, Волгоград, 400131
А. Ю. Рязанова
Россия
Рязанова Анастасия Юрьевна, канд. мед. наук
Площадь Павших Борцов, д. 1, Волгоград, 400131
Н. С. Токарева
Россия
Токарева Наталья Сергеевна
Площадь Павших Борцов, д. 1, Волгоград, 400131
Дополнительные файлы
Рецензия
Для цитирования:
Петров В.И., Рязанова А.Ю., Токарева Н.С. Анализ потребления препаратов с высоким риском развития лекарственного поражения печени при COVID-19. Безопасность и риск фармакотерапии. 2024;12(3):268-284. https://doi.org/10.30895/2312-7821-2024-396
For citation:
Petrov V.I., Ryazanova A.Yu., Tokareva N.S. Analysis of the Consumption of Medicinal Products Associated with a High Risk of Drug-Induced Liver Injury in Patients with COVID-19. Safety and Risk of Pharmacotherapy. 2024;12(3):268-284. (In Russ.) https://doi.org/10.30895/2312-7821-2024-396




































