Перейти к:
Доклинические исследования офтальмотоксичности лекарственных средств: обзор регуляторных подходов и методов исследования
https://doi.org/10.30895/2312-7821-2025-406
Резюме
ВВЕДЕНИЕ. Оценка офтальмотоксичности потенциальных лекарственных средств является высокоинформативным элементом доклинических исследований, раскрывающим механизмы действия и фармакологические эффекты химического соединения на орган зрения при местном и системном применении. Однако единый алгоритм оценки офтальмотоксичности в настоящее время отсутствует, что свидетельствует о целесообразности изучения и обобщения российского и зарубежного опыта.
ЦЕЛЬ. Разработка алгоритма оценки офтальмотоксичности лекарственных препаратов в доклинических исследованиях in vivo на основе российских и международных рекомендаций.
ОБСУЖДЕНИЕ. Проведен анализ подходов к изучению офтальмотоксичности химических соединений в российских и международных нормативных документах (Руководство по проведению доклинических исследований лекарственных средств, ГОСТ 34658-2020, Руководство Организации экономического сотрудничества и развития (OECD) № 450 и № 263). Показано, что рекомендуемые методы применимы в доклинических исследованиях лекарственных препаратов и позволяют изучать влияние химических соединений на структуру (офтальмоскопия, биомикроскопия, оптическая когерентная томография) и функциональные параметры (электроретинография) глаза. Представлена основная информация о сравнительной анатомии и физиологии органа зрения мышей, крыс и кроликов, имеющая значение при исследовании раздражающего глаза и ретинотоксического эффектов и трансляции результатов в клинические исследования. Приведено содержательное описание методов исследования офтальмотоксичности и особенностей их практического применения у основных видов лабораторных животных с учетом особенностей их анатомии и физиологии. В результате обобщения изученных данных предложен комплексный дифференциальный подход к исследованию офтальмотоксичности разрабатываемых лекарственных препаратов.
ВЫВОДЫ. Предложенный алгоритм оценки токсического действия на глаза лекарственных препаратов как для офтальмологического, так и системного применения позволяет оптимизировать дизайн и сроки проведения доклинических исследований с использованием лабораторных животных и повысить безопасность применения препаратов у человека.
Ключевые слова
Для цитирования:
Науменко Л.В., Говорова Ю.А., Таран А.С. Доклинические исследования офтальмотоксичности лекарственных средств: обзор регуляторных подходов и методов исследования. Безопасность и риск фармакотерапии. 2025;13(4):411-425. https://doi.org/10.30895/2312-7821-2025-406
For citation:
Naumenko L.V., Govorova Yu.A., Таrаn A.S. Preclinical Ophthalmotoxicity Studies of Medicinal Products: a Review of Regulatory Approaches and Research Methods. Safety and Risk of Pharmacotherapy. 2025;13(4):411-425. (In Russ.) https://doi.org/10.30895/2312-7821-2025-406
ВВЕДЕНИЕ
Лекарственные средства наряду с лечебным эффектом могут оказывать нежелательное действие на различные ткани и органы, в том числе на глаза [1][2]. Офтальмологические расстройства возникают в результате как местного, так и системного (особенно длительного) применения лекарственных средств [3–6], однако лишь немногие способны вызывать выраженные или необратимые нарушения зрения [7][8]. Например, топическое применение сульфаниламидов может вызывать отек цилиарного тела и привести к развитию закрытоугольной глаукомы. Местно назначаемые адренергические средства, некоторые бета-2-адреномиметики и антихолинергические средства способны вызывать расширение зрачков и провоцировать развитие закрытоугольной глаукомы. Антибактериальные препараты (тетрациклины, хинолоны), антиаритмические препараты (амиодарон, хинидин), диуретики (фуросемид, тиазиды), алпразолам, противогрибковые средства (гризеофульвин, итраконазол, вориконазол) и некоторые другие могут стать причиной развития фототоксических реакций. Глюкокортикоиды при системном, местном или интравитреальном введении повышают внутриглазное давление, что может привести к развитию глаукомы, кроме того, токсическое действие препаратов системного и местного применения может проявляться развитием помутнения хрусталика. Системное введение фенотиазинов или бусульфана вызывает катарактальные изменения в хрусталике [3].
Многие системные препараты достигают сетчатки через сосудистое русло. Аминохинолины вызывают характерную макулопатию по типу «бычьего глаза». Фенотиазины связываются с гранулами меланина и могут приводить к тяжелой фототоксической ретинопатии. Типичная тамоксифеновая ретинопатия проявляется кристаллическими отложениями во внутренних слоях сетчатки. У некоторых пациентов, получавших ретиноиды, снижается ночное зрение и нарушается адаптация к темноте [3].
Перед назначением препаратов системного действия рекомендуется проведение офтальмологического осмотра и/или изучение офтальмологического анамнеза пациентов, особенно это актуально для ретинотоксических препаратов [9–12]. Следует подчеркнуть, что местно и системно вводимые лекарственные средства способны оказывать как прямое, так и опосредованное офтальмотоксическое действие через поражение проводящих путей зрительного анализатора, подкорковых ядер и зрительной коры [13].
Распространенность офтальмотоксических реакций при местном и системном применении лекарственных препаратов определяет целесообразность проведения исследований офтальмотоксичности в рамках доклинической оценки их безопасности [9]. Для этого используют различные методы: от изучения выживаемости клеток культуры тканей роговичного эпителия до оценки ретинотоксичности препарата in vivo с помощью in vitro комплекса современных методов диагностики: электроретинографии (ЭРГ), оптической когерентной томографии (ОКТ), OКT-ангиографии (ОКТ-А) [14–16] и др. Однако единый алгоритм оценки офтальмотоксичности разрабатываемых лекарственных препаратов в доклинических исследованиях в настоящее время отсутствует. В данной работе выполнена попытка структурированного описания современных методов исследования офтальмотоксичности на моделях с использованием лабораторных животных.
Цель работы — формирование алгоритма оценки офтальмотоксичности лекарственных препаратов в доклинических исследованиях in vivo на основе российских и международных рекомендаций.
Поиск информации проводили в библиографических базах данных PubMed, Scopus, eLIBRARY.RU, КиберЛенинка, поисковой системе Google Scholar по ключевым словам: офтальмотоксичность / ophthalmotoxicity, глаз / eye, токсическое действие на глаза / toxic effect on the eyes, доклиническое исследование / preclinical study, нежелательное действие / adverse effect, офтальмоскопия / ophthalmoscopy, внутриглазное давление / intraocular pressure, элекроретинограмма / electroretinogram, лабораторные животные / laboratory animals. Анализировали полнотекстовые статьи (67 оригинальных работ) на русском или английском языках, опубликованные в период 2000–2024 гг., относящиеся к следующим типам: метаанализы, систематические обзоры, рандомизированные клинические исследования, описания клинических случаев, доклинические/экспериментальные исследования, обзорные статьи. Повторяющиеся работы из обзора исключали. Изучены также релевантные международные, российские и европейские рекомендации и официальные руководства по исследованию раздражающего/разъедающего действия веществ на глаза.
ОСНОВНАЯ ЧАСТЬ
Особенности оценки офтальмотоксичности у лабораторных животных
Лекарственные средства, инстиллируемые в конъюнктивальную полость, могут подвергаться системной абсорбции в объеме 70–80%, при этом биодоступность препарата (концентрация в передней камере глаза) не превышает 5% от введенной дозы [17]. У лабораторных животных (кроликов, крыс, мышей и др.) соотношение «доза введенного препарата — масса тела» выше, чем у человека, и, несмотря на более редкую частоту моргания (с каждым морганием препарат выводится из конъюнктивальной полости вместе со слезой), у лабораторных животных могут развиваться более серьезные системные побочные эффекты [18].
Биодоступность лекарственного средства (активного соединения) находится в прямой зависимости от скорости оттока внутриглазной жидкости, то есть клиренса препарата. При изучении офтальмотоксичности препаратов, вводимых интравитреально, следует учитывать физиологические особенности каждого вида. У человека и кролика близкие значения скорости оттока внутриглазной жидкости (2,8 и 2,7 мл/мин соответственно) и ее среднего объема (310 и 287 мл соответственно) [18]. У крыс и мышей эти показатели ниже в 10 раз. Особенностями строения глаз грызунов, в отличие от других лабораторных животных, является анатомическое соотношение объемов хрусталика и стекловидного тела к размеру глазного яблока: у грызунов хрусталик занимает около 70% объема глаза, тогда как у человека, минипигов и кроликов около 55% объема глаза приходится на стекловидное тело [19].
Глаз является единственным органом, внутреннее строение которого доступно для прижизненного осмотра в исследовании токсичности потенциальных лекарственных средств. Среди лабораторных животных, используемых для изучения ретинотоксичности, наибольшую ценность представляют обезьяны, так как строение макулы у них имеет наибольшее конвергентное сходство с человеком. У приматов, например, может развиваться друзеноидная макулопатия, схожая с дегенерацией сетчатки у человека [13, 20]. Однако из-за высокой стоимости и сложности содержания нечеловеческих приматов, а также этических аспектов использование данных видов лабораторных животных ограничено [21].
Наличие мигательной перепонки или третьего века у млекопитающих, которая отсутствует у человека и приматов, следует учитывать при оценке раздражающего действия на глаза или влияния соединения на слезопродукцию [18]. Воспаленная мигательная перепонка может имитировать гиперемию конъюнктивы или, наоборот, маскировать поражение глазной поверхности. Роговица крысы, мыши и кролика занимает бóльшую площадь передней поверхности глаза по сравнению с глазом человека [22]. При выборе животных для изучения офтальмотоксичности следует учитывать способность некоторых препаратов, особенно для системного применения, связываться с меланином: у животных-альбиносов и животных с пигментированным глазным дном могут быть разные проявления ретинотоксичности [13].
I. Perlman (2009) при изучении офтальмотоксичности рекомендует проводить тестирование как при системном, так и при интравитреальном/субконъюнктивальном введении препарата на двух видах лабораторных животных в связи с возможными особенностями проявлений токсичности, при этом объем проводимых исследований, по мнению автора, следует определять исходя из потребностей экспериментаторов [21].
При исследовании офтальмотоксичности наиболее часто используются крысы-альбиносы, которые из-за отсутствия меланина склонны к развитию атрофии сетчатки, вызванной фотоповреждением [13][20]. У крыс-альбиносов при офтальмоскопии хорошо визуализируются сосудистые сети сетчатки и хориоидеи. При изучении офтальмотоксических эффектов соединений, имеющих сродство к меланину, следует учитывать возможность их накопления в слое пигментного эпителия сетчатки у крыс-неальбиносов, что может влиять на результаты исследований [20]. Аналогично у кроликов выраженность ретинотоксических эффектов гентамицина зависит от состояния пигментации глазного дна [21].
Крысы имеют холангиотический тип васкуляризации сетчатки: сосуды радиально отходят от диска зрительного нерва и равномерно распределяются по глазному дну без создания бессосудистой зоны в центральной области сетчатки, так как не имеют макулы [20]. Для адаптации к ночному образу жизни порядка 99% фоторецепторов крыс представлены палочками, что необходимо учитывать при проведении ЭРГ, так как амплитуды волн скотопической электроретинограммы будут преобладать над фотопическим ответом [21].
Кролики имеют бóльшую площадь конъюнктивы, видимую в просвете глазной щели, по сравнению с нечеловеческими приматами, что следует учитывать при оценке раздражающего действия препаратов на глаза [18]. При гистологическом исследовании энуклеированных глазных яблок у кроликов были обнаружены физиологические передние синехии, что в некоторых участках приводило к органической блокаде угла передней камеры [22]. У кроликов мерангиотический тип кровоснабжения сетчатки с билатеральным выходом сосудов из диска зрительного нерва по горизонтальному меридиану по ходу расположения миелинизированных проминирующих в стекловидное тело пучков нервных волокон. Из-за неразвитой сосудистой сети сетчатки кроликов существуют ограничения экстраполяции данных о ретинотоксичности изучаемого соединения на человека. Диск зрительного нерва кроликов имеет дорсальное расположение (поэтому осмотр глазного дна кроликов удобней проводить в направлении снизу вверх), а также глубокую физиологическую экскавацию, которую трудно дифференцировать от глаукомной вследствие отсутствия развитой решетчатой пластинки. Тапетум у кроликов отсутствует [21].
Преимуществом использования мышей в доклинических исследованиях является доступность трансгенных и нокаутированных линий для изучения механизма действия соединений и их токсических эффектов [21].
Альтернативой грызунам и кроликам при исследовании офтальмотоксичности являются минипиги: помимо доступности, воспроизводимости, экономической составляющей содержания данного вида у минипигов возможно проведение всего комплекса исследований офтальмотоксичности, так как они имеют общие анатомические и функциональные показатели органа зрения, сопоставимые с таковыми у других лабораторных животных [24].
Таким образом, для получения корректных результатов оценки офтальмотоксического действия разрабатываемых лекарственных препаратов на структуры глаза необходимо выбрать метод и вид животного, в наибольшей степени подходящий для реализации цели исследования.
Основные методы диагностики при исследовании офтальмотоксичности
Оценка раздражающего глаза действия
Изучение офтальмотоксичности проводится на доклиническом и клиническом этапах исследования нового лекарственного препарата, а также при изучении воздействия на орган зрения растворов для очистки и хранения контактных линз, средств бытовой химии, аэрозолей, пестицидов, продуктов промышленного производства. Главным образом изучают раздражающее или повреждающее воздействие на роговицу и конъюнктиву глазного яблока. В Российской Федерации общепринятым методом исследования раздражающего действия на глаза является конъюнктивальная проба с однократным закапыванием препарата в глаз при изучении острой токсичности1 [25].
Для оценки раздражающего действия веществ на глаза в 1944 г. был разработан тест Дрейза [26]. Процедура включает в себя нанесение 0,5 мл раствора испытуемого вещества в нужной концентрации на один глаз обездвиженного находящегося в сознании животного после предварительной аналгезии. Контролем служит необработанный глаз. Вещество тестируется с помощью поэтапной процедуры с использованием на каждом этапе трех животных одного пола. Для тестирования, как правило, используются кролики-альбиносы, но возможно использование других животных [26].
В качестве альтернативы или частичной замены теста Дрейза, проводимого in vivo, Организацией экономического сотрудничества и развития (Organisation for Economic Co-operation and Development, OECD) предложено несколько методов тестирования in vitro. В руководстве OECD TG 405 (2023) по оценке раздражения/повреждения глаз химическими соединениями2 подробно описаны программа тестирования и подходы к анализу полученных данных. Этим документом руководствуется Европейское агентство по лекарственным средствам (European Medicines Agency, EMA)3.
В Российской Федерации и ряде других стран действует межгосударственный стандарт «Методы испытания по воздействию химической продукции на организм человека. Оценка раздражающего/разъедающего воздействия на глаза» (ГОСТ 34658-2020), который по структуре и методике исследования поражения глаз химическими веществами in vivo соответствует международному руководству OECD TG 405.
Стратегия последовательного испытания химических соединений (в том числе разрабатываемых лекарственных средств и их вспомогательных компонентов) для выявления раздражающего/разъедающего действия на глаза, согласно OECD TG 405 и ГОСТ 34658-2020, предполагает 8 этапов, которые подробно описаны в данных документах. В рамках данной стратегии для определения необходимости испытания на глазах in vivo предварительно необходимо изучить и оценить в совокупности всю доступную информацию о воздействии рассматриваемого вещества и его структурных аналогов с использованием анализа весомости доказательств (weight of evidence, WoE). Особое внимание уделяют имеющимся результатам исследований in vitro и ex vivo. Рекомендуется по возможности избегать исследований агрессивных веществ in vivo. Тестирование может быть прервано на любом этапе, если выявлено, что испытуемое вещество обладает высокой токсичностью, раздражающим или разъедающим действием (конечная точка исследования).
Следующим шагом в разработке нормативной базы для выявления раздражающего/разъедающего глаз действия химических веществ стал переход от стратегии последовательного тестирования (OECD TG 405) к новому интегрированному подходу (Integrated Approaches to Testing and Assessment, IATA), рекомендуемому в OECD GD 2634. Интегрированный подход (IATA) предполагает использование структурированных методов, позволяющих объединить и взвесить разные типы данных для идентификации и характеристики опасности для глаз и/или подтверждения безопасности вещества (группы веществ). Для этого используются данные исследований на людях и животных, результаты тестов in vitro и другие источники информации. Если стратегия последовательного тестирования (OECD TG 405) фокусировалась на оценке отдельных данных, то интегрированный подход (OECD GD 263) объединяет их для получения более точной и комплексной оценки опасности веществ (табл. 1, опубликована на сайте журнала5).
Согласно рекомендациям OECD GD 263 тестирование in vivo должно проводиться только после рассмотрения всей имеющейся информации об изучаемом соединении и его тестирования in vitro. На первом этапе проводится сбор и анализ сведений из литературы, баз данных и других надежных источников о физико-химических свойствах изучаемого вещества, случаях серьезного повреждения глаз у людей, результатах токсикологических исследований, о прогнозах in silico токсикологических характеристик этого вещества и др. Второй этап оценки опасности серьезного повреждения и раздражения глаз включает анализ опубликованных данных, полученных в исследованиях in vitro. Третий этап, включающий проведение испытаний на животных (OECD TG 405), предусмотрен только в случае отсутствия нежелательных эффектов после анализа всех данных, полученных на предыдущих этапах.
Эти три этапа, включающие 12 модулей, представлены как последовательность, но риск серьезных повреждений и/или раздражения глаз может быть выявлен на любом этапе, и порядок действий при этом может быть изменен.
Для реализации интегрированного подхода по оценке раздражающего/повреждающего действия веществ на глаза в OECD GD 263 представлены качественные характеристики источников информации (модули с 1 по 8), которые позволяют оценить весомость, объективность и применимость данных о свойствах исследуемого соединения или смеси (по принципу аддитивности ее компонентов). Характеристики включают в себя: категорию вещества, присваиваемую согласно глобальной согласованной системе по классификации и маркировке Организации Объединенных Наций (Globally Harmonized System for classification and labelling, UN GHS)6 исходя из данных, которые содержит научный источник; уровень валидности и принятия нормативных требований регулирующих органов, роль метода исследования в комплексной оценке раздражающего/повреждающего действия на глаза; описание метода тестирования; научную основу метода и механизм повреждающего действия вещества; доступность протокола исследования; сильные и слабые стороны метода; область применения и ограничения метода; прогностический уровень результатов исследования (чувствительность, специфичность, точность метода исследования); оценку внутрилабораторной и межлабораторной воспроизводимости результатов тестирования.
Далее согласно OECD GD 263 должна проводиться задокументированная и обоснованная «оценка весомости доказательств» (модуль 9) данных о раздражающем/повреждающем действии вещества на глаза, полученных из научных источников (модули 1–8). Уровень значимости их влияния на конечный вывод о свойствах исследуемого вещества следующий (от большего к меньшему): данные о раздражении/повреждении глаз у людей (модуль 1) > результаты тестирования на кроликах in vivo (OECD TG 405) и/или in vitro методами, одобренными OECD (модули 2 и 3 соответственно) > данные, полученные из экспериментов на животных или другими методами, не принятыми OECD (модули 4 и 5), информация о повреждающем действии на кожу (модуль 6), физико-химические свойства (модуль 7), данные, полученные нетестовым путем (модуль 8). Если проанализированные данные признаются весомыми, достоверными и актуальными и возможно сделать авторитетное заключение о наличии или отсутствии у изучаемого вещества повреждающего действия на глаза с присвоением ему определенной категории в соответствии с классификацией UN GHS, то дальнейшие испытания не требуются. В противном случае проводят этап 3 исследования вещества (модули 10–12) методами, предусмотренными IATA (табл. 1, опубликована на сайте журнала7).
Диагностические тесты in vivo, используемые в доклинических исследованиях, обладают высокой информативностью, однако для получения корректных результатов оценки токсического действия разрабатываемых лекарственных препаратов на структуры глаза необходимо выбрать метод и вид животного, в наибольшей степени подходящий для реализации цели исследования.
Измерение внутриглазного давления
Метод позволяет оценить способность изучаемого вещества повышать или понижать внутриглазное давление (ВГД) при местном применении, а также выявить его возможное системное действие. При проведении исследования глазных капель один глаз лабораторного животного является опытным, второй — контрольным, в том числе для исключения системной активности действующего вещества [27].
На данный момент существует несколько подходов к измерению ВГД у разных видов экспериментальных животных инвазивными и неинвазивными методами, и их перечень продолжает увеличиваться [28][29].
Инвазивные методы. Методики прямого определения ВГД связаны с канюлизацией глаза, и, следовательно, их недостатками являются необходимость применения анестезии и прокола глазного яблока. Необходимо соблюдать осторожность, чтобы избежать повреждения радужной оболочки, передней капсулы хрусталика, хрусталика или роговицы. Риск повреждения радужной оболочки может быть уменьшен с помощью местного применения мидриатиков, но это может повлиять на ВГД [30]. Проводимые манипуляции могут повлиять на уровень ВГД, а частота возможных измерений ограничена. Однако это способ измерить фактическое ВГД (истинное, а не тонометрическое), и разброс результатов измерений при этом меньше, чем при использовании неинвазивных методов [31].
В лабораторных условиях, когда одной из основных задач исследования является изучение фармакодинамических параметров потенциального антиглаукомного препарата, его влияние на биомеханические свойства роговицы, глубину передней камеры глаза оправданным будет измерение уровня ВГД методом прямой канюлизации [32].
Неинвазивные методы. В экспериментах на животных для измерения ВГД чаще используют неинвазивные тонометры, такие как аппланационный тонометр Гольдмана [33] и его переносные варианты [33–35], пневмотонометр [36] и другие ручные портативные тонометры.
Тонометр отскока или рикошета — единственный тонометр, специально разработанный для использования на грызунах (крысах, мышах). Позволяет измерять ВГД с помощью легкого металлического зонда, который прижимается к поверхности роговицы. Измерение ВГД у лабораторных животных, как правило, проводят с помощью отскоковой тонометрии, поскольку она неинвазивна, датчик контактирует с глазом только в течение очень короткого периода времени, ударяет с минимальной силой, тонометрию отскока можно проводить без анестезии роговицы и повторять неограниченное количество раз [31][29].
У большинства видов лабораторных животных, описываемых в данной статье, величина нормального ВГД составляет 15–25 мм рт. ст., а асимметрия его уровня между парными глазами может достигать 8 мм рт. ст. [37]. Однако эти данные несколько отличаются у разных авторов, например ВГД у крыс 17,30±5,25 мм рт. ст. [38], у кроликов 18,1±0,6 мм рт. ст. [39].
Тонометрия у находящихся в сознании животных при первоначальном воздействии с большой вероятностью вызовет страх и стрессовую реакцию, которые могут быть устранены только в результате нескольких тренировочных занятий. Оценка ВГД должна выполняться каждый раз в одно и том же время, так как ВГД колеблется в течение 24-часового цикла [31]. Скорость циркуляции внутриглазной жидкости непосредственно влияет на фармакокинетические параметры изучаемого соединения, ее необходимо учитывать при оценке суточных колебаний ВГД [18].
Офтальмологическая визуализация
Для изучения токсического действия соединений на структуры переднего отрезка глаза широко применяется биомикроскопия с помощью щелевой лампы. Для исследования у лабораторных животных удобнее применять портативные переносные модели, однако настольные биомикроскопы, как правило, имеют оптику лучшего качества, бóльшую вариативность ширины и ориентации щелевого луча. При интерпретации результатов биомикроскопии следует учитывать биологические особенности вида животного [37]. Например, у крыс линии Спрэг-Доули распространены фоновые патологии роговицы (рубцы, дистрофии, дегенерации), поэтому нивелирование их влияния на результаты исследования достигается путем рандомизации, чтобы особи с помутнениями роговицы были представлены во всех опытных группах. У таких видов, как кошки, собаки, кролики и грызуны, отсутствует боуменова мембрана, что влияет на проницаемость роговицы и концентрацию инстиллируемого соединения в передней камере глаза [18].
Обзор особенностей оценки результатов биомикроскопии с использованием щелевой лампы и их применимости в контексте современной офтальмологической токсикологии и разработки лекарственных средств, проведенный J.S. Eaton и соавт. [40], позволил выявить 138 оригинальных или модифицированных классификаций изменений структур переднего отрезка глаза. Авторы отметили, что для видов с пигментированными типом строения глаз, а также для собак, кошек, свиней, приматов системы оценки были недостаточно представлены в литературе (например, для последних отсутствует классификация хрусталиковых изменений). Присутствие меланина в радужке, цилиарном теле и сосудистой оболочке (внутриглазное депо для некоторых препаратов [41]) оказывает существенное влияние на фармакокинетику и фармакодинамику соединений. Поэтому авторы рекомендовали на доклиническом этапе оценки безопасности потенциальных лекарственных препаратов использовать хотя бы один вид лабораторных животных с пигментированными структурами глаза [40]. Для изучения токсических эффектов лекарственных средств, вводимых интравитреально, на сетчатку и зрительный нерв обоснованно выбирать такие виды лабораторных животных, которые имеют схожий с человеком объем стекловидного тела (4 мл), например кроликов [18].
Для осмотра глазного дна применяют прямую и обратную (непрямую) офтальмоскопию — технически простой, но весьма информативный метод исследования. Прямая офтальмоскопия и появившиеся позже бинокулярный непрямой офтальмоскоп, щелевая лампа и различные высокодиоптрийные асферические линзы позволяют получать изображения глазного дна in vivo [42], быстро оценивать состояние прозрачности глазных сред (развитие помутнений роговицы или хрусталика, гемофтальма), провести прямой осмотр артериовенозной системы, диска зрительного нерва, высокоспециализированной нервной ткани — сетчатки. Преимуществом прямой офтальмоскопии является возможность изучения глазного дна с сильным увеличением, чего нельзя добиться методом непрямого освещения.
Непрямая офтальмоскопия с помощью щелевой лампы позволяет визуализировать бóльшую поверхность сетчатки, включая крайнюю периферию [43]. Расширение функциональных возможностей щелевой лампы достигается посредством использования при работе с ней специальных офтальмологических линз различных типов. Использование асферических поверхностей в офтальмологических линзах, применение высокоэффективных просветляющих покрытий, внедрение в медицинскую практику лазерных микрохирургических установок, появление новых материалов привело к тому, что в настоящее время на мировом рынке офтальмологической аппаратуры представлена широчайшая гамма контактных и бесконтактных линз.
У животных разных биологических видов имеются различия в анатомии глазного дна, что следует учитывать при проведении офтальмоскопии и оценке ее результатов. Большинство лабораторных животных, за исключением приматов, не имеют макулы и фовеи [18]. Кошки и собаки имеют tapetum lucidum — светоотражающий слой для синего, зеленого и желтого цветов. У кроликов, которые благодаря сходным размерам глазного яблока довольно часто используются в экспериментах, сетчатка имеет значимые отличия от сетчатки человека (мерангиотический тип сетчатки, отсутствие макулярной области, иное распределение фоторецепторов различных типов, выраженная миелинизация нервных волокон в горизонтальной плоскости).
Существующие системы оценки состояния глаз с применением щелевой лампы (тест Дрейза, классификации Макдональда–Шеддака, Хакетта–Макдональда, оценка проявлений увеита (standardization of uveitis nomenclature, SUN) и др.) рассчитаны на кроликов-альбиносов, поэтому J.S. Eaton и соавт. [40] разработали собственную систему полуколичественной доклинической оценки офтальмотоксичности SPOTS (semiquantitative preclinical ocular toxicology scoring system). Авторы включили в данную систему расширенные критерии оценки состояния переднего и заднего отрезков глаза, стандартизированные настройки щелевой лампы, применимость у всего спектра видов лабораторных животных [44].
Наряду со щелевыми лампами для исследования и фотографирования различных участков глаза широко используются фундус-камеры. Фундус-камера дает возможность проводить мультиспектральную съемку и анализ изображения, флуоресцентную ангиографию и сравнительную оценку полученных данных в динамике (мониторинг), а также архивировать полученные данные [45][46].
Растущая доступность смартфонов и повышение качества встроенных в них цифровых камер в последнее десятилетие сделали возможной (и легкой) запись четких, детализированных фотографических изображений глазного дна. Офтальмоскопия с помощью смартфона стала реальной альтернативой традиционным подходам к визуализации глазного дна, особенно в местах с ограниченными ресурсами [42].
Е.В. Прудникова и соавт. [23] рекомендуют проведение офтальмоскопии дважды: до начала исследования и перед его завершением, однако кратность исследования должна быть увеличена в экспериментах с длительностью более 3 месяцев и в случае, когда высоко ожидаем офтальмотоксический эффект разрабатываемого лекарственного препарата. Авторы также указывают на целесообразность промежуточных исследований в критических точках эксперимента и/или при появлении у лабораторных животных признаков глазной патологии.
Использование ОКТ позволяет прижизненно получать подробную гистоморфометрическую картину ретинальной патологии, выполняется при токсикологических исследованиях на различных видах лабораторных животных как при интраретинальной инъекции, так и при системном введении изучаемого соединения [47]. Так, с помощью ОКТ была показана дегенерация фоторецепторов (истончение наружного ядерного слоя сетчатки) при интравитреальном, внутривенном и внутрибрюшинном введении мышам йодоуксусной кислоты [48].
Офтальмологическая визуализация играет важную роль при исследовании как офтальмологических препаратов, так и препаратов, применяемых при системных заболеваниях с офтальмологическими проявлениями [49].
Исследование микроциркуляции глаза
Количественная оценка глазного кровотока, особенно измерение общего кровотока в сетчатке, важны для диагностики и лечения различных типов глазных заболеваний [50][51] и могут использоваться для оценки влияния медикаментозных препаратов на глазной кровоток. Одним из наиболее распространенных методов для оценки микроциркуляции у экспериментальных животных является флюоресцентная ангиография (ФАГ), которая нашла широкое применение в офтальмологии. Например, с помощью сочетания ОКТ и ФАГ было продемонстрировано развитие субретинального отека после интравитреального введения DL-альфа-аминоадипиновой кислоты у новозеландских белых кроликов и мышей [52]. Авторы предложили использовать данную модель субретинального отека при доклиническом исследовании лекарственных средств.
OКT-ангиография (ОКТА) визуализирует медленный поперечный поток в капиллярах, что позволяет обнаружить вариацию или декорреляцию сигнала OКT между изображениями поперечного сечения. Поскольку используется внутренний контраст движущихся клеток крови, введение красителя не требуется. ОКТ-ангиография является трехмерной, поэтому сетчаточные и хориоидальные сосудистые сплетения могут быть разделены на блоки для визуализации анфас и количественной оценки [53]. C помощью комбинации методов ЭРГ, ОКТ, ОКТА была доказана меньшая ретинотоксичность у кроликов ингибитора гистонодеацетилазы белиностата как перспективного средства для интравитреальной химиотерапии внутриглазной ретинобластомы, по сравнению с мелфаланом [52].
Лазерная допплеровская флоуметрия обеспечивает непрерывное измерение тканевой перфузии в относительно маленьком объеме материала [54]. Это неинвазивный метод, который можно использовать в эксперименте для выполнения повторных измерений в течение коротких или длительных периодов времени [55]. Так, использование лазерной допплеровской флоуметрии позволило выявить снижение уровня хориоидального кровотока после интравитреального введения ингибитора ангиогенеза ранибизумаба, подтверждая наличие вазоконстрикторного эффекта препарата [56].
Электрофизиологические методы диагностики
Электрофизиологическое исследование является одним из наиболее информативных методов диагностики заболеваний структур сетчатки, важным источником объективной оценки функционального состояния зрительного анализатора [57]. Изменение биоэлектрической активности сетчатки, как правило, предшествует выявлению выраженных органических поражений тканей глаза, в том числе в результате действия лекарственных средств.
ЭРГ, высокочувствительный метод считывания потенциала фоторецепторов сетчатки в ответ на световое раздражение, является наиболее применимым для исследований на животных. Мишенями лекарственных препаратов являются рецепторы, эндогенные сигнальные молекулы или потенциалзависимые ионные каналы, которые могут влиять на электрические свойства нейронов. ЭРГ позволяет in vivo отслеживать эффекты лекарственных средств на зрительные пути в условиях, приближенных к естественным [58]. Проведение ЭРГ лабораторным животным возможно как согласно руководству Международного общества клинической электрофизиологии зрения (International Society for Clinical Electrophysiology of Vision, ISCEV) по процедурам визуальной электродиагностики [59], так и по адаптированным тестам для отдельного биологического вида [14]. При изучении фармакологического и токсического эффектов (депрессия амплитуды ЭРГ-волн) потенциального лекарственного средства преимуществом ЭРГ является то, что она позволяет оценить эти эффекты количественно [57].
Для проведения исследования животным инстиллируют мидриатик и анестетик в оба глаза. ЭРГ регистрируется с поверхности роговицы с помощью электродов. У лабораторных животных регистрация обычно проводится под наркозом, хотя также были опубликованы данные о возможности проведения этой процедуры без наркоза [60][61]. Активный электрод накладывают на роговицу, референсный игольчатый электрод вводят подкожно в затылочную часть головы, игольчатый электрод заземления вводят подкожно сбоку в область нижнего ребра или хвоста.
ЭРГ можно проводить после темновой и световой адаптации. Адаптированное к темноте состояние используется, когда исследователь заинтересован в палочко-опосредованном ответе. Световая адаптация эффективно насыщает палочки, и, таким образом, светоадаптацию можно использовать для извлечения реакций, вызываемых колбочками. ЭРГ основана на изменении ионного тока в сетчатке при вспышке света. В исследованиях ЭРГ у мышей и крыс в качестве стимулирующих устройств используют стробоскопические вспышки [62] или эффект Ганцфельда [63–65]. А.А. Суетов и соавт. [66] описали проведение мультифокальной ЭРГ у кроликов с помощью прибора «Нейро-ЭРГ» («Нейрософт», Россия), где в качестве светового стимулятора использовали LCD-монитор.
Токи, образующиеся в радиально ориентированных клетках сетчатки (фоторецепторах, биполярных клетках, клетках Мюллеровой глии и клетках пигментного эпителия сетчатки), преимущественно текут в одном направлении и генерируют суммарный потенциал, легко регистрируемый дистальным роговичным электродом. Мгновенная электроретинограмма может быть получена с использованием различных параметров стимуляции и фонового освещения, а также могут быть проанализированы многочисленные отдельные компоненты ЭРГ, каждый из которых указывает на функциональность различных классов клеток сетчатки.
С помощью ЭРГ анализируют амплитуды и задержки а- и b-волн. А-волна в основном обусловлена активацией фоторецепторов, тогда как b-волна в основном генерируется активацией глутаматергических биполярных клеток ON-типа. Латерально ориентированные клетки сетчатки вносят незначительный вклад в обычную вспышку ЭРГ, вместо этого они формируют ответ паттерн-ЭРГ, специального метода, используемого для записи внутренних ответов сетчатки [67].
ЭРГ позволяет количественно оценить степень токсического поражения сетчатки (амплитуда и латентность а- и b-волн), локализовать макулярные нарушения (при мультифокальной ЭРГ), определить преимущественное нарушение функций нейронов сетчатки. Например, паттерн-ЭРГ характеризует состояние ганглиозных клеток сетчатки, ритмическая ЭРГ с частотой 30 Гц — состояние колбочек, полнопольная (Ганцфельд) ЭРГ после темновой адаптации показывает комбинированный (максимальный) ответ фоторецепторов, однако у грызунов с преобладанием палочкового аппарата требуется более длительная темновая адаптация [63][68].
Существует ряд моделей заболеваний сетчатки и зрительного нерва (например, глаукомное поражение слоя нервных волокон (глаукомная нейропатия), диабетическая ретинопатия, другие ишемические поражения сетчатки), влияние которых на зрительные электрофизиологические параметры достаточно хорошо изучено, что позволяет использовать их при исследовании лекарственных средств. ЭРГ может обеспечить раннее указание на функциональное восстановление в ответ на терапевтическое вмешательство [58].
Преимуществами ЭРГ являются возможность использования у всех основных видов лабораторных животных и быстрота проведения при определенном опыте и квалификации исполнителя. Изменения биоэлектрической активности сетчатки под влиянием того или иного патологического фактора наступают раньше, чем развиваются морфологические нарушения в сетчатке и зрительном нерве. Таким образом, результаты ЭРГ могут продемонстрировать самые ранние ретинотоксические функциональные эффекты изучаемого соединения, когда офтальмоскопия будет малоинформативна [63]. В литературе описано применение ЭРГ для выявления офтальмотоксического действия соединений как при системном (внутривенном, внутрибрюшинном, пероральном), так и при локальном введении (интравитреальном, субконъюнктивальном, инстилляции в конъюнктивальную полость) [64][69][70].
Алгоритм оценки офтальмотоксичности в доклинических исследованиях
Проведенный анализ показал, что целостный подход к изучению офтальмотоксичности разрабатываемых лекарственных препаратов в доклинических исследованиях в настоящее время отсутствует. В рекомендациях OECD GD 263 и ГОСТ 34658-2020 детально изложен алгоритм изучения раздражающего/повреждающего действия химического соединения на глаза. При этом нет руководств, в которых были бы систематизированы данные о применении методов углубленного изучения ретинотоксичности, поражения зрительного нерва и проводящих путей зрительного анализатора в доклинических исследованиях in vivo. Каждый коллектив авторов из всей совокупности возможных в этой области методов исследования выбирает те, которые в наибольшей степени отвечают задачам конкретного исследования [57][66]. Поэтому нами предпринята попытка обобщить и представить в виде алгоритма последовательность действий (с указанием рекомендуемого объема исследований), необходимых для комплексной оценки офтальмотоксичности на доклиническом этапе с учетом типа препарата: офтальмологический, системного действия (рис. 1).
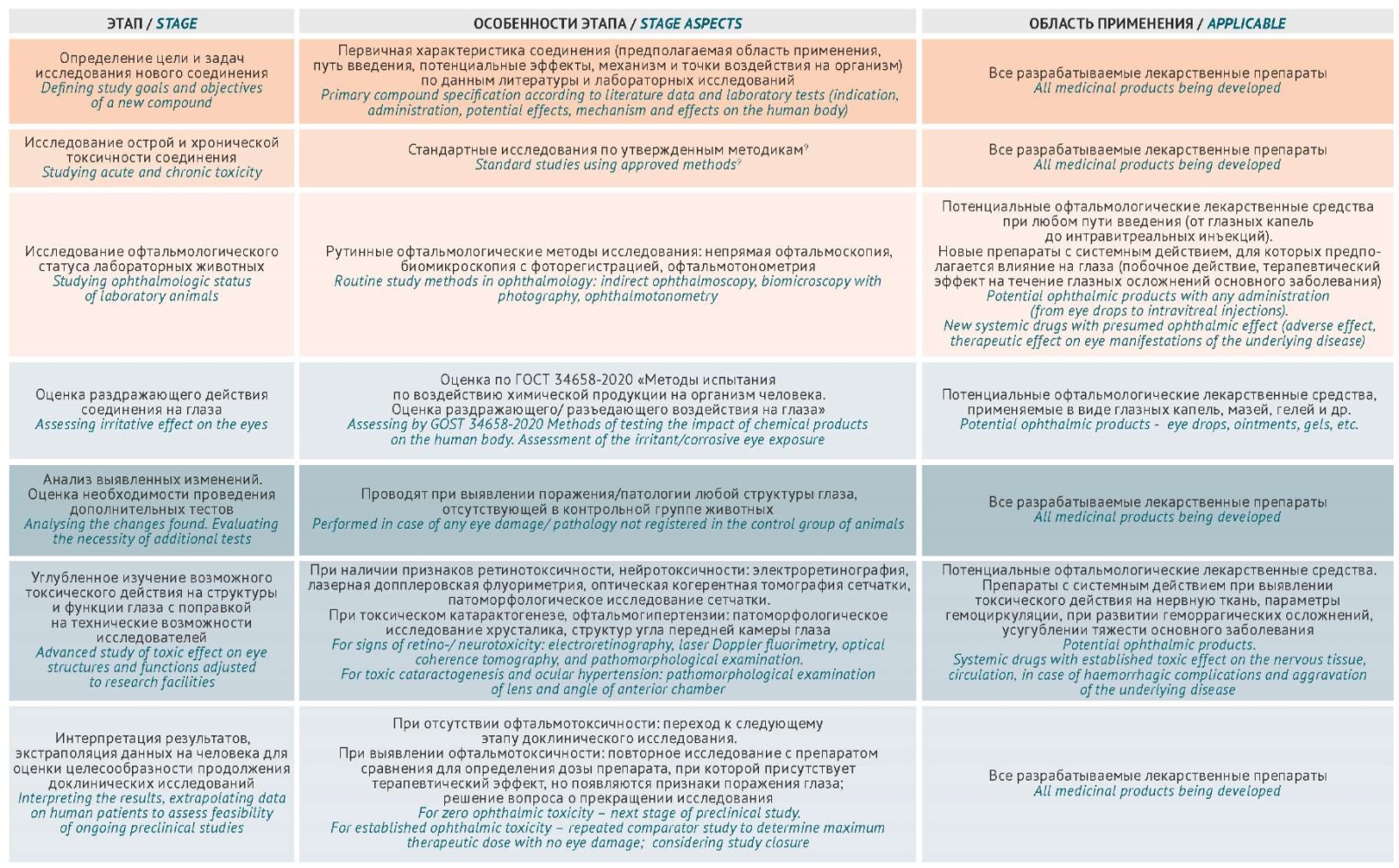
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Алгоритм изучения офтальмотоксичности потенциальных лекарственных средств в доклинических исследованиях
Fig. 1. Algorithm for studying ophthalmotoxicity of potential drugs in preclinical studies
Если исследование острой токсичности фармакологически активного вещества имеет целью определение LD50 при однократном или двукратном введении при ограниченном времени наблюдения за лабораторными животными, то длительность исследования хронической токсичности зависит от предполагаемой длительности применения препарата в клинической практике8. Изучение офтальмотоксичности может быть реализовано параллельно при исследовании как острой, так и хронической токсичности.
Следует сделать дополнительное пояснение: при подготовке данной статьи авторы изучили большое количество научных публикаций и могут обоснованно сделать вывод о том, что применение любого метода прижизненного исследования выполнимо на любом виде лабораторного животного при соответствующем уровне технического оснащения и квалификации научного персонала.
Изучение нейротоксического действия потенциальных лекарственных средств, ассоциированного с поражением сосудистого русла головного мозга, логично дополнять методами, которые позволяют визуализировать сетчатку (ОКТА, офтальмоскопия), из-за общего онтогенетического происхождения и функциональной связи между этими структурами [71]. Углубленное изучение нейротоксического действия системно вводимых препаратов целесообразно дополнять проведением ЭРГ для оценки состояния нейронов сетчатки [65]. Так, электрофизиологические методы позволили выявить отдаленные офтальмотоксические эффекты вигабатрина у детей [72]. Исследование нефротоксического эффекта вещества (поражение почечного нефрона) может быть дополнено изучением микроциркуляции цилиарного тела, конъюнктивы и сетчатки, поскольку тяжесть нефропатии коррелирует со снижением уровня глазной гемоперфузии [73].
Проведение ЭРГ на этапе доклинического исследования нового соединения для выявления токсического эффекта на глаз является целесообразным вне зависимости от того, планируется ли его применение как местного офтальмологического средства или как препарата для системного введения [57].
ЗАКЛЮЧЕНИЕ
Исследование офтальмотоксичности потенциальных лекарственных препаратов является неотъемлемой и высокоинформативной частью доклинических испытаний. Для выявления офтальмологических нарушений при местном и системном применении лекарственных препаратов используется широкий спектр методов исследования морфологии и функции глаза. Унификация принятых в Российской Федерации подходов к изучению офтальмотоксичности с мировой практикой является положительной и обоснованной тенденцией. Авторами предложен алгоритм оценки офтальмотоксичности в исследованиях in vivo лекарственных препаратов при обнаружении негативных офтальмологических9эффектов с указанием рекомендуемого объема исследований. Использование разработанного алгоритма позволит оптимизировать дизайн доклинических исследований с использованием лабораторных животных и выявить возможные токсические эффекты разрабатываемых лекарственных препаратов на глаза на ранних этапах исследования.
Дополнительная информация. Таблица 1 размещена на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2025-406-tabl
Additional information. Table 1 is published on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2025-406-tabl
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Л.В. Науменко — концепция работы, написание текста рукописи и критический пересмотр содержания, утверждение окончательной версии рукописи для публикации; Ю.А. Говорова — концепция работы, сбор и анализ данных литературы и нормативной документации, написание и редактирование текста рукописи; А.С. Таран — сбор и анализ данных литературы и нормативной документации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Liudmila V. Naumenko conceptualised the work, drafted the manuscript text, revised the content, and approved the final version for publication. Yulia A. Govorova conceptualised the work, searched and analysed literature and regulatory documentation, drafted and edited the text. Alena S. Taran searched and analysed literature data and regulatory documentation.
1. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К; 2012.
2. OECD Guideline for the testing of chemicals. Acute eye irritation/corrosion. Test Guideline 405. OECD; 2023.
3. Guideline on non-clinical local tolerance testing of medicinal products. EMA/CHMP/SWP/2145/2000 Rev. 1, Corr. 1*. EMA; 2015.
4. OECD Guidance document No 263 on integrated approaches to testing and assessment (IATA) for serious eye damage and eye irritation. ENV/JM/MONO(2017)15/REV1. OECD; 2023.
5. https://doi.org/10.30895/2312-7821-2025-406-tabl
6. Globally harmonized system of classification and labelling of chemicals (GHS Rev. 10, 2023). United Nations; 2023.
https://unece.org/transport/dangerous-goods/ghs-rev10-2023
7. https://doi.org/10.30895/2312-7821-2025-406-tabl
8. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К; 2012.
9. Там же.
Список литературы
1. To TQ, Townsend JC. Ocular toxicity of systemic medications: A case series. Optometry. 2000;71(1):29–39. PMID: 10680416
2. Peng JP, Yang XY, Luo F, et al. Hydroxychloroquine-induced hyperpigmentation of the skin and bull’s-eye maculopathy in rheumatic patients: A case report and literature review. Front Immunol. 2024;15:1383343. https://doi.org/10.3389/fimmu.2024.1383343
3. Li J, Tripathi RC, Tripathi BJ. Drug-induced ocular disorders. Drug Saf. 2008;31(2):127–41. https://doi.org/10.2165/00002018-2008-31020-00003
4. Tsang SH, Sharma T. Drug-induced retinal toxicity. In: Tsang SH, Sharma T, eds. Atlas of inherited retinal diseases. Springer Cham; 2018. https://doi.org/10.1007/978-3-319-95046-4_48
5. Ye YT, Zhou ZY, Wen LS, et al. The significance of the ocular adverse effect induced by systemic taxane application. Front Bioscience (Landmark Ed). 2022;27(6):171. https://doi.org/10.31083/j.fbl2706171
6. Ahn SJ, Ryu SJ, Lim HW, Lee BR. Toxic effects of hydroxychloroquine on the choroid: Evidence from multimodal imaging. Retina. 2019;39(5):1016–26. https://doi.org/10.1097/IAE.0000000000002047
7. Santaella RM, Fraunfelder FW. Ocular adverse effects associated with systemic medications: Recognition and management. Drugs. 2007;67(1):75–93. https://doi.org/10.2165/00003495-200767010-00006
8. Green MB, Duker JS. Adverse ocular effects of systemic medications. Life (Basel). 2023;13(3):660. https://doi.org/10.3390/life13030660
9. Mecklenburg L, Schraermeyer U. An overview on the toxic morphological changes in the retinal pigment epithelium after systemic compound administration. Toxicol Pathol. 2007;35(2):252–67. https://doi.org/10.1080/01926230601178199
10. Wilkie DA. The ophthalmic examination as it pertains to general ocular toxicology: Basic and advanced techniques and species-associated findings. In: Gilger B, ed. Ocular pharmacology and toxicology. Methods in pharmacology and toxicology. Totowa, NJ: Humana Press; 2013. https://doi.org/10.1007/7653_2013_7
11. Краснова ТВ, Канюков ИВ. Ретинопатическое побочное действие лекарственных средств и меры профилактики. Вестник Оренбургского государственного университета. 2004;S(38):202–5. EDN: JVEKOV
12. Corradetti G, Violanti S, Au A, Sarraf D. Wide field retinal imaging and the detection of drug associated retinal toxicity. Int J Retin Vitreous. 2019;5(Suppl 1):26. https://doi.org/10.1186/s40942-019-0172-0
13. Muthuswamy A, Pardo ID, Rao DB, et al. Neuroanatomy and sampling of central projections for the visual system in mammals used in toxicity testing. Toxicol Pathol. 2021;49(3):455–71. https://doi.org/10.1177/0192623320967279
14. Kaczmarek JV, Bogan CM, Pierce JM, et al. Intravitreal HDAC inhibitor belinostat effectively eradicates vitreous seeds without retinal toxicity in vivo in a rabbit retinoblastoma model. Invest Ophthalmol Vis Sci. 2021;62(14):8. https://doi.org/10.1167/iovs.62.14.8
15. Alépée N, Leblanc V, Grandidier MH, et al. SkinEthic HCE Time-to-Toxicity on solids: A test method for distinguishing chemicals inducing serious eye damage, eye irritation and not requiring classification and labelling. Toxicol In Vitro. 2021;75:105203. https://doi.org/10.1016/j.tiv.2021.105203
16. Bonneau N, Potey A, Vitoux MA, et al. Corneal neuroepithelial compartmentalized microfluidic chip model for evaluation of toxicity-induced dry eye. Ocul Surf. 2023;30:307–19. https://doi.org/10.1016/j.jtos.2023.11.004
17. Ramsay E, Del Amo EM, Toropainen E, et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 2018;119:83–9. https://doi.org/10.1016/j.ejps.2018.03.034
18. Vézina M. Comparative ocular anatomy in commonly used laboratory animals. In: Weir A, Collins M, eds. Assessing ocular toxicology in laboratory animals. Molecular and integrative toxicology. Totowa, NJ: Humana Press; 2012. Р. 1–21. https://doi.org/10.1007/978-1-62703-164-6_1
19. Wu Y, Feng Y, Yang J, et al. Anatomical and Micro-CT measurement analysis of ocular volume and intraocular volume in adult Bama Miniature pigs, New Zealand rabbits, and Sprague-Dawley rats. PloS One. 2024;19(9):e0310830. https://doi.org/10.1371/journal.pone.0310830
20. Shibuya K, Tomohiro M, Sasaki S, Otake S. Characteristics of structures and lesions of the eye in laboratory animals used in toxicity studies. J Toxicol Pathol. 2015;28(4):181–8. https://doi.org/10.1293/tox.2015-0037
21. Perlman I. Testing retinal toxicity of drugs in animal models using electrophysiological and morphological techniques. Doc Ophthalmol. 2009;118(1):3–28. https://doi.org/10.1007/s10633-008-9153-6
22. Агафонов СГ, Гасанова СР, Шацких АВ. Морфологические особенности глаз лабораторных животных по данным световой микроскопии. В кн.: Тахчиди ХП, ред. Актуальные проблемы офтальмологии 2008. М.; 2009.
23. Прудникова ЕВ, Бокарев АВ, Минина АО, Пилипец ЕЯ. Офтальмоскопия как метод оценки фармакологической безопасности препаратов. Лабораторные животные для научных исследований. 2023;(4):35–42. https://doi.org/10.57034/2618723X-2023-04-03
24. Negro Silva LF, Li C, de Seadi Pereira PJB, et al. Biochemical and electroretinographic characterization of the minipig eye in the context of drug safety investigations. Int J Toxicol. 2019;38(5):415–22. https://doi.org/10.1177/1091581819867929
25. Семенова МВ, Чукина СИ, Ковешникова ЕИ. Изучение местно-раздражающего действия препаратов аверсект форте и аверсект комби при нанесении на кожу и слизистую оболочку глаза. Российский паразитологический журнал. 2016;36(2):240–4. https://doi.org/10.12737/20069
26. Ubels JL, Daniel P. Clousing in vitro alternatives to the use of animals in ocular toxicology testing. Ocul Surf. 2005;3(3):126–42. https://doi.org/10.1016/s1542-0124(12)70195-7
27. Realini T, Fechtner RD, Atreides SP, Gollance S. The uniocular drug trial and second-eye response to glaucoma medications. Ophthalmology. 2004;111(3):421–6. https://doi.org/10.1016/j.ophtha.2003.08.022
28. Avila MY, Carré DA, Stone RA, Civan MM. Reliable measurement of mouse intraocular pressure by a servo-null micropipette system. Invest Ophthalmol Vis Sci. 2001;42(8):1841–6. PMID: 11431452
29. Ansari-Mood M, Mehdi-Rajaei S, Sadjadi R, et al. Twenty-four-hour measurement of intraocular pressure in guinea pigs (Cavia porcellus). J Am Assoc Lab Anim Sci. 2016;55(1):95–7. PMID: 26817986
30. Atalay E, Tamçelik N, Cicik ME. The impact of pupillary dilation on intraocular pressure and anterior segment morphology in subjects with and without pseudoexfoliation. Curr Eye Res. 2015;40(6):646–52. https://doi.org/10.3109/02713683.2014.954674
31. Millar JC, Pang IH. Non-continuous measurement of intraocular pressure in laboratory animals. Exp Eye Res. 2015;141:74–90. https://doi.org/10.1016/j.exer.2015.04.018
32. Gandhi JK, Chowdhury UR, Manzar Z, et al. Differential intraocular pressure measurements by tonometry and direct cannulation after treatment with soluble adenylyl cyclase inhibitors. J Ocul Pharmacol Ther. 2017;33(8):574–81. https://doi.org/10.1089/jop.2017.0027
33. Kanski J, Kanski J. Ocular examination techniques. In: Clinical ophthalmology: A systematic approach. Butterworth Heinemann/Elsevier; 2007. Р. 1–32.
34. Luan CS, Chen XM, Deng YP, et al. The relationship between central corneal thickness and Perkins applanation tonometry in rabbits. Zhonghua Yan Ke Za Zhi. 2005;41(7):642–6 (In Chinese).
35. Acosta AC, Espana EM, Nose I, et al. Estimation of intraocular pressure in rabbits with commonly used tonometers. Ophthalmic Surg Lasers Imaging. 2007;38(1):43–9. https://doi.org/10.3928/15428877-20070101-06
36. Avila, MY, Múnera A, Guzmán A, et al. Noninvasive intraocular pressure measurements in mice by pneumotonometry. Invest Ophthalmol Vis Sci. 2005;46(9):3274–80. https://doi.org/10.1167/iovs.04-1188
37. Munger RJ, Collins M. Assessment of ocular toxicity potential: Basic theory and techniques. In: Weir A, Collins M, eds. Assessing ocular toxicology in laboratory animals. Molecular and integrative toxicology. Totowa, NJ: Humana Press; 2012. Р. 23–52. https://doi.org/10.1007/978-1-62703-164-6_2
38. Mermoud A, Baerveldt G, Minckler DS, et al. Intraocular pressure in Lewis rats. Invest Ophthalmol Vis Sci. 1994;35(5):2455–60.
39. Порфирьев ИА, Гончар ОП. Внутриглазное давление у кроликов. Методы определения. Нормальные показатели. Вестник Российского университета дружбы народов. Серия: Сельскохозяйственные науки. Животноводство. 2005;(12):73–5. EDN: IIRCMR
40. Eaton JS, Miller PE, Bentley E, et al. Slit lamp-based ocular scoring systems in toxicology and drug development: A literature survey. J Ocul Pharmacol Ther. 2017;33(10):707–17. https://doi.org/10.1089/jop.2017.0021
41. Jakubiak P, Lack F, Thun J, et al. Influence of melanin characteristics on drug binding properties. Mol Pharm. 2019;16(6):2549–56. https://doi.org/10.1021/acs.molpharmaceut.9b00157
42. Corr RH. Fundoscopy in the smartphone age: current ophthalmoscopy methods in neurology. Arq Neuropsiquiatr. 2023;81(5):502–9. https://doi.org/10.1055/s-0043-1763489
43. Петрачков ДВ, Будзинская МВ, Барышев КВ. Современные возможности визуализации периферических отделов сетчатки при диабетической ретинопатии. Вестник офтальмологии. 2020;136(4):272–8. https://doi.org/10.17116/oftalma2020136042272
44. Eaton JS, Miller PE, Bentley E, et al. The SPOTS System: An ocular scoring system optimized for use in modern preclinical drug development and toxicology. J Ocul Pharmacol Ther. 2017;33(10):718–34. https://doi.org/10.1089/jop.2017.0108
45. Анафьянова ТВ, Волков АА, Карамчакова ЛА. Диагностические возможности фундус-камеры в офтальмологии. Фундаментальные исследования. 2011;(9-3):382–4. EDN: OCQSEP
46. Panwar N, Huang P, Lee J, et al. Fundus photography in the 21st century — A review of recent technological advances and their implications for worldwide healthcare. Telemed J E Health. 2016;22(3):198–208. https://doi.org/10.1089/tmj.2015.0068
47. Nork TM, Rasmussen, CA, Christian BJ, et al. Emerging imaging technologies for assessing ocular toxicity in laboratory animals. In: Weir A, Collins M, eds. Assessing ocular toxicology in laboratory animals. Molecular and integrative toxicology. Totowa, NJ: Humana Press; 2012. Р. 53–121. https://doi.org/10.1007/978-1-62703-164-6_3
48. Rösch S, Johnen S, Mazinani B, et al. The effects of iodoacetic acid on the mouse retina. Graefes Arch Clin Exp Ophthalmol. 2015;253(1):25–35. https://doi.org/10.1007/s00417-014-2652-0
49. Brock WJ, Somps CJ, Torti V, et al. Ocular toxicity assessment from systemically administered xenobiotics: Considerations in drug development. Int J Toxicol. 2013;32(3):171–88. https://doi.org/10.1177/1091581813484500
50. Pournaras CJ, Rungger-Brändle E, Riva CE, et al. Regulation of retinal blood flow in health and disease. Prog Retin Eye Res. 2008;27(3):284–330. https://doi.org/10.1016/j.preteyeres.2008.02.002
51. Flammer J, Orgül S, Costa VP, et al. The impact of ocular blood flow in glaucoma. Prog Retin Eye Res. 2002;21(4):359–93. https://doi.org/10.1016/S1350-9462(02)00008-3
52. Xie Z, Wu X, Cheng R, et al. A novel model of subretinal edema induced by DL-alpha aminoadipic acid. Exp Eye Res. 2023;228:109388. https://doi.org/10.1016/j.exer.2023.109388
53. Hagag AM, Huang D. Optical coherence tomography angiography in neuro-ophthalmology. J Neuroophthalmol. 2017;37(4):355–7. https://doi.org/10.1097/WNO.0000000000000584
54. Киселева ТН, Чудин АВ, Рамазанова КА. Методы исследования микроциркуляции глаза у экспериментальных животных. Вестник офтальмологии. 2014;130(5):100–3. EDN: TGLRUV
55. Chauhan BC, Yu PK, Cringle SJ, Yu DY. Confocal scanning laser Doppler flowmetry in the rat retina: Origin of flow signals and dependence on scan depth. Arch Ophthalmol. 2006;124(3):397–402. https://doi.org/10.1001/archopht.124.3.397
56. Mottet B, Aptel F, Geiser MH, et al. Choroidal blood flow after the first intravitreal ranibizumab injection in neovascular age-related macular degeneration patients. Acta Ophthalmol. 2018;96(7):e783–8. https://doi.org/10.1111/aos.13763
57. Казайкин ВН, Пономарев ВО, Лизунов АВ, Титаренко ЕМ. Современное применение электрофизиологических методов в диагностике заболеваний глаза и оценке токсических эффектов фармакологических препаратов (краткий обзор литературы) Отражение. 2021;2(12):36–40. https://doi.org/10.25276/2686-6986-2021-2-36-40
58. Rosolen SG, Kolomiets B, Varela O, Picaud S. Retinal electrophysiology for toxicology studies: Applications and limits of ERG in animals and ex vivo recordings. Exp Toxicol Pathol. 2008;60(1):17–32. https://doi.org/10.1016/j.etp.2007.11.012
59. Robson AG, Nilsson J, Li S, et al. ISCEV guide to visual electrodiagnostic procedures. Doc Ophthalmol. 2018;136(1):1–26. https://doi.org/10.1007/s10633-017-9621-y
60. McCulloch DL, Marmor MF, Brigell MG, et al. ISCEV Standard for full-field clinical electroretinography (2015 update). Doc Ophthalmol. 2015;130(1):1–12. https://doi.org/10.1007/s10633-014-9473-7
61. Tomiyama Y, Fujita K, Nishiguchi KM, et al. Measurement of electroretinograms and visually evoked potentials in awake moving mice. PLoS One. 2016;11(6):e0156927. https://doi.org/10.1371/journal.pone.0156927
62. Пересыпкина АА, Покровский МВ, Губарева ВО, Левкова ЕА. Коррекция гипертензивной нейроретинопатии производным диметиламиноэтанола 7–16 в эксперименте. Кубанский научный медицинский вестник. 2018;25(1):103–7. EDN: YOUTYH
63. Ver Hoeve J, Munge R, Murph C, Nork T. Emerging electrophysiological technologies for assessing ocular toxicity in laboratory animals. In: Weir A, Collins M, eds. Assessing ocular toxicology in laboratory animals. Molecular and integrative toxicology. Totowa, NJ: Humana Press; 2012. Р. 123–57. https://doi.org/10.1007/978-1-62703-164-6_4
64. Li X, Zhang W, Ye Z, et al. Safety evaluation and pharmacodynamics of minocycline hydrochloride eye drops. Mol Vis. 2022;28:460–79. PMID: 36605830
65. Tao Y, Chen T, Liu B, et al. The neurotoxic effects of N-methyl-N-nitrosourea on the electrophysiological property and visual signal transmission of rat’s retina. Toxicol Appl Pharmacol. 2015;286(1):44–52. https://doi.org/10.1016/j.taap.2015.03.013
66. Суетов АА, Алекперов СИ, Одинокая МА, Костина АА. Мультифокальная электроретинография в исследовании очаговых и диффузных изменений сетчатки кролика. Вестник офтальмологии. 2020;136(4):47–56. https://doi.org/10.17116/oftalma202013604147
67. Bayer AU, Cook P, Brodie SE, et al. Evaluation of different recording parameters to establish a standard for flash electroretinography in rodents. Vision Res. 2001;41(17):2173–85. https://doi.org/10.1016/s0042-6989(01)00103-1
68. Клочихина ЕМ, Ердяков АК, Морозова МП и др. Электрическая активность сетчатки у крыс со стрептозотоцин-индуцированным сахарным диабетом. Сахарный диабет. 2018;21(5):356–63. https://doi.org/10.14341/DM9490
69. Salas-Ambrosio PJ, Bernad-Bernad MJ, Linares-Alba MA, et al. Toxicity evaluation of a novel rapamycin liposomal formulation after subconjunctival and intravitreal injection. J Ocul Pharmacol Ther. 2021;37(5):261–76. https://doi.org/10.1089/jop.2020.0108
70. Moriguchi M, Nakamura S, Inoue Y, et al. Irreversible photoreceptors and RPE cells damage by intravenous sodium iodate in mice is related to macrophage accumulation. Invest Ophthalmol Vis Sci. 2018;59(8):3476–87. https://doi.org/10.1167/iovs.17-23532
71. Majimbi M, McLenachan S, Nesbit M, et al. In vivo retinal imaging is associated with cognitive decline, blood-brain barrier disruption and neuroinflammation in type 2 diabetic mice. Front Endocrinol (Lausanne). 2023;14:1224418. https://doi.org/10.3389/fendo.2023.1224418
72. Hébert-Lalonde N, Carmant L, Major P, et al. Electrophysiological evidences of visual field alterations in children exposed to vigabatrin early in life. Pediatr Neurol. 2016;59:47–53. https://doi.org/10.1016/j.pediatrneurol.2016.03.001
73. Фурсова АЖ, Дербенева АС, Васильева МА и др. Особенности развития, клинические проявления и диагностика изменений сетчатки при хронической болезни почек. Вестник офтальмологии. 2021;137(1):107–14. https://doi.org/10.17116/oftalma2021137011107
Об авторах
Л. В. НауменкоРоссия
Науменко Людмила Владимировна, д-р мед. наук
Площадь Павших борцов, д. 1, Волгоград, 400131
Ю. А. Говорова
Россия
Говорова Юлия Александровна, канд. мед. наук
Площадь Павших борцов, д. 1, Волгоград, 400131
А. С. Таран
Россия
Таран Алена Сергеевна, канд. мед. наук
Площадь Павших борцов, д. 1, Волгоград, 400131
Дополнительные файлы

|
1. Таблица 1. Подход к изучению и оценке серьезных повреждений и раздражения глаз в соответствии с Руководством по интегрированным подходам к исследованиям и оценке серьезного повреждения и раздражения глаз Организации экономического сотрудничества и развития № 263 (OECD GD № 263) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(161KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Науменко Л.В., Говорова Ю.А., Таран А.С. Доклинические исследования офтальмотоксичности лекарственных средств: обзор регуляторных подходов и методов исследования. Безопасность и риск фармакотерапии. 2025;13(4):411-425. https://doi.org/10.30895/2312-7821-2025-406
For citation:
Naumenko L.V., Govorova Yu.A., Таrаn A.S. Preclinical Ophthalmotoxicity Studies of Medicinal Products: a Review of Regulatory Approaches and Research Methods. Safety and Risk of Pharmacotherapy. 2025;13(4):411-425. (In Russ.) https://doi.org/10.30895/2312-7821-2025-406
JATS XML





































