Перейти к:
Антипсихотик-индуцированное удлинение интервала QT и развитие Torsade de Pointes у пациентов с психическими расстройствами: обзор
https://doi.org/10.30895/2312-7821-2024-410
Резюме
ВВЕДЕНИЕ. Удлинение интервала QT является одной из наиболее значимых кардиотоксических нежелательных реакций, ассоциированных с применением антипсихотиков (АП), в связи с высоким риском развития жизнеугрожающих желудочковых аритмий, в частности пируэтной тахикардии (Тorsade de Рointes, TdP).
ЦЕЛЬ. Систематизировать сведения о влиянии антипсихотиков на длительность интервала QT и риск развития пируэтной тахикардии у пациентов с психическими расстройствами и представить рекомендации по предотвращению их развития для практикующих психиатров и клинических фармакологов.
ОБСУЖДЕНИЕ. Поиск информации проводили в PubMed, eLIBRARY.RU, Google Scholar. В анализ включали полнотекстовые статьи, содержащие результаты плацебо-контролируемых исследований, перекрестных исследований, исследований типа «случай–контроль», систематических обзоров, метаанализов, Кокрейновских обзоров, опубликованных с 01.09.2013 по 30.09.2023. Основной механизм кардиотоксического действия АП заключается в ингибировании ими потенциал-зависимых ионных каналов мембраны кардиомиоцитов (прежде всего калиевых). Большинство АП 1-го поколения дозозависимо увеличивают длительность интервала QTc, наибольший риск наблюдался при применении тиоридазина, хлорпромазина и левомепромазина. Результаты проведенного анализа данных не позволили подтвердить гипотезу о том, что АП новых поколений имеют меньший риск удлинения интервала QTc по сравнению с АП 1-го поколения. Для АП 2-го и 3-го поколений в меньшей степени характерна связь между их сывороточной концентрацией и выраженностью удлинения интервала QTc. Все АП второго поколения удлиняют интервал QTc и повышают риск TdP, наибольший риск выявлен для клозапина и оланзапина. Представлено распределение АП по группам в зависимости от степени риска удлинения интервала QTc: группа низкого риска (арипипразол, луразидон, карипразин, палиперидон, зуклопентиксол), умеренного риска (кветиапин, перфеназин, флуфеназин, оланзапин, клотиапин, галоперидол) и высокого риска (хлорпромазин, промазин, клозапин, левомепромазин, зипрасидон). Обнаружено, что связь между АП-индуцированным удлинением интервала QTс и развитием TdP неоднозначна. В случае гомогенного действия АП на кардиомиоциты риск развития ТdP низкий, несмотря на значительное удлинение интервала QTс.
ВЫВОДЫ. Обобщенные данные о влиянии АП на длительность интервала QT и риск развития TdP у пациентов с психическими расстройствами, предложенные рекомендации по снижению риска развития TdP могут быть востребованы психиатрами и клиническими фармакологами при подборе АП и способствовать минимизации вероятности возникновения потенциально фатальных АП-индуцированных аритмогенных кардиологических нежелательных реакций.
Ключевые слова
Для цитирования:
Насырова Р.Ф., Кидяева А.В., Петрова М.М., Шнайдер Н.А. Антипсихотик-индуцированное удлинение интервала QT и развитие Torsade de Pointes у пациентов с психическими расстройствами: обзор. Безопасность и риск фармакотерапии. 2024;12(4):380-395. https://doi.org/10.30895/2312-7821-2024-410
For citation:
Nasyrova R.F., Kidyaeva A.V., Petrova M.M., Shnayder N.A. Antipsychotic-Induced QT Prolongation and Torsade de Pointes in Patients with Mental Disorders: A Review. Safety and Risk of Pharmacotherapy. 2024;12(4):380-395. (In Russ.) https://doi.org/10.30895/2312-7821-2024-410
Введение
Продолжительность жизни пациентов с хроническими психическими расстройствами, по некоторым данным, более чем на 20 лет ниже, чем в общей популяции [1]. У таких пациентов чаще встречаются сердечно-сосудистые, респираторные и метаболические нарушения [2], при этом наиболее частой причиной смерти являются сердечно-сосудистые заболевания [3]. До 40% случаев приходится на синдром внезапной смерти (СВС) [4]. Частота СВС у пациентов, принимающих антипсихотики (АП), в 2–3 раза выше, чем в общей популяции, — 15 на 10 000 лет воздействия АП [5].
АП — лекарственные средства (ЛС) психолептического (успокаивающего) действия, которые способны прежде всего редуцировать психотическую (галлюцинаторно-бредовую) симптоматику и психомоторное возбуждение [6]. Они имеют широкий спектр применения в психиатрической практике, показаны для лечения шизофрении [7], бредовых, аффективных расстройств [8, 9], синдрома Туретта [10], поведенческих нарушений у пациентов с расстройствами личности [11, 12], умственной отсталостью [13], для купирования психомоторного возбуждения различной этиологии [14], в том числе при делирии и деменции [15]. АП первого поколения чаще используют для купирования острого психоза с психомоторным возбуждением. АП второго и третьего поколений используют для лечения как продуктивной, так и негативной симптоматики [16], а также для коррекции когнитивных расстройств у пациентов с расстройствами шизофренического спектра [17]. АП доказанно снижают частоту рецидивов психических расстройств и применяются в качестве поддерживающей терапии длительно, на протяжении многих лет [18], что обусловливает необходимость тщательного подбора АП с учетом как их эффективности, так и безопасности для пациента.
Одной из важных кардиотоксических нежелательных реакций (НР) при применении некоторых ЛС является удлинение интервала QT в связи с повышением риска развития жизнеугрожающих желудочковых аритмий, в том числе пируэтной тахикардии (Torsade de Pointes, TdP), и СВС [19–21]. Частота этих НР среди пациентов, получающих АП, достигает 8%, что вдвое превышает среднепопуляционную [22].
Интервал QT — это время от начала деполяризации до окончания реполяризации желудочков. Длительность интервала QT обратно пропорционально зависит от частоты сердечных сокращений (ЧСС) [19]. В связи с этим для более точного анализа были предложены формулы для расчета корригированного интервала QT (QTc), нормированного по ЧСС [23] (рис. 1).
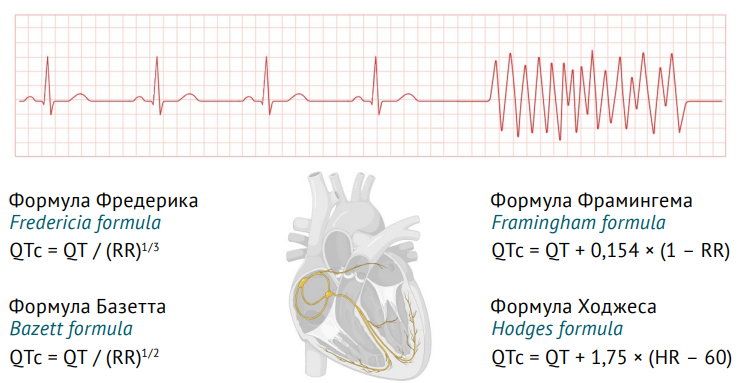
Рис. 1. Формулы для расчета корригированного интервала QT (адаптировано авторами из [23]). QTc — корригированная (относительно частоты сердечных сокращений) величина интервала QT; HR — частота сердечных сокращений; RR — интервал, рассчитывается по формуле RR = 60/HR, выражается в секундах
Fig. 1. Formulae for calculating the corrected QT interval (adapted by the authors from [23]). QTc, QT interval corrected for the heart rate; HR, heart rate; RR, interval between successive R-waves calculated as RR = 60/HR (in seconds)
Наиболее часто в клинической практике используется формула Базетта, хотя она неточна в случае высокой или низкой ЧСС [24]. Ее использование оправдано при ЧСС от 60 до 100 уд/ мин, а при бради- и тахикардии целесообразно использование формулы Фредерика. Формулы Фрамингема и Ходжеса применяют у пациентов с фибрилляцией предсердий [19]. Согласно рекомендациям Минздрава России для объективной оценки интервала QT следует использовать формулы Базетта и Фредерика1. Управление по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) рекомендует для анализа интервала QT применять преимущественно формулу Фредерика, а также другие указанные формулы, кроме формулы Базетта, являющейся по мнению экспертов FDA наихудшей2.
В норме QTc составляет 340–450 мс для женщин и 340–430 мс для мужчин3. Определение АП-индуцированного удлинения интервала QTс (УИ QTc) продолжает обсуждаться. В некоторых руководствах указано, что АП-индуцированным УИ QTс считается >500 мс4 или увеличение интервала QTс на >60 мс по сравнению с исходным интервалом до лечения [25]. По другим руководствам, настороженность должны вызывать АП, применение которых связано с УИ QTc от исходного уровня на >20 мс [26] и >10 мс [27].
Среди пациентов с психическими расстройствами распространенность УИ QTc >500 мс составляет от 0,9 до 2,6% [28]. АП-индуцированное УИ QTс может приводить к развитию TdP, потенциально опасной для жизни форме полиморфной желудочковой тахикардии [29], которая характеризуется постепенным изменением амплитуды и закручиванием комплексов QRS вокруг изоэлектрической линии на электрокардиограмме (ЭКГ) [25].
Вероятно, данные о частоте АП-индуцированной TdP занижены. Одна из причин заключается в том, что для точного диагноза требуется запись ЭКГ во время нарушения сердечного ритма. Другая причина в том, что значительная часть пациентов не выживает после пароксизма желудочковой аритмии [30]. Женщины подвергаются более высокому риску развития АП-индуцированного TdP, чем мужчины [31]. Однако не уточнен порог УИ QTc, при котором обязательно возникает TdP, хотя QTc >500 мс был связан с двукратным или трехкратным увеличением риска развития TdP, и каждые 10 мс УИ QT увеличивают риск развития TdP примерно на 5–7% [32]. Показано, что до 90% пациентов, у которых развивается TdP при одновременном приеме неантиаритмических ЛС, включая АП, имеют длительность QTc >500 мс5. АП-индуцированное УИ QTс <5 мс, как правило, не считается проаритмическим, а удлинение на ≥20 мс рассматривается как определенный фактор риска TdP [33].
Таким образом, АП-индуцированное УИ QTс является серьезной междисциплинарной проблемой, поскольку может в конечном итоге привести к СВС [5] у пациента с психическим расстройством на фоне проводимой психофармакотерапии.
Цель работы — систематизировать сведения о влиянии антипсихотиков на длительность интервала QT и риск развития пируэтной тахикардии (Torsade de Pointes) у пациентов с психическими расстройствами и представить рекомендации по предотвращению их развития для практикующих психиатров и клинических фармакологов.
Поиск информации проводили в библиографических базах данных PubMed, eLIBRARY.RU и поисковой системе Google Scholar по ключевым словам: «антипсихотик», «интервал QT», «антипсихотик-индуцированное удлинение интервала QT», «внезапная сердечная смерть», «Torsade de Pointes», «лечение», «психическое расстройство». В анализ включали полнотекстовые статьи на английском и русском языках, содержащие результаты плацебо-контролируемых исследований, перекрестных исследований, исследований типа «случай–контроль», систематических обзоров, метаанализов, Кокрейновских обзоров, описания клинических случаев. Были проанализированы статьи, опубликованные с 01.09.2013 по 30.09.2023. Повторяющиеся статьи были исключены из данного нарративного обзора.
В обзоре представлены результаты анализа 34 публикаций (включая клинические случаи), посвященных влиянию АП на интервал QTс и риск развития ТdP, в том числе 11 клинических исследований, проведенных в США [33, 34], Японии [35, 36], Китае, Индии, Сингапуре, Южной Корее, Таиланде, Малайзии [37], Австралии [38], Франции, Италии [28, 39], Латинской Америке [40], Великобритании [41], Австрии, Германии, Швейцарии [22]. Объемы выборок варьировали от 1 (описание клинического случая) [35, 36] до 3505 человек [39]. Возраст пациентов варьировал от младенческого [33] до 90 лет [40]. Во всех исследованиях принимали участие пациенты мужского и женского пола. Длительность приема АП варьировала от 1 сут [36] до нескольких лет [33]. Коррекция интервала QT относительно ЧСС производилась по формулам Базетта [42] и Фредерика [33], а также с помощью номограммы [38].
ОСНОВНАЯ ЧАСТЬ
Риск антипсихотик-индуцированного удлинения интервала QTc
АП разных фармакологических групп могут иметь вариабельный риск УИ QTс у пациентов с психическими расстройствами, что обусловлено, прежде всего, механизмом действия АП на потенциал-зависимые ионные каналы сердца (таблица 1 «Механизмы антипсихотик-индуцированного удлинения интервала QTc», опубликована на сайте журнала6).
Механизмы, опосредующие АП-индуцированное УИ QTc, изучены недостаточно, хотя есть данные, указывающие на прямое влияние АП на определенные подтипы ионных каналов миокарда, преимущественно калиевые [43]. Предполагаемым ведущим механизмом является ингибирование быстрого калиевого тока замедленного выпрямления (IKr), обусловленное блокадой каналов hERG (по новой номенклатуре Kv11.1) [25, 44]. Обнаружена положительная корреляция между риском УИ QTс и сродством АП к каналу Kv11.1 [45]. Блокирование IKr приводит к увеличению продолжительности потенциала действия желудочков, что вызывает избыточный приток натрия или снижение оттока калия. Этот избыток положительно заряженных ионов приводит к расширенной фазе реполяризации, что удлиняет интервал QTс и является причиной TdP. В отличие от фибрилляции желудочков, TdP является уникальной желудочковой аритмией, поскольку она может закончиться спонтанно. Тем не менее TdP может трансформироваться в фибрилляцию желудочков и вызвать СВС [46]. Известно, что некоторые АП (сертиндол, галоперидол и тиоридазин) действуют как высокоаффинные или умеренно высокоаффинные ингибиторы калиевых каналов Kv11.1 [47]. Эти каналы, по-видимому, имеют большую пористую полость, чем другие шесть трансмембранных доменов калиевых каналов, и содержат остатки ароматических аминокислот в области S6 канала, что придает им высокую восприимчивость к взаимодействию с АП [48].
Антипсихотики первого поколения
К АП первого поколения относят большую группу ЛС, которые можно условно разделить на две подгруппы: с мощным антипсихотическим (инцизивным) действием и преимущественно седативным действием.
Антипсихотики с мощным антипсихотическим (инцизивным) действием. К этой подгруппе относят зарегистрированные в России галоперидол, дроперидол, зуклопентиксол, перфеназин, трифлуоперазин, флупентиксол, флуфеназин7 и использующиеся в других странах бенперидол*8, пенфлуридол*, прохлорперазин*, пимозид*, пипотиазин* и тиотиксен*.
Наибольшее количество проанализированных нами исследований (8 из 11) было посвящено галоперидолу, но их результаты противоречивы. Согласно данным, приведенным C. Iribarren и соавт., галоперидол вызывает УИ QTc [33], а по результатам исследования Y.T. Xiang и соавт. галоперидол обладает низким риском УИ QTc (уровень значимости p=0,03; отношение шансов (ОШ) 0,4; 95% доверительный интервал (ДИ): 0,1–0,9) [37]. S.L. Campleman и соавт. зафиксировали УИ QTc в среднем на 8,8 мс при использовании галоперидола в токсических дозах в 24,4% случаев (ОШ 2,6; 95% ДИ 1,3–5,4) [42]. E. Raschi и соавт. заявляют о повышении риска развития TdP при применении галоперидола [39]. Однако в ряде исследований не выявлено значимого УИ QTc при использовании галоперидола как в терапевтических [22], так и в токсических дозах [38]. N. Naksuk и соавт. не обнаружили повышения риска СВС у пациентов отделения интенсивной терапии, получавших низкие дозы галоперидола для купирования делирия [49]. B. Salvati и соавт. не обнаружили УИ QTc у пациентов, принимающих галоперидол в пероральной форме [28].
Зуклопентиксол, согласно данным M.E. Friedrich и соавт., не вызывает УИ QTc [22], однако повышает риск развития TdP по результатам исследования E. Raschi и соавт. [39]. По результатам трех исследований флупентиксол при приеме в терапевтических дозах не вызывает УИ QTc [22], в токсических дозах — вызывает УИ QTc <10 мс [5] и повышает риск развития TdP [39]. Флуфеназин по результатам исследования M.E. Friedrich и соавт. не вызывает УИ QTc [22]. Однако согласно данным P.D. Lambiase и соавт. этот АП вызывает УИ QTc <10 мс при использовании в терапевтических дозах [5] и >20 мс при использовании в токсических дозах [5]. Перфеназин и прохлорперазин* при применении в токсических дозах вызывают УИ QTc <10 мс [5], а трифлуоперазин не вызывает УИ QTc [38]. Результаты исследования S.R. Beach и соавт. показывают, что дроперидол вызывает УИ QTc у 1–9% пациентов, но не повышает риск развития TdP [50]. Бенперидол* вызывает УИ QTc, но реже, чем галоперидол (p=0,049) [51]. Пимозид* вызывает УИ QTc [33] и повышает риск развития TdP [39] у пациентов с психическими расстройствами.
Исследований влияния пенфлуридола*, пипотиазина* и тиотиксена* на интервал QTc за анализируемый период нами не найдено.
Антипсихотики с преимущественно седативным действием. Ко второй подгруппе АП первого поколения относят зарегистрированные в Российской Федерации хлорпромазин, тиоридазин, левомепромазин, перициазин, промазин, тиаприд, хлорпротиксен и незарегистрированные мезоридазин*, мелперон*, пипамперон*, циамемазин*.
Хлорпромазин вызывает УИ QTc (ОШ 1,9; 95% ДИ: 1,07–3,5) [33, 37], >10 мс при использовании в терапевтических [5] и в токсических дозах (17%; 95% ДИ: 7–36%) [38]. По результатам трех исследований тиоридазин вызывает УИ QTc [33] при использовании как в терапевтических (ОШ 4,4; 95% ДИ: 1,2–15,2) [37], так и в токсических дозах [38], а также повышает риск развития TdP [38]. Левомепромазин по результатам исследования M.E. Friedrich и соавт. не вызывает УИ QTc [22]. Однако согласно данным исследования P.D. Lambiase и соавт. он вызывает УИ QTc >10 мс при использовании в терапевтических дозах [5] и повышает риск развития TdP [39]. Согласно результатам исследования I. Berling и соавт. перициазин не вызывает УИ QTc при использовании в токсических дозах [38]. Хлорпротиксен не вызывает УИ QTc [22], но повышает риск развития TdP [39]. Промазин, тиаприд и пипамперон* также повышают риск развития TdP [39]. Мелперон* вызывает УИ QTc >10 мс при использовании в терапевтических дозах [5] и повышает риск развития TdP [39].
Исследований влияния мезоридазина* на интервал QTc за анализируемый период нами не найдено.
Антипсихотики второго поколения
К АП второго поколения относят подгруппы препаратов с преимущественно стимулирующим (дезингибирующим) действием, мультирецепторные блокаторы и селективные антагонисты дофаминовых и серотониновых рецепторов.
Антипсихотики с преимущественно стимулирующим (дезингибирующим) действием. К этой подгруппе можно отнести амисульприд и сульпирид9.
В исследованиях M.E. Friedrich и соавт. [22] и M.H. Zhu и соавт. [52] не выявлено УИ QTc при применении амисульприда. Однако в большинстве исследований обнаружено УИ QTc при его приеме: >10 мс при использовании в терапевтических дозах [5], частота случаев УИ QTс повышается при использовании препарата в токсических дозах (28%; 95% ДИ: 17–42%) [38, 52], что ассоциировано с повышением риска развития TdP [39].
Сульпирид, согласно данным двух исследований, вызывает УИ QTc при использовании в терапевтических дозах (ОШ 2,4; 95% ДИ: 1,3–4,5) [37], риск кардиотоксичности препарата повышается при его использовании в токсических дозах [5].
Мультирецепторные блокаторы (серотонин-дофаминовые 5-НТ2А/D2 антагонисты, антагонисты М1-рецепторов, антагонисты Н1-рецепторов). В Российской Федерации разрешено применение препаратов кветиапин, клозапин, оланзапин10. В других странах используют также азенапин*, зотепин*, клотиапин*, локсапин*.
По результатам исследования Y.T. Xiang и соавт. кветиапин обладает низким риском УИ QT (p=0,053; ОШ 0,2; 95% ДИ: 0,05–1,02) [37]. Согласно данным 7 исследований кветиапин вызывает УИ QTc [33, 34, 53] >10 мс при использовании в терапевтических дозах [5] и в среднем на 14,1 мс при приеме в токсических дозах в 20,4% случаев (ОШ 1,87; 95% ДИ: 1,5–2,4) [42], (12%; 95% ДИ: 5–27%) [38] и повышает риск развития TdP [39, 53]. При этом использование низких доз кветиапина для купирования делирия у пациентов отделения интенсивной терапии оказалось безопасным и не повышало риск СВС [49].
Клозапин вызывает УИ QTc [28, 33, 50] (ОШ 2,4; 95% ДИ: 1,4–4,2) [5, 22, 37] и повышает риск развития TdP [39]. Клотиапин* также вызывает УИ QTc [28]. По результатам исследования S.R. Beach и соавт. азенапин* вызывает значительное УИ QTc [50]. Однако P.D. Lambiase и соавт. обнаружили, что при использовании этого АП в токсических дозах УИ QTc составляет <10 мс [5].
Противоречивые выводы сделаны по результатам исследований оланзапина. По данным одних публикаций оланзапин вызывает значительное УИ QTc [50] и повышает риск развития TdP [39]. По данным других — оланзапин при приеме в средних и максимальных суточных дозах обладает низким риском УИ QT (p=0,03; ОШ 0,3; 95% ДИ: 0,1–0,9) [34, 37]. Прием оланзапина в токсических дозах, по данным S.L. Campleman и соавт., не вызывает УИ QTc [42], но результаты двух других исследований продемонстрировали негрубые УИ QTc: <10 мс [5] в 3% случаев (95% ДИ: 0,5–10%) [38]. Согласно результатам исследования W.S. Aronow и соавт. оланзапин не вызывает УИ QTc при монотерапии, но при политерапии с другими ЛС группы риска вызывает УИ QTc и повышает риск развития TdP [53], например в сочетании с антидепрессантами [23] и антиконвульсантами [54].
По результатам трех исследований локсапин* вызывает незначительное УИ QTc (на 4–5 мс) при приеме в терапевтических дозах [50] и <10 мс при использовании в токсических дозах [5], но при этом повышает риск развития TdP [39].
Исследований влияния зотепина* на интервал QTc за анализируемый период нами не найдено.
Селективные антагонисты дофаминовых D2-рецепторов и серотониновых 5-НТ2А-рецепторов. В этой подгруппе разрешены к применению в Российской Федерации зипрасидон, луразидон, палиперидон, рисперидон и сертиндол11. В других странах используют также блонансерин*, илоперидон*, пероспирон*.
По результатам 5 исследований зипрасидон вызывает значительное УИ QTc [33, 50] — более 10 мс [5] и даже более 30 мс [53], повышает риск развития TdP [39, 50], особенно при политерапии [23, 53, 54]. Сертиндол вызывает УИ QTc при использовании в терапевтических дозах: по одним данным, в среднем до 19 мс [41], по другим — более 20 мс [5]. Илоперидон* вызывает значительное УИ QTc — более 10 мс [50].
Рисперидон также вызывает УИ QTc [5, 33, 35, 37, 53]. При использовании в токсических дозах этот АП вызывает УИ QTc <10 мс [5], реже — от 12,0 (95% ДИ: 5–27%) [38] до 17,2% случаев (ОШ 1,4; 95% ДИ: 0,7–2,8) [42] — более 10 мс. Препарат повышает риск развития TdP [39, 53]. По данным S.R. Beach и соавт., рисперидон вызывает УИ QTc и повышает риск развития TdP при наличии других факторов риска [23, 50].
Палиперидон вызывает УИ QTc >10 мс только при использовании в токсических дозах [5]. Луразидон не вызывает УИ QTc [5, 28].
Блонансерин* не вызывает УИ QTc [55]. Однако R. Kambayashi и соавт. зарегистрировали случай развития TdP у японца с наследственным синдромом УИ QTc (LQT3) при смене терапии с пероспирона* на блонансерин* [36]. Авторы объяснили это тем, что блонансерин* может вызывать рефлекторно-индуцированное повышение симпатического тонуса, приводящее к увеличению тока кальция, входящего в кардиомиоциты. Таким образом, блонансерин* может вызывать внутриклеточную перегрузку кальцием, вызывающую раннюю постдеполяризацию мембраны кардиомиоцитов, что может объяснить появление TdP у пациента [36].
Исследований влияния пероспирона* на интервал QTc за анализируемый период нами не найдено.
Антипсихотики третьего поколения
АП третьего поколения представляют собой подгруппу парциальных агонистов дофаминовых рецепторов и подгруппу селективных агонистов обратного захвата серотонина и антагонистов серотониновых рецепторов.
Парциальные агонисты дофаминовых D2- и серотониновых 5-НТ1А-рецепторов и антагонисты серотониновых 5-НТ2А-рецепторов. К этой подгруппе относят арипипразол, брекспипразол, карипразин, разрешенные к медицинскому применению в Российской Федерации12, и применяемый за рубежом луматеперон*.
По результатам 5 исследований арипипразол не вызывает УИ QTс [22, 28, 56–59], в том числе при использовании в токсических дозах [38]. Согласно другим исследованиям, арипипразол вызывает УИ QTc в среднем на 7,6 мс в терапевтических дозах [33], <10 мс — при использовании в токсических дозах [5] или при политерапии [53], но может повышать риск развития TdP при наличии других факторов риска [39, 50] или политерапии [53]. Брекспипразол [5, 53] и карипразин не вызывают УИ QTc [5].
Исследований влияния луматеперона* на интервал QTc за анализируемый период нами не найдено.
Селективные агонисты обратного захвата серотонина и антагонист 5-HT2A рецепторов. Эта подгруппа в настоящее время представлена единственным АП — пимавансерином*, не зарегистрированным в Российской Федерации.
Пимавансерин* редко (в 1,1% случаев) вызывает УИ QTc >60 мс [60, 61]. В рандомизированном клиническом исследовании эффективности пимавансерина (фаза III) для терапии психотических симптомов у пациентов с болезнью Паркинсона или болезнью Альцгеймера среднее УИ QTс составило 5,4 ± 0,9 мс. У одного пациента (3%) наблюдалось бессимптомное увеличение QTc более чем на 60 мс. Всего при применении пимавансерина* было зарегистрировано 5 случаев клинически значимого, но бессимптомного УИ QTс (1,3%) [40].
Обновление данных о кардиотоксичности антипсихотиков
Проведенные нами анализ публикаций последних лет и систематизация данных продемонстрировали, что большинство АП первого поколения дозозависимо увеличивают длительность интервала QTc, в низких дозах не оказывая кардиотоксического действия, но проявляя его в высоких терапевтических и токсических дозах. Важное значение имеет форма приема АП. Например, применение парентеральной формы галоперидола требует от психиатра большей настороженности в плане этой кардиотоксической НР. Принято считать, что внутривенное введение галоперидола несет более высокий риск УИ QTc и развития TdP, чем пероральный прием. Y. Ozeki и соавт. обнаружили, что из 11 случаев летального исхода в результате TdP 8 случаев произошли при внутривенном применении галоперидола [62]. В связи с этим FDA рекомендовало проводить ЭКГ всем пациентам, получающим галоперидол [44]. Однако в более позднем исследовании S.R. Beach и соавт. не обнаружено однозначного доказательства того, что внутривенное введение некоторых АП (в частности, галоперидола) сопряжено с бо́льшим риском УИ QTс или TdP, чем применение других АП. По данным большинства проспективных исследований внутривенное использование галоперидола не вызывало большего УИ QTс, чем плацебо, а частота развития TdP оказалась низкой [63].
Среди АП первого поколения риски УИ QTc и развития TdP выше у ЛС подгруппы с преимущественно седативным эффектом по сравнению с препаратами подгруппы инцизивных АП. Наибольший риск УИ QTc имеют тиоридазин, хлорпромазин и левомепромазин. По требованию FDA в 2000 г. фармацевтическая компания Novartis внесла поправки в маркировку тиоридазина с указанием на риск развития TdP и СВС при его приеме [64].
Широко распространено мнение, что АП второго поколения реже вызывают УИ QTс по сравнению с АП первого поколения [1]. Результаты проведенного нами обзора не позволяют подтвердить эту точку зрения. Для АП второго и третьего поколений в меньшей степени характерна связь между концентрацией АП в сыворотке крови и выраженностью УИ QTс [65], в то время как дозозависимая кардиотоксичность характерна для АП первого поколения. Все АП второго поколения (подгруппы с преимущественно дезингибирующим действием и подгруппы мультирецепторных блокаторов) удлиняют интервал QTc и повышают риск TdP (наиболее высокий риск имеет клозапин). Неоднозначны результаты исследований оланзапина. W.S. Aronow и соавт., проанализировав базу данных Medicaid, пришли к выводу, что кветиапин связан с меньшим риском TdP и СВС по сравнению с оланзапином [53]. Однако, согласно данным исследований M.P. Hanna и соавт., УИ QTc чаще наблюдалось у пациентов, принимавших кветиапин, чем оланзапин, хотя количество случаев этой НР при приеме обоих АП в когорте было относительно низким [34]. В 2011 г. FDA выпустило предупреждение о способности кветиапина вызывать УИ QTс при передозировке или при наличии значимых факторов риска [50] и поручило компании AstraZeneca добавить предупреждение к маркировке кветиапина о возможности развития УИ QTc и TdP при его приеме [47].
Большинство АП подгруппы селективных антагонистов дофаминовых и серотониновых рецепторов удлиняют интервал QTc и повышают риск развития TdP. В наибольшей степени это характерно для сертиндола и зипрасидона. Низкий риск развития этой НР выявлен для палиперидона. Не обнаружено УИ QTc при приеме луразидона.
Наиболее безопасными с точки зрения возникновения УИ QTc представляются АП подгруппы парциальных агонистов дофаминовых и серотониновых 5-НТ1А-рецепторов. Редкие сообщения об УИ QTс и развитии TdP относились только к арипипразолу. Сведений о развитии кардиотоксических НР при приеме брекспипразола и карипразина нами не обнаружено.
В исследовании C. Bordet и соавт. сертиндол продемонстрировал самый высокий риск УИ QTс, за ним следовали зипразидон и амисульприд. Наименьший риск УИ QTc выявлен для луразидона. АП первого поколения были связаны с более высоким риском УИ QTс (ОШ 1,21; 95% ДИ: 1,10–1,33), чем АП второго поколения [45].
Согласно результатам исследования A. Preda и соавт. риск УИ QTс был значительно ниже у пациентов, получавших арипипразол, по сравнению с теми, кто получал клозапин (ОШ 0,29; 95% ДИ: 0,22–0,38 и ОШ 0,05; 95% ДИ: 0,0–0,79) [66]. S.R. Beach и соавт. показали, что тиоридазин, зипразидон и препараты галоперидола для внутривенного применения имели наибольший риск УИ QTс и ассоциировались с развитием TdP. Арипипразол оказался наиболее безопасным АП [67]. В исследовании C.S. Wu и соавт. наибольший риск АП-индуцированного УИ QTc был обнаружен для клотиапина*, галоперидола, прохлорперазина*, тиоридазина, оланзапина, кветиапина, рисперидона и сульпирида [68].
На основе результатов ранее проведенных исследований [28, 50, 69–71], в зависимости от риска УИ QTc применяющиеся в реальной клинической практике АП были разделены нами на 3 группы: низкого (арипипразол, луразидон, карипразин, палиперидон, зуклопентиксол), умеренного (кветиапин, перфеназин, флуфеназин, оланзапин, клотиапин*, галоперидол) и высокого риска (хлорпромазин, промазин, клозапин, левомепромазин, зипрасидон).
Однако связь между АП-индуцированным УИ QTс и развитием TdP неоднозначна. В случае гомогенного действия АП на кардиомиоциты риск развития ТdP может быть низкий, несмотря на значительное УИ QTс [26]. Для проверки риска развития АП-индуцированной TdP все рассмотренные АП (табл. 113) были занесены нами в поисковую систему базы данных CredibleMeds — постоянно обновляемого ресурса, разработанного специалистами Аризонского университета (Arizona Center for Education and Reserch on Therapeutics, AzCERT)14. Это некоммерческий проект, основной задачей которого является содействие безопасному использованию ЛС. В соответствии с полученными результатами, в CredibleMeds® АП разделены на 4 группы согласно риску развития TdP (рис. 2).
К группе имеющих известный риск развития TdP отнесены АП, для которых представлены веские доказательства, подтверждающие, что эти АП удлиняют интервал QT и явно связаны с риском TdP, даже если их принимать в соответствии с официальной инструкцией по медицинскому применению. К группе ЛС возможного риска отнесены АП, для которых имеются веские доказательства ассоциации применения этих препаратов с возможным удлинением интервала QT, но в настоящее время недостаточно доказательств того, что эти АП при использовании в соответствии с указаниями в официальной инструкции по медицинскому применению связаны с риском развития TdP. К группе ЛС условного риска отнесены АП, для которых имеются существенные данные, подтверждающие связь между их применением и риском TdP, но только при определенных условиях (например, избыточная доза, гипокалиемия, врожденный УИ QT или взаимодействие между АП, которое приводит к УИ QT).
В отдельную группу включены АП, для которых нет достаточных сведений о влиянии на интервал QT. Эти АП рассмотрены в базе данных CredibleMeds, но имеющиеся в настоящее время доказательства недостаточны для отнесения АП ни к одной из категорий риска желудочковой тахикардии. Это не является свидетельством отсутствия рисков УИ QT или TdP при применении данных АП, так как не исключена вероятность, что ЛС не были должным образом протестированы.
Рекомендации по снижению риска развития антипсихотик-индуцированной TdP
Учитывая приведенные в настоящем обзоре данные, для уменьшения риска АП-индуцированной TdP нами сформулированы следующие рекомендации:
1) с осторожностью назначать АП, удлиняющий интервал QTc, пациентам, имеющим модифицируемые и немодифицируемые факторы риска (рис. 3);
2) избегать назначения АП, удлиняющего интервал QTc, пациентам с интервалом QTc >450 мс до лечения;
3) прекратить прием АП, удлиняющего интервал QTc, если интервал QTc удлиняется до 500 мс и более после начала терапии;
4) уменьшить дозу или прекратить прием АП, удлиняющего интервал QTc, если интервал QTc увеличивается на 60 мс и более по сравнению с его значением до лечения;
5) поддерживать концентрацию калия, магния и кальция в сыворотке крови в пределах нормы;
6) избегать клинически значимых межлекарственных взаимодействий, повышающих риск УИ QTc;
7) избегать быстрого внутривенного введения АП, удлиняющего интервал QTc;
8) избегать одновременного применения более одного АП, удлиняющего интервал QTс;
9) избегать использования АП, удлиняющего интервал QTc, у пациентов с TdP в анамнезе или у тех, у кого ранее была проведена реанимация после эпизода внезапной сердечной смерти.
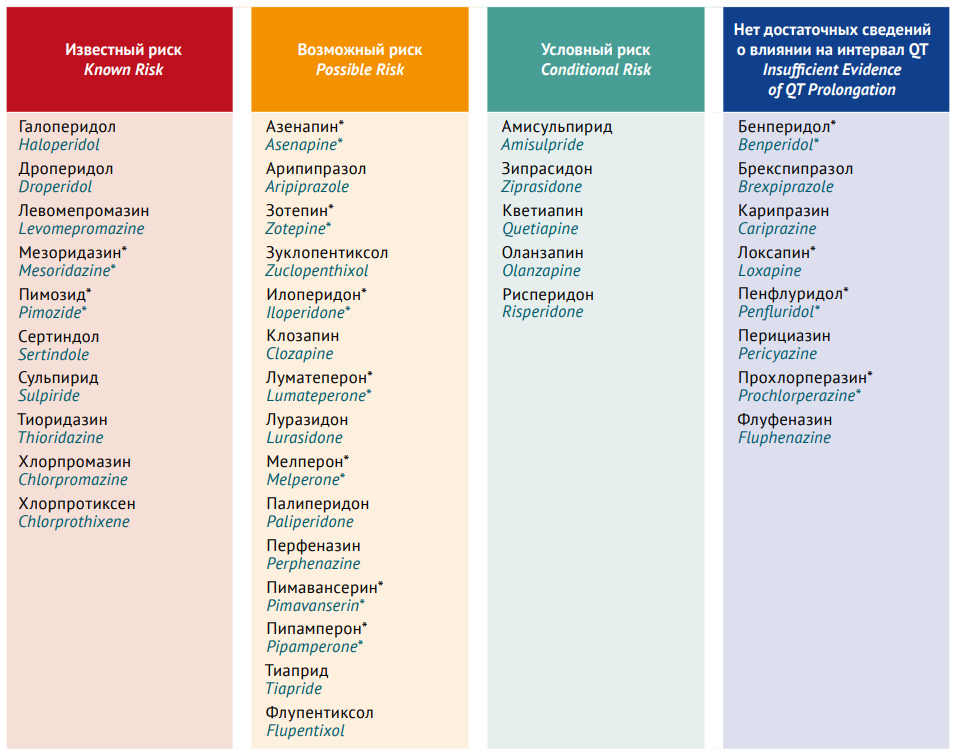
Рис. 2. Распределение антипсихотиков по группам в соответствии с риском развития Torsade de Pointes (по данным www.CredibleMeds.org). Знаком «*» отмечены лекарственные препараты, не зарегистрированные в Российской Федерации
Примечание. В списке QTdrugs базы Crediblemeds.org отсутствуют данные о препаратах блонансерин*, клотиапин*, пероспирон*, пипотиазин*, промазин, тиотиксен*, трифлуоперазин (дата последнего обновления 12.12.2023)
Fig. 2. Antipsychotics grouped by the drug-associated risk of Torsade de Pointes (according to www.CredibleMeds.org). Asterisks (*) show antipsychotics that are not approved in Russia
Note. The QTdrugs list at CredibleMeds.org does not include data on blonanserin*, clotiapine*, perospirone*, pipothiazine*, promazine, thiothixene*, and trifluoperazine (last update: 12.12.2023)
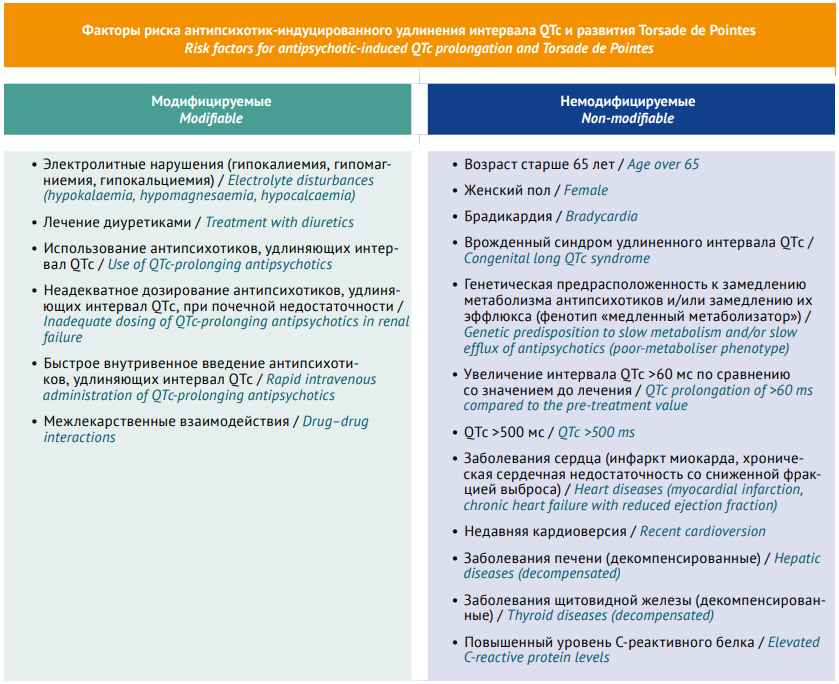
Рис. 3. Факторы риска антипсихотик-индуцированного удлинения интервала QTc и развития Torsade de Pointes (адаптировано авторами из [23])
Fig. 3. Risk factors for antipsychotic-induced QTc prolongation and Torsade de Pointes (adapted by the authors from [23])
Примечание. QTс – скорректированный интервал QT.
Note. QTc, corrected QT interval.
Заключение
Результаты анализа проведенных ранее исследований демонстрируют, что основной механизм кардиотоксического действия АП заключается в ингибировании ими потенциал-зависимых ионных каналов мембраны кардиомиоцитов (прежде всего калиевых). Большинство АП первого поколения оказывают дозозависимый эффект на длительность интервала QTc, при этом наибольшим риском удлинения интервала QTc и развития TdP обладают тиоридазин, хлорпромазин и левомепромазин. Считается, что применение АП новых поколений ассоциировано с меньшим риском удлинения интервала QTс по сравнению с АП первого поколения, но результаты проведенного нами обзора опровергают эту точку зрения. Для АП второго и третьего поколений в меньшей степени характерна связь между их сывороточной концентрацией и выраженностью удлинения интервала QTс. Все АП второго поколения удлиняют интервал QTc и повышают риск TdP, наибольший риск связывают с применением клозапина и оланзапина. В зависимости от степени риска удлинения интервала QTc АП могут быть разделены на 3 группы: низкого (арипипразол, луразидон, карипразин, палиперидон, зуклопентиксол), умеренного (кветиапин, перфеназин, флуфеназин, оланзапин, клотиапин, галоперидол) и высокого риска (хлорпромазин, промазин, клозапин, левомепромазин, зипрасидон). Обнаружено, что связь между АП-индуцированным удлинением интервала QTс и развитием TdP неоднозначна. В случае гомогенного действия АП на кардиомиоциты риск развития ТdP низкий, несмотря на значительное удлинение интервала QTс.
Целесообразно до начала и на фоне приема АП проводить динамическую оценку продолжительности интервала QTс для достижения оптимального баланса между эффективностью и безопасностью психофармакотерапии и минимизации вероятности возникновения потенциально фатальных АП-индуцированных аритмогенных кардиологических НР.
Обобщенные данные о механизмах АП-индуцированного УИ QTс, о влиянии АП разных фармакологических групп и поколений на длительность интервала QTс и риск развития TdP у пациентов с психическими расстройствами могут быть востребованы психиатрами и клиническими фармакологами. Подбор АП, их доз и длительности приема на основе предложенных рекомендаций будет способствовать минимизации вероятности возникновения потенциально фатальных АП-индуцированных аритмогенных кардиологических НР.
1 Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации. Минздрав России; 2020. https://cr.minzdrav.gov.ru/schema/569_1#doc_a2
2 E14 Clinical evaluation of QT/QTc interval prolongation and proarrhythmic potential for non-antiarrhythmic drugs. FDA-2004-D-0241. FDA; 2018. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/e14-clinical-evaluation-qtqtc-interval-prolongation-and-proarrhythmic-potential-non-antiarrhythmic-0
3 Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации. Минздрав России; 2020. https://cr.minzdrav.gov.ru/schema/569_1#doc_a2
4 Там же.
5 E14 and S7B Clinical and nonclinical evaluation of QT/QTc interval prolongation and proarrhythmic potential — Questions and answers. Guidance for Industry. ICH; 2022. https://www.fda.gov/media/161198/download
6 https://doi.org/10.30895/2312-7821-2024-410-tabl1
7 https://grls.rosminzdrav.ru/
8 Здесь и далее в статье знаком «*» отмечены антипсихотики, не зарегистрированные в Российской Федерации.
9 https://grls.rosminzdrav.ru/
10 Там же.
11 Там же.
12 https://grls.rosminzdrav.ru/
13 https://doi.org/10.30895/2312-7821-2024-410-tabl1
14 www.CredibleMeds.org
Список литературы
1. Chohan PS, Mittal R, Javed A. Antipsychotic medication and QT prolongation. Pak J Med Sci. 2015;31(5):1269–71. https://doi.org/10.12669/pjms.315.8998
2. Khasanova AK. Pharmacogenetic factors of clozapine-induced metabolic syndrome. Personalized Psychiatry and Neurology. 2023;3(2):38–47. https://doi.org/10.52667/2712-9179-2023-3-2-38-47
3. Giardin F, Gex-Fabry M, Berney P, Shah D, Gaspoz J, Dayer P. Drug-induced long QT in adult psychiatric inpatients: the 5-year cross-sectional ECG screening outcome in psychiatry study. Am J Psychiatry. 2013;170(12):1468–76. https://doi.org/10.1176/appi.ajp.2013.12060860
4. Акимова ЕС, Зиганшина ЛЕ, Лоранская ИД, Качан ВО, Клепикова МВ, Кочетков АИ и др. Лекарственно-индуцированные заболевания. М.: Прометей; 2022. EDN: SSCIYA
5. Lambiase PD, de Bono JP, Schilling RJ, Lowe M, Turley A, Slade A, et al. British Heart Rhythm Society Clinical practice guidelines on the management of patients developing QT prolongation on antipsychotic medication. Arrhythm Electrophysiol Rev. 2019;8(3):161–5. https://doi.org/10.15420/aer.2019.8.3.G1
6. Абриталин ЕЮ, Александровский ЮА, Ананьева НИ, Аничков АД, Ахапкин РВ, Букреева НД и др. Психиатрия: национальное руководство. М.: ГЭОТАР-Медиа; 2018. EDN: YMILDU
7. Gorobets LN, Semenova ND, Litvinov AV. Application of antipsychotic medication: gender differences in tolerance and medication response. Personalized Psychiatry and Neurology. 2022;2(2):57–66. https://doi.org/10.52667/2712-9179-2022-2-2-57-66
8. Zhou J, Zhu T, Zhu X, Galling B, Xiao L. Factors associated with antipsychotic use in non-psychotic depressed patients: results from a clinical multicenter survey. BMC Psychiatry. 2022;22(1):80. https://doi.org/10.1186/s12888-021-03411-y
9. Jha MK, Mathew SJ. Pharmacotherapies for treatment-resistant depression: how antipsychotics fit in the rapidly evolving therapeutic landscape. Am J Psychiatry. 2023;180(3):190–9. https://doi.org/10.1176/appi.ajp.20230025
10. Roessner V, Eichele H, Stern JS, Skov L, Rizzo R, Debes NM, et al. European clinical guidelines for Tourette syndrome and other tic disorders—version 2.0. Part III: pharmacological treatment. Eur Child Adolesc Psychiatry. 2022;31(3):425–41. https://doi.org/10.1007/s00787-021-01899-z
11. Leichsenring F, Heim N, Leweke F, Spitzer C, Steinert C, Kernberg OF. Borderline personality disorder: a review. JAMA. 2023;329(8):670–9. https://doi.org/10.1001/jama.2023.0589
12. Pascual JC, Arias L, Soler J. Pharmacological management of borderline personality disorder and common comorbidities. CNS Drugs. 2023;37:489–97. https://doi.org/10.1007/s40263-023-01015-6
13. Gomes T, Khuu W, Tadrous M, Vigod S, Cobigo V, Lunsky Y. Antipsychotic initiation among adults with intellectual and developmental disabilities in Ontario: a population-based cohort study. BMJ Open. 2019;9(7):e028125. https://doi.org/10.1136/bmjopen-2018-028125
14. Pompili M, Ducci G, Galluzzo A, Rosso G, Palumbo C, De Berardis D. The management of psychomotor agitation associated with schizophrenia or bipolar disorder: a brief review. Int J Environ Res Public Health. 2021;18(8):4368. https://doi.org/10.3390/ijerph18084368
15. Zareifopoulos N, Panayiotakopoulos G. Treatment options for acute agitation in psychiatric patients: theoretical and empirical evidence. Cureus. 2019;11(11):e6152. https://doi.org/10.7759/cureus.6152
16. Orzelska-Górka J, Mikulska J, Wiszniewska A, Biała G. New atypical antipsychotics in the treatment of schizophrenia and depression. Int J Mol Sci. 2022;23(18):10624. https://doi.org/10.3390/ijms231810624
17. MacKenzie NE, Kowalchuk C, Agarwal SM, Costa-Dookhan KA, Caravaggio F, Gerretsen P, et al. Antipsychotics, metabolic adverse effects, and cognitive function in schizophrenia. Front Psychiatry. 2018;9:622. https://doi.org/10.3389/fpsyt.2018.00622
18. Wunderink L. Personalizing antipsychotic treatment: evidence and thoughts on individualized tailoring of antipsychotic dosage in the treatment of psychotic disorders. Ther Adv Psychopharmacol. 2019;9:2045125319836566. https://doi.org/10.1177/2045125319836566
19. Остроумова ОД, Голобородова ИВ. Лекарственно-индуцированное удлинение интервала QT: распространенность, факторы риска, лечение и профилактика. Consilium Medicum. 2019;21(5):62–7. https://doi.org/10.26442/20751753.2019.5.190415
20. Волков ВП. Кардиотоксичность антипсихотических препаратов. Тверь: Триада; 2018. EDN: YMHBSX
21. Волков ВП. Нейролептическая кардиомиопатия. Тверь: Триада; 2020. EDN: TKMHCF
22. Friedrich ME, Winkler D, Konstantinidis A, Huf W, Engel R, Toto S, et al. Cardiovascular adverse reactions during antipsychotic treatment: results of AMSP, a drug surveillance program between 1993 and 2013. Int J Neuropsychopharmacol. 2020;23(2):67–75. https://doi.org/10.1093/ijnp/pyz046
23. Shnayder NA, Kidyaeva AV, Vaiman EE, Asadullin AR, Petrova MM, Kaskaeva DS, et al. Role of pharmacokinetics and pharmacogenetics of antidepressant-induced prolongation of the QT interval and Torsade de Pointes in patients with mental disorders. Personalized Psychiatry and Neurology. 2023;3(2):72–119. https://doi.org/10.52667/2712-9179-2023-3-2-72-119
24. Vandenberk B, Vandael E, Robyns T, Vandenberghe J, Garweg C, Foulon V, et al. Which QT correction formulae to use for QT monitoring? J Am Heart Assoc. 2016;5(6):e003264. https://doi.org/10.1161/JAHA.116.003264
25. Drew BJ, Ackerman MJ, Funk M, Gibler WB, Kligfield P, Menon V, et al. Prevention of Torsade de Pointes in hospital settings: a scientific statement from the American Heart Association and the American College of Cardiology Foundation. Circulation. 2010;121(8):1047–60. https://doi.org/10.1161/CIRCULATIONAHA.109.192704
26. Khatib R, Sabir FRN, Omari C, Pepper C, Tayebjee MH. Managing drug-induced QT prolongation in clinical practice. Postgrad Med J. 2021;97(1149):452–8. https://doi.org/10.1136/postgradmedj-2020-138661
27. Rochester MP, Kane AM, Linnebur SA, Fixen DR. Evaluating the risk of QTc prolongation associated with antidepressant use in older adults: a review of the evidence. Ther Adv Drug Saf. 2018;9(6):297–308. https://doi.org/10.1177/2042098618772979
28. Salvati B, Miola A, Toffanin T, Pigato G, Pavan C, Favaro A, et al. Prevalence and risk factors for QTc prolongation in acute psychiatric hospitalization. Prim Care Companion CNS Disord. 2022;24(1):21m02915. https://doi.org/10.4088/PCC.21m02915
29. Christensen L, Turner JR, Peterson GM, Naunton M, Thomas J, Yee KC, Kosari S. Identification of risk of QT prolongation by pharmacists when conducting medication reviews in residential aged care settings: a missed opportunity? J Clin Med. 2019;8(11):1866. https://doi.org/10.3390/jcm8111866
30. Danielsson B, Collin J, Nyman A, Bergendal A, Borg N, State M, et al. Drug use and torsades de pointes cardiac arrhythmias in Sweden: a nationwide register-based cohort study. BMJ Open. 2020;10(3):e034560. https://doi.org/10.1136/bmjopen-2019-034560
31. Salem JE, Dureau P, Bachelot A, Germain M, Voiriot P, Lebourgeois B, et al. Association of oral contraceptives with drug-induced QT interval prolongation in healthy nonmenopausal women. JAMA Cardiol. 2018;3(9):877–82. https://doi.org/10.1001/jamacardio.2018.2251
32. Li M, Ramos LG. Drug-induced QT prolongation and Torsades de Pointes. P T. 2017;42(7):473–7. PMID: 28674475
33. Iribarren C, Round AD, Peng JA, Lu M, Zaroff JG, Holve TJ, et al. Validation of a population-based method to assess drug-induced alterations in the QT interval: a self-controlled crossover study. Pharmacoepidemiol Drug Saf. 2013;22(11):1222–32. https://doi.org/10.1002/pds.3479
34. Hanna MP, Adie SK, Ketcham SW, Deshmukh A, Gondi K, Abdul-Aziz AA, et al. Atypical antipsychotic safety in the CICU. Am J Cardiol. 2022;163:117–23. https://doi.org/10.1016/j.amjcard.2021.09.052
35. Mizuki Y, Takaki M. Blonanserin ameliorated the tendency toward QTc prolongation associated with risperidone in a patient with schizophrenia. J Clin Psychopharmacol. 2015;35(1):101–2. https://doi.org/10.1097/JCP.0000000000000267
36. Kambayashi R, Hagiwara-Nagasawa M, Goto A, Chiba K, Izumi-Nakaseko H, Naito AT, et al. Experimental analysis of the onset mechanism of TdP reported in an LQT3 patient during pharmacological treatment with serotonin-dopamine antagonists against insomnia and nocturnal delirium. Heart Vessels. 2020;35(4):593–602. https://doi.org/10.1007/s00380-019-01521-y
37. Xiang YT, Chiu HF, Ungvari GS, Correll CU, Lai KY, Wang CY, et al. QTc prolongation in schizophrenia patients in Asia: clinical correlates and trends between 2004 and 2008/2009. Hum Psychopharmacol. 2015;30(2):94–9. https://doi.org/10.1002/hup.2458
38. Berling I, Isbister GK. Prolonged QT risk assessment in antipsychotic overdose using the QT nomogram. Ann Emerg Med. 2015;66(2):154–64. https://doi.org/10.1016/j.annemergmed.2014.12.005
39. Raschi E, Poluzzi E, Salvo F, Koci A, Suling M, Antoniazzi S, et al. The contribution of national spontaneous reporting systems to detect signals of torsadogenicity: issues emerging from the ARITMO project. Drug Saf. 2016;39(1):59–68. https://doi.org/10.1007/s40264-015-0353-1
40. Tariot PN, Cummings JL, Soto-Martin ME, Ballard C, Erten-Lyons D, Sultzer DL, et al. Trial of pimavanserin in dementia-related psychosis. N Engl J Med. 2021;385(4):309–19. https://doi.org/10.1056/NEJMoa2034634
41. Nielsen J, Wang F, Graff C, Kanters JK. QT dynamics during treatment with sertindole. Ther Adv Psychopharmacol. 2015;5(1):26–31. https://doi.org/10.1177/2045125314560738
42. Campleman SL, Brent J, Pizon AF, Shulman J, Wax P, Manini AF; Toxicology Investigators’ Consortium (ToxIC). Drug-specific risk of severe QT prolongation following acute drug overdose. Clin Toxicol (Phila). 2020;58(12):1326–34. https://doi.org/10.1080/15563650.2020.1746330
43. Pereira L, Budovich A, Claudio-Saez M. Monitoring of metabolic adverse effects associated with atypical antipsychotic use in an outpatient psychiatric clinic. J Pharm Pract. 2018;32:1–6. https://doi.org/10.1177/0897190017752712
44. Sicouri S, Antzelevitch C. Mechanisms underlying the actions of antidepressant and antipsychotic drugs that cause sudden cardiac arrest. Arrhythm Electrophysiol Rev. 2018;7(3):199–209. https://doi.org/10.15420/aer.2018.29.2
45. Bordet C, Garcia P, Salvo F, Touafchia A, Galinier M, Sommet A, Montastruc F. Antipsychotics and risk of QT prolongation: a pharmacovigilance study. Psychopharmacology (Berl). 2023;240(1):199–202. https://doi.org/10.1007/s00213-022-06293-4
46. Yap YG, Camm AJ. Drug induced QT prolongation and Torsades de Pointes. Heart. 2003;89(11):1363–72. https://doi.org/10.1136/heart.89.11.1363
47. Hasnain M, Vieweg WV, Howland RH, Kogut C, Breden Crouse EL, Koneru JN, et al. Quetiapine and the need for a thorough QT/QTc study. J Clin Psychopharmacol. 2014;34(1):3–6. https://doi.org/10.1097/JCP.0000000000000075
48. Duncan RS, McPate MJ, Ridley JM, Gao Z, James AF, Leishman DJ, et al. Inhibition of the HERG potassium channel by the tricyclic antidepressant doxepin. Biochem Pharmacol. 2007;74(3):425–37. https://doi.org/10.1016/j.bcp.2007.04.024
49. Naksuk N, Thongprayoon C, Park JY, Sharma S, Gaba P, Rosenbaum AN, et al. Editor’s choice-clinical impact of delirium and antipsychotic therapy: 10-year experience from a referral coronary care unit. Eur Heart J Acute Cardiovasc Care. 2017;6(6):560–8. https://doi.org/10.1177/2048872615592232
50. Beach SR, Celano CM, Sugrue AM, Adams C, Ackerman MJ, Noseworthy PA, Huffman JC. QT prolongation, Torsades de Pointes, and psychotropic medications: a five year update. Psychosomatics. 2018;59(2):105–22. https://doi.org/10.1016/j.psym.2017.10.009
51. Schmidt A, Fischer P, Wally B, Scharfetter J. Influence of intravenous administration of the antipsychotic drug benperidol on the QT interval. Neuropsychiatr. 2017;31(4):172–5. https://doi.org/10.1007/s40211-017-0230-5
52. Zhu MH, Liu ZJ, Hu QY, Yang JY, Jin Y, Zhu N, et al. Amisulpride augmentation therapy improves cognitive performance and psychopathology in clozapine-resistant treatment-refractory schizophrenia: a 12-week randomized, double-blind, placebo-controlled trial. Mil Med Res. 2022;9(1):59. https://doi.org/10.1186/s40779-022-00420-0
53. Aronow WS, Shamliyan TA. Effects of atypical antipsychotic drugs on QT interval in patients with mental disorders. Ann Transl Med. 2018;6(8):147. https://doi.org/10.21037/atm.2018.03.17
54. Zhuravlev NM, Shnayder NA, Vaiman EE, Abdyrakhmanova AK, Petrova MM, Bochanova EN, et al. Interindividual variability of anticonvulsant-induced QT prolongation risk. Personalized Psychiatry and Neurology. 2022;1(2):22–45. https://doi.org/10.52667/2712-9179-2022-2-1-23-45
55. Iwata N, Ishigooka J, Naoi I, Matsumoto M, Kanamori Y, Nakamura H, Higuchi T. Long-term safety and efficacy of blonanserin transdermal patches in Japanese patients with schizophrenia: a 52-week open-label, multicenter study. CNS Drugs. 2020;34(1):103–16. https://doi.org/10.1007/s40263-019-00692-6
56. Kane JM, Peters-Strickland T, Baker RA, Hertel P, Eramo A, Jin N, et al. Aripiprazole once-monthly in the acute treatment of schizophrenia: findings from a 12-week, randomized, double-blind, placebo-controlled study. J Clin Psychiatry. 2014;75(11):1254–60. https://doi.org/10.4088/JCP.14m09168
57. Nasrallah HA, Aquila R, Du Y, Stanford AD, Claxton A, Weiden PJ. Long-term safety and tolerability of aripiprazole lauroxil in patients with schizophrenia. CNS Spectr. 2019;24(4):395–403. https://doi.org/10.1017/S1092852918001104
58. Pigott TA, Carson WH, Saha AR, Torbeyns AF, Stock EG, Ingenito GG; Aripiprazole Study Group. Aripiprazole for the prevention of relapse in stabilized patients with chronic schizophrenia: a placebo-controlled 26-week study. J Clin Psychiatry. 2003;64(9):1048–56. https://doi.org/10.4088/jcp.v64n0910
59. Kasper S, Lerman MN, McQuade RD, Saha A, Carson WH, Ali M, et al. Efficacy and safety of aripiprazole vs. haloperidol for long-term maintenance treatment following acute relapse of schizophrenia. Int J Neuropsychopharmacol. 2003;6(4):325–37. https://doi.org/10.1017/S1461145703003651
60. Bugarski-Kirola D, Bitter I, Liu IY, Abbs B, Stankovic S. ENHANCE: phase 3, randomized, double-blind, placebo-controlled study of adjunctive pimavanserin for schizophrenia in patients with an inadequate response to antipsychotic treatment. Schizophr Bull Open. 2022;3:sgac006. https://doi.org/10.1093/schizbullopen/sgac006
61. Bugarski-Kirola D, Arango C, Fava M, Nasrallah H, Liu IY, Abbs B, Stankovic S. Pimavanserin for negative symptoms of schizophrenia: results from the ADVANCE phase 2 randomised, placebo-controlled trial in North America and Europe. Lancet Psychiatry. 2022;9(1):46–58. https://doi.org/10.1016/S2215-0366(21)00386-2
62. Ozeki Y, Fujii K, Kurimoto N, Yamada N, Okawa M, Aoki T, et al. QTc prolongation and antipsy chotic medications in a sample of 1017 patients with schizo phrenia. Prog Neuropsychopharmacol Biol Psychiatry. 2010;34(2):401–5. https://doi.org/10.1016/j.pnpbp.2010.01.008
63. Beach SR, Gross AF, Hartney KE, Taylor JB, Rundell JR. Intravenous haloperidol: a systematic review of side effects and recommendations for clinical use. Gen Hosp Psychiatry. 2020;67:42–50. https://doi.org/10.1016/j.genhosppsych.2020.08.008
64. Малин ДИ, Рывкин ПВ, Булатова ДР. Синдром удлиненного интервала QT при применении антипсихотических и антидепрессивных препаратов. Современная терапия психических расстройств. 2023;(2):48–56. https://doi.org/10.21265/PSYPH.2023.69.57.006
65. Hommers L, Scherf-Clavel M, Stempel R, Roth J, Falter M, Deckert J, et al. Antipsychotics in routine treatment are minor contributors to QT prolongation compared to genetics and age. J Psychopharmacol. 2021;35(9):1127–33. https://doi.org/10.1177/02698811211003477
66. Preda A, Shapiro BB. A safety evaluation of aripiprazole in the treatment of schizophrenia. Expert Opin Drug Saf. 2020;19(12):1529–38. https://doi.org/10.1080/14740338.2020.1832990
67. Beach SR, Celano CM, Noseworthy PA, Januzzi JL, Huffman JC. QTc prolongation, torsades de pointes, and psychotropic medications. Psychosomatics. 2013;54(1):1–13. https://doi.org/10.1016/j.psym.2012.11.001
68. Wu CS, Tsai YT, Tsai HJ. Antipsychotic drugs and the risk of ventricular arrhythmia and/or sudden cardiac death: a nation-wide case-crossover study. J Am Heart Assoc. 2015;4(2):e001568. https://doi.org/10.1161/JAHA.114.001568
69. Leucht S, Cipriani A, Spineli L, et al. Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis. Lancet. 2015;3:925–927. https://doi.org/10.1016/S0140-6736(13)60733-3
70. Carrà G, Crocamo C, Bartoli F, Lax A, Tremolada M, Lucii C, et al. First-generation antipsychotics and QTc: any role for mediating variables? Hum Psycho pharmacol. 2016;31(4):313–8. https://doi.org/10.1002/hup.2540
71. Silvestre JS, Prous JR. Comparative evaluation of hERG potassium channel blockade by antipsychotics. Methods Find Exp Clin Pharmacol. 2007;29(7):457–65. https://doi.org/10.1358/mf.2007.29.7.1119172
72. Lehmann DF, Eggleston WD, Wang D. Validation and clinical utility of the hERG IC 50 :C max ratio to determine the risk of drug-induced Torsades de Pointes: a meta-analysis. Pharmacotherapy. 2018;38(3):341–8. https://doi.org/10.1002/phar.2087
73. Tie H, Walker BD, Valenzuela SM, Breit SN, Campbell TJ. The heart of psychotropic drug therapy. Lancet. 2000;355(9217):1825. https://doi.org/10.1016/S0140-6736(05)73083-X
74. Le Marois M, Sanson C, Maizières MA, Partiseti M, Bohme GA. The atypic antipsychotic clozapine inhibits multiple cardiac ion channels. Naunyn Schmiedebergs Arch Pharmacol. 2023;396(1):161–6. https://doi.org/10.1007/s00210-022-02314-3
75. Lee HJ, Choi JS, Hahn SJ. Mechanism of inhibition by olanzapine of cloned hERG potassium channels. Neurosci Lett. 2015;609:97–102. https://doi.org/10.1016/j.neulet.2015.10.039
76. Lee HJ, Choi BH, Choi JS, Hahn SJ. Effects of iloperidone on hERG 1A/3.1 heterotetrameric channels. Neuroreport. 2021;32(16):1299–306. https://doi.org/10.1097/WNR.0000000000001724
77. Lee HJ, Choi JS, Choi BH, Hahn SJ. Inhibition of cloned hERG potassium channels by risperidone and paliperidone. Naunyn Schmiedebergs Arch Pharmacol. 2017;390(6):633–42. https://doi.org/10.1007/s00210-017-1364-5
78. Tamargo J. Drug-induced Torsade de Pointes: from molecular biology to bedside. Jpn J Pharmacol. 2000;83:1–19. https://doi.org/10.1254/jjp.83.1
Об авторах
Р. Ф. НасыроваРоссия
Насырова Регина Фаритовна, д-р мед. наук
ул. Бехтерева, д. 3, Санкт-Петербург, 192019,
ул. Чапаевская, д. 89, г. Самара, 443099
А. В. Кидяева
Россия
Кидяева Алла Викторовна
ул. Бехтерева, д. 3, Санкт-Петербург, 1920193,
наб. реки Мойки, д. 126, Санкт-Петербург, 190121
М. М. Петрова
Россия
Петрова Марина Михайловна, д-р мед. наук, профессор
ул. Партизана Железняка, д. 1, г. Красноярск, 660022
Н. А. Шнайдер
Россия
Шнайдер Наталья Алексеевна, д-р мед. наук, профессор
ул. Бехтерева, д. 3, Санкт-Петербург, 192019,
ул. Партизана Железняка, д. 1, г. Красноярск, 660022
Дополнительные файлы

|
1. Таблица 1. Механизмы антипсихотик-индуцированного удлинения интервала QTc | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(185KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Насырова Р.Ф., Кидяева А.В., Петрова М.М., Шнайдер Н.А. Антипсихотик-индуцированное удлинение интервала QT и развитие Torsade de Pointes у пациентов с психическими расстройствами: обзор. Безопасность и риск фармакотерапии. 2024;12(4):380-395. https://doi.org/10.30895/2312-7821-2024-410
For citation:
Nasyrova R.F., Kidyaeva A.V., Petrova M.M., Shnayder N.A. Antipsychotic-Induced QT Prolongation and Torsade de Pointes in Patients with Mental Disorders: A Review. Safety and Risk of Pharmacotherapy. 2024;12(4):380-395. (In Russ.) https://doi.org/10.30895/2312-7821-2024-410




































