Перейти к:
Фармакогенетическое тестирование — инструмент для предотвращения гепатотоксических реакций изониазида при терапии туберкулеза легких: клинический случай
https://doi.org/10.30895/2312-7821-2025-450
Резюме
ВВЕДЕНИЕ. Потенциальная гепатотоксичность изониазида является ведущей причиной его отмены, что значительно уменьшает эффективность противотуберкулезной терапии, повышает риск рецидива заболевания и вызывает вторичную лекарственную устойчивость Mycobacterium tuberculosis. Развитие гепатотоксических реакций при применении изониазида связано с генетическими особенностями активности изофермента N-ацетилтрансферазы-2 (NAT2), участвующего в биотрансформации препарата в печени. Снижение дозы изониазида у пациентов с медленным типом ацетилирования позволяет предотвратить поражение печени, но единый алгоритм дозирования этого противотуберкулезного средства в зависимости от результатов фармакогенетического тестирования отсутствует.
ОПИСАНИЕ СЛУЧАЯ. Мужчина 35 лет, якут, с диагнозом «А16.0 Очаговый туберкулез S1–2 обоих легких в фазе инфильтрации без выделения микобактерий туберкулеза» в 2022 г. проходил лечение в отделении туберкулеза органов дыхания ГБУ Республики Саха (Якутия) «НПЦ «Фтизиатрия» им. Е.Н. Андреева». Диагноз установлен на основании клинико-лабораторных и инструментальных исследований. Назначена внутрь 1 раз/сут комбинация противотуберкулезных средств: изониазид — 500 мг, рифампицин — 600 мг, пиразинамид — 1750 мг и этамбутол — 1200 мг. В интенсивной фазе терапии туберкулеза легких у пациента появились симптомы токсического поражения печени гепатоцеллюлярного типа умеренной степени тяжести: тошнота, однократная рвота, слабость, боль в эпигастральной области. Активность аланиновой трансаминазы в сыворотке крови повышена до 665,5 Ед/л, аспарагиновой трансаминазы — до 218,8 Ед/л. При ультразвуковом исследовании диагностированы умеренная гепатомегалия, диффузные изменения паренхимы печени, селезенки, хронический холецистит, реактивный панкреатит. По результатам фармакогенетического тестирования установлено, что пациент является носителем аллельных вариантов гена NAT2: *5, *11, *12, ассоциированных с медленным типом ацетилирования изониазида. Противотуберкулезные средства были временно отменены, назначена гепатопротективная терапия. При продолжении лечения доза изониазида была снижена до 300 мг/сут, остальные препараты пациент принимал в прежней дозе. Переносимость противотуберкулезной терапии была удовлетворительной, гепатотоксические реакции не развивались. Интенсивная фаза лечения туберкулеза составила 64 сут. По результатам положительной клинико-рентгенологической динамики пациент выписан из стационара. Терапия в фазе продолжения включала комбинацию изониазида в дозе 300 мг и рифампицина в дозе 600 мг 1 раз/сут в течение 120 сут. После завершения терапии было констатировано клиническое излечение, пациент переведен в III группу диспансерного наблюдения.
ВЫВОДЫ. Индивидуализация дозы изониазида по результатам фармакогенетического тестирования позволила продолжить лечение пациента лекарственно-чувствительным туберкулезом легких и избежать повторного развития изониазид-индуцированного поражения печени.
Ключевые слова
Для цитирования:
Краснова Н.М., Емельянова Э.А., Егорова А.А., Прокопьев Е.С., Венгеровский А.И., Сычев Д.А. Фармакогенетическое тестирование — инструмент для предотвращения гепатотоксических реакций изониазида при терапии туберкулеза легких: клинический случай. Безопасность и риск фармакотерапии. 2025;13(3):279-289. https://doi.org/10.30895/2312-7821-2025-450
For citation:
Krasnova N.M., Emelyanova E.A., Egorova A.A., Prokopyev E.S., Vengerovskii A.I., Sychev D.A. Pharmacogenetic Testing as a Tool to Prevent Isoniazid-Induced Hepatotoxicity in Pulmonary Tuberculosis Therapy: A Case Report. Safety and Risk of Pharmacotherapy. 2025;13(3):279-289. (In Russ.) https://doi.org/10.30895/2312-7821-2025-450
ВВЕДЕНИЕ
В настоящее время при лечении туберкулеза используют более 20 лекарственных средств. Изониазид с 1952 г. остается препаратом первой линии в комплексной фармакотерапии лекарственно-чувствительного туберкулеза1 [1]. Изониазид оказывает бактерицидное действие на микобактерии туберкулеза, но его потенциальная гепатотоксичность признана серьезной проблемой во фтизиатрии. В клинической практике острое повреждение печени, вызванное изониазидом, диагностируют у 0,5–1% пациентов, летальный исход встречается в 0,05–0,1% случаев [2].
В настоящее время установлена связь между индивидуальной активностью изофермента N-ацетилтрансферазы-2 (N-acetyltransferase 2, NAT2) и частотой гепатотоксических реакций при приеме изониазида2 [3][4].
Бóльшая часть молекул изониазида ацетилируется в печени при участии NAT2 с образованием N-ацетилизониазида, затем этот метаболит гидролизуется до изоникотиновой кислоты и гепатотоксического ацетилгидразина. Ацетилгидразин окисляется изоферментом цитохрома Р450 2E1 (CYP2E1) в реакционноспособные метаболиты: ацетилдиазен, кетен и ион ацетилоний. Изониазид также гидролизуется амидазой с образованием гепатотоксичного соединения гидразина. Системой защиты печени служит ацетилирование ацетилгидразина до нетоксического диацетилгидразина под влиянием NAT2 [5]. Поскольку NAT2 является основным ферментом, участвующим в метаболизме изониазида, его низкая активность сопровождается накоплением основного токсического метаболита ацетилгидразина и развитием гепатотоксических реакций [6].
В качестве важной причины поражения печени при лечении пациентов с лекарственно-чувствительным туберкулезом органов дыхания рассматривают генетические особенности скорости биотрансформации изониазида. Ген NAT2 отличается выраженным полиморфизмом, что является основной причиной межиндивидуальных различий фармакокинетики, действия изониазида и влияет на режим его дозирования [7][8]. Клиническое значение для выбора дозы изониазида имеет носительство полиморфных единичных нуклеотидов NAT2: *5, *6, *7, *11, *12, *13. Метаболизм изониазида ускоряют аллельные варианты NAT2*11, *12 и *13, замедляют — NAT2*5, *6, *7 [9]. На распределение полиморфного аллеля NAT2 влияют раса, этническое происхождение и место проживания пациента [10].
В популяции в зависимости от генетически детерминированной активности изофермента NAT2 выделяют три фенотипические группы: быстрые, промежуточные и медленные ацетиляторы. Медленный тип ацетилирования оценивается как маркер гепатотоксичности изониазида во всех этнических группах [3][4][11][12]. У медленных ацетиляторов концентрация изониазида в плазме выше, чем концентрация у быстрых и промежуточных ацетиляторов. Площадь под фармакокинетической кривой в пределах интервала дозирования в стационарных условиях при многократном введении (AUCτ,ss) и средняя стационарная концентрация (Cav) изониазида в плазме крови в 2,5 раза выше у медленных ацетиляторов, чем у промежуточных, и в 3,5 раза выше, чем у быстрых [13].
Результаты метаанализа 37 клинических исследований, включающие данные о 1527 пациентах с туберкулезом, получавших изониазид (контрольная группа — 7184 человека), подтвердили, что пациенты с медленным типом ацетилирования имеют более высокий риск развития поражения печени по сравнению с таковым у быстрых и промежуточных ацетиляторов (отношение шансов 3,15; 95% доверительный интервал: 2,58–3,84; уровень статистической значимости p<0,000; показатель гетерогенности I²=51,3%) [4].
Следует отметить, что изониазид-индуцированное поражение печени может быть обусловлено не только вариантами генетически детерминированной активности NAT2, но и негенетическими факторами: хронические заболевания печени, женский пол, истощение, ВИЧ-инфекция3, совместное применение некоторых лекарственных средств, например рифампицина, пиразинамида [2].
Использование фармакогенетического тестирования как инструмента персонализированной медицины позволяет выявлять генетические особенности фармакокинетики и фармакодинамики лекарственных препаратов, что обеспечивает эффективное лечение и уменьшает частоту терапевтических неудач [14]. Уменьшение дозы изониазида у пациентов с туберкулезом с медленным типом ацетилирования позволяет снизить частоту гепатотоксических реакций [15–17]. Однако единый алгоритм дозирования изониазида в зависимости от результатов фармакогенетического тестирования не разработан, и проблема подбора оптимальной фармакотерапии туберкулеза по-прежнему остается актуальной.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Мужчина 35 лет, якут, в 2022 г. проходил лечение в отделении туберкулеза органов дыхания государственного бюджетного учреждения Республики Саха (Якутия) «Научно-практический центр "Фтизиатрия" им. Е.Н. Андреева» (далее — НПЦ «Фтизиатрия»).
Из анамнеза: по результатам флюорографического исследования, выполненного в июле 2022 г. при медицинском осмотре, у пациента заподозрен туберкулез легких, в связи с этим он направлен на дополнительное обследование. В НПЦ «Фтизиатрия» проведена компьютерная томография органов грудной клетки (рис. 1), выявлены очаговые изменения специфического характера в сегментах S1–2 обоих легких. Пациент был госпитализирован для проведения химиотерапии туберкулеза.
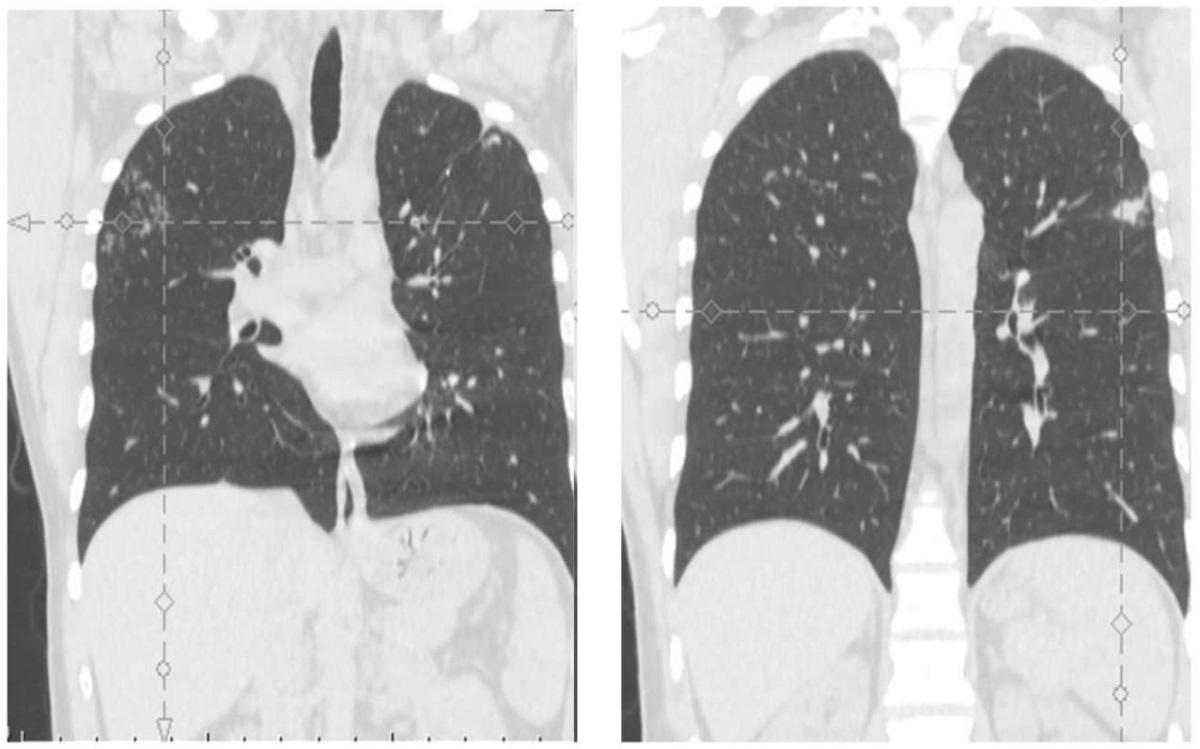
Фотография предоставлена авторами / The photograph is provided by the authors
Рис. 1. Компьютерная томограмма органов грудной клетки пациента О. от 05.07.2022, до начала лечения
Fig. 1. Computed tomography scan of the chest: Patient О., 5 July 2022, before treatment
При поступлении в отделение и во время противотуберкулезной химиотерапии выполняли клинические, лабораторные и инструментальные исследования в соответствии с утвержденными клиническими рекомендациями «Туберкулез у взрослых»4.
Объективные данные на момент поступления: состояние удовлетворительное, симптомы интоксикации отсутствуют, температура тела 36,6 °С, рост 170 см, масса тела 68 кг, индекс массы тела 23,5 кг/м² (норма). Кожный покров и видимые слизистые оболочки чистые, обычной окраски, язык чистый, влажный. Тургор мягких тканей сохранен. Периферические лимфатические узлы не увеличены. Грудная клетка правильной формы. Пальпация грудной клетки безболезненная. При перкуссии звук легочный, проводится во все отделы легких. Аускультативно дыхание жесткое, хрипы не выслушиваются. Частота дыхания 18–20 в минуту. Тоны сердца ясные, патологических шумов нет. Частота сердечных сокращений (ЧСС) 100 уд. в минуту, артериальное давление 130/90 мм рт. ст. Живот мягкий, безболезненный. Печень и селезенка не увеличены. Мочеиспускание свободное, безболезненное. Стул, со слов пациента, ежедневный, оформлен.
Анамнез жизни: женат, имеет 2 детей, работает водителем. Контакт с источником туберкулеза не установлен.
Диагностические процедуры
Клинический анализ крови: количество эритроцитов 4,89×10¹²/л, средний объем эритроцита 93,00, содержание общего гемоглобина 124 г/л, средняя концентрация гемоглобина в эритроците 311,00 г/л, гематокрит 47,10%, скорость оседания эритроцитов 10 мм/ч, количество лейкоцитов 4,66×10⁹/л, из них лимфоцитов 23,00%, моноцитов 7,00%, сегментоядерных нейтрофилов 68,00%, эозинофилов 2,00%, количество тромбоцитов 232,00×10⁹/л.
Биохимический анализ крови: содержание общего белка 55,30 г/л, альбуминов 33,40 г/л, креатинина 84,00 мкмоль/л, мочевины 3,20 ммоль/л, мочевой кислоты 406,30 мкмоль/л, общего холестерина 3,40 ммоль/л, глюкозы 5,26 ммоль/л, общего билирубина 3,95 мкмоль/л, С-реактивного белка 8,30 мг/л, железа 24,90 мкмоль/л, калия 4,40 ммоль/л, натрия 139,00 ммоль/л, кальция 1,92 ммоль/л, активность аланинаминовой трансаминазы (АЛТ) 26,60 Ед/л, аспарагиновой трансаминазы (АСТ) 20,48 Ед/л, α-амилазы 78,00 Ед/л, щелочной фосфатазы (ЩФ) 53,00 Ед/л.
Коагулограмма (гемостазиограмма): содержание фибриногена 4,00 г/л, тромбиновое время 17,70 с, протромбиновое время 13,30 с, активированное частичное тромбопластиновое время 21,40 с, протромбиновый индекс 102,00%, международное нормализованное отношение 1,00, содержание D-димера 282,3 нг/мл.
Фибробронхоскопия диагностическая с получением материала для выявления микобактерий туберкулеза от 27.07.2022. Заключение: деформирующий эндобронхит 1 ст.
Определение ДНК Mycobacterium tuberculosis complex (микобактерий туберкулеза) в бронхоальвеолярной лаважной жидкости с помощью метода полимеразной цепной реакции в реальном времени и в мокроте методом полимеразной цепной реакции GeneXpert — микобактерии не идентифицированы.
Исследование мокроты методом люминесцентной микроскопии для выявления кислотоустойчивых микобактерий (КУМ) в 100 полях зрения — реакция отрицательная.
Диагноз. На основании анамнеза, данных объективного осмотра, лабораторных и инструментальных методов исследования, рентгеновской томографии поставлен диагноз: А16.0 Очаговый туберкулез S1–2 обоих легких в фазе инфильтрации без выделения микобактерий туберкулеза.
Медицинские вмешательства. В соответствии с клиническими рекомендациями5 пациенту назначен стационарный режим для проведения химиотерапии туберкулеза в интенсивной фазе: внутрь 1 раз/сут в разное время: изониазид 500 мг (7,35 мг/кг/сут), рифампицин 600 мг (8,82 мг/кг/сут), пиразинамид 1750 мг (25,74 мг/кг/сут), этамбутол 1200 мг (17,65 мг/кг/сут). Эффективность и безопасность химиотерапии туберкулеза оценивали ежедневно по клиническим симптомам и 1 раз в месяц по показателям лабораторных и инструментальных исследований.
Пациенту выполнено фармакогенетическое тестирование для определения носительства аллельных вариантов гена NAT2. Для генотипирования из цельной крови выделяли ДНК с помощью набора реагентов ExtractDNA Blood («Евроген», Россия). Носительство полиморфных вариантов NAT2*5 (rs1801280, Т341С), NAT2*6 (rs1799930, G590A), NAT2*7 (rs1799931, G857A), NAT2*11 (rs1799929, C481T), NAT2*12 (rs1208, A803G), NAT2*13 (rs1041983, C282T) определяли методом полимеразной цепной реакции в режиме реального времени на амплификаторе Real-Time CFX96 Touch (Bio-Rad, США) с помощью набора реагентов «ГенТест-М NAT2» (ООО «НОМОТЕК», Россия).
Для генетического исследования осуществляли забор 3–4 мл крови из вены локтевого сгиба в вакуумные пробирки с помощью закрытой вакуумной системы (Zhejiang Gongdong Medical Technology Co., Китай). Пробирки имели мелкодисперсное напыление этилендиаминтетрауксусной кислотой в качестве антикоагулянта. Генетически детерминированную скорость метаболизма измеряли, основываясь на информации веб-сайта6.
По результатам тестирования у пациента установлен генотип, ассоциированный с медленным типом ацетилирования изониазида (табл. 1), коррекцию дозы изониазида не проводили.
Таблица 1. Результаты фармакогенетического исследования пациента О. на носительство полиморфизма гена NAT2
Table 1. Results of pharmacogenetic testing of Patient O. for NAT2 gene polymorphism carrier status
|
Изучаемый ген Gene analysed |
Идентификатор ПЕН SNP identifier |
Комбинации аллелей Allele combinations |
|
NAT2*13 С282Т |
rs1041983 |
СС |
|
NAT2*5 Т341С |
rs1801280 |
СС |
|
NAT2*11 С481Т |
rs1799929 |
TT |
|
NAT2*6 G590A |
rs1799930 |
GG |
|
NAT2*12 A803G |
rs1208 |
GG |
|
NAT2*7 G857A |
rs1799931 |
GG |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ПЕН — полиморфизм единичных нуклеотидов.
Note. SNP, single nucleotide polymorphism.
На 13 сут после начала приема противотуберкулезных средств у пациента появились жалобы на тошноту, однократную рвоту, слабость. При обследовании выявлены боль в эпигастральной области, печень выступает из-под реберной дуги на 2,0–3,0 см, мягкой консистенции, с гладкой ровной поверхностью. В крови активность АЛТ повышена до 665,5 Ед/л, АСТ — до 218,8 Ед/л, активность ЩФ и содержание билирубина в пределах референсных значений. При ультразвуковом исследовании диагностированы умеренная гепатомегалия, диффузные изменения паренхимы печени, селезенки, хронический холецистит, реактивный панкреатит. Результаты клинико-лабораторного мониторинга и инструментальных исследований свидетельствуют о развитии осложнения противотуберкулезной химиотерапии — токсического поражения печени умеренной степени тяжести гепатоцеллюлярного типа7.
Согласно утвержденным клиническим рекомендациям8 пациенту временно, до нормализации активности трансаминаз в крови, отменены противотуберкулезные средства и проведена гепатопротективная терапия: 2 раза/сут в течение 10 сут внутривенное капельное вливание 400 мг адеметионина в 200 мл изотонического раствора натрия хлорида и 400 мл раствора инозин + меглюмин + метионин + никотинамид + янтарная кислота.
Извещение о развитии нежелательной реакции передано в Автоматизированную информационную систему Росздравнадзора9.
Динамика и исходы. В результате этих мероприятий у пациента улучшилось самочувствие, в крови нормализовались активность АЛТ и АСТ (рис. 2). Через 21 сут возобновлена противотуберкулезная химиотерапия изониазидом, доза которого снижена до 300 мг/сут (5 мг/кг/сут). Другие противотуберкулезные средства пациент продолжил принимать в ранее назначенном режиме.
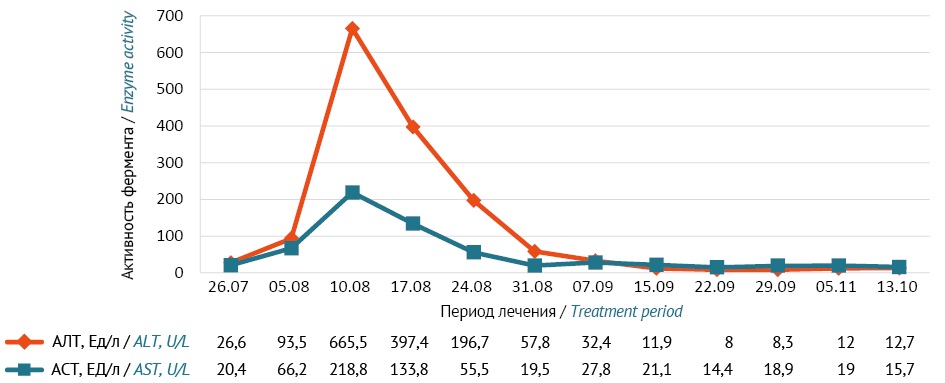
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Динамика активности аланиновой трансаминазы (АЛТ) и аспарагиновой трансаминазы (АСТ) в плазме крови пациента О. во время химиотерапии туберкулеза
Fig. 2. Changes in alanine transaminase (ALT) and aspartate transaminase (AST) activity in the plasma of Patient O. during chemotherapy of tuberculosis
После снижения дозы изониазида переносимость противотуберкулезной терапии расценена как удовлетворительная, пациент жалоб не предъявлял, активность печеночных трансаминаз не повышалась.
Пациент успешно завершил интенсивную фазу химиотерапии туберкулеза длительностью 64 сут и был выписан из стационара. По решению врачебной комиссии рекомендовано контролируемое лечение в условиях дневного стационара в фазе продолжения: комбинация изониазид 300 мг + рифампицин 600 мг внутрь 1 раз/сут в течение 120 сут. После завершения этой фазы терапии установлено клиническое излечение, пациент переведен в III группу диспансерного наблюдения.
ОБСУЖДЕНИЕ
Патогенез поражения печени, вызванного изониазидом, до конца не изучен. В настоящее время установлены три основных механизма развития поражения печени: митохондриальная дисфункция, окислительный стресс, активация иммунной системы [18]. При применении изониазида чаще всего развивается гепатоцеллюлярный тип поражения печени, он может вызывать диффузный гепатоцеллюлярный некроз [19]. Гепатоцеллюлярный тип поражения печени характеризуется повышением активности АЛТ более чем в 2 раза или соотношением АЛТ/ЩФ >510. Активность трансаминаз в сыворотке крови растет в срок от 1 нед. до 9–12 мес. после начала лечения изониазидом [20]. В половине случаев высокий уровень АЛТ определяется к 1–6 мес. после приема изониазида [21][22].
У большинства пациентов поражение печени изониазидом протекает бессимптомно и диагностируется только после определения в крови маркеров гепатотоксичности. Клинически может проявляться такими симптомами, как слабость, боль в животе, желтуха, тошнота и рвота [22]. В представленном клиническом случае активность АЛТ на 13 сут после начала приема изониазида превысила норму более чем в 18 раз, что сопровождалось слабостью и симптомами нарушения функции желудочно-кишечного тракта.
В ретроспективном наблюдательном исследовании [23] у пациентов с медленным типом ацетилирования гепатотоксические реакции изониазида развивались на более ранних сроках противотуберкулезной терапии: в среднем через 2 нед. (межквартильный размах: 0,5–3 мес.), у быстрых и промежуточных ацетиляторов поражение печени регистрировалось через 2 мес. от начала терапии туберкулеза (межквартильный размах: 1,7–5,5 мес.). У 5% медленных ацетиляторов патология печени выявлялась в течение первой недели, у 16% — на второй неделе, у 45% — к 13 мес. противотуберкулезной терапии. У 2% быстрых/промежуточных ацетиляторов гепатотоксические реакции возникали через 1,5 мес. от старта лечения, частота этих реакций постепенно нарастала до 13% случаев к 13 мес.
Результаты исследования [23] свидетельствуют о важности проведения фармакогенетического тестирования для раннего выявления пациентов с медленным типом ацетилирования. Для таких пациентов риск гепатотоксичности в ранний период, особенно во время интенсивной фазы терапии (1,5 мес.), значительно выше, чем в остальной популяции, что также подтверждают данные рассматриваемого клинического случая. Поэтому необходима разработка комплекса мероприятий, направленных на своевременное прогнозирование, предотвращение и устранение гепатотоксических реакций у медленных ацетиляторов, в том числе проведение более частого клинико-лабораторного мониторинга для выявления ранних признаков гепатотоксичности. Но в настоящее время единого мнения об оптимальных сроках такого мониторинга нет.
В российских исследованиях установлены различия по распространенности медленных ацетиляторов среди этнических групп европеоидов и монголоидов, проживающих на территории Российской Федерации. Медленный тип ацетилирования наиболее часто встречается среди русского населения Санкт-Петербурга (60,0%) [24], Воронежской области (58,0%) [25], Москвы (49,0%) [26], Республики Саха (Якутия) (61,5%) [27]. Реже носителями медленных аллельных вариантов гена NAT2 являются коренное население Республики Саха (Якутия) — якуты (22,7%) [10], а также проживающие в Республике Башкортостан русские (12,8%), татары (11,8%) и башкиры (11,4%) [28]. Учитывая такие различия в распространенности медленных ацетиляторов среди этнических групп, врачам следует иметь настороженность в отношении вероятности медленного типа ацетилирования в указанных группах.
В инструкции по медицинскому применению (ИМП) изониазида указано, что медленным ацетиляторам препарат следует назначать с осторожностью в связи с высоким риском развития нежелательных реакций.
В соответствии с клиническими рекомендациями «Туберкулез органов дыхания у взрослых»11, утвержденными Минздравом России, и ИМП изониазид для лечения лекарственно-чувствительного туберкулеза назначают ежедневно внутрь пациентам с массой тела 33–50 кг в суточной дозе 300 мг, пациентам с массой тела 51–70 кг — в дозе 300–600 мг, пациентам с массой тела более 70 кг — в дозе 600 мг. Максимальная суточная доза — 600 мг.
При приеме изониазида в стандартных дозах медленными ацетиляторами низкая скорость ацетилирования способствует медленному метаболизму препарата и увеличению концентрации его гепатотоксических промежуточных соединений в крови [29] с высоким риском поражения печени. Рекомендованные дозы изониазида для медленных ацетиляторов являются избыточными. Результаты метаанализов [16][17], охватывающих в общей сложности данные 52 клинических исследований, показали, что предварительная коррекция дозы изониазида в соответствии с генотипом NAT2 снижает частоту развития нежелательных реакций без потери терапевтической эффективности.
Медленным ацетиляторам изониазид может быть назначен в дозе, уменьшенной вдвое по сравнению со стандартной [9]. Дозы изониазида, обеспечивающие эффективное лечение и снижение частоты гепатотоксических реакций, составляют: для медленных ацетиляторов — 2,5 мг/кг/сут, для промежуточных — 5 мг/кг/сут, для быстрых — 7,5 мг/кг/сут [30]. Однако в настоящее время результаты исследований по определению дозы изониазида в зависимости от скорости ацетилирования под влиянием NAT2 имеют низкий уровень доказательности, что недостаточно для создания алгоритма фармакотерапии изониазидом.
Представленный клинический случай свидетельствует о критической роли полиморфизма гена NAT2 с генотипом медленного ацетилирования в развитии поражения печени при приеме изониазида в стандартной дозе. На клиническом примере показано, что коррекция дозы изониазида с учетом типа ацетилирования позволила продолжить лечение пациента с туберкулезом и избежать повторного развития гепатотоксических реакций. Согласно ИМП, пациентам с массой тела 51–70 кг изониазид назначают в дозе 300–600 мг. В описанном случае у пациента с низкой скоростью ацетилирования дозу изониазида уменьшили до 300 мг/сут (около 4,41 мг/кг).
Эти данные свидетельствуют о том, что фармакогенетически обоснованное дозирование изониазида имеет важное значение для предотвращения нежелательных реакций при лечении пациентов с лекарственно-чувствительным туберкулезом. Результаты исследования могут быть использованы при разработке алгоритма дозирования изониазида в зависимости от генетически детерминированной активности изофермента NAT2.
ВЫВОДЫ
- Индивидуализация дозы изониазида по результатам фармакогенетического тестирования позволила продолжить лечение пациента с лекарственно-чувствительным туберкулезом легких и избежать повторного развития изониазид-индуцированного поражения печени.
- C целью индивидуализации дозы изониазида перед началом химиотерапии всем пациентам необходимо проводить фармакогенетическое тестирование для определения скорости ацетилирования этого препарата при участии NAT2.
- Пациентам с медленным типом ацетилирования целесообразно назначать изониазид в минимальной рекомендуемой дозе — 300 мг/сут.
- Для своевременной диагностики и лечения поражения печени на фоне приема изониазида целесообразно разработать единый алгоритм дозирования изониазида и мониторинга клинико-лабораторных показателей у пациентов с медленным типом ацетилирования.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.М. Краснова — сбор и анализ данных литературы, анализ и интерпретация результатов исследования, написание текста рукописи; Э.А. Емельянова — сбор и анализ данных литературы; А.А. Егорова — забор крови и отслеживание динамики лабораторных показателей пациента; Е.С. Прокопьев — концепция работы, формулировка выводов; А.И. Венгеровский и Д.А. Сычев — утверждение окончательной версии рукописи для публикации.
Информированное согласие на публикацию. Получено информированное добровольное согласие пациента на обработку персональных данных и их использование с научной и образовательной целью, в том числе на публикацию персональной медицинской информации в обезличенной форме.
Authors’ contributions. All authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Natalia M. Krasnova collected and analysed literature data, analysed and interpreted the study results, drafted the manuscript. Elvira A. Emelyanova collected and analysed literature data. Alexandra A. Egorova took blood samples and monitored the dynamics of the patient’s laboratory values; Egor S. Prokopiev developed the concept of the work and formulated the conclusions. Alexander I. Vengerovskii, Dmitry A. Sychev approved the final version of the manuscript for publication.
Consent for publication. The patients gave informed consent for the processing of their protected personal and health information, as well as for its use and anonymised publication for scientific and educational purposes.
1. Туберкулез у взрослых. Клинические рекомендации. Минздрав России; 2022.
2. LiverTox: Clinical and research information on drug-induced liver injury. https://www.ncbi.nlm.nih.gov/books/NBK548754/
3. Государственный реестр лекарственных средств. https://grls.minzdrav.gov.ru/
4. Туберкулез у взрослых. Клинические рекомендации. Минздрав России; 2022.
5. Туберкулез у взрослых. Клинические рекомендации. Минздрав России; 2022.
6. https://nat.mbg.duth.gr/Human_NAT2_alleles.htm
7. Лекарственные поражения печени у взрослых. Клинические рекомендации. Минздрав России; 2022.
8. Там же.
9. http://npr.roszdravnadzor.ru/
10. Лекарственные поражения печени у взрослых. Клинические рекомендации. Минздрав России; 2022.
11. Туберкулез у взрослых. Клинические рекомендации. Минздрав России; 2022.
Список литературы
1. Daniel MT. The history of tuberculosis. Respir Med. 2006;100(11): 1862–70. https://doi.org/10.1016/j.rmed.2006.08.006
2. Суханов ДС, Алексеева ЮС, Тимофеев ЕВ. Гепатотоксическое действие и метаболизм противотуберкулезных препаратов. Медицина: теория и практика. 2023;8(2):48–62. https://doi.org/10.56871/MTP.2023.90.21.007
3. Khan S, Mandal RK, Elasbali AM, Dar SA, Jawed A, Wahid M, et al. Pharmacogenetic association between NAT2 gene polymorphisms and isoniazid induced hepatotoxicity: trial sequence meta-analysis as evidence. Biosci Rep. 2019;39(1):BSR20180845. https://doi.org/10.1042/BSR20180845
4. Zhang M, Wang S, Wilffert B, Tong R, Soolingen D, Hof S, et al. The association between the NAT2 genetic polymorphisms and risk of DILI during anti-TB treatment: a systematic review and meta-analysis. Br J Clin Pharmacol. 2018;84(12):2747–60. https://doi.org/10.1111/bcp.13722
5. Pourmohamadi N, Toutkaboni MPA, Roodbari NH, Tabarsi P, Baniasadi S. Association of cytochrome P450 2E1 and N-acetyltransferase 2 genotypes with serum isoniazid level and anti-tuberculosis drug-induced hepatotoxicity: a cross-sectional study. Iran J Med Sci. 2023;48(5):474–83. https://doi.org/10.30476/ijms.2023.96145.2765
6. Erwin ER, Addison AP, John SF, Olaleye OA, Rosell RC. Pharmacokinetics of isoniazid: the good, the bad, and the alternatives. Tuberculosis (Edinb). 2019;116(l):66–70. https://doi.org/10.1016/j.tube.2019.04.012
7. Hong BL, D’Cunha R, Li P, Al-Shaer MH, Alghamdi WA, An G, et al. A systematic review and meta-analysis of isoniazid pharmacokinetics in healthy volunteers and patients with tuberculosis. Clin Ther. 2020;42(11):e220–e41. https://doi.org/10.1016/j.clinthera.2020.09.009
8. Thomas L, Raju AP, Chaithra, Sekhar MS, Varma M, Saravu K, et al. Influence of N-acetyltransferase 2 (NAT2) genotype/single nucleotide polymorphisms on clearance of isoniazid in tuberculosis patients: a systematic review of population pharmacokinetic models. Eur J Clin Pharmacol. 2022;78(10):1535–53. https://doi.org/10.1007/s00228-022-03362-7
9. Качанова АА, Пименова ЮА, Шуев ГН, Акмалова КА, Созаева ЖА, Краснова НМ и др. Изучение влияния полиморфных маркеров гена NAT2 на риск развития нежелательных реакций у пациентов с легочными формами туберкулеза, получавших изониазид и рифампицин. Безопасность и риск фармакотерапии. 2021;9(1):25–33. https://doi.org/10.30895/2312-7821-2021-9-1-25-33
10. Краснова НМ, Алексеева ЕА, Рудых ЗА, Чертовских ЯВ, Климова ТМ, Ефремова ЕН и др. Распространенность полиморфизмов гена N-ацетилтрансферазы 2 среди пациентов якутской национальности с впервые выявленным туберкулезом органов дыхания. Вестник Российской академии медицинских наук. 2020;75(2):154–61. https://doi.org/10.15690/vramn1217
11. Suvichapanich S, Fukunaga K, Zahroh H, Mushiroda T, Mahasirimongkol S, Toyo-Oka L, et al. NAT2 ultraslow acetylator and risk of anti-tuberculosis drug-induced liver injury: a genotype-based meta-analysis. Pharmacogenet Genomics. 2018;28(7):167–76. https://doi.org/10.1097/FPC.0000000000000339
12. Yang S, Hwang SJ, Park JY, Chung EK, Lee JI. Association of genetic polymorphisms of CYP2E1, NAT2, GST and SLCO1B1 with the risk of anti-tuberculosis drug-induced liver injury: a systematic review and meta-analysis. BMJ Open. 2019;9(8):e027940. https://doi.org/10.1136/bmjopen-2018-027940
13. Краснова НМ, Николаев ВМ, Макарова ТС, Татаринова ОВ, Прокопьев ЕС, Кравченко АФ и др. Влияние скорости ацетилирования на фармакокинетику изониазида у пациентов с впервые выявленным туберкулезом легких. Экспериментальная и клиническая фармакология. 2022;85(5):25–8. https://doi.org/10.30906/0869-2092-2022-85-5-25-28
14. Rodrigues-Soares F, Suarez-Kurtz G. Pharmacogenomics research and clinical implementation in Brazil. Basic Clin Pharmacol Toxicol. 2019;124(5):538–49. https://doi.org/10.1111/bcpt.13196
15. Azuma J, Ohno M, Kubota R, Yokota S, Nagai T, Tsuyuguchi K, et al. NAT2 genotype guided regimen reduces isoniazid-induced liver injury and early treatment failure in the 6-month four-drug standard treatment of tuberculosis: a randomized controlled trial for pharmacogenetics-based therapy. Eur J Clin Pharmacol. 2013;69(5):1091–101. https://doi.org/10.1007/s00228-012-1429-9
16. Cai Y, Yi J, Zhou C, Shen X. Pharmacogenetic study of drug-metabolising enzyme polymorphisms on the risk of anti-tuberculosis drug-induced liver injury: a meta-analysis. PLoS One. 2012;7(10):e47769. https://doi.org/10.1371/journal.pone.0047769
17. Wang PY, Xie SY, Hao Q, Zhang C, Jiang BF. NAT2 polymorphisms and susceptibility to anti-tuberculosis drug-induced liver injury: a meta-analysis. Int J Tuberc Lung Dis. 2012;16(5):589–95. https://doi.org/10.5588/ijtld.11.0377
18. Zhuang X, Li L, Liu T, Zhang R, Yang P, Wang X, Dai L. Mechanisms of isoniazid and rifampicin-induced liver injury and the effects of natural medicinal ingredients: A review. Front Pharmacol. 2022;13:1037814. https://doi.org/10.3389/fphar.2022.1037814
19. Wang P, Pradhan K, Zhong X-B, Ma X. Isoniazid metabolism and hepatotoxicity. Acta Pharm Sin B. 2016;6(5):384–92. https://doi.org/10.1016/j.apsb.2016.07.014
20. Metushi I, Uetrecht J, Phillips E. Mechanism of isoniazid-induced hepatotoxicity: then and now. Br J Clin Pharmacol. 2016;81(6):1030–6. https://doi.org/10.1111/bcp.12885
21. Долгушина АИ, Волчегорский ИА, Новоселов ПН, Ушкарева ЭВ, Олевская ЕР, Кузнецова АС. Гепатотоксичность противотуберкулезных препаратов. Экспериментальная и клиническая гастроэнтерология. 2018;156(8):116–24. 2016;26(9):436–44. https://doi.org/10.1097/FPC.0000000000000232
22. Schiuma M, Dinegro S, Battini V, Torre A, Covizzi A, Civati A, et al. NAT2 acetylation status predicts hepatotoxicity during antituberculosis therapy: Cumulative risk analysis of a multiethnic cohort. Int J Mol Sci. 2025;26(8):3881. https://doi.org/10.3390/ijms26083881
23. Belogubova EV, Kuligina ESh, Togo AV, Karpova MB, Ulibina JM, Shutkin VA, et al. ‘Comparison of extremes’ approach provides evidence against the modifying role of NAT2 polymorphism in lung cancer susceptibility. Cancer Lett. 2005;221(2):177–83. https://doi.org/10.1016/j.canlet.2004.11.008
24. Gaikovitch EA, Cascorbi I, Mrozikiewicz PM, Brockmoller J, Frotschl R, Kopke K, et al. Polymorphisms of drug-metabolizing enzymes CYP2C9, CYP2C19, CYP2D6, CYP1A1, NAT2 and of P-glycoprotein in a Russian population. Eur J Clin Pharmacol. 2003;59(4):303–12. https://doi.org/10.1007/s00228-003-0606-2
25. Кожекбаева ЖМ, Гра ОА, Фадеева ВС, Голденкова-Павлова ИВ, Корсунская ИМ, Брускин СА и др. Ассоциация полиморфизма NAT2 с риском развития псориаза в Московской популяции. Молекулярная биология. 2009;43(1):62–76. https://doi.org/10.1134/S0026893309010087
26. Краснова НМ, Ефремова ЕН, Егорова АА, Филиппова ОИ, Чертовских ЯВ, Рудых ЗА и др. Сравнительный анализ результатов генотипирования гена N-ацетилтрансферазы 2 у пациентов с впервые выявленным туберкулезом органов дыхания, проживающих в Республике Саха (Якутия). Бюллетень сибирской медицины. 2020;19(4):102–9. https://doi.org/10.20538/1682-0363-2020-4-102-109
27. Генетика — фундаментальная основа инноваций в медицине и селекции. Материалы VIII научно-практической конференции с международным участием, Ростов-на-Дону, 26–29 сентября 2019 г. Ростов-на-Дону–Таганрог: Издательство Южного федерального университета; 2019.
28. Сналина НЕ, Сычев ДА. Генетические предикторы гепатотоксичности изониазида. Молекулярная медицина. 2018;16(2):31–6. https://doi.org/10.29296/24999490-2018-02-04
29. Matsumoto T, Ohno M, Azuma J. Future of pharmacogenetics-based therapy for tuberculosis. Pharmacogenomics. 2014;15(5):601–7. https://doi.org/10.2217/pgs.14.38
Об авторах
Н. М. КрасноваРоссия
Краснова Наталия Михайловна, канд. мед. наук, доцент
ул. Белинского, д. 58, г. Якутск, 677000
Э. А. Емельянова
Россия
Емельянова Эльвира Андреевна, канд. мед. наук, доцент
ул. Белинского, д. 58, г. Якутск, 677000
А. А. Егорова
Россия
Егорова Александра Алексеевна
ул. Петра Алексеева, д. 93, г. Якутск, 677015
Е. С. Прокопьев
Россия
Прокопьев Егор Спиридонович
ул. Петра Алексеева, д. 93, г. Якутск, 677015
А. И. Венгеровский
Россия
Венгеровский Александр Исаакович, д-р мед. наук, профессор
Московский тракт, д. 2, г. Томск, 634050
Д. А. Сычев
Россия
Сычев Дмитрий Алексеевич, академик РАН, д-р мед. наук, профессор
ул. Баррикадная, д. 2/1, стр. 1, Москва, 125993
Дополнительные файлы
Рецензия
Для цитирования:
Краснова Н.М., Емельянова Э.А., Егорова А.А., Прокопьев Е.С., Венгеровский А.И., Сычев Д.А. Фармакогенетическое тестирование — инструмент для предотвращения гепатотоксических реакций изониазида при терапии туберкулеза легких: клинический случай. Безопасность и риск фармакотерапии. 2025;13(3):279-289. https://doi.org/10.30895/2312-7821-2025-450
For citation:
Krasnova N.M., Emelyanova E.A., Egorova A.A., Prokopyev E.S., Vengerovskii A.I., Sychev D.A. Pharmacogenetic Testing as a Tool to Prevent Isoniazid-Induced Hepatotoxicity in Pulmonary Tuberculosis Therapy: A Case Report. Safety and Risk of Pharmacotherapy. 2025;13(3):279-289. (In Russ.) https://doi.org/10.30895/2312-7821-2025-450





































