Перейти к:
Изучение профиля безопасности оригинального препарата на основе секретома мезенхимных стромальных клеток при интратестикулярном введении кроликам
https://doi.org/10.30895/2312-7821-2025-457
Резюме
ВВЕДЕНИЕ. Данная работа является продолжением исследований оригинального биологического лекарственного препарата на основе секретома мезенхимных стромальных клеток (МСК) человека для восстановления сперматогенеза и фертильности. Для обеспечения безопасности препарата необходимо проведение доклинических исследований на двух видах животных: грызунах (проведено ранее) и негрызунах.
ЦЕЛЬ. Изучение общетоксического действия, фармакологической безопасности, пирогенности, иммунотоксических свойств, репродуктивной токсичности и местной переносимости оригинального биологического препарата на основе секретома МСК при двукратном введении под белочную оболочку семенников половозрелым кроликам.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование проведено на 50 самцах кроликов породы Советская шиншилла (5 групп по 10 животных). Исследуемый препарат МедиРег (восстановленный раствор лиофилизата секретома МСК в смеси с носителем, коллагеновым гелем Аппликолл) вводили под белочную оболочку семенника на 1 и 28 сутки в трех дозах: терапевтической (содержание эндотелиального фактора роста сосудов (VEGF) не менее 0,76 нг), превышающей терапевтическую в 1,5 раза (VEGF не менее 1,14 нг) и превышающей терапевтическую в 2,5 раза (VEGF не менее 1,9 нг). Контроль: интактные кролики и кролики, которым вводили смесь коллагенового геля Аппликолл и воды для инъекций. Оценивали клиническое состояние, температуру тела, результаты модифицированного теста Ирвина, электрокардиограмму, частоту сердечных сокращений, дыхательных движений, артериальное давление, показатели мочи, крови, биохимического анализа, состояние системы гемостаза, газовый состав крови, параметры спермограммы. Проводили патоморфологическое исследование органов. Срок наблюдения — 60 суток.
РЕЗУЛЬТАТЫ. На 3 сутки у животных в группах, получавших 1,5 и 2,5 терапевтической дозы препарата, обнаружено значимое понижение протромбинового времени, однако в период отсроченного наблюдения показатель снижался только в группе плацебо. При гистологическом исследовании у 1–2 из 5 (20–40%) кроликов во всех группах, кроме интактных, обнаружены единичные участки расслоения соединительнотканных перегородок между канальцами с формированием полости, заполненной рыхлым веществом с выраженным эозинофильным окрашиванием, и деформация канальца вдоль стенки полости. Вероятно, это вызвано механическим сдавлением канальца при введении большого объема вещества. У 2 из 5 (40%) животных группы плацебо выявлено обратимое увеличение пузырьковидных желез с выраженным расширением долек, содержащих прозрачный секрет. Гистологическая картина пузырьковидных желез соответствовала норме.
ВЫВОДЫ. Препарат на основе секретома МСК и носитель в составе препарата (коллагеновый гель) при двукратном введении под белочную оболочку семенника кролика обладают приемлемым профилем безопасности.
Ключевые слова
Для цитирования:
Монакова А.О., Балабаньян В.Ю., Вавилова В.А., Басалова Н.А., Попов В.С., Акопян Ж.А., Ефименко А.Ю. Изучение профиля безопасности оригинального препарата на основе секретома мезенхимных стромальных клеток при интратестикулярном введении кроликам. Безопасность и риск фармакотерапии. 2025;13(2):213-228. https://doi.org/10.30895/2312-7821-2025-457
For citation:
Monakova А.О., Balabanyan V.Yu., Vavilova V.A., Basalova N.A., Popov V.S., Akopyan Zh.A., Efimenko A.Yu. Safety Profile Evaluation of an Original Mesenchymal Stromal Cell Secretome-Based Medicinal Product after Intratesticular Injection in Rabbits. Safety and Risk of Pharmacotherapy. 2025;13(2):213-228. (In Russ.) https://doi.org/10.30895/2312-7821-2025-457
ВВЕДЕНИЕ
Проблема бесплодия затрагивает от 8 до 17% пар во всем мире, причем мужской фактор по разным данным вносит значимый вклад примерно у 30–50% пар. По данным различных исследований, в большинстве случаев мужское бесплодие определяется как идиопатическое [1–5]. В связи с невозможностью точного установления этиологии в этом случае терапевтические подходы включают вспомогательные репродуктивные технологии или эмпирическое лечение, включающее гормональную терапию, селективные модуляторы рецепторов эстрогена, ингибиторы ароматазы или антиоксиданты. Некоторые препараты, такие как бромкриптин, альфа-блокаторы, системные кортикостероиды, магний, гонадотропин, фолликулостимулирующий гормон, назначают не по показаниям, утвержденным в инструкции по медицинскому применению (off-label) для лечения идиопатического мужского бесплодия. По данным Европейской ассоциации урологов (European Association of Urology), перечисленные подходы зачастую не имеют достаточной доказательной базы, часть из них обладает низкой эффективностью или небезопасна для пациентов [6–8]. Таким образом, для результативной терапии мужского бесплодия необходим поиск новых терапевтических подходов.
Патогенез мужского бесплодия может включать повреждение сразу нескольких клеточных типов, формирующих специфическое микроокружение сперматогониальной стволовой клетки, или нишу, которая поддерживает ее функционирование для обеспечения сперматогенеза. В связи с этим перспективной стратегией может быть плейотропное воздействие сразу на несколько поврежденных компонентов ниши. Ранее такая фармакологическая активность нами была показана для мезенхимных стромальных клеток (МСК). МСК оказывают регенеративное действие преимущественно за счет секреции комбинации паракринных компонентов — секретома, который включает факторы роста, цитокины, хемокины, молекулы в составе внеклеточных везикул и белки внеклеточного матрикса [9]. Преимуществом МСК является низкая иммуногенность за счет секреции иммуномодулирующих факторов, а использование только секретома позволяет избежать иммунного ответа на клеточные компоненты. Важно отметить, что использование бесклеточного препарата (секретома МСК) снижает риски, связанные с возможным ответом иммунной системы экспериментальных животных (в данной работе — кроликов) на антигены клеток человека в доклинических исследованиях [10]. Введение секретома МСК под белочную оболочку семенников способствовало восстановлению сперматогенеза у крыс в модели крипторхизма и у мышей в модели химиотерапевтического повреждения сперматогенеза доксорубицином [11][12].
В соответствии с регуляторными требованиями1 препарат на основе секретома МСК относится к биологическим лекарственным препаратам, поскольку производится с использованием клеток жировой ткани человека. В предыдущей работе нами была показана безопасность препарата на основе секретома МСК в исследованиях общей, субхронической, иммунологической и репродуктивной токсичности на грызунах [13]. Изучение безопасности на двух видах животных, грызунах и негрызунах, является необходимым этапом доклинических исследований оригинального лекарственного препарата2. В данной работе представлены результаты оценки безопасности данного препарата на кроликах как на животных, не относящихся к грызунам.
Цель работы — изучение общетоксического действия, фармакологической безопасности, пирогенности, иммунотоксических свойств и местной переносимости оригинального биологического препарата на основе секретома МСК при двукратном введении под белочную оболочку семенников половозрелым кроликам.
Задачи исследования оригинального биологического препарата на основе секретома МСК следующие.
- Изучить общетоксическое действие.
- Изучить фармакологическую безопасность.
- Выявить потенциальный орган-мишень токсического воздействия.
- Изучить пирогенность.
- Изучить токсичность в отношении компонентов иммунной системы.
- Изучить токсичность в отношении репродуктивной системы.
- Изучить местную переносимость.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. В исследовании использовали 50 половозрелых самцов кроликов породы Советская шиншилла (5 групп по 10 животных) с массой тела 3493±380,8 г на начало эксперимента (питомник ФГУП ОПХ «Манихино»). Проведение исследований было одобрено на заседании биоэтической комиссии (БЭК) АО «НПО «ДОМ ФАРМАЦИИ» (протокол заседания БЭК от 27.09.2023 № 1.41/23). Животных содержали в стандартных условиях в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22.09.20103 и Руководством по содержанию и использованию лабораторных животных4.
Животных содержали в стандартных условиях по одному кролику в клетке. Кролики получали стандартный корм и воду очищенную ad libitum. Исследуемый препарат и плацебо вводили предварительно наркотизированным животным. Наркотизацию животных выполняли путем внутривенного введения ветеринарных препаратов Золетил 100 (Virbac, Франция) и Ксила (Interchemie, Нидерланды) в дозах 25 и 5 мг/кг соответственно.
Исследуемый препарат. Биологический лекарственный препарат МедиРег на основе секретома МСК был наработан в составе серии PR120306 на Научно-производственном участке Центра регенеративной медицины Медицинского научно-образовательного института МГУ имени М.В. Ломоносова (лицензия на производство лекарственных средств для медицинского применения № Л012-00102-77/00764252) в соответствии с промышленным регламентом № 001-2023.
Выделение МСК из жировой ткани человека. Образцы жировой ткани здоровых доноров механически измельчали, смешивали с растворами ферментов коллагеназы I типа (200 ед/ мл, Worthington Biochemical, США) и диспазы (40 ед/ мл, Sigma, Германия) и инкубировали при температуре 37 °C в течение 30–45 мин. Затем ферменты ингибировали добавлением равного объема среды, смесь центрифугировали при 200 g в течение 10 мин. Осадок суспендировали, а затем фильтровали через нейлоновые фильтры с размером пор 100 мкм BD Falcon Cell Strainer (BD, США) и центрифугировали при 200 g 5 мин. Осадок ресуспендировали в культуральной среде AdvanceSTEM™ (HyClone, США), после чего выделенные клетки высаживали в культуральные флаконы. Работу с материалом доноров проводили после получения информированного согласия в соответствии с разрешением локального этического комитета (ЛЭК) Университетской клиники МНОИ МГУ имени М.В. Ломоносова, IRB00010587 (протокол заседания ЛЭК от 13.11.2023 № 10/23).
Получение секретома МСК. Для получения секретома МСК клетки 5–6 пассажа, достигшие 80% конфлюентности, промывали трехкратно раствором Хэнкса (ООО НПП «ПанЭко», Россия). Во флаконы добавляли среду DMEM с низким содержанием глюкозы (Gibco, США). Клетки культивировали в течение 7 сут, после чего собирали кондиционированную среду, очищали от клеточного дебриса путем центрифугирования в течение 10 мин при 300 g, а затем 30 мин при 2000 g при температуре 4 °С.
Концентрирование секретома МСК. Для концентрирования использовали фильтры для центрифуги JetSpin (FTT510500, Jet Bio-Filtration, Китай) с размером пор, предназначенным для отсечения молекул размером меньше 10 кДа. Секретом МСК концентрировали на фильтрах при скорости 3000 g. Полученный концентрат дозировали по 1 мл во флаконы и лиофилизировали.
Выбор дозы и способа введения. Выбор дозы и кратности применения проведен на основании руководства5: терапевтическая доза и две дозы, превышающие терапевтическую, в режиме дозирования на одно введение больше, чем предполагается в клинической практике. В клинической практике предполагается однократное введение препарата, количество инъекций в данном исследовании равнялось двум. Летальную дозу в предыдущем исследовании [13] установить не удалось, поэтому помимо терапевтической дозы были изучены максимально переносимые дозы — в 1,5 и 2,5 раза превышающие терапевтическую.
Для определения дозозависимости токсических эффектов выбраны следующие дозы: терапевтическая доза (1 доза с содержанием эндотелиального фактора роста сосудов (vascular endothelial growth factor, VEGF) не менее 0,76 нг), доза, превышающая терапевтическую дозу в 1,5 раза (1,5 дозы с содержанием VEGF не менее 1,14 нг) и в 2,5 раза (2,5 дозы с содержанием VEGF не менее 1,9 нг).
Перед введением животным лиофилизат секретома МСК разводили водой для инъекций в количестве, необходимом для получения дозы, затем смешивали с коллагеновым гелем Аппликолл (ООО «МакМеди», Россия) в объемном соотношении 1:4. Полученный раствор вводили в оба семенника в объеме, максимально возможном для данного вида животного: по 190 мкл в каждый. В качестве плацебо использовали смесь растворителя воды для инъекций и носителя коллагенового геля Аппликолл в соотношении 1:4. Плацебо вводили животным в объеме, эквивалентном максимальному объему введения тестируемого препарата.
Дизайн исследования. Всего в исследование было включено 5 групп животных по 10 особей6: группы 1 и 2 — контрольные, группы 3–5 — получавшие исследуемый препарат. В качестве контроля были взяты интактные животные и животные, которым вводили плацебо в объеме, аналогичном объему введения исследуемого биологического лекарственного препарата. Плацебо или препарат на основе секретома МСК вводили на 1 и 28 сут.
За экспериментальными животными проводили наблюдение в течение всего периода введения препарата (всего 30 сут), а также отсроченно — 30 сут после окончания инъекций для определения обратимости возможных патологических изменений. Дизайн исследования представлен в таблицах 1, 2.
Таблица 1. Характеристика групп животных для исследования токсичности биологического лекарственного препарата на основе секретома мезенхимных стромальных клеток при двукратном введении под белочную оболочку семенника кролика
Table 1. Characteristics of animal groups for the toxicity study of the mesenchymal stromal cell secretome-based biological product in rabbits after two injections under the testicular tunica albuginea
№ группы Group number | Количество животных Number of animals | Препарат для введения Injected substance | Доза Dose | Эвтаназия животных Euthanasia |
1 | 10 | Нет No | Не применимо (интактные животные) Not applicable (intact rabbits) | На 31-е сут — по 5 самцов из каждой группы, 60-е сут — оставшиеся животные 5 animals of each group were sacrificed on day 31, and the remaining animals were sacrificed on day 60 |
2 | 10 | Плацебо Placebo | Вода для инъекций с коллагеновым гелем Water for injection with collagen gel | |
3 | 10 | Биологический лекарственный препарат Biological medicinal product | 1 доза с содержанием VEGF ≥0,76 нг 1 dose (≥0.76 ng of VEGF) | |
4 | 10 | 1,5 дозы с содержанием VEGF ≥1,14 нг 1.5 doses (≥1.14 ng of VEGF) | ||
5 | 10 | 2,5 дозы с содержанием VEGF ≥1,9 нг 2.5 doses (≥1.9 ng of VEGF) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. VEGF — эндотелиальный фактор роста сосудов.
Note. VEGF, vascular endothelial growth factor.
Таблица 2. График проведения манипуляций
Table 2. Manipulation schedule
Манипуляции Manipulations | Сутки эксперимента Study days |
Регистрация массы тела Registration of body weight | 1 (до введения препарата или плацебо), далее — еженедельно 1 (prior to product/placebo administration) and then weekly |
Введение препарата или плацебо под белочную оболочку семенника животным групп № 2–5 Product/placebo injection under the testicular tunica albuginea in animals of groups 2–5 | 1, 28 |
Клиническое наблюдение Clinical observation | Ежедневно Daily |
Регистрация температуры тела Body temperature measurement | 1, 28 (до введения препарата или плацебо и через 3 ч после введения) 1 and 28 (prior to and 3 hours after product/placebo administration) |
Оценка функционального состояния центральной нервной системы (тест Ирвина с модификацией) Assessment of the central nervous system function (modified Irwin test) | 2, 29, 58 |
Регистрация электрокардиограммы, частоты сердечных сокращений, артериального давления, частоты дыхательных движений Taking of electrocardiograms and heart rate, respiratory rate, and blood pressure measurements | 28 (после введения препарата или плацебо), 57 28 (after product/placebo administration), 57 |
Сбор образцов мочи Collection of urine samples | 29–30, 58–59 |
Взятие образцов крови для общего и биохимического анализа, оценки состояния системы гемостаза Collection of blood samples to assess blood counts, biochemistry, and haemostasis function | 3, 30, 59 |
Взятие образцов крови для определения газового состава крови Collection of blood samples for the arterial blood gas test | 30, 59 |
Оценка спермограммы животных Evaluation of the spermogram of animals | 31, 60 |
Эвтаназия 5 животных каждой группы Euthanasia of 5 animals from each group | 31 |
Эвтаназия оставшихся животных Euthanasia of the remaining animals | 60 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Общеклиническое наблюдение. У животных регистрировали: поведение, положение тела в пространстве, состояние шерстяного покрова, дефекацию и изменения в месте введения. Более детальный осмотр не выполняли, так как не отмечали выраженных признаков интоксикации, которые свидетельствовали бы об отклонении от нормы состояния животных.
Анализ мочи. Для сбора мочи животных на 4 и 24 ч помещали в индивидуальные метаболические клетки со стеклянным гранулятом. После сбора образцы мочи переносили в центрифужные пробирки и центрифугировали в течение 10 мин при 1500 об/мин. Аликвоты надосадочной жидкости отбирали в 96-луночные планшеты для проведения качественных реакций на патологические компоненты мочи. Общий анализ мочи был проведен по следующим параметрам: эритроциты, общий белок, глюкоза, билирубин, относительная плотность, pH. Для определения рН мочи использовали тест-полоски (DF, Китай). Относительную плотность мочи определяли с помощью рефрактометра AMTAST VUR3T (AMTAST, США). Микроскопическое исследование мочевого осадка не проводили, так как в пробах не было выявлено положительной реакции на кровь. Пробы мочи, собранные через 24 ч, использовали для определения суточного диуреза. В объединенной пробе с помощью биохимического анализатора Random Access A-25 (Biosystem, Испания) определяли креатинин (с расчетом клиренса креатинина) и мочевину.
Оценка гематологических показателей. Кровь забирали прижизненно из краевой вены уха в объеме 0,2 мл в пробирки Impromini с трикалиевой солью этилендиаминтетрауксусной кислоты (ЭДТА K3) (IMPROVE, Китай). В цельной крови с антикоагулянтом на гематологическом анализаторе Mythic 18 (Orphee, Швейцария) определяли следующие показатели: количество эритроцитов, 10¹²/л; уровень гемоглобина, г/л; гематокрит, %; количество лейкоцитов, 10⁹/л; количество тромбоцитов, 10⁹/л; лимфоциты, %; моноциты, %; гранулоциты, %. Дополнительные параметры не проанализированы в связи с отсутствием клинически значимых отклонений основных показателей у животных в группах, получавших исследуемый препарат, от животных интактной группы.
Определение параметров гемостаза. Кровь забирали прижизненно из краевой ушной вены в объеме 0,7 мл в пробирки с 3,8% цитратом натрия. Далее пробы крови центрифугировали с помощью центрифуги Z216МК (Hermle Labortechnik, Германия) 15 мин при 1800 g (4350 об/мин) для получения плазмы. В образцах цитратной плазмы определяли протромбиновое время, активированное частичное тромбопластиновое время (АЧТВ) и фибриноген с помощью коагулометра АПГ4-02-П (ООО «ЭМКО», Россия).
Оценка биохимических показателей крови. Кровь отбирали из краевой ушной вены в пробирки Improvacuter с активатором свертывания (IMPROVE, Китай). Для получения сыворотки кровь центрифугировали на центрифуге лабораторной клинической ОПн-3.04 «Дастан» (ОАО «ТНК «Дастан», Кыргызская Республика) 15 мин при 3000 об/мин. Полученную сыворотку переносили во вторичные пробирки. Биохимические показатели крови: аланиновая трансаминаза, аспарагиновая трансаминаза, общий белок, альбумин, креатинин, мочевина, общий билирубин, общий холестерин, триглицериды, щелочная фосфатаза, глюкоза, лактатдегидрогеназа — определяли в сыворотке крови на биохимическом анализаторе Random Access А-25 (Biosystems, Испания) с использованием реагентов фирмы BioSystems (Испания).
Оценка миелограммы. Взятие и анализ (микроскопия мазка) костного мозга не проводили в соответствии с планом исследования, поскольку в клиническом анализе крови животных, получавших исследуемые объекты, не было зарегистрировано отклонений в гематологических показателях.
Оценка фармакологической безопасности.
Влияние на сердечно-сосудистую систему. Для регистрации электрокардиограммы (ЭКГ) животное предварительно наркотизировали. Регистрацию ЭКГ проводили с помощью компьютерного электрокардиографа для ветеринарии «Поли-спектр-8/Е» (ООО «Нейрософт», Россия) не менее 60 с. Для неинвазивного метода использовали электроды многоразовые прижимные. Проводили сравнительную оценку следующих показателей: частота сердечных сокращений, RR (мс), P (мс), PQ (мс), QRS (мс), QT (мс). После регистрации ЭКГ у животных измеряли систолическое артериальное давление неинвазивным методом при помощи ветеринарного монитора давления Zoomed BPM-2 (Zoomed, Россия).
Влияние на дыхательную систему. Оценку частоты дыхательных движений проводили визуально за 1 мин у предварительно наркотизированных животных.
На 30 и 59 сут эксперимента были отобраны образцы артериальной крови для определения газового состава крови. Кровь отбирали из центральной ушной артерии при помощи катетера 26G в шприцы в объеме 50–100 мкл и при помощи газоанализатора i-STAT (Abbott, США) определяли следующие параметры: парциальное давление углекислого газа, парциальное давление кислорода, насыщение гемоглобина кислородом.
Оценка функционального состояния центральной нервной системы. Проводили с помощью батареи тестов, предложенной S. Irwin, с модификациями и рекомендованной для оценки фармакологической безопасности руководством S7A IСH7 [14][15]. Для оценки возможных поведенческих и/или физиологических изменений регистрировали наличие или отсутствие патологических признаков, указывающих на возбуждение или седацию, стереотипные движения, изменения в локомоторной активности, оценку рефлексов, оценку состояния вегетативной нервной системы и дыхания.
Оценка нефротоксичности. Изучение нефротоксичности включало оценку суточного диуреза; показателей общего анализа мочи: относительная плотность, pH, глюкоза, билирубин, белок, кровь, кетоны; показателей биохимического анализа мочи: креатинин и мочевина; клиренс креатинина; оценку массовых коэффициентов и гистологический анализ почек.
Оценка пирогенности. Температуру тела регистрировали на 1 и 28 сут (до введения и через 3 ч после введения исследуемого препарата или плацебо) с помощью ректального термометра (ректального датчика) ветеринарного монитора пациента Zoomed IM-10 (ЗАО «Ист Медикал», Россия). Испытание проводили на кроликах с исходной температурой 38,8–39,1 ºС, статистически значимо не различавшейся между группами. В рамках данного эксперимента исследуемый объект признают апирогенным, если полученный результат ≤1,2 ºС, а индивидуальное повышение температуры ни у одного из 5 кроликов в группе не превышает 0,5 ºС8.
Изучение иммунотоксических свойств. Изучали гематологические и биохимические показатели крови (общее количество лейкоцитов, абсолютные дифференциальные показатели лейкоцитов, уровень глобулинов), гистологическое исследование органов (тимус, селезенка, паховые лимфатические узлы, костный мозг), оценивали массовые коэффициенты органов (тимус, селезенка)9.
Эвтаназия. Животных эвтаназировали при помощи наркотизации с последующим удалением жизненно важных внутренних органов (конечный этап эвтаназии)10. Данный вид эвтаназии животных сопровождался минимумом боли, страдания и дистресса и проводился компетентными сотрудниками.
Патоморфологическое исследование. После эвтаназии животные были тщательно обследованы на предмет внешних патологических признаков. Органы, извлеченные при некропсии, были взвешены, парные органы взвешивали вместе. Данный показатель использован для расчета процентного отношения массы органов к массе тела по формуле (1):
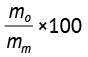 , (1)
, (1)
где mo — масса органа, mm — масса тела животного.
Процедуру взвешивания внутренних органов осуществляли на электронных весах ВК-300 (ЗАО «Масса-К», Россия). Наименьший предел взвешивания 0,1 г, наибольший — 300 г. Цена поверочного деления 0,01 г, класс точности II.
У животных были взяты следующие органы (фрагменты органов) и ткани: аорта, сердце, трахея, легкие с бронхами, тимус, слюнные железы, пищевод, желудок, двенадцатиперстная кишка, подвздошная кишка, слепая кишка, толстый кишечник, поджелудочная железа, печень, селезенка, почки, мочевой пузырь, желчный пузырь, надпочечники, семенники, придаток левого семенника (эпидидимис), простата, семенные пузырьки, паховые лимфатические узлы, щитовидная и паращитовидная железы, головной мозг, спинной мозг, гипофиз, седалищный нерв, глазные яблоки, гардерова железа, кожа, кость с костным мозгом (бедренная кость с сохранением эпифиза), скелетные мышцы, органы с макроскопическими изменениями, обнаруженными при некропсии. Органы, подлежащие взвешиванию: головной мозг; сердце; легкие с трахеей, тимус, печень, селезенка, почки, надпочечники, семенники.
Для последующего гистологического исследования органы и ткани были зафиксированы в 10% растворе нейтрального формалина в течение 24 ч [16]. После фиксации была проведена гистологическая проводка — дегидратация материала при помощи автоматического гистопроцессора KD-TS3S1 (Китай) в изопропиловых спиртах восходящей концентрации с последующей инфильтрацией парафином при температуре 55–57 °С. Полученные фрагменты заливали в парафиновые блоки, из которых изготавливали срезы толщиной 3–5 мкм. Срезы депарафинизировали в растворе ксилола, окрашивали гематоксилином и эозином при помощи автоматической станции для окраски гистологических препаратов KD-RS (Китай) и после просветления заключали под покровное стекло [17]. Анализ гистологических препаратов проводили при помощи светооптического микроскопа Микромед 2 (3–20 inf.) (ООО «Наблюдательные приборы», Россия) при увеличении в 40, 100 и 400 раз. Микрофотографирование проводили при помощи цифровой фотокамеры ToupCam UCMOS05100KPA (Китай) и программного обеспечения ToupView 3.7.7892.
Оценка местной переносимости. Для оценки местной переносимости при некропсии визуально оценивали макроскопические изменения в тканях семенника, а также проводили гистологическую оценку тканей, непосредственно контактировавших с исследуемыми объектами.
Анализ данных. Для всех данных была применена описательная статистика: данные проверяли на соответствие закону нормального распределения с помощью критерия Шапиро–Уилка. В случае нормального распределения рассчитывали среднее значение (M) и стандартное отклонение (SD), которые вместе со значением n (количество наблюдений) представлены в итоговых таблицах. В случаях несоответствия данных закону нормального распределения рассчитывали медиану (Me) и квартильный размах (Q1;Q3). Оценку наличия выбросов в данных не проводили.
Для оценки независимых данных с признаками нормального распределения использовали однофакторный дисперсионный анализ (one-way ANOVA). Независимые данные были проверены на гомогенность дисперсий с помощью критерия Брауна–Форсайта. Для оценки связанных данных использовали дисперсионный анализ c повторными измерениями (repeated measures ANOVA), данные предварительно проверяли на сферичность дисперсий с помощью теста Моучли. В случае невыполнения предположения о сферичности дисперсий применяли дисперсионный анализ с эпсилон-корректировкой методом Гейссера–Гринхауса. В случае обнаружения достоверного влияния исследуемого фактора последующие межгрупповые сравнения (post-hoc analysis) проводили с использованием критерия Тьюки.
Для анализа независимых данных, не подчиняющихся закону нормального распределения или не соответствующих критериям применения дисперсионного анализа, использовали критерий Краскела–Уоллиса с дальнейшим применением метода средних рангов для множественных сравнений в случае обнаружения достоверного влияния исследуемого фактора. Различия определяли при уровне значимости р≤0,05. Статистический анализ данных выполняли с помощью лицензированного программного обеспечения Statistica 10.0 (StatSoft, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общетоксическое действие
Случаев гибели и интоксикации животных во всех группах в эксперименте не зарегистрировано. Кролики были в удовлетворительном состоянии, поведенческие реакции и динамика массы тела кроликов, получавших тестируемый препарат, не отличались от показателей интактных и получавших плацебо животных, в том числе в период отсроченного наблюдения.
Общий и биохимический анализы мочи. По окончании периода введения под белочную оболочку семенника в группе животных, получавших плацебо, отмечали повышение уровня креатинина и мочевины в моче относительно интактной группы. Однако по окончании периода отсроченного наблюдения клинически значимых эффектов не наблюдали, что указывает на обратимость выявленного эффекта. Креатинин и мочевина являются почечными факторами, повышение их уровня может указывать на снижение почечной функции или повышенное разрушение мышечных клеток. Уровень креатинина и мочевины может изменяться под влиянием препаратов, при обезвоживании и выполнении различных манипуляций на животных в результате индивидуальных реакций [18]. Для выявления точной причины повышения креатинина и мочевины в моче может потребоваться более тщательное диагностическое обследование.
Гематологические, биохимические показатели крови и параметры системы гемостаза. На 3 сут после введения препарата на основе секретома МСК в количестве 1,5 и 2,5 терапевтической дозы у животных было обнаружено снижение протромбинового времени относительно интактной группы, которое выходило за пределы референсного интервала 8,7–11,0 с, но не дублировало динамику значений, полученных на 31 сут эксперимента, где не наблюдали статистически значимых значений между группами (рис. 1). По окончании периода отсроченного наблюдения снижение протромбинового времени ниже референсного интервала отмечали только в группе плацебо, что, по-видимому, является феноменом, не связанным с введением исследуемого препарата и плацебо.
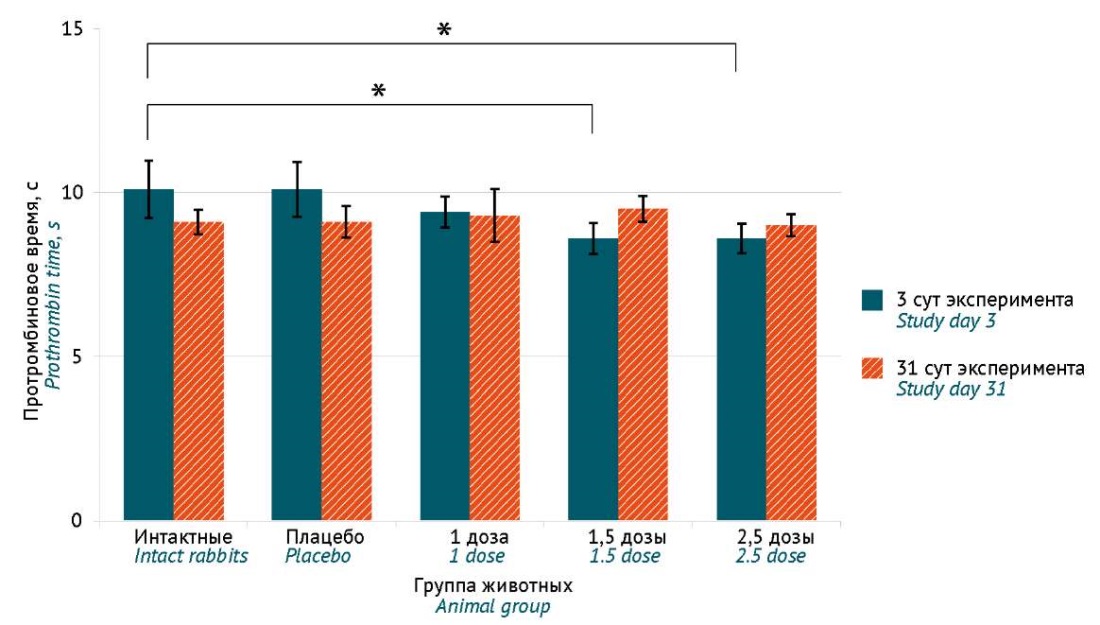
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Протромбиновое время на 3 сут (синие столбцы) и 31 сут (оранжевые столбцы) после введения кроликам под белочную оболочку семенников препарата на основе секретома мезенхимных стромальных клеток и плацебо (данные представлены как среднее и стандартное отклонение М±SD). * Уровень значимости p<0,05
Fig. 1. Prothrombin time on day 3 (blue columns) and day 31 (orange columns) after administration of the mesenchymal stromal cell secretome-based medicinal product or the placebo under the tunica albuginea of the testes. The data are presented as M±SD (mean ± standard deviation). * p<0.05
Клинически значимого влияния исследуемого препарата и плацебо на остальные гематологические и биохимические показатели не выявлено.
Фармакологическая безопасность. Не выявлено токсичности препарата на основе секретома МСК и коллагенового геля в отношении сердечно-сосудистой, дыхательной систем и почек. При введении исследуемого препарата (2,5 терапевтической дозы с содержанием VEGF не менее 1,9 нг) не выявлена токсичность в отношении центральной нервной системы. Поскольку не было отклонений при введении максимальной дозы препарата, тест Ирвина у животных, получавших среднюю и минимальную дозу препарата, не проводили.
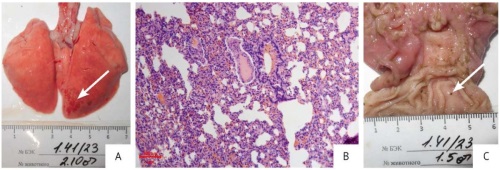
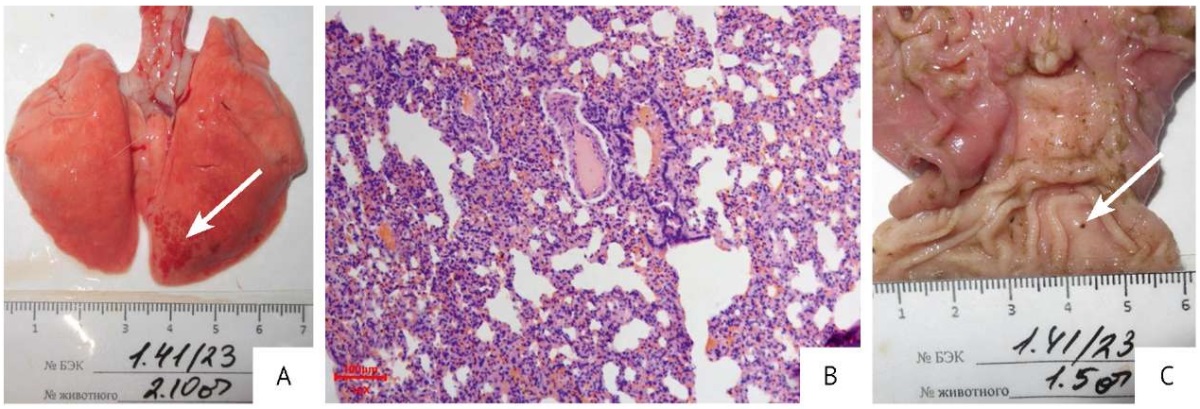
Результаты патоморфологического исследования. У единичных особей во всех группах по окончании периода введения наблюдали небольшие свежие кровоизлияния в легких (рис. 2А, 2B), эрозивно-язвенные поражения слизистой оболочки желудка (рис. 2C). Данные изменения характеризуются как острый процесс и могут являться как следствием процедуры эвтаназии, так и фоновым спонтанным заболеванием. У всех остальных животных микроскопических изменений в исследованных органах и тканях не выявлено, а строение соответствовало норме.
Фотография выполнена авторами / The photograph is taken by the authors
Рис. 2. Макроскопические и микроскопические изменения органов, обнаруженные при плановой некропсии кроликов. (А) Эвисцерированные легкие (животное из группы плацебо), кровоизлияния в каудальной доле правого легкого (стрелка). (B) Срез легких (животное из группы с введением 2,5 терапевтической дозы препарата на основе секретома мезенхимных стромальных клеток), участок ателектаза. Окраска гематоксилином и эозином, увеличение ×100. (C) Эвисцерированный желудок (интактное животное), эрозивно-язвенное поражение слизистой оболочки (стрелка)
Fig. 2. Macroscopic and microscopic changes detected in organs during routine necropsy of rabbits. (A) Eviscerated lungs with haemorrhages in the caudal lobe of the right lung (marked with an arrow), placebo group. (B) Haematoxylin–eosin-stained lung section with areas of atelectasis (magnification: 100×), treatment group (2.5 therapeutic doses of the mesenchymal stromal cell secretome-based medicinal product). (C) Eviscerated stomach with erosive and ulcerative changes (marked with an arrow), intact group
Пирогенность
Выявлено статистически значимое отличие показателя температуры «до введения» и «через 3 ч после введения» в группах, получивших плацебо, 1 и 2,5 дозы тестируемого объекта. Однако выявленное отличие было меньше 1,2 ºС, а индивидуальное повышение температуры ни у одного из пяти кроликов не превышало 0,5 ºС, что указывает на апирогенность исследуемых объектов, вводимых в изучаемых дозах11.
Иммунотоксические свойства
По окончании периода введения и периода отсроченного наблюдения клинически значимых отклонений по общему количеству лейкоцитов, абсолютному количеству лимфоцитов, моноцитов, гранулоцитов, уровню глобулинов не выявлено. Патологических отклонений в тканях паховых лимфатических узлов, тимуса, селезенки, костного мозга у животных всех групп не наблюдали, что говорит об отсутствии иммунотоксического эффекта у исследуемого препарата и коллагенового геля.
Репродуктивная токсичность и местная переносимость
Ранее в расширенных исследованиях репродуктивной токсичности на грызунах было показано отсутствие токсического воздействия на репродуктивную функцию крыс и потомства в первом и втором поколении [13]. У кроликов исследуемый препарат на основе секретома МСК и плацебо не оказали влияния на спермограмму экспериментальных животных. В месте введения в семенниках, прилегающих тканях и органах половой системы макроскопически видимых изменений не обнаружено. У всех кроликов семенники были в форме эллипса, плотной консистенции, окружены плотной соединительнотканной белочной оболочкой, хорошо просматривалась сосудистая сеть органа. Вместе с тем при проведении патоморфологического анализа по окончании периода введения у 2 из 5 самцов (40%) из группы плацебо выявлено увеличение в размерах пузырьковидных желез, дольки которых были резко расширены и содержали прозрачный секрет, предположительно коллаген, свободно вытекающий при разрезе (рис. 3, табл. 3).
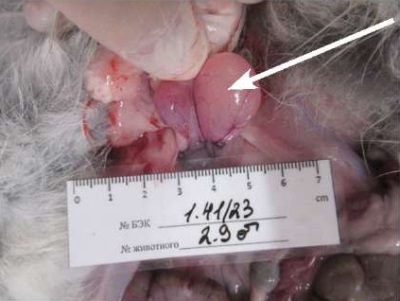
Фотография выполнена авторами / The photograph is taken by the authors
Рис. 3. Вскрытая брюшная полость кролика из группы плацебо: увеличенные пузырьковидные железы (стрелка)
Fig. 3. Opened abdominal cavity of a rabbit from the placebo group, demonstrating enlarged vesicular glands (marked with the arrow)
Таблица 3. Патоморфологические изменения в семенниках кроликов после двукратного введения под белочную оболочку семенника биологического лекарственного препарата на основе секретома мезенхимных стромальных клеток или плацебо
Table 3. Pathology findings at the injection site of the rabbit testicle after double subalbugineal administration of the mesenchymal stromal cell secretome-based medicinal product or the placebo
Характеристика изменений Characteristics of the findings | Количество животных с изменениями в репродуктивной системе / количество животных в группе Animals with changes in the reproductive system / animals per group | ||||
Интактные животные Intact animals | Введение препарата Medicinal product administration | Введение плацебо Placebo administration | |||
1 доза (VEGF ≥0,76 нг) 1 dose (≥0.76 ng of VEGF) | 1,5 дозы (VEGF ≥1,14 нг) 1.5 doses (≥1.14 ng of VEGF) | 2,5 дозы (VEGF ≥1,9 нг) 2.5 doses (≥1.9 ng of VEGF) | |||
31 сут эксперимента / Study day 31 | |||||
Семенники Testicles | 0/5 | 0/5 | 1/5 | 0/5 | 1/5 |
Формирование полости в пределах соединительнотканных перегородок Cavity formation inside connective tissue septa | |||||
Пузырьковидная железа Vesicular gland | 0/5 | 0/5 | 0/5 | 0/5 | 2/5 |
Увеличена в размерах, содержит секреторное включение Increase in size, secretory inclusion | |||||
Растяжение слизистой оболочки, уплощение складок Stretching of the mucous membrane, flattening of folds | 0/5 | 0/5 | 0/5 | 0/5 | 2/5 |
60 сут эксперимента / Study day 60 | |||||
Пузырьковидная железа Vesicular gland | 0/5 | 2/5 | 1/5 | 1/5 | 1/5 |
Формирование полости в пределах соединительнотканных перегородок Cavity formation inside connective tissue septa | |||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. VEGF — vascular endothelial growth factor.
Note. VEGF, vascular endothelial growth factor.
Однако микроскопическое строение пузырьковидной железы у самцов из группы плацебо не было нарушено, дистрофические изменения эпителия отсутствовали, отмечено разглаживание обычно складчатой слизистой оболочки и уплощение эпителия в результате скопления секрета в полости (рис. 4).
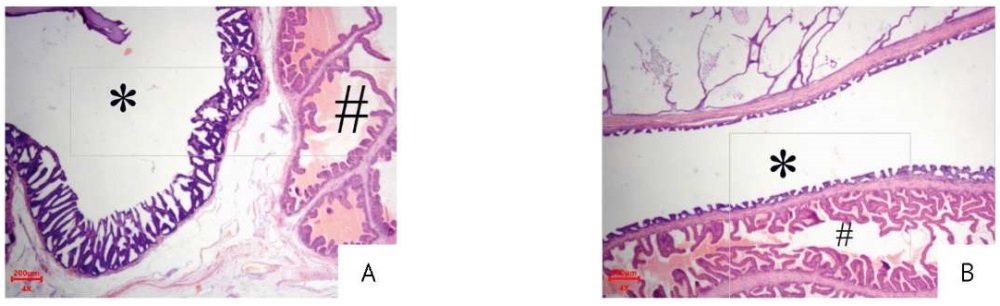
Фотография выполнена авторами / The photograph is taken by the authors
Рис. 4. Срезы пузырьковидной железы кроликов, 31 сут эксперимента. Окраска гематоксилином и эозином, увеличение ×40. (А) Нормальное строение железы у кролика из группы с введением 2,5 терапевтической дозы препарата на основе секретома мезенхимных стромальных клеток. Стенка пузырьковидной железы (*) состоит из умеренно развитой мышечной оболочки и хорошо развитой слизистой оболочки, образовывающей многочисленные складки, выстланные псевдостратифицированным цилиндрическим эпителием. Рядом с пузырьковидной железой, отделенная от нее слоем мышечной и соединительной ткани, располагается предстательная железа (#), представляющая собой трубчато-альвеолярную железу, разделенную соединительнотканными трабекулами, внутренняя поверхность складчатая, выстлана простым цилиндрическим или двухрядным цилиндрическим эпителием, в просвете содержится эозинофильный секрет. (B) Изменения в пузырьковидной железе у кролика из группы плацебо. Просвет пузырьковидной железы (*) расширен, при этом стенка истончается, слизистая оболочка уплощается, высота складок снижена, цилиндрический эпителий также уплощен. Рядом с железой, отделенная от нее слоем мышечной и соединительной ткани, располагается предстательная железа (#), представляющая собой трубчато-альвеолярную железу, разделенную соединительнотканными трабекулами, внутренняя поверхность складчатая, выстлана простым цилиндрическим или двухрядным цилиндрическим эпителием, в просвете содержится эозинофильный секрет
Fig. 4. Haematoxylin–eosin-stained rabbit vesicular gland sections (magnification: 40×) on day 31. (A) Normal vesicular gland structure, treatment group (2.5 therapeutic doses of the mesenchymal stromal cell secretome-based medicinal product). The vesicular gland wall (*) consists of a moderately developed muscle membrane and a well-developed mucous membrane forming numerous folds lined with pseudostratified columnar epithelium. Next to the vesicular gland, separated from it by a layer of muscle and connective tissue, there is the prostate gland (#), which is a tubuloalveolar gland divided by connective tissue trabeculae. Its inner surface is folded and lined with single- or double-layered columnar epithelium. The lumen of the prostate gland contains eosinophilic secretion. (B) Changes in the vesicular gland, placebo group. The lumen of the vesicular gland (*) is expanded, the wall is thinned, the mucous membrane is flattened, the height of the folds is reduced, and the columnar epithelium is also flattened. Next to the vesicular gland, separated from it by a layer of muscle and connective tissue, there is the prostate gland (#), which is a tubuloalveolar gland divided by connective tissue trabeculae. Its inner surface is folded and lined with single- or double-layered columnar epithelium. The lumen of the prostate gland contains eosinophilic secretion.
Гистологический анализ семенников показал, что у большинства животных их строение соответствовало норме. Семенники покрыты белочной оболочкой, паренхима образована многочисленными извитыми канальцами, выстланными сперматогенным эпителием. Сперматогенез завершенный, представлен большим количеством сперматозоидов в просветах канальцев. В интерстиции обнаружено большое количество мелких сосудов и группы гландулоцитов, представленных клетками Лейдига (рис. 5А).
По окончании периода введения (табл. 3) у одного самца, получавшего 1,5 терапевтической дозы препарата на основе секретома МСК, и у одного самца из группы плацебо были выявлены участки значительного расслоения соединительнотканных перегородок с формированием полости, заполненной «рыхлым» веществом, предположительно коллагеном, с выраженным эозинофильным окрашиванием. При этом канальцы вдоль стенки полости деформированы в результате сдавливания, но без признаков дистрофических нарушений сперматогенного эпителия (рис. 5B, 5C). В период отсроченного наблюдения подобные изменения наблюдали в среднем у 1–2 животных из 5 в группе (20–40%) животных, получавших исследуемый препарат (все три группы) и плацебо. У интактных животных подобные изменения не выявлены.
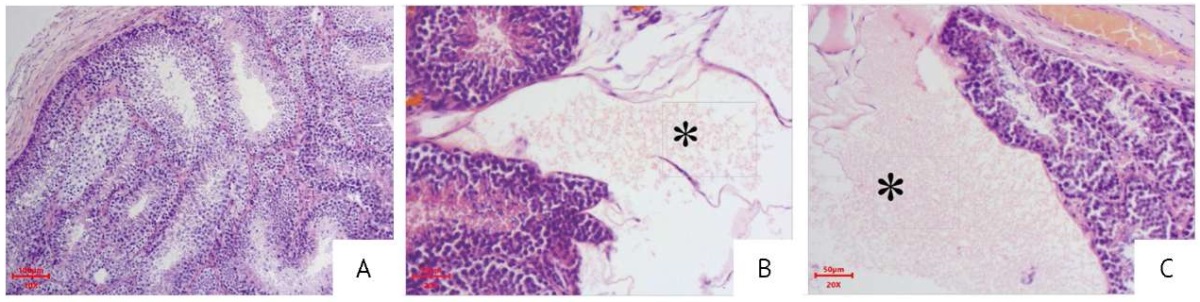
Фотография выполнена авторами / The photograph is taken by the authors
Рис. 5. Срезы органов репродуктивной системы кроликов, окраска гематоксилином и эозином. А — нормальное строение семенника кролика из группы с введением 1,5 терапевтической дозы препарата на основе секретома мезенхимных стромальных клеток (31 сут эксперимента, по окончании периода введения). Увеличение ×100. (А) Семенник снаружи покрыт соединительнотканной капсулой из плотно расположенных коллагеновых волокон с тонкими кровеносными и лимфатическими сосудами. Компактно расположенные семенные канальцы, окруженные соединительнотканными прослойками с клетками Лейдига, фиброцитами и гистиоцитами, выстланы немногочисленными сустентоцитами (клетки Сертоли) и сперматогенным эпителием, клетки которого находятся на разных стадиях сперматогенеза: сперматогонии, первичные и вторичные сперматоциты, сперматиды и сперматозоиды. (В) Место введения 1,5 терапевтической дозы препарата на основе секретома мезенхимных стромальных клеток в семенник кролика (31 сут эксперимента, по окончании периода введения). Увеличение ×200. (С) Место введения плацебо в семенник кролика (60 сут эксперимента, по окончании периода отсроченного наблюдения). Увеличение ×200. На фотографиях В и С видна полость (*) в области белочной оболочки, стенками которой являются соединительнотканные прослойки семенных канальцев, в просвете полости определяется зернистая эозинофильно окрашенная субстанция, которая визуально раздвигает канальца в стороны
Fig. 5. Haematoxylin–eosin-stained rabbit reproductive organ sections on day 31. (A) Normally structured rabbit testicle (magnification: 100×) on study day 31 (end of administration), treatment group (1.5 therapeutic doses of the mesenchymal stromal cell secretome-based medicinal product). The outer side of the testicle is covered by a connective tissue capsule of tightly packed collagen fibers with thin blood and lymphatic vessels. Seminiferous tubules are closely located, are surrounded by connective tissue layers with Leydig cells, fibrocytes, and histiocytes, and are lined with a few sustentacular cells (Sertoli cells) and seminiferous epithelium. The seminiferous epithelial cells are at different stages of spermatogenesis (spermatogonia, primary and secondary spermatocytes, spermatids, and spermatozoa). (B) injection site of the rabbit testicle (magnification: 200×) on study day 31 (end of administration), Treatment group (1.5 therapeutic doses of the mesenchymal stromal cell secretome-based medicinal product). (C) Injection site of the rabbit testicle (magnification: 200×) on study day 60 (end of observation), placebo group. Photographs B and C feature areas of the tunica albuginea with cavities (*). Cavity walls are formed by layers of connective tissue of the seminiferous tubules. Cavity lumens contain a granular eosinophilic substance, which visually pushes the tubules apart.
Единичные гистологические изменения — участки расслоения соединительнотканных перегородок с формированием полости между семенными канальцами, вероятно, обусловлены механическим воздействием локального введения максимального объема исследуемого препарата и плацебо. Данный эффект сохранялся вплоть до 60 сут, что, по-видимому, свидетельствует о необходимости более длительного периода для биодеградации коллагена в тканях семенника. Однако следует отметить, что патологические изменения не вызывали развития дистрофических изменений в семенных канальцах и не затрагивали сперматогенез, что позволяет сделать вывод об отсутствии токсического влияния препарата на основе секретома МСК и носителя в составе препарата (коллагенового геля) на мужскую репродуктивную систему.
ЗАКЛЮЧЕНИЕ
Исследуемый препарат на основе секретома МСК в изученных дозах и носитель в составе препарата (коллагеновый гель) не оказали негативного влияния на общее состояние животных, динамику массы тела, гематологические и биохимические показатели, состояние репродуктивной, сердечно-сосудистой, дыхательной и центральной нервной системы. Не было выявлено нефротоксичности, иммунотоксичности и пирогенности исследуемого препарата и носителя.
У животных из группы плацебо были выявлены обратимые гистологические изменения в пузырьковидной железе. В группах с введением препарата и с введением плацебо в семенниках выявлены участки значительного расслоения соединительнотканных перегородок с формированием полости, заполненной рыхлым веществом с выраженным эозинофильным окрашиванием, и деформация канальца вдоль стенки полости в результате сдавливания. Обнаруженные изменения, по-видимому, обусловлены механическим воздействием довольно большого объема исследуемых объектов и не связаны с их фармакологическим действием.
Таким образом, исследуемый препарат на основе секретома МСК и носитель в составе препарата (коллагеновый гель) при введении под белочную оболочку семенника кролика обладают приемлемым профилем безопасности.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.О. Монакова — дизайн исследования, контроль основных точек экспериментов, написание и редактирование текста рукописи; В.Ю. Балабаньян — дизайн и методология исследования, редактирование текста рукописи; В.А. Вавилова — планирование и проведение исследования, сбор и анализ данных, написание текста рукописи; Н.А. Басалова — подготовка образцов препарата, редактирование текста рукописи; В.С. Попов — дизайн исследования, выбор методов работы с животными; Ж.А. Акопян — идея исследования; А.Ю. Ефименко — идея и планирование исследования, формулировка цели и задач, критический пересмотр текста рукописи.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Anna O. Monakova designed the study, controlled the main points of experiments, drafted and edited the manuscript. Vadim Yu. Balabanyan designed the study and its methodology and edited the manuscript. Valeria A. Vavilova planned and conducted the experiments, collected and analysed data, and drafted the manuscript. Nataliya A. Basalova prepared medicinal product samples and edited the manuscript. Vladimir S. Popov designed the study and selected the methods for working with animals. Zhanna A. Akopyan conceived the study idea. Anastasia Yu. Efimenko elaborated the study idea, planned the study, formulated the study aims and objectives, and critically revised the manuscript.
Соответствие принципам этики. Проведение исследования одобрено на заседании биоэтической комиссии (БЭК) АО «НПО «ДОМ ФАРМАЦИИ», (протокол заседания БЭК от 27.09.2023 № 1.41/23). Работу с материалом доноров проводили после получения информированного согласия в соответствии с разрешением локального этического комитета (ЛЭК) Университетской клиники МНОИ МГУ имени М.В. Ломоносова, IRB00010587 (протокол заседания ЛЭК от 13.11.2023 № 10/23).
Ethics approval. The study was approved by the Bioethics Committee of the research-and-manufacturing company “HOME OF PHARMACY”, JSC (Meeting Minutes 1.41/23 of 27 September 2023). The work with donor material was performed with informed consent and with permission of the Local Ethics Committee (LEC) of Lomonosov Moscow State University, IRB00010587 (LEC Meeting Minutes 10/23 of 13 November 2023).
1. Решение Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
2. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
3. Директива 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях.
4. ГОСТ 33215-2014 Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур.
ГОСТ 33216-2014 Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами.
5. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
6. Там же.
7. ICH S7A Safety Pharmacology Studies for Human Pharmaceuticals. ICH; 2001.
8. ОФС.1.2.4.0005.15 Пирогенность. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
9. ICH S8 Immunotoxicity Studies for Human Pharmaceuticals. ICH; 2006.
10. Директива 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях.
11. ОФС.1.2.4.0005.15 Пирогенность. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
Список литературы
1. Punab M, Poolamets O, Paju P, Vihljajev V, Pomm K, Ladva R, et al. Causes of male infertility: A 9-year prospective monocentre study on 1737 patients with reduced total sperm counts. Hum Reprod. 2017;32(1):18–31. https://doi.org/10.1093/humrep/dew284
2. Jungwirth A, Giwercman A, Tournaye H, Diemer T, Kopa Z, Dohle G, et al. European Association of Urology guidelines on male infertility: The 2012 update. Eur Urol. 2012;62(2):324–32. https://doi.org/10.1016/j.eururo.2012.04.048
3. Sagaradze G, Basalova N, Kirpatovsky V, Ohobotov D, Nimiritsky P, Grigorieva O, et al. A magic kick for regeneration: Role of mesenchymal stromal cell secretome in spermatogonial stem cell niche recovery. Stem Cell Res Ther. 2019;10(1):342. https://doi.org/10.1186/s13287-019-1479-3
4. Caroppo E, Colpi GM. Male infertility: A review of key papers appearing in the reproductive medicine and andrology section of the Journal of Clinical Medicine. J Clin Med. 2023;12(6):2366. https://doi.org/10.3390/jcm12062366
5. Fainberg J, Kashanian JA. Recent advances in understanding and managing male infertility. F1000Res. 2019;8:(F1000 Faculty Rev):670. https://doi.org/10.12688/f1000research.17076.1
6. Chen G, Kathrins M, Ohlander S, Niederberger C. Medical management of male infertility: Now and future. Curr Opin Urol. 2023;33(1):10–5. https://doi.org/10.1097/MOU.0000000000001056
7. Dissanayake DMDH, Keerthirathna WLR, Peiris LDC. Male infertility problem: A contemporary review on present status and future perspective. Gender and the Genome. 2019;3:1–7. https://doi.org/10.1177/2470289719868240
8. Minhas S, Bettocchi C, Boeri L, Capogrosso P, Carvalho J, Cilesiz NC, et al. European Association of Urology Guidelines on male sexual and reproductive health: 2021 update on male infertility. Eur Urol. 2021;80(5):603–20. https://doi.org/10.1016/j.eururo.2021.08.014
9. Kalinina N, Kharlampieva D, Loguinova M, Butenko I, Pobeguts O, Efimenko A, et al. Characterization of secretomes provides evidence for adipose-derived mesenchymal stromal cells subtypes. Stem Cell Res Ther. 2015;6:221. https://doi.org/10.1186/s13287-015-0209-8
10. Fujii S, Miura Y. Immunomodulatory and regenerative effects of MSC-derived extracellular vesicles to treat acute GVHD. Stem Cells. 2022;40(11):977–90. https://doi.org/10.1093/stmcls/sxac057
11. Sagaradze GD, Basalova NA, Kirpatovsky VI, Ohobotov DA, Grigorieva OA, Balabanyan VY, et al. Application of rat cryptorchidism model for the evaluation of mesenchymal stromal cell secretome regenerative potential. Biomed Pharmacother. 2019;109:1428–36. https://doi.org/10.1016/j.biopha.2018.10.174
12. Monakova A, Sagaradze G, Basalova N, Popov V, Balabanyan V, Efimenko A. Novel potency assay for MSC secretome-based treatment of idiopathic male infertility employed Leydig cells and revealed vascular endothelial growth factor as a promising potency marker. Int J Mol Sci. 2022;23(16):9414. https://doi.org/10.3390/ijms23169414
13. Монакова АО, Сагарадзе ГД, Балабаньян ВЮ, Басалова НА, Матичина АА, Матичин АА и др. Изучение безопасности оригинального препарата на основе секретома мезенхимных стромальных клеток при локальном введении в яички и при внутримышечном введении препарата крысам. Безопасность и риск фармакотерапии. 2023;12(1):99–116. https://doi.org/10.30895/2312-7821-2023-364
14. Irwin S. Comprehensive observational assessment: Ia. A systematic, quantitative procedure for assessing the behavioral and physiologic state of the mouse. Psychopharmacologia. 1968;13(3):222–57. https://doi.org/10.1007/BF00401402
15. Palozi RAC, Guarnier LP, Romão PVM, Nocchi SR, Dos Santos CC, Lourenço ELB, et al. Pharmacological safety of Plinia cauliflora (Mart.) Kausel in rabbits. Toxicol Rep. 2019;6:616–24. https://doi.org/10.1016/j.toxrep.2019.06.017
16. Гущин ЯА, Мужикян АА. Влияние фиксирующих жидкостей на микроскопическую структуру органов мелких лабораторных животных. Международный вестник ветеринарии. 2014;(3):88–95. EDN: SUEDYF
17. Мужикян АА, Макарова МН, Гущин ЯА. Особенности гистологической обработки органов и тканей лабораторных животных. Международный вестник ветеринарии. 2014;(2):103–9. EDN: SFLHTJ
18. Melillo A. Rabbit clinical pathology. Journal of Exotic Pet Medicine. 2007;16(3):135–45. https://doi.org/10.1053/j.jepm.2007.06.002
Об авторах
А. О. МонаковаРоссия
Монакова Анна Олеговна
Ломоносовский пр-т, д. 27, корп. 10, Москва, 119234
В. Ю. Балабаньян
Россия
Балабаньян Вадим Юрьевич, д-р фарм. наук
Ломоносовский пр-т, д. 27, корп. 10, Москва, 119234
В. А. Вавилова
Россия
Вавилова Валерия Александровна
ул. Заводская, д. 3, к. 245, Всеволожский р-н, г.п. Кузьмоловский, Ленинградская обл., 188663
Н. А. Басалова
Россия
Басалова Наталия Андреевна, канд. биол. наук
Ломоносовский пр-т, д. 27, корп. 10, Москва, 119234
В. С. Попов
Россия
Попов Владимир Сергеевич, канд. биол. наук
Ломоносовский пр-т, д. 27, корп. 10, Москва, 119234
Ж. А. Акопян
Россия
Акопян Жанна Алексеевна, канд. мед. наук
Ломоносовский пр-т, д. 27, корп. 10, Москва, 119234
А. Ю. Ефименко
Россия
Ефименко Анастасия Юрьевна, д-р мед. наук
Ломоносовский пр-т, д. 27, корп. 10, Москва, 119234
Дополнительные файлы
Рецензия
Для цитирования:
Монакова А.О., Балабаньян В.Ю., Вавилова В.А., Басалова Н.А., Попов В.С., Акопян Ж.А., Ефименко А.Ю. Изучение профиля безопасности оригинального препарата на основе секретома мезенхимных стромальных клеток при интратестикулярном введении кроликам. Безопасность и риск фармакотерапии. 2025;13(2):213-228. https://doi.org/10.30895/2312-7821-2025-457
For citation:
Monakova А.О., Balabanyan V.Yu., Vavilova V.A., Basalova N.A., Popov V.S., Akopyan Zh.A., Efimenko A.Yu. Safety Profile Evaluation of an Original Mesenchymal Stromal Cell Secretome-Based Medicinal Product after Intratesticular Injection in Rabbits. Safety and Risk of Pharmacotherapy. 2025;13(2):213-228. (In Russ.) https://doi.org/10.30895/2312-7821-2025-457