Перейти к:
Влияние потенциально гепатотоксичных препаратов на активность аланиновой трансаминазы у пациентов с COVID-19: исследование «случай–контроль»
https://doi.org/10.30895/2312-7821-2025-458
Резюме
ВВЕДЕНИЕ. Повышение активности печеночных ферментов часто встречается у пациентов с COVID-19. Разработка индивидуального подбора лекарственных препаратов с целью снижения риска гепатотоксичности требует изучения роли лекарственной терапии в развитии нарушений функции печени у пациентов с COVID-19.
ЦЕЛЬ. Выявить наличие и степень выраженности связи между повышением активности аланиновой трансаминазы (АЛТ) и применением потенциально гепатотоксичных препаратов у госпитализированных пациентов с COVID-19 для дифференцированного выбора препаратов с учетом меньшего риска гепатотоксичности в практическом здравоохранении.
МАТЕРИАЛЫ И МЕТОДЫ. Проанализированы 1296 медицинских карт пациентов, госпитализированных в инфекционный госпиталь Волгоградской области с диагнозом COVID-19 в 2020–2022 гг. Исследование «случай–контроль» выполнено с использованием метода подбора пар пациентов, идентичных по полу, возрасту, степени тяжести и исходу COVID-19. Среди пациентов с исходной активностью АЛТ <1 или 2 верхней границы нормы (ВГН) отбирали тех, у кого на протяжении всей госпитализации наблюдали повышение активности АЛТ ≥2, 3 и 5 ВГН (группы «случай») и пациентов с активностью АЛТ <2 ВГН (группы «контроль»).
РЕЗУЛЬТАТЫ. Шанс обнаружения приема 3 или более лекарственных средств высокого риска лекарственного повреждения печени (ЛС ВР ЛПП) был значимо выше во всех группах «случай» по сравнению с контролем (отношение шансов (ОШ) 2,38 (1,54–3,67), р<0,001 для ≥3 ЛС ВР ЛПП и повышения активности АЛТ >2 ВГН при исходной <1 ВГН, 195 пар; ОШ 2,59 (1,48–4,53), р<0,001 для ≥3 ЛС ВР ЛПП и повышения активности АЛТ >3 ВГН при исходной <1 ВГН, 115 пар). Прием отдельных ЛС также значимо увеличивал риск повышения активности АЛТ >2 ВГН при исходной <1 ВГН (ремдесивир ОШ 4,38 (2,98–6,42), р<0,001; олокизумаб ОШ 7,83 (3,35–18,32), р<0,001; левилимаб ОШ 3,0 (1,19–7,56), р=0,014) и риск повышения активности АЛТ >3 ВГН при исходной <2 ВГН (ремдесивир ОШ 2,0 (1,21–3,30), р=0,006; олокизумаб ОШ 3,94 (2,35–6,62), р<0,001; левилимаб ОШ 2,67 (1,24–5,74), р=0,009).
ВЫВОДЫ. Выявлена статистически значимая связь между повышением активности АЛТ и применением нескольких гепатотоксичных ЛС у госпитализированных пациентов с COVID-19. Необходимы проведение дальнейших исследований безопасности ЛС, применяемых для лечения COVID-19, и разработка мер по раннему выявлению и профилактике ЛПП.
Ключевые слова
Для цитирования:
Петров В.И., Рязанова А.Ю., Токарева Н.С. Влияние потенциально гепатотоксичных препаратов на активность аланиновой трансаминазы у пациентов с COVID-19: исследование «случай–контроль». Безопасность и риск фармакотерапии. 2025;13(2):172-183. https://doi.org/10.30895/2312-7821-2025-458
For citation:
Petrov V.I., Ryazanova A.Yu., Tokareva N.S. The Effect of Potentially Hepatotoxic Medicinal Products on Alanine Transaminase Levels in COVID-19 Patients: A Case–Control Study. Safety and Risk of Pharmacotherapy. 2025;13(2):172-183. (In Russ.) https://doi.org/10.30895/2312-7821-2025-458
ВВЕДЕНИЕ
Лекарственная гепатотоксичность является одной из ведущих причин отзыва лекарственных препаратов на пострегистрационном этапе [1]. Информация о поражении печени, вызванном лекарственными средствами (ЛС), в большинстве случаев получена из отдельных сообщений, и количественная оценка риска отсутствует [2]. Наиболее часто среди нежелательных реакций со стороны печени в отчетах о безопасности ЛС встречается повышение активности аланиновой трансаминазы (АЛТ). Изменение активности других печеночных ферментов, развитие гепатита, острой печеночной недостаточности встречаются реже1. Результаты анализа некоторых баз данных о безопасности ЛС свидетельствуют о том, что, хотя изолированное повышение активности АЛТ не является надежным признаком тяжелого повреждения печени, повышение активности трансаминаз в сочетании с симптомами гепатита или желтухи может быть предиктором повышенного риска острой печеночной недостаточности [3]. Сывороточная АЛТ является одним из наиболее часто запрашиваемых биохимических тестов в клинической практике и неотъемлемой частью диагностики и лечения пациентов как с заболеваниями печени, так и без них. Более того, повышенный уровень АЛТ позволяет прогнозировать смертность независимо от заболевания печени в общей популяции [4][5].
Истинная распространенность лекарственных поражений печени (ЛПП) остается неизвестной, и в клинической практике данный диагноз формулируется редко. Это может быть связано с нежеланием врачей документировать ятрогенные заболевания, с применением нескольких потенциально гепатотоксичных ЛС, неверной трактовкой весьма разнообразной симптоматики и сложностями с выявлением причинно-следственной связи между применением конкретного ЛС и поражением печени2. Предложенная в 1993 г. и модифицированная в 2016 г. шкала CIOMS/RUCAM3 учитывает клинические данные, имеющиеся в литературе сведения о гепатотоксичности подозреваемого ЛС, эффект при повторном назначении ЛС. Шкала RUCAM до сих пор является наиболее используемым в мире инструментом для диагностики ЛПП в эпидемиологических исследованиях, отчетах о клинических случаях и сериях случаев [6].
Ограничения применения шкалы RUCAM связаны с очевидными условиями получения высокого балла вероятной и высоковероятной связи между приемом ЛС и развитием ЛПП, а именно с наличием данных о снижении активности печеночных ферментов после отмены ЛС и повышении их активности при повторном применении, которые не всегда возможно получить в реальной клинической практике и что требует долгосрочного контакта с пациентом [7]. Кроме того, основанием для применения шкалы RUCAM является повышение активности АЛТ выше 5 верхних границ нормы (ВГН) и/или щелочной фосфатазы выше 2 ВГН, в то время как согласно клиническим рекомендациям4 легкие варианты ЛПП могут проявляться повышением активности АЛТ ≥2 ВГН.
Существенные трудности возникают при диагностике ЛПП у пациентов с хроническими заболеваниями печени, особенно с вирусными гепатитами и неалкогольной жировой болезнью печени [8][9], а в последнее время и у пациентов при COVID-19 [10]. Пандемия COVID-19 подняла вопрос о безопасности новых противовирусных и биологических средств, разработанных и внедренных в клиническую практику после ускоренной процедуры регистрации, а также ЛС, применяемых off-label (по показаниям, не указанным в инструкции по медицинскому применению лекарственного препарата). Повышение активности печеночных ферментов часто встречается у пациентов, госпитализированных с COVID-19, и может быть вызвано репликацией вируса SARS-CoV-2 в печени, гипоксемией, полиорганной недостаточностью и цитокиновым штормом при тяжелом течении COVID-19, а также может быть связано с действием ЛС [11–13].
Рассматривая ЛС в качестве предполагаемой причины повреждения печени, R. Teschke и соавт. [14] провели поиск случаев ЛПП у пациентов с COVID-19. Авторами выявлено 996 опубликованных в 2020–2021 гг. описаний случаев предполагаемого ЛПП у пациентов с COVID-19, наиболее часто вызванных противовирусными препаратами. Частота регистрации ЛПП у пациентов с COVID-19, вызванных генно-инженерными биологическими препаратами (ГИБП), такими как тоцилизумаб, ниже по сравнению с частотой случаев при применении противовирусных ЛС. Однако из 8 случаев ЛПП, вызванных тоцилизумабом, которые были описаны в начале пандемии, в 2 потребовалась трансплантация печени [15]. Не следует забывать и о возможной гепатотоксичности парацетамола и нестероидных противовоспалительных средств, а также антибактериальных ЛС, часто применяемых у пациентов с COVID-19 [16].
Цель работы — выявить наличие и степень выраженности связи между повышением активности АЛТ и применением потенциально гепатотоксичных лекарственных препаратов у госпитализированных пациентов с COVID-19 для дифференцированного выбора препаратов с учетом меньшего риска гепатотоксичности в практическом здравоохранении.
МАТЕРИАЛЫ И МЕТОДЫ
Для анализа отобраны медицинские карты пациентов, госпитализированных в инфекционный госпиталь Волгоградской области с диагнозом COVID-19 в сентябре 2020 г. (252 медицинские карты), марте, сентябре 2021 г. (432 медицинские карты), марте, сентябре и ноябре 2022 г. (612 медицинских карт), у которых имелись данные об активности АЛТ исходно и на 5-е или последующие сутки пребывания в стационаре. Определение активности АЛТ проводилось энзиматическим кинетическим методом на анализаторе биохимическом автоматическом DIRUI CS-400 (Dirui Industrial Со., Ltd). Проведение исследования было одобрено на заседании локального комитета по этике ВолгГМУ (протокол № 2021/085 от 24.12.2021).
Критерии включения: возраст старше 18 лет; информированное согласие на использование и публикацию персональной медицинской информации в научных целях, подписанное в день госпитализации; подтвержденный диагноз COVID-19; нахождение на стационарном лечении не менее 5 сут.
Критерии невключения: исходная активность АЛТ выше 2 ВГН, исходная активность АСТ выше 2 ВГН, общий билирубин при поступлении выше 1 ВГН, диагноз хронического заболевания печени (вирусный гепатит, цирроз, новообразование печени, синдром Жильбера) по данным медицинских карт.
Критерии исключения: отсутствие данных об активности АЛТ на 5 и/или последующие сутки пребывания пациента в стационаре.
Повышение активности АЛТ >1 ВГН (42 Ед/л для мужчин, 30 Ед/л для женщин [3]) при поступлении в стационар наблюдалось у 670/1296 (51,7%) пациентов с COVID-19, ≥2 ВГН — у 145/1296 (11,2%). Среди пациентов с исходной активностью АЛТ <1 ВГН проводили поиск пациентов с повышением активности АЛТ ≥2 и 3 ВГН на 5-е или последующие сутки от начала фармакотерапии и пациентов, у которых активность АЛТ не превышала 2 ВГН на протяжении всей госпитализации. Среди пациентов с исходной активностью АЛТ <2 ВГН проводили поиск пациентов с повышением активности АЛТ ≥3 и 5 ВГН на 5-е или последующие сутки от начала фармакотерапии и пациентов, у которых активность АЛТ не превышала 2 ВГН. Для каждого пациента с повышением активности АЛТ («случай») подбирали пару среди пациентов, у которых активность АЛТ не превышала 2 ВГН на протяжении всей госпитализации («контроль»), совпадающую со случаем по полу, возрасту (±2 г.), степени поражения легких (нет / 0–1 / 3–4 степени по данным компьютерной томографии (КТ) или рентгенографии (РГ) легких) и исходу (выздоровел/умер). При наличии нескольких пар «случай» и «контроль», совпадающих по всем параметрам, пары подбирались случайным образом. Для пациентов с повышением активности АЛТ ≥5 ВГН рассчитывали баллы по обновленной шкале RUCAM [7].
Для всех препаратов, назначенных пациентам в стационаре, проводили поиск информации о способности вызывать ЛПП в отечественных и зарубежных базах данных5. Среди потенциально гепатотоксичных препаратов выделяли ЛС с высоким риском развития ЛПП (ВР ЛПП), при назначении которых повышение активности трансаминаз наблюдается более чем у 0,1% пациентов, и ЛС с возможным ЛПП, при назначении которых повышение активности трансаминаз наблюдается менее чем у 0,1% пациентов. Дизайн исследования представлен на рисунке 1.

Рис. 1. Дизайн исследования. АЛТ — аланиновая трансаминаза; ВГН — верхняя граница нормы; ЛПП — лекарственное повреждение печени
Fig. 1. Study design. ALT, alanine transaminase; ULN, upper limit of the normal range; DILI, drug-induced liver injury
Методом подбора в зависимости от исходного уровня и динамики активности АЛТ было сформировано от 93 до 240 пар пациентов, идентичных по полу, возрасту и степени тяжести COVID-19 (рис. 1). Степень поражения легких и исход заболевания были обязательными критериями для подбора пары, в результате чего последующий анализ не выявил статистической разницы между сформированными группами таких параметров, как уровень С-реактивного белка, креатинина, лейкоцитов, параметров коагулограммы (табл. 1, опубликована на сайте журнала6).
Статистическую обработку результатов исследования проводили с помощью программ Excel и Epi Info7. Количественные признаки описывали в виде среднего арифметического (М) ± стандартное отклонение (σ), качественные — с помощью абсолютных значений и долей (%). Для проверки статистической значимости различий между исследуемыми группами использовали критерий Стьюдента для количественных переменных и критерий Мак-Немара для качественных, уровень значимости p<0,05. Связь между повышением активности АЛТ и приемом ЛС определяли на основании отношения шансов (ОШ) и 95% доверительного интервала. При количестве дискордантных пар («+ –» и «– +») менее 20 ОШ не указывали [17].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Среди пациентов с исходной активностью АЛТ <1 ВГН повышение активности АЛТ ≥2 ВГН на фоне проводимой фармакотерапии в подобранных парах в 164/195 (84,1%) случаях сопровождалось повышением активности АСТ ≥1 ВГН и в 26/195 (13,3%) незначительным повышением уровня общего билирубина в сыворотке крови (табл. 1). Соотношение активности АСТ/ АЛТ (коэффициент де Ритиса) варьировало от 0,2 до 2,6 и было ниже 1,0 у 175/195 (89,7%) пациентов.
Повышение активности АЛТ ≥3 ВГН у пациентов с исходной активностью АЛТ <2 ВГН в 225/240 (93,8%) случаях сопровождалось повышением активности АСТ ≥1 ВГН и в 25/240 (10,4%) незначительным повышением уровня общего билирубина. Соотношение АСТ/АЛТ варьировало от 0,1 до 2,6 и было ниже 1,0 у 224/240 (93,3%) пациентов.
Определение активности щелочной фосфатазы и гамма-глутамилтрансферазы (ГГТ) проводилось редко. Повышение активности щелочной фосфатазы >1 ВГН наблюдалось у 9/1296 пациентов (0,7%), из них у 2 пациентов >2 ВГН. В обоих случаях у пациентов ранее был поставлен диагноз хронического заболевания печени и они были исключены из анализа на 1 этапе. Повышение активности ГГТ >1 ВГН наблюдалось у 8/1296 (0,6%) в сочетании с исходным повышением активности АЛТ.
Среди ЛС, назначенных пациентам, 25 препаратов были способны вызывать повышение активности АЛТ более чем у 0,1% пациентов (ЛП ВР ЛПП) и 13 препаратов вызывали повышение активности АЛТ менее чем в 0,1% случаев (возможное ЛПП) по данным отчетов о безопасности ЛС8 (рис. 1). Всем пациентам при поступлении в стационар назначался хотя бы один препарат ВР ЛПП. Пациенты групп «случай» получали в среднем больше ЛС ВР ЛПП и ЛС высокого и возможного риска развития ЛПП (далее ЛС ЛПП), чем пациенты группы «контроль» (табл. 1, опубликована на сайте журнала9). Была выявлена статистически значимая связь между повышением активности АЛТ и шансом одновременного приема нескольких ЛС ВР ЛПП и ЛС ЛПП (табл. 2, 3).
Таблица 2. Оценка шансов повышения активности аланиновой трансаминазы при исходном значении <1 верхней границы нормы в зависимости от применения потенциально гепатотоксичных препаратов у госпитализированных пациентов с COVID-19
Table 2. Estimation of the odds ratio for an increase in alanine transaminase levels from <1 times the upper limit of the normal range at baseline with the use of potentially hepatotoxic medicinal products in hospitalised patients with COVID-19
Фактор риска Risk factor | Повышение активности АЛТ ≥2 ВГН при исходной <1 ВГН Elevated ALT levels ≥2 ULN with baseline ALT levels <1 ULN | Повышение активности АЛТ ≥3 ВГН при исходной <1 ВГН Elevated ALT levels ≥3 ULN with baseline ALT levels <1 ULN | ||||||||||||||
Количество пар, подверженных (+, «случай») и не подверженных (–, «контроль») фактору риска Number of pairs exposed (+, cases) and not exposed (–, controls) to the risk factor | ОШ OR | 95% ДИ, нижняя граница 95% CI, lower limit | 95% ДИ, верхняя граница 95% CI, upper limit | р | Количество пар, подверженных (+, «случай») и не подверженных (–, «контроль) фактору риска Number of pairs exposed (+, cases) and not exposed (–, controls) to the risk factor | ОШ OR | 95% ДИ, нижняя граница 95% CI, lower limit | 95% ДИ, верхняя граница 95% CI, upper limit | р | |||||||
+ | + | – | – | + | + | – | – | |||||||||
+ | – | + | – | + | – | + | – | |||||||||
≥3 ЛС ВР ЛПП / HR DILI inducers | 70 | 69 | 29 | 27 | 2,379 | 1,542 | 3,671 | <0,001 | 42 | 44 | 17 | 12 | 2,588 | 1,478 | 4,530 | <0,001 |
≥4 ЛС ВР ЛПП / HR DILI inducers | 16 | 49 | 24 | 106 | 2,042 | 1,253 | 3,327 | 0,003 | 10 | 33 | 16 | 56 | 2,063 | 1,140 | 3,747 | 0,015 |
≥5 ЛС ВР ЛПП / HR DILI inducers | 0 | 18 | 8 | 169 | 2,250 | 0,978 | 5,175 | 0,0499 | 0 | 13 | 5 | 97 | 2,600 | 0,927 | 7,293 | 0,059 |
≥3 ЛС ЛПП / all DILI inducers | 107 | 50 | 28 | 10 | 1,786 | 1,124 | 2,836 | 0,013 | 62 | 31 | 17 | 5 | 1,824 | 1,009 | 3,295 | 0,043 |
≥4 ЛС ЛПП / all DILI inducers | 42 | 57 | 31 | 65 | 1,839 | 1,187 | 2,848 | 0,006 | 29 | 36 | 15 | 35 | 2,400 | 1,314 | 4,383 | 0,003 |
≥5 ЛС ЛПП / all DILI inducers | 12 | 44 | 22 | 117 | 2,000 | 1,199 | 3,337 | 0,007 | 7 | 31 | 14 | 63 | 2,214 | 1,178 | 4,162 | 0,011 |
Фавипиравир/Favipiravir | 11 | 27 | 16 | 141 | 1,688 | 0,9093 | 3,132 | 0,093 | 8 | 17 | 10 | 80 | 1,700 | 0,778 | 3,713 | 0,178 |
Ремдесивир/Remdesivir | 7 | 32 | 16 | 140 | 2,000 | 1,098 | 3,645 | 0,021 | 4 | 16 | 12 | 83 | 1,333 | 0,631 | 2,818 | 0,450 |
Олокизумаб/Olokizumab | 8 | 47 | 6 | 134 | 7,833 | 3,349 | 18,322 | <0,001 | 5 | 35 | 5 | 70 | 7,000 | 2,742 | 17,867 | <0,001 |
Левилимаб/Levilimab | 2 | 18 | 6 | 169 | 3,000 | 1,191 | 7,558 | 0,014 | 0 | 8 | 6 | 101 | – | 0,406 | 4,662 | 0,593 |
Парацетамол/Paracetamol | 30 | 49 | 43 | 73 | 1,140 | 0,757 | 1,716 | 0,532 | 18 | 33 | 24 | 40 | 1,375 | 0,813 | 2,326 | 0,233 |
Омепразол/Omeprazole | 180 | 5 | 8 | 2 | – | 0,161 | 2,167 | 0,405 | 109 | 4 | 1 | 1 | – | 0,396 | 196,9 | 0,180 |
Цефтриаксон/Ceftriaxone | 18 | 45 | 44 | 88 | 1,023 | 0,675 | 1,550 | 0,916 | 15 | 25 | 30 | 45 | 0,833 | 0,490 | 1,417 | 0,500 |
Цефоперазон+сульбактам / Cefoperazone sulbactam | 1 | 12 | 24 | 158 | 0,500 | 0,250 | 0,999 | 0,046 | 1 | 8 | 10 | 96 | – | 0,2744 | 2,251 | 0,637 |
Левофлоксацин/Levofloxacin | 4 | 13 | 15 | 163 | 0,867 | 0,412 | 1,821 | 0,705 | 1 | 5 | 11 | 98 | – | 0,124 | 1,419 | 0,134 |
Аторвастатин/Atorvastatin | 16 | 44 | 36 | 99 | 1,222 | 0,787 | 1,899 | 0,371 | 7 | 29 | 20 | 59 | 1,450 | 0,820 | 2,563 | 0,199 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ОШ — отношение шансов; ДИ — доверительный интервал; ВГН — верхняя граница нормы; ЛС ВР ЛПП — лекарственные средства высокого риска лекарственного поражения печени; ЛС ЛПП — лекарственные средства высокого риска + возможного лекарственного поражения печени; "–" — не применимо. Значения ОШ и р при р<0,05 выделены полужирным шрифтом.
Note. OR, odds ratio; CI, confidence interval; ULN, upper limit of the normal range; HR DILI inducers, medicines with a high risk of drug-induced liver injury; all DILI inducers, medicines with a high and possible risk of drug-induced liver injury; –, not applicable. OR and p-values for p<0.05 are shown in bold.
Таблица 3. Оценка шансов повышения активности аланиновой трансаминазы при исходном значении <2 верхней границы нормы в зависимости от применения потенциально гепатотоксичных препаратов у госпитализированных пациентов с COVID-19
Table 3. Estimation of the odds ratio for an increase in alanine transaminase levels from <2 times the upper limit of the normal range at baseline with the use of potentially hepatotoxic medicinal products in hospitalised patients with COVID-19
Фактор риска Risk factor | Повышение активности АЛТ ≥3 ВГН при исходной <2 ВГН Elevated ALT levels ≥3 ULN with baseline ALT levels <2 ULN | Повышение активности АЛТ ≥5 ВГН при исходной <2 ВГН Elevated ALT levels ≥5 ULN with baseline ALT levels <2 ULN | ||||||||||||||
Количество пар, подверженных (+, «случай») и не подверженных (–, «контроль») фактору риска Number of pairs exposed (+, cases) and not exposed (–, controls) to the risk factor | ОШ OR | 95% ДИ, нижняя граница 95% CI, lower limit | 95% ДИ, верхняя граница 95% CI, upper limit | р | Количество пар подверженных (+, «случай») и не подверженных (–, «контроль) фактору риска Number of pairs exposed (+, cases) and not exposed (–, controls) to the risk factor | ОШ OR | 95% ДИ, нижняя граница 95% CI, lower limit | 95% ДИ, верхняя граница 95% CI, upper limit | р | |||||||
+ | + | – | – | + | + | – | – | |||||||||
+ | – | + | – | + | – | + | – | |||||||||
≥3 ЛС ВР ЛПП / HR DILI inducers | 90 | 76 | 41 | 33 | 1,854 | 1,268 | 2,710 | 0,001 | 34 | 26 | 20 | 13 | 1,300 | 0,726 | 2,329 | 0,376 |
≥4 ЛС ВР ЛПП / HR DILI inducers | 20 | 66 | 36 | 118 | 1,833 | 1,221 | 2,752 | 0,003 | 9 | 27 | 10 | 47 | 2,700 | 1,307 | 5,578 | 0,005 |
≥5 ЛС ВР ЛПП / HR DILI inducers | 1 | 28 | 13 | 198 | 2,116 | 1,116 | 4,158 | 0,019 | 1 | 12 | 5 | 75 | – | 0,787 | 8,696 | 0,146 |
≥3 ЛС ЛПП / all DILI inducers | 129 | 55 | 42 | 14 | 1,310 | 0,876 | 1,957 | 0,187 | 44 | 20 | 21 | 8 | 0,952 | 0,516 | 1,757 | 0,876 |
≥4 ЛС ЛПП / all DILI inducers | 53 | 77 | 44 | 66 | 1,750 | 1,208 | 2,535 | 0,003 | 21 | 43 | 14 | 29 | 3,071 | 1,680 | 5,614 | <0,001 |
≥5 ЛС ЛПП / all DILI inducers | 13 | 66 | 36 | 125 | 1,833 | 1,221 | 2,752 | 0,003 | 6 | 24 | 13 | 50 | 1,846 | 0,940 | 3,626 | 0,070 |
Фавипиравир/Favipiravir | 15 | 31 | 21 | 173 | 1,476 | 0,848 | 2,569 | 0,166 | 5 | 16 | 8 | 64 | 2,000 | 0,856 | 4,763 | 0,102 |
Ремдесивир/Remdesivir | 6 | 46 | 23 | 165 | 2,000 | 1,212 | 3,300 | 0,006 | 3 | 22 | 4 | 64 | 5,500 | 1,895 | 15,950 | <0,001 |
Олокизумаб/Olokizumab | 5 | 71 | 18 | 146 | 3,944 | 2,352 | 6,616 | <0,001 | 2 | 29 | 5 | 57 | 5,800 | 2,245 | 14,984 | <0,001 |
Левилимаб/Levilimab | 0 | 24 | 9 | 207 | 2,667 | 1,240 | 5,737 | 0,009 | 0 | 9 | 3 | 81 | – | 0,749 | 17,228 | 0,083 |
Парацетамол/Paracetamol | 43 | 58 | 53 | 86 | 1,094 | 0,754 | 1,588 | 0,635 | 17 | 18 | 22 | 36 | 0,818 | 0,439 | 1,525 | 0,527 |
Омепразол/Omeprazole | 228 | 7 | 4 | 1 | – | 0,445 | 8,152 | 0,366 | 88 | 3 | 1 | 1 | – | 0,241 | 157,5 | 0,317 |
Цефтриаксон/Ceftriaxone | 27 | 47 | 57 | 109 | 0,825 | 0,560 | 1,213 | 0,327 | 10 | 12 | 26 | 45 | 0,462 | 0,232 | 0,915 | 0,023 |
Цефоперазон+сульбактам /Cefoperazone sulbactam | 3 | 18 | 31 | 188 | 0,581 | 0,325 | 1,038 | 0,063 | 0 | 8 | 13 | 72 | 0,615 | 0,255 | 1,485 | 0,275 |
Левофлоксацин/ Levofloxacin | 2 | 12 | 24 | 202 | 0,500 | 0,250 | 1,000 | 0,046 | 1 | 3 | 10 | 79 | – | 0,053 | 1,165 | 0,052 |
Аторвастатин/ Atorvastatin | 24 | 54 | 39 | 123 | 1,385 | 0,917 | 2,090 | 0,120 | 10 | 21 | 15 | 47 | 1,400 | 0,722 | 2,716 | 0,317 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ОШ — отношение шансов; ДИ — доверительный интервал; ВГН — верхняя граница нормы; ЛС ВР ЛПП — лекарственные средства высокого риска лекарственного поражения печени; ЛС ЛПП — лекарственные средства высокого риска + возможного лекарственного поражения печени; "–" — не применимо. Значения ОШ и р при р<0,05 выделены полужирным шрифтом.
Note. OR, odds ratio; CI, confidence interval; ULN, upper limit of the normal range; HR DILI inducers, medicines with a high risk of drug-induced liver injury; all DILI inducers, medicines with a high and possible risk of drug-induced liver injury; –, not applicable. OR and p-values for p<0.05 are shown in bold.
Частота назначений 10 ЛС ВР ЛПП была достаточна для определения отношения шансов применения отдельного ЛС в группах «случай» и «контроль», в то время как другие ЛС ЛПП назначались редко и не могли сформировать ≥20 дискордантных пар для расчета ОШ. Так, гидроксихлорохин, например, получали 4–6 пациентов групп «случай» и 2–4 пациента в группах «контроль», тоцилизумаб был назначен 4–5 пациентам групп «случай» и 2–4 пациентам групп «контроль». Омепразол получали почти все пациенты, в связи с чем выявить связь между повышением активности АЛТ и приемом омепразола не представлялось возможным, как и в случаях ЛС, назначающихся редко. Два противовирусных препарата, фавипиравир и ремдесивир, назначались достаточно часто у пациентов изучаемых групп, при этом для ремдесивира была выявлена значимая связь между его приемом и повышением активности АЛТ. Шанс применения олокизумаба и левилимаба был значимо выше в некоторых группах «случай».
Среди пациентов с повышением активности АЛТ на 5-е и последующие сутки от начала применения потенциально гепатотоксичных ЛС максимальное количество баллов по шкале RUCAM (рекомендована для использования в качестве полуколичественной системы оценки у пациентов с подозрением на ЛПП для оценки возможного ЛПП при приеме конкретного лекарственного препарата)10 было возможно у пациентов старше 55 лет, у которых после отмены гепатотоксичного ЛС наблюдалось снижение активности АЛТ на ≥50% от пикового значения в течение 8 сут (табл. 4). Все пациенты получали не одно потенциально гепатотоксичное ЛС, в связи с чем суммарный балл понизился на 2 (табл. 4, пункт 4) и у всех пациентов альтернативная причина была высоко вероятна — минус 3 балла (табл. 4, пункт 5). В разделе шкалы RUCAM, посвященной альтернативной причине повреждения печени, отсутствует указание непосредственно на COVID-19, однако представлен большой диагностический алгоритм исключения патологий печени и отмечены такие состояния, как сепсис и гипотензия. В связи с наличием одновременного приема нескольких гепатотоксичных ЛС, наличия высокой вероятности альтернативной причины повреждения печени (COVID-19) и отсутствия повторного применения ЛС и, соответственно, дополнительных баллов в зависимости от динамики активности АЛТ после повторного применения, максимальное количество баллов, соответствующее возможной вероятности ЛПП, было выявлено у 11 пациентов. Такой размер выборки недостаточен для исследования «случай–контроль» по методу подобранных пар11. Среди пациентов с возможным по шкале RUCAM ЛПП 2 пациента получали фавипиравир, 3 пациента — ремдесивир, 4 пациента получали парацетамол, 1 — тоцилизумаб, 3 — олокизумаб, 1 — левилимаб, 3 — цефтриаксон, 2 — цефоперазон сульбактам, 1 — левофлоксацин, 3 — аторвастатин и все пациенты — омепразол. Снижение активности АЛТ наблюдалось после отмены противовирусных препаратов, парацетамола и ГИБП.
Таблица 4. Суммарная оценка и классификация причинно-следственной связи повышения активности аланиновой трансаминазы ≥5 верхних границ нормы и приема гепатотоксичных препаратов по шкале RUCAM
Table 4. Summary assessment and classification of the causal relationship between elevated alanine transaminase levels ≥5 times the upper limit of the normal range and the use of hepatotoxic medicinal products according to the RUCAM scale
Параметры для гепатоцеллюлярного повреждения Factors for hepatocellular injury | Количество баллов Score | Количество пациентов Number of patients |
1. Временной интервал между началом приема лекарственных средств и началом реакции 5–90 сут 1. Time to onset from the beginning of the medicinal product: 5–90 days | +2 | 93 |
2. Изменение уровня аланиновой трансаминазы после прекращения приема лекарственных средств 2. Changes in alanine transaminase levels after cessation of the medicinal product Снижение ≥50% за 8 сут Decrease ≥50% within 8 days Снижение ≥50% за 30 сут Decrease ≥50% within 30 days | ||
+3
+2 | 13
1 | |
3. Факторы риска: возраст ≥55 лет 3. Risk factors: age ≥55 years | +1 | 76 |
4. Сопутствующий прием гепатотоксического лекарственного средства, совпадающий или близкий по времени к началу лекарственного повреждения печени 4. Concomitant use of a medicinal product known to be hepatotoxic with compatible or suggestive time to onset | –2 | 93 |
5. Альтернативная причина высоко вероятна 5. A highly probable alternative cause | –3 | 93 |
6. Предшествующая гепатотоксичность лекарственного средства: реакция маркирована в инструкции по применению 6. Previous hepatotoxicity of the medicinal product: the adverse drug reaction is labelled in the product characteristics | +2 | 93 |
7. Реакция на непреднамеренное повторное воздействие: другие ситуации 7. Response to unintentional re-exposure: other situations | 0 | 93 |
Суммарный балл по шкале RUCAM Total RUCAM score | ||
3–5 баллов — возможно 3–5 points: causality is possible | 3 | 11 |
1–2 балла — маловероятно 1–2 points: causality is unlikely | 2 | 2 |
1 | 1 | |
≤0 баллов — исключено ≤0 points: causality is excluded | 0 | 65 |
–1 | 14 | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Максимальная активность АЛТ 1178 ЕД/л наблюдалась у пациента 45 лет, у которого оценка вероятности ЛПП при приеме парацетамола по шкале RUCAM составила 1 балл (рис. 2). При поступлении у пациента на КТ наблюдалось поражение 28% легких. Сопутствующая патология — ожирение (индекс массы тела 32,1 кг/м²). Максимальная активность АСТ составила 530 ЕД/л, уровень общего билирубина максимально — 19,3 ммоль/л, СРБ 27,8 мг/мл. Пациент не нуждался в проведении оксигенотерапии и был выписан с улучшением на амбулаторное лечение. Среди 11 пациентов, набравших 3 балла по шкале RUCAM, максимальная активность АЛТ составила 377 ЕД/л у пациента, получавшего парацетамол и омепразол.
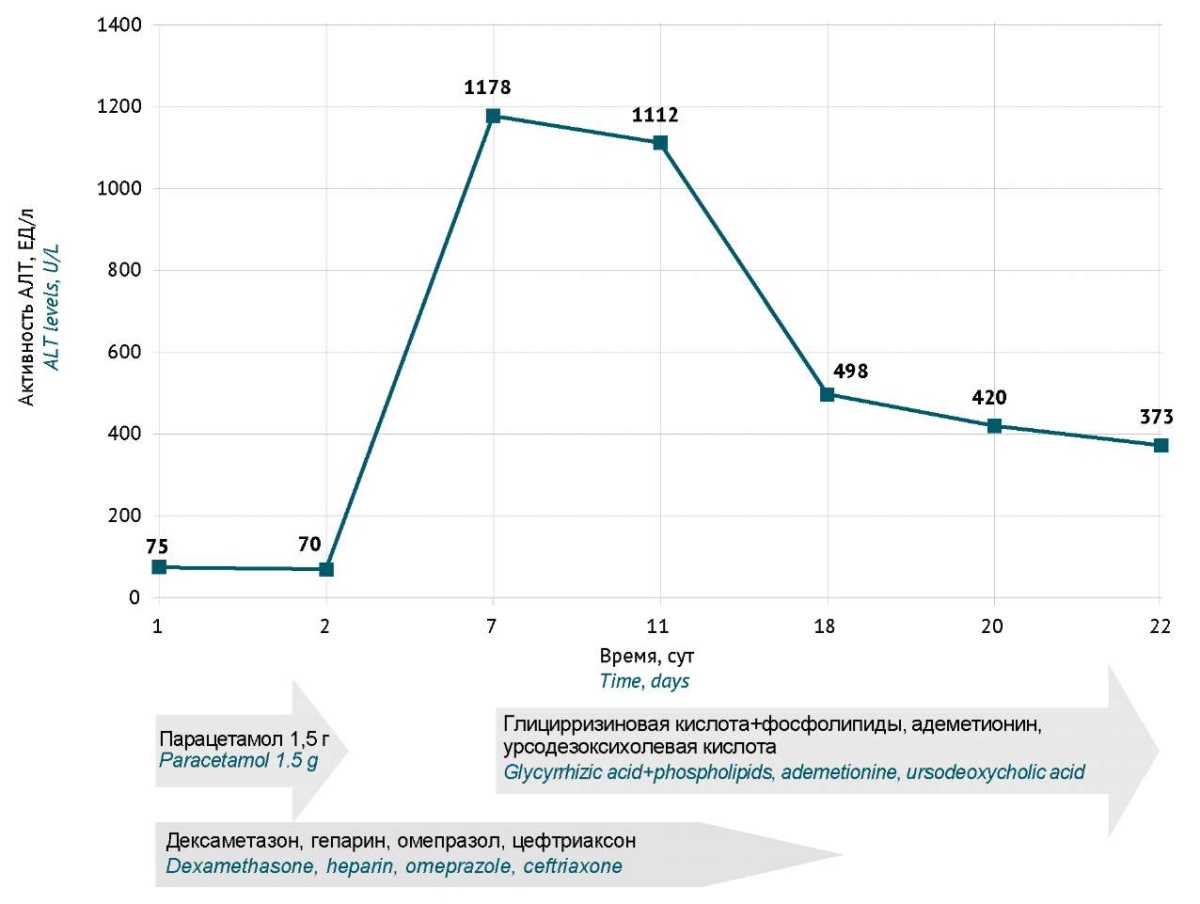
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Динамика активности аланиновой трансаминазы (АЛТ) у пациента 45 лет с COVID-19 (1 балл по шкале RUCAM для парацетамола)
Fig. 2. Time course of ALT levels in a 45-year-old COVID-19 patient (1 point on the RUCAM scale for paracetamol)
Ограничения исследования
Общим ограничением для всех анализов типа «случай—контроль» по сравнению с рандомизированными контролируемыми испытаниями является более низкая степень достоверности результатов. Хотя выбор подходящей контрольной группы кажется эффективным, полностью исключить вероятность систематической ошибки отбора нельзя. Ретроспективный характер исследования также снижает достоверность наблюдений. Сложность проведения исследования заключалась также в ограничениях, связанных с частотой проведения лабораторных тестов и длительностью наблюдения за пациентами, ограниченной сроком пребывания в стационаре. Пациенты групп «контроль» меньше находились на стационарном лечении, кратность повторения анализов зависела от состояния пациентов и исходных параметров, в то время как повышение активности АЛТ при применении гепатотоксичных средств диагностируется от 5 до 90 сут от действия ЛС. Не у всех пациентов возможно было оценить динамику АЛТ после отмены гепатотоксичного ЛС. Размер выборки, достаточный для выполнения исследований «случай–контроль», зависит от долей «случай» и «контроль», которые были подвержены действию факторов риска. Низкая частота применения некоторых гепатотоксичных ЛС, например гидроксихлорохина или тоцилизумаба, так же как и очень высокая, например омепразола, требует большего размера выборки для получения достоверных результатов для этих ЛС.
ЗАКЛЮЧЕНИЕ
Проблема безопасности фармакотерапии у пациентов с COVID-19 связана с одновременным применением нескольких ЛС с потенциальной гепатотоксичностью, таких как противовирусные и антибактериальные ЛС, нестероидные противовоспалительные средства, ГИБП. В проведенном исследовании «случай–контроль» с использованием метода подбора пар была выявлена статистически значимая связь между повышением активности АЛТ и применением нескольких гепатотоксичных ЛС у госпитализированных пациентов с COVID-19. Так, у пациентов с исходной активностью АЛТ <1 ВГН повышение активности АЛТ было ассоциировано с приемом 3 и более ЛС ВР ЛПП (ОШ=2,379, 95% ДИ 1,542–3,671, p<0,001 для АЛТ ≥2 ВГН и ОШ=2,589, 95%ДИ 1,479–4,530, p<0,001 для АЛТ ≥3 ВГН). Прием нового противовирусного препарата ремдесивира и двух ГИБП российского производства, олокизумаба и левилимаба, наиболее часто встречался у пациентов с повышением активности АЛТ >2 ВГН при исходной активности АЛТ <1 ВГН (ремдесивир ОШ 4,38 (2,98–6,42), р<0,001; олокизумаб ОШ 7,83 (3,35–18,32), р<0,001 и левилимаб 3,0 (1,19–7,56), р=0,014) и у пациентов с повышением активности АЛТ >3 ВГН при исходной <2 ВГН (ремдесивир ОШ 2,0 (1,21–3,30), р=0,006, олокизумаб ОШ 3,94 (2,35–6,62), р<0,001, левилимаб ОШ 2,67 (1,24–5,74), р=0,009). Необходимо проведение дальнейших исследований безопасности ЛС, применяемых для лечения COVID-19, и разработка мер по раннему выявлению и профилактике лекарственных поражений печени.
Дополнительная информация. Таблица 1 размещена на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2025-13-1-tabl1
Additional information. Table 1 is posted on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2025-13-1-tabl1
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: В.И. Петров — дизайн исследования, редактирование и утверждение окончательного варианта рукописи для публикации; А.Ю. Рязанова и Н.С. Токарева — сбор и обработка данных медицинских карт, написание текста рукописи.
Соответствие принципам этики. Исследование проводилось в соответствии с этическими принципами медицинских исследований с участием человека, изложенными в Хельсинкской декларации 2013 г. Проведение исследования было одобрено на заседании локального комитета по этике ВолгГМУ (протокол № 2021/085 от 24.12.2021).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Vladimir I. Petrov designed the study, edited the manuscript, and approved the final version for publication. Anastasia Yu. Ryazanova and Natalia S. Tokareva collected and processed data from medical records and drafted the manuscript.
Ethics approval. The study was conducted in accordance with the ethical principles for medical research involving human subjects described in the Declaration of Helsinki. The study was approved by the local ethics committee at the Volgograd State Medical University (Approval No. 2021/085 of 24 December 2021).
1. https://www.vigiaccess.org/
2. Лекарственные поражения печени (ЛПП) у взрослых. Клинические рекомендации. Минздрав России; 2022.
3. Council for International Organizations of Medical Sciences (CIOMS) scale, Roussel Uclaf Causality Assessment Method (RUCAM) — Шкала Совета международных организаций медицинских наук (CIOMS), метод оценки достоверности причинно-следственной связи компании Roussel Uclaf.
4. Лекарственные поражения печени (ЛПП) у взрослых. Клинические рекомендации. Минздрав России; 2022.
5. Государственный реестр лекарственных средств. https://grls.rosminzdrav.ru/
LiverTox. https://www.ncbi.nlm.nih.gov/books/NBK547852/
VigiBase. https://www.vigiaccess.org/
EudraVigilance. https://www.ema.europa.eu/en/human-regulatory/research-development/pharmacovigilance/eudravigilance
6. https://doi.org/10.30895/2312-7821-2025-13-1-tabl1
7. Статистическое программное обеспечение для эпидемиологии, разработанное Центрами по контролю и профилактике заболеваний США. https://www.cdc.gov/epiinfo/index.html
8. https://grls.rosminzdrav.ru/Default.aspx
9. https://doi.org/10.30895/2312-7821-2025-13-1-tabl1
10. Лекарственные поражения печени (ЛПП) у взрослых. Клинические рекомендации. Минздрав России; 2022.
11. https://sampsize.sourceforge.net/iface/s3.html
Список литературы
1. Onakpoya IJ, Heneghan CJ, Aronson JK. Post-marketing withdrawal of 462 medicinal products because of adverse drug reactions: A systematic review of the world literature. BMC Med. 2016;14:10. https://doi.org/10.1186/s12916-016-0553-2
2. De Abajo FJ, Montero D, Madurga M, García Rodríguez LA. Acute and clinically relevant drug-induced liver injury: A population based case-control study. Br J Clin Pharmacol. 2004;58(1):71–80. https://doi.org/10.1111/j.1365-2125.2004.02133.x
3. Valenti L, Pelusi S, Bianco C, Ceriotti F, Berzuini A, Iogna Prat L, et al. Definition of healthy ranges for alanine aminotransferase levels: A 2021 update. Hepatol Commun. 2021;5(11):1824–32. https://doi.org/10.1002/hep4.1794
4. Schmilovitz-Weiss H, Gingold-Belfer R, Boltin D, Beloosesky Y, Meyerovitch J, Tor R, et al. Risk of mortality and level of serum alanine aminotransferase among community-dwelling elderly in Israel. Eur J Gastroenterol Hepatol. 2018;30(12):1428–33. https://doi.org/10.1097/MEG.0000000000001225
5. Jensen MD, Lauritzen T, Vilstrup H, Jepsen P. Alanine aminotransferase and 20-year risk of major chronic diseases and death in a healthy cohort aged 30 to 49 years. Clin Epidemiol. 2020;12:345–51. https://doi.org/10.2147/CLEP.S241292
6. Danan G, Teschke R. Drug-induced liver injury: Why is the Roussel Uclaf Causality Assessment Method (RUCAM) still used 25 years after its launch? Drug Saf. 2018;41;735–43. https://doi.org/10.1007/s40264-018-0654-2
7. Danan G, Teschke R. RUCAM in drug and herb induced liver injury: The update. Int J Mol Sci. 2015;17(1):14. https://doi.org/10.3390/ijms17010014
8. Bessone F, Dirchwolf M, Rodil MA, Razori MV, Roma MG. Review article: Drug-induced liver injury in the context of nonalcoholic fatty liver disease — a physiopathological and clinical integrated view. Aliment Pharmacol Ther. 2018;48(9):892–913. https://doi.org/10.1111/apt.14952
9. Treem WR, Palmer M, Lonjon-Domanec I, Seekins D, Dimick-Santos L, Avigan MI, et al. Consensus guidelines: Best practices for detection, assessment and management of suspected acute drug-induced liver injury during clinical trials in adults with chronic viral hepatitis and adults with cirrhosis secondary to hepatitis B, C and nonalcoholic steatohepatitis. Drug Saf. 2021;44(2):133–65. https://doi.org/10.1007/s40264-020-01014-2
10. Жарова МЕ, Иваников ИО, Григорьева ЮВ, Никонов ЕЛ. Поражение печени у пациентов с COVID-19: клинико-патогенетические особенности и факторы риска. Доказательная гастроэнтерология. 2023;12(3):51–62. https://doi.org/10.17116/dokgastro20231203151
11. Петров ВИ, Пономарева АВ, Ивахненко ИВ, Разваляева ОВ, Мешрки БА, Стаценко ВИ. Этиопатогенетические аспекты повреждения печени у пациентов с COVID-19. Вестник Волгоградского государственного медицинского университета. 2020;17(4):9–15. https://doi.org/10.19163/1994-9480-2020-4(76)-9-15
12. Papagiouvanni I, Kotoulas SC, Pataka A, Spyratos DG, Porpodis K, Boutou AK, et al. COVID-19 and liver injury: an ongoing challenge. World J Gastroenterol. 2023;29(2):257–71. https://doi.org/10.3748/wjg.v29.i2.257
13. Li P, Liu Y, Cheng Z, Yu X, Li Y. COVID-19-associated liver injury: Clinical characteristics, pathophysiological mechanisms and treatment management. Biomed Pharmacother. 2022;154:113568. https://doi.org/10.1016/j.biopha.2022.113568
14. Teschke R, Méndez-Sánchez N, Eickhoff A. Liver injury in COVID-19 patients with drugs as causatives: A systematic review of 996 DILI cases published 2020/2021 based on RUCAM as causality assessment method. Int J Mol Sci. 2022;23(9):4828. https://doi.org/10.3390/ijms23094828
15. Muhović D, Bojović J, Bulatović A, Vukčević B, Ratković M, Lazović R, et al. First case of drug-induced liver injury associated with the use of tocilizumab in a patient with COVID-19. Liver Int. 2020;40(8):1901–5. https://doi.org/10.1111/liv.14516
16. Петров ВИ, Рязанова АЮ, Привальцева НС, Некрасов ДА. Полипрагмазия при лечении стационарных больных с новой коронавирусной инфекцией COVID-19. Фармация и фармакология. 2022;10(3):267–77. https://doi.org/10.19163/2307-9266-2022-10-3-267-277
17. Гржибовский АМ, Иванов СВ, Горбатова МА. Исследования типа «случай-контроль» в здравоохранении. Наука и здравоохранение. 2015;(4):5–17. EDN: VCFVUZ
Об авторах
В. И. ПетровРоссия
Петров Владимир Иванович, академик РАН, д-р мед. наук, профессор
Площадь Павших Борцов, д. 1, г. Волгоград, 400131
А. Ю. Рязанова
Россия
Рязанова Анастасия Юрьевна, канд. мед. наук
Площадь Павших Борцов, д. 1, г. Волгоград, 400131
Н. С. Токарева
Россия
Токарева Наталья Сергеевна
Площадь Павших Борцов, д. 1, г. Волгоград, 400131
Дополнительные файлы

|
1. Таблица 1. Характеристика подобранных пар пациентов с COVID-19 и исходной активностью аланиновой трансаминазы <1 и 2 верхних границ нормы | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(229KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Петров В.И., Рязанова А.Ю., Токарева Н.С. Влияние потенциально гепатотоксичных препаратов на активность аланиновой трансаминазы у пациентов с COVID-19: исследование «случай–контроль». Безопасность и риск фармакотерапии. 2025;13(2):172-183. https://doi.org/10.30895/2312-7821-2025-458
For citation:
Petrov V.I., Ryazanova A.Yu., Tokareva N.S. The Effect of Potentially Hepatotoxic Medicinal Products on Alanine Transaminase Levels in COVID-19 Patients: A Case–Control Study. Safety and Risk of Pharmacotherapy. 2025;13(2):172-183. (In Russ.) https://doi.org/10.30895/2312-7821-2025-458




































