Перейти к:
Нежелательные реакции при терапии внутривенными иммуноглобулинами: анализ данных российской национальной базы фармаконадзора
https://doi.org/10.30895/2312-7821-2024-12-4-420-431
Резюме
ВВЕДЕНИЕ. Препараты иммуноглобулина человека успешно применяются в клинической практике для лечения многих аутоиммунных и воспалительных заболеваний. Большинство современных иммуноглобулинов хорошо переносятся пациентами, однако при их использовании могут возникать осложнения, связанные с присутствием в составе препаратов различных белковых и небелковых составляющих плазмы крови человека. Для совершенствования мер по обеспечению качества, эффективности и безопасности иммунобиологических лекарственных препаратов, в том числе внутривенных иммуноглобулинов, необходим регулярный мониторинг данных об индивидуальных и групповых нежелательных реакциях, развивающихся при их применении.
ЦЕЛЬ. Систематизация и комплексная оценка информации в инструкциях по медицинскому применению и данных российской национальной базы фармаконадзора о возможных нежелательных реакциях при применении внутривенных препаратов иммуноглобулинов, держателем регистрационных удостоверений (ДРУ) которых являются российские компании.
МАТЕРИАЛЫ И МЕТОДЫ. Проанализированы инструкции по медицинскому применению всех препаратов внутривенных иммуноглобулинов, зарегистрированных в Российской Федерации. Изучена информация спонтанных сообщений, поступивших в период с 01.01.2020 по 30.08.2024 в федеральную базу данных «ФАРМАКОНАДЗОР/МОНИТОРИНГ КИ ЛС» автоматизированной информационной системы Росздравнадзора, о случаях развития нежелательных реакций при применении внутривенных иммуноглобулинов, ДРУ которых являются российские компании.
РЕЗУЛЬТАТЫ. В настоящее время в Российской Федерации зарегистрировано 20 лекарственных препаратов на основе иммуноглобулина человеческого нормального для внутривенного введения. Российские компании являются ДРУ 9 препаратов, при применении этих внутривенных иммуноглобулинов в указанный период зафиксировано 133 сообщения о случаях развития нежелательных реакций. Наиболее распространенные: гипертермия — 41 (16,5%) случай, головная боль — 14 (5,6%), крапивница — 14 (5,6%), неэффективность — 14 (5,6%). В большинстве случаев (70%) внутривенные иммуноглобулины применяли по показаниям, утвержденным в инструкции по медицинскому применению.
ВЫВОДЫ. Все выявленные при анализе российской национальной базы фармаконадзора нежелательные реакции являются предвиденными и представлены в инструкции по медицинскому применению препаратов внутривенных иммуноглобулинов. Для снижения риска развития нежелательных реакций и повышения безопасности терапии внутривенными иммуноглобулинами необходимо развитие комплексного подхода, включающего меры по обеспечению качества препаратов иммуноглобулина человека и стандартизацию процедур их применения.
Ключевые слова
Для цитирования:
Нечаев А.В., Лешина С.А., Клепикова А.Г., Гайдерова Л.А., Корнилова О.Г., Вельц Н.Ю., Горелов К.В., Поливанов В.А. Нежелательные реакции при терапии внутривенными иммуноглобулинами: анализ данных российской национальной базы фармаконадзора. Безопасность и риск фармакотерапии. 2024;12(4):420-431. https://doi.org/10.30895/2312-7821-2024-12-4-420-431
For citation:
Nechaev A.V., Leshina S.A., Klepikova A.G., Gaiderova L.A., Kornilova O.G., Velts N.Yu., Gorelov K.V., Polivanov V.A. Adverse Reactions to Intravenous Immunoglobulin Therapy: An Analysis of the Russian National Pharmacovigilance Database. Safety and Risk of Pharmacotherapy. 2024;12(4):420-431. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-4-420-431
ВВЕДЕНИЕ
Инфузионная терапия иммуноглобулинами (внутривенная иммуноглобулиновая терапия, ВВИГ) имеет историю, уходящую в 1940-е годы. Первый препарат ВВИГ был разработан в 1944 г. доктором E.J. Cohn, который использовал метод фракционирования холодным этанолом для выделения иммуноглобулинов из плазмы человека [1]. Первоначально иммуноглобулин использовался для лечения первичных иммунодефицитных заболеваний, таких как агаммаглобулинемия. Первое сообщение о применении иммуноглобулина было опубликовано O.C. Bruton (1952). Описан клинический случай болезни 8-летнего мальчика с рецидивирующим пневмококковым сепсисом и отсутствием гамма-глобулина при содержании остальных сывороточных белков. При клиническом обследовании не было обнаружено иных отклонений от нормы. При этом у пациента не наблюдалась выработка антител к пневмококку с четырьмя использованными антигенными веществами [2]. Успешное применение иммуноглобулинов дало импульс для широкого применения этого метода лечения по всему миру [3].
В настоящее время иммуноглобулин человека нормальный (ИГЧН) применяют в качестве заместительной терапии при первичных иммунодефицитах с нарушением продукции антител (агаммаглобулинемия, общий вариабельный иммунодефицит)1, вторичных иммунодефицитах в качестве иммуномодулирующего средства и для специфической профилактики определенных бактериальных и вирусных инфекций2, при аутоиммунных (идиопатическая тромбоцитопеническая пурпура, болезнь Кавасаки), воспалительных (хроническая воспалительная демиелинизирующая полинейропатия, мультифокальная моторная нейропатия), неврологических (синдром Гийена–Барре, миастения) и дерматологических (токсический эпидермальный некролиз, синдром Стивенса–Джонсона) нарушениях [4]. Лекарственные средства этой группы входят в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденный распоряжением Правительства Российской Федерации от 12.10.2019 № 2406-р.
ИГЧН — группа иммунобиологических лекарственных препаратов, основным действующим веществом которых является концентрированная иммунологически активная фракция иммуноглобулинов G, выделенная из пула плазмы не менее чем от 1000 здоровых доноров3. Объединение материала от разных доноров приводит к тому, что в готовых лекарственных формах присутствуют не только антитела к антигенам широкого спектра возбудителей бактериальных и вирусных инфекций и/или их токсинов, но и примеси физиологических или приобретенных донором субстанций белковых и небелковых составляющих плазмы крови человека, таких как фракция иммуноглобулина А, компоненты системы комплимента, гемагглютинирующие антитела (анти-А и анти-В гемагглютинины, анти-D, анти-Kell антитела), пирогенные вещества эндогенной природы, бактериальные эндотоксины [5], что повышает вероятность развития нежелательных реакций (НР) при применении ИГЧН.
Внутривенное введение препаратов ИГЧН впервые в клинической практике было осуществлено в 1962 г. [6]. Использование первых препаратов ИГЧН для внутривенного введения очень часто сопровождалось развитием серьезных НР из-за низкой степени очистки и присутствия иммуноглобулина класса А (IgA) в количествах, вызывающих анафилактические реакции [7].
В свете Поручения Президента Российской Федерации от 31.08.2014 № Пр-2070 и от 07.02.2016 № Пр-226 о создании современных производственных мощностей по выпуску российских препаратов крови для гарантии национальной безопасности были усилены меры по обеспечению качества, эффективности и безопасности ИГЧН. В настоящее время для получения иммуноглобулинов в промышленных масштабах применяется усовершенствованный метод Кона, используется разделение белков плазмы с помощью различных веществ (полиэтиленгликоль, каприлат натрия или каприловая кислота), а также различных видов хроматографии и нанофильтрации. Для обеспечения вирусной безопасности вводят дополнительные стадии инактивации вирусов (пастеризация, инкубация при низком значении рН, обработка сольвент-детергентом, β-пропиолактоном) [8].
Большинство современных ВВИГ хорошо переносятся пациентами, но в некоторых случаях могут вызывать развитие НР [9–13]:
- легкие реакции: головная боль, усталость, тошнота, рвота, лихорадка, озноб;
- умеренные реакции: гипертония, тахикардия, приливы, крапивница;
- тяжелые реакции: анафилаксия, асептический менингит, тромбоз, гемолиз.
Риск возникновения побочных эффектов может увеличиваться под влиянием нескольких факторов, в том числе:
- концентрация и состав иммуноглобулинов в препарате ВВИГ;
- высокая скорость инфузии;
- факторы, связанные с пациентом: сопутствующие заболевания (сердечно-сосудистые заболевания, почечная недостаточность и др.), ожирение, возраст старше 65 лет;
- факторы, связанные с препаратом: процессы производства, транспортировки, хранения и обращения с препаратами ВВИГ.
Частота развития НР при применении ВВИГ по данным литературы варьирует от 1 до 81% (в среднем 20%), большинство НР являются легкими и преходящими4 [14–16].
Анализ и систематизация данных об осложнениях, возникающих на фоне терапии иммунобиологическими лекарственными препаратами, будут способствовать накоплению данных об их индивидуальных и групповых нежелательных эффектах и выработке мер по их предотвращению.
Цель работы — систематизация и комплексная оценка информации в инструкциях по медицинскому применению и данных российской национальной базы фармаконадзора о возможных нежелательных реакциях при применении внутривенных препаратов иммуноглобулинов, держателем регистрационных удостоверений которых являются российские компании.
МАТЕРИАЛЫ И МЕТОДЫ
В рамках исследования проанализирована информация, содержащаяся в инструкциях по медицинскому применению всех ВВИГ, включенных в Государственный реестр лекарственных препаратов5, о возможных НР при их использовании.
Также проведен ретроспективный анализ спонтанных сообщений, поступивших в период с 01.01.2020 по 30.08.2024 в российскую национальную базу данных «ФАРМАКОНАДЗОР/МОНИТОРИНГ КИ ЛС» Автоматизированной информационной системы (АИС) Росздравнадзора, в которых содержалась информация о развитии НР при введении ВВИГ, произведенных в России и за рубежом. В анализ включали сообщения о случаях развития НР после применения ВВИГ, держателем регистрационных удостоверений которых являются российские компании, с подтвержденной экспертами федерального государственного бюджетного учреждения «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора причинно-следственной связью «НР — лекарственный препарат». Оценка степени достоверности причинно-следственной связи «НР — лекарственный препарат» в задачи данного исследования не входила.
Информацию спонтанных сообщений анализировали по следующим критериям: производитель лекарственного препарата; субъект, из которого поступило сообщение; показания к применению; серьезность, клинические проявления и исход НР.
Статистическую обработку данных проводили с использованием программного обеспечения Microsoft Excel 2019. Описательная статистика была выполнена для всех анализируемых показателей; качественные переменные описаны абсолютными (n) и относительными (%) величинами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящее время в Российской Федерации на основе ИГЧН (МНН: иммуноглобулин человека нормальный) зарегистрировано 20 лекарственных препаратов для внутривенного введения, из них 9 российского и 11 зарубежного производства. Зарегистрированные ВВИГ представлены в трех лекарственных формах: лиофилизат для приготовления раствора для инфузий, раствор для инфузий и раствор для внутривенного введения.
В разделе «Побочное действие» инструкций по медицинскому применению препаратов ИГЧН для внутривенного введения, разрешенных к применению в Российской Федерации, информация о НР классифицирована в соответствии с поражением органов и систем органов в терминах медицинского словаря для регуляторной деятельности (Medical Dictionary for Regulatory Activities, MedDRA). Частота развития представлена в соответствии с рекомендациями Всемирной организации здравоохранения: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 до <1/100), редко (≥1/10000 до <1/1000), очень редко (<1/10000, включая отдельные случаи) (табл. 1).
Анализ инструкций по медицинскому применению ВВИГ показал, что наиболее часто при применении всех препаратов этой группы могут возникать нарушения со стороны иммунной системы (гиперчувствительность), нервной системы (головная боль — очень часто, головокружение — часто), со стороны сосудов (артериальная гипертензия, покраснение, приливы), желудочные-кишечные нарушения (тошнота, рвота, диарея, боль в эпигастрии), нарушения со стороны кожи и подкожных тканей (крапивница, высыпания, зуд, покраснение, шелушение кожи), общие нарушения и реакции в месте введения (боль, лихорадка, гриппоподобное заболевание, чувство стеснения в горле), отклонения данных лабораторных и инструментальных исследований (снижение гемоглобина, положительная прямая проба Кумбса, увеличение активности печеночных ферментов, увеличение активности лактатдегидрогеназы). К нечастым нарушениям относятся сонливость, тремор, ощущение сердцебиения, тахикардия, тромбоэмболические осложнения, васкулиты (в том числе асептический васкулит), анафилактический шок, анизоцитоз, протеинурия, повышение уровня креатинина крови.
В базу данных «ФАРМАКОНАДЗОР/МОНИТОРИНГ КИ ЛС» АИС Росздравнадзора с 01.01.2020 по 30.08.2024 поступило 863 сообщения о случаях развития серьезных НР на фоне введения ВВИГ (в том числе и о неэффективности лекарственного препарата), из них в 317 (36,4%) сообщениях указано, что НР зафиксированы на территории Российской Федерации. В 133 (15,4%) случаях НР возникли после применения ВВИГ, держателем регистрационных удостоверений которых являются российские компании.
Дальнейшему анализу были подвергнуты сообщения, касающиеся лекарственного препарата, держателем регистрационных удостоверений которых являются российские компании: в 133 сообщениях было выявлено 249 клинических проявлений, которые были отнесены в последующем к 74 НР. Наиболее часто были зарегистрированы такие НР, как: гипертермия — 41 (16,5%) случай, головная боль — 14 (5,6%), крапивница — 14 (5,6%), неэффективность — 14 (5,6%), рвота — 11 (4,4%). Все выявленные в базе данных «ФАРМАКОНАДЗОР/МОНИТОРИНГ КИ ЛС» АИС Росздравнадзора НР являются предвиденными и представлены в инструкции по медицинскому применению препаратов данной группы.
Все проанализированные НР отнесены к категории «клиническое значимое событие, определяющее течение и исход заболевания», при этом у большинства пациентов — 68 (51%) случаев — в динамике было отмечено улучшение состояния (рис. 1).
Таблица 1. Классификация нежелательных реакций при применении препаратов внутривенных иммуноглобулинов, зарегистрированных в Российской Федерации (по данным Государственного реестра лекарственных средств)
Table 1. Classification of adverse drug reactions associated with intravenous immunoglobulins authorised for use in the Russian Federation (according to the Russian State Register of Medicines)
Системно-органный класс по MedDRA MedDRA System Organ Class | Нежелательная реакция Adverse drug reaction | |
Клинические проявления Clinical manifestations | Частота Frequency | |
Инфекционные и паразитарные заболевания Infections and infestations | Инфекции верхних дыхательных путей (отит, назофарингит) Upper respiratory tract infections (otitis media, nasopharyngitis) | Нечасто Uncommon |
Нарушения со стороны крови и лимфатической системы Blood and lymphatic system disorders | Лейкопения, обратимая гемолитическая анемия, гемолиз, анизоцитоз (включая микроцитоз) Leucopenia, reversible haemolytic anaemia, haemolysis, anisocytosis (including microcytosis) | Очень редко Very rare |
Нарушения со стороны иммунной системы Immune system disorders | Анафилактический шок Anaphylactic shock | Редко Rare |
Нарушения со стороны нервной системы Nervous system disorders | Головная боль, мигрень Headache, migraine | Очень часто Very common |
Головокружение, сонливость, тремор, синусовая головная боль Dizziness, drowsiness, tremor, sinus headache | Нечасто Uncommon | |
Асептический менингит, парестезия Aseptic meningitis, paresthesia | Очень редко Very rare | |
Нарушения со стороны сердца Cardiac disorders | Учащенное сердцебиение, тахикардия Palpitations, tachycardia | Нечасто Uncommon |
Инфаркт миокарда Myocardial infarction | Очень редко Very rare | |
Нарушения со стороны сосудов Vascular disorders | Артериальная гипертензия, покраснение Arterial hypertension, redness | Часто Common |
Артериальная гипотензия, приливы, периферические сосудистые нарушения Arterial hypotension, hot flashes, peripheral vascular disorders | Нечасто Uncommon | |
Коллапс Collapse | Редко Rare | |
Тромбоэмболические осложнения (инсульт, эмболия легочной артерии, тромбоз глубоких вен, синдром острого посттрансфузионного повреждения легких) Thromboembolic events (stroke, pulmonary embolism, deep vein thrombosis, transfusion-related acute lung injury | Очень редко Very rare | |
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения Respiratory, thoracic, and mediastinal disorders | Затруднение дыхания, боль при дыхании, чувство стеснения в горле, боль в груди Difficulty breathing, painful respiration, throat tightness, chest pain | Нечасто Uncommon |
Нарушения со стороны желудочно-кишечного тракта Gastrointestinal disorders | Рвота, тошнота Vomiting, nausea | Часто Common |
Диарея, боль в эпигастрии Diarrhoea, epigastric pain | Нечасто Uncommon | |
Нарушения со стороны печени и желчевыводящих путей Hepatic and hepatobiliary disorders | Гипербилирубинемия Hyperbilirubinemia | Нечасто Uncommon |
Нарушения со стороны кожи и подкожных тканей Skin and subcutaneous tissue disorders | Крапивница, высыпания Urticaria, eruptions | Часто Common |
Поражения кожи (включая высыпания, крапивницу, сыпь, зуд, покраснение, шелушение кожи) Skin lesions (including eruptions, urticaria, rash, itching, redness, peeling of the skin) | Нечасто Uncommon | |
Нарушения со стороны скелетно-мышечной и соединительной ткани Musculoskeletal and connective tissue disorders | Боль в спине Back pain | Часто Common |
Артралгия, миалгия (включая спазмы в мышцах, ригидность мышц, мышечная слабость) Arthralgia, myalgia (including muscle spasms, muscle stiffness, muscle weakness) | Нечасто Uncommon | |
Нарушения со стороны почек и мочевыводящих путей Renal and urinary disorders | Протеинурия, повышение уровня креатинина в крови Proteinuria, increased blood creatinine | Редко Rare |
Острая почечная недостаточность Acute renal failure | Очень редко Very rare | |
Общие расстройства и нарушения в месте введения General disorders and administration site conditions | Озноб, лихорадка, усталость, реакции в месте инъекции Chills, fever, fatigue, injection site reactions | Часто Common |
Боль в груди, общее недомогание, приливы крови к лицу, гипертермия, пузырьковые высыпания на слизистой оболочке рта и глотки, чувство стеснения в горле Chest pain, general malaise, facial hot flushes, hyperthermia, oropharyngeal blistering, throat tightness | Редко Rare | |
Лабораторные и инструментальные данные Investigations (laboratory or test results) | Снижение гемоглобина, увеличение концентрации связанного и несвязанного билирубина в крови, положительная прямая проба Кумбса, положительная непрямая проба Кумбса, увеличение активности лактатдегидрогеназы в крови, снижение гематокрита, увеличение активности аланиновой трансаминазы, увеличение активности аспарагиновой трансаминазы, увеличение концентрации креатинина крови Decreased haemoglobin, increased conjugated and unconjugated blood bilirubin, positive direct Coombs test, positive indirect Coombs test, increased blood lactate dehydrogenase, decreased haematocrit, increased alanine aminotransferase, increased aspartate aminotransferase, increased blood creatinine | Нечасто Uncommon |
Примечание. MedDRA — медицинский словарь для регуляторной деятельности.
Note. MedDRA, Medical Dictionary for Regulatory Activities.
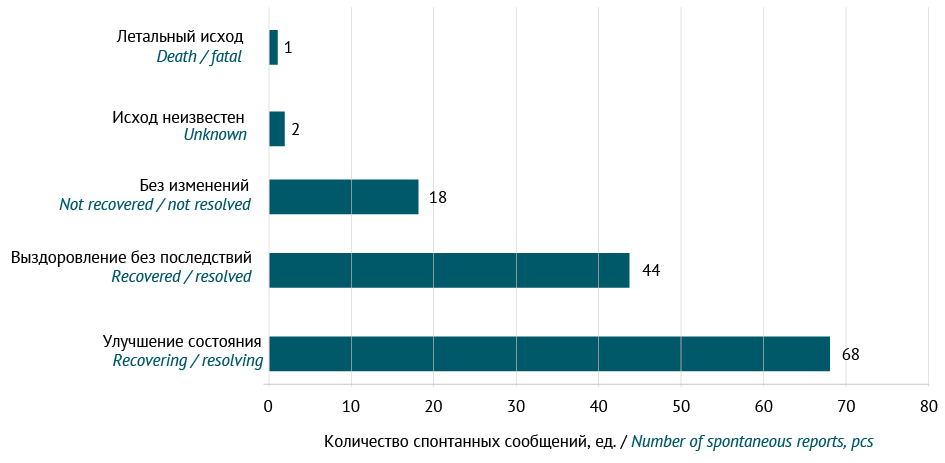
Рис. 1. Исход заболевания после развития нежелательной реакции на фоне применения внутривенных иммуноглобулинов (по данным спонтанных сообщений, поступивших в российскую национальную базу фармаконадзора в период 01.01.2020 по 30.08.2024)
Fig. 1. Disease outcomes following adverse drug reactions associated with intravenous immunoglobulins (according to spontaneous reports submitted to the Russian national pharmacovigilance database from 01.01.2020 to 30.08.2024)
Выявлено, что в 40 (30%) случаях ВВИГ применялись не по показаниям, утвержденным в инструкции по медицинскому применению (off-label), либо сообщения не содержали информацию о диагнозе пациента и показаниях для назначения инфузионной терапии ИГЧН. Эти данные также совпадают с данными литературы: ИГЧН применяют off-label примерно в 33% случаев при более чем 50 заболеваниях6 [10].
Применение ВВИГ off-label, особенно при неврологических заболеваниях, является в настоящее время серьезной проблемой. Показания к применению зарегистрированных в Российской Федерации ВВИГ в неврологии ограничены синдромом Гийена–Барре, хронической воспалительной демиелинизирующей полинейропатией и мультифокальной моторной невропатией7. Несмотря на то что при некоторых редких неврологических расстройствах использование ВВИГ является оптимальным с позиций безопасности и эффективности [17, 18] и эти препараты включены в стандарты оказания медицинской помощи при хронической воспалительной демиелинизирующей полинейропатии8, миастении гравис9, остром диссеминированном энцефаломиелите10, существует принципиальная проблема в виде отсутствия указания о возможности их назначения в инструкциях по медицинскому применению этих препаратов. В международной практике препараты ИГЧН широко применяют для терапии миастенического криза, идиопатических воспалительных миопатий, синдрома ригидного человека, демиелинизирующей полинейропатии, ассоциированной с моноклональной гаммапатией неясного значения, некоторых форм эпилепсии, активного рассеянного склероза у женщин в период беременности [19–27]. Таким образом, целесообразным является проведение дополнительных исследований с целью оценки эффективности и безопасности применения ВВИГ при ряде нозологий.
Контроль качества ВВИГ является одним из наиболее действенных способов минимизации рисков возникновения НР [28]. В последнее десятилетие были проведены исследования по обеспечению качества отечественных препаратов крови, на основании которых были разработаны и включены в Государственную фармакопею Российской Федерации требования к качеству препаратов группы иммуноглобулинов человека11. Для оценки состава и содержания биологических примесей в нормативную документацию ВВИГ введены показатели специфической безопасности, количественно и качественно регламентирующие содержание в готовой лекарственной форме анти-А, анти-В гемагглютининов, анти-D антител, уровня содержания IgA, активности комплемента, унифицированы методики их оценки. Разработаны и внедрены в практическую деятельность стандартные образцы для оценки специфической безопасности препаратов иммуноглобулинов человека, гармонизированы с международными требованиями национальные стандарты качества по методам контроля12 [29].
Для снижения риска развития НР при применении ВВИГ следует использовать препараты в соответствии с инструкциями по медицинскому применению и действующими клиническими рекомендациями по лечению различных нозологий: соблюдать рекомендованную дозу, объем, скорость проведения инфузии, временные рамки введения, а также учитывать возможные межлекарственные взаимодействия [30]. Необходимо также соблюдать стандартные процедуры проведения инфузионной терапии ВВИГ, включающие сбор анамнеза для выбора препарата, установление начальной дозы и скорости введения, при необходимости — выбор метода премедикации (глюкокортикоиды, антигистаминные препараты) [31]. Для всех пациентов, получающих внутривенно иммуноглобулины, необходимо проводить адекватную гидратацию перед началом инфузии, осуществлять контроль диуреза, контроль креатинина в плазме, исключить применение «петлевых» диуретиков. Во время введения ВВИГ следует тщательно контролировать состояние пациента, и наблюдение должно продолжаться в течение 1 ч после введения. Помещения, где вводят ВВИГ, должны быть обеспечены средствами противошоковой терапии13.
ЗАКЛЮЧЕНИЕ
В Российской Федерации в настоящее время зарегистрировано 20 препаратов ИГЧН для внутривенного введения. Результаты анализа информации спонтанных сообщений показали, что при применении ВВИГ, держателями регистрационных удостоверений которых являются российские компании, наиболее распространены такие НР, как гипертермия — 41 (16,5%) случай, головная боль — 14 (5,6%), крапивница — 14 (5,6%), неэффективность — 14 (5,6%). В большинстве случаев ВВИГ применялись по показаниям, утвержденным в инструкции по медицинскому применению. В международной медицинской практике область применения этих препаратов значительно шире, они включены в клинические рекомендации по оказанию медицинской помощи при ряде заболеваний, но в инструкциях по медицинскому применению препаратов необходимые указания отсутствуют. Полученные данные подтверждают целесообразность проведения дополнительных исследований для оценки эффективности и безопасности препаратов ИГЧН для внутривенного введения.
Профиль безопасности ВВИГ продолжает дополняться информацией, полученной в пострегистрационных исследованиях. Снижение риска возникновения НР может быть достигнуто реализацией комплексного подхода, объединяющего меры, направленные на обеспечение качества ИГЧН (такие как разработка высокотехнологичных препаратов и методов оценки их качества), и меры, обеспечивающие надлежащее применение ВВИГ (в частности, внедрение стандартных процедур проведения инфузионной терапии).
1 Первичные иммунодефициты с преимущественной недостаточностью синтеза антител. Клинические рекомендации. Минздрав России; 2022.
2 ВИЧ-инфекция у взрослых. Клинические рекомендации. Минздрав России; 2020.
3 ОФС.1.8.2.003.15 Иммуноглобулины человека. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
4 https://grls.minzdrav.gov.ru/
5 Там же.
6 Guideline on the clinical investigation of human normal immunoglobulin for intravenous administration (IVIg). EMA/CHMP/BPWP/94033/2007 rev. 4. EMA; 2021.
7 https://grls.rosminzdrav.ru
8 Приказ Минздрава России от 18.10.2022 № 679н «Об утверждении стандарта медицинской помощи детям при других воспалительных полинейропатиях (хронической воспалительной демиелинизирующей полинейропатии) диагностика, лечение и диспансерное наблюдение)».
9 Приказ Минздрава России от 05.07.2016 № 465н «Об утверждении стандарта скорой медицинской помощи при тяжелой миастении».
10 Приказ Минздрава России от 24.12.2012 № 1532н «Об утверждении стандарта первичной медико-санитарной помощи при остром рассеянном энцефаломиелите (диагностика)».
11 ОФС.1.8.2.003.15 Иммуноглобулины человека. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
ФС.3.3.2.008.15 Иммуноглобулин человека нормальный для внутривенного введения. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
12 ОФС.1.8.2.0007.15 Определение антикомплементарной активности лекарственных препаратов иммуноглобулинов человека для внутривенного введения. Государственная фармакопея Российской Федерации. XIII изд. М.; 2016.
ОФС.1.8.2.0004.15 Испытание на анти-D антитела в лекарственных препаратах иммуноглобулинов человека. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
ОФС.1.8.2.0005.15 Определение анти-А и анти-В гемагглютининов в лекарственных препаратах из плазмы крови человека. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
13 https://grls.rosminzdrav.ru
Список литературы
1. Cohn EJ, Oncley JL, Strong LE, Hughes WL, Armstrong SH. Chemical, clinical, and immunological studies on the products of human plasma fractionation. I. The characterization of the protein fractions of human plasma. J Clin Invest. 1944;23(4):417–32. https://doi.org/10.1172/JCI101508
2. Bruton OC. Agammaglobulineemia. Pediatrics. 1952;9(6):722–8. PMID: 14929630
3. Sanford JP, Favour CB, Tribeman MS. Absence of serum gamma globulins in an adult. N Engl J Med. 1954;250(24):1027–9. https://doi.org/10.1056/NEJM195406172502403
4. Румянцев АГ, Щербина АЮ, ред. Иммуноглобулины для внутривенного введения: практические аспекты применения. М.: Практическая медицина; 2018. EDN: GRLACL
5. Stiehm ER. Adverse effects of human immunoglobulin therapy. Transfus Med Rev. 2013;27(3):171–8. https://doi.org/10.1016/j.tmrv.2013.05.004
6. Barandum S, Kisthler F, Jeunet F, Isliker H. Intravenous administration of human gammaglobulin. Vox Sang. 1962;7(2):157–74. https://doi.org/10.1111/j.1423-0410.1962.tb03240.x
7. Олефир ЮВ, Меркулов ВА, Мосягин ВД, Вдовиченко МВ, Иванов ВБ, Кудашева ЭЮ и др. Препараты иммуноглобулина человека нормального: эволюция взглядов на показания к применению. Фарматека. 2015;20(313):32–7. EDN: VMICFB
8. Кудашева ЭЮ, Борисевич ИВ, Иванов ВБ, Климов ВИ, Корнилова ОГ, Лебединская ЕВ, Бунятян НД. Современные технологические подходы к обеспечению вирусной безопасности препаратов иммуноглобулинов человека. Успехи современного естествознания. 2015;(5):132–8. EDN: UCMJID
9. Латышева ТВ, Латышева ЕА, Мартынова ИА. Место иммуноглобулинов для внутривенного введения в современной клинической практике: Привиджен — новый 10% иммуноглобулин. Терапевтический архив. 2016;88(4):82–7. https://doi.org/10.17116/terarkh201688482-87
10. Латышева ЕА, Латышева ТВ. Применение внутривенных иммуноглобулинов в интенсивной терапии. Общая реаниматология. 2012;8(3):45. https://doi.org/10.15360/1813-9779-2012-3-45
11. Иванов В, Мосягин В, Вдовиченко М, Кудашева Э, Бондарев В, Борисевич И. Иммуноглобулин человека нормальный: эффективность и безопасность применения. Врач. 2015;(11):17–20. EDN: UYMPJT
12. Терещенко НМ, Кушнир ЯБ, Абрамова МП, Готовчиков АА, Краснов ВС, Соколов АЮ и др. Опыт применения препаратов иммуноглобулина человека для внутривенного введения в лечении редких неврологических заболеваний. Бюллетень сибирской медицины. 2023;22(1):174–82. https://doi.org/10.20538/1682-0363-2023-1-174-182
13. Вахлярская СС, Костылева МН, Боткина АС, Ильина ЕС, Донюш ЕК, Кондратенко ИВ. Практические аспекты применения иммуноглобулинов для внутривенного введения при различной патологии. Педиатрия. Журнал им. Г.Н. Сперанского. 2021;100(2):174–81. EDN: IFYDHG
14. Яковлев ЯЯ, Рудковская ЛВ, Лавринова ОВ, Матвеева НВ, Андриянова О.В. Тяжелый гиперэозинофильный синдром с поражением кожи у детей в практике педиатра. Мать и дитя в Кузбассе. 2022;(3):69–77. https://doi.org/10.24412/2686-7338-2022-3-69-77
15. Васильева МА. Безопасность клинического применения поливалентных внутривенных иммуноглобулинов в педиатрии. Иммунопатология, аллергология, инфектология. 2023;(2):61–4. https://doi.org/10.14427/jipai.2023.2.61
16. Nain E, Kıykım A, Kasap NA, Barış S, Özen A, Aydıner EK. Immediate adverse reactions to intravenous immunoglobulin in primary immune deficiencies: a single center experience. Turk J Pediatr. 2020;62(3):379–86. https://doi/10.24953/turkjped.2020.03.004
17. Lünemann JD, Quast I, Dalakas MC. Efficacy of intravenous immunoglobulin in neurological diseases. Neurotherapeutics. 2016;13(1):34–46. https://doi.org/10.1007/s13311-015-0391-5
18. Никитин CС, Борискина ЛМ. Иммуноглобулины в неврологической практике: обзор литературы. Нервно-мышечные болезни. 2019;9(1):32–51. https://doi.org/10.17650/2222-8721-2019-9-1-32-51
19. Kubota J, Hamano SI, Daida A, Hiwatari E, Ikemoto S, Hirata Y, et al. Predictive factors of first dosage intravenous immunoglobulin-related adverse effects in children. PLos One. 2020;15(1):e0227796. https://doi.org/10.1371/journal.pone.0227796
20. Wood JG, Heywood AE, Dennington PM, Lloyd AR, Ziegler JB. Trends in intravenous immunoglobulin use in New South Wales, Australia. Intern Med J. 2024;54(1):149–56. https://doi.org/10.1111/imj.16175
21. Сергутина СЮ, Сивкович СА, Старовойт ВВ, Калюта АА. Применение иммуноглобулинов для внутривенного введения при лечении заболеваний системы крови: обзор литературы и собственные исследования. Часть 1. Гематология. Трансфузиология. Восточная Европа. 2021;7(2):229–41. https://doi.org/10.34883/PI.2021.7.2.011
22. Hadaschik E, Eming R, French LE, Girolomoni G, Herti M, Jolles S, et al. European Guidelines (S1) on the use of high-dose intravenous immunoglobulin in dermatology. Hautarzt. 2020;71(7):542–52. https://doi.org/10.1007/s00105-020-04610-6
23. Егорова ОН, Тарасова ГМ, Дацина АВ, Сажина ЕГ. Особенности применения внутривенных иммуноглобулинов при ревматических заболеваниях. Современная ревматология. 2024;18(3):78–84. https://doi.org/10.14412/1996-7012-2024-3-78-84
24. Сигунова ДА, Морозова АС. Иммуномодулирующая терапия внутривенными иммуноглобулинами при иммунной тромбоцитопении у детей: оценка эффективности и спектра нежелательных явлений. Forcipe. 2020;(3):163–4. EDN: EAGTRU
25. Nergaard-Pedersen K, Nielsen K, Shteffensen R, Eriksen L, Iorgensen MM, Kesmodel US, Christiansen OB. Intravenous immunoglobulin and prednisolone to women with unexplained recurrent pregnancy loss after assisted reproductive technology treatment: a protocol for a randomised, double-blind, placebo-controlled trial. BMJ Open. 2022;12:e064780. https://doi.org/10.1136/bmjopen-2022-064780
26. Сергутина СЮ, Сивкович СА, Старовойт ВВ, Калюта АА. Применение иммуноглобулинов для внутривенного введения при лечении заболеваний системы крови: обзор литературы и собственные исследования. Часть 2. Гематология. Трансфузиология. Восточная Европа. 2021;7(3):346–62. https://doi.org/10.34883/PI.2021.7.3.008
27. Ахмедова МО, Юсупбаев РБ, Пулатова ГА. Применение иммуноглобулина при внутриутробных инфекциях во время беременности. Science and Innovation. 2022;(4):74–82. https://doi.org/10.5281/zenodo.6896302
28. Супотницкий МВ, Елапов АА, Борисевич ИВ, Кудашева ЭЮ, Климов ВИ, Лебединская ЕВ. Иммуноглобулины для внутривенного введения в аспекте показателей качества, эффективности и безопасности. Успехи современного естествознания. 2015;(5):84–94. EDN: UCMJFB
29. Нечаев АВ, Кудашева ЭЮ, Постнова ЕЛ, Волкова РА, Фадейкина ОВ, Борисевич ИВ, Мовсесянц АА. Особенности разработки, аттестации и применения фармакопейного стандартного образца содержания иммуноглобулинов класса А в препаратах иммуноглобулинов человека для парентерального применения. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(3–1):443–51. https://doi.org/10.30895/2221-996X-2023-23-3-1-443-451
30. Скепьян ЕН. Клинико-фармакологические особенности применения препаратов нормального иммуноглобулина человека в практике врача. Медицинский журнал. 2023;(3):62–9. https://doi.org/10.51922/1818-426X.2023.3.62
31. Kretowska-Grunwald A, Krawczuk-Rybak M, Sawicka-Zukowska M. Intravenous immunoglobulin-induced aseptic meningitis—a narrative review of the diagnostic process, pathogenesis, preventative measures and treatment. J Clin Med. 2022;11(13):35–71. https://doi.org/10.3390/jcm11133571
Об авторах
А. В. НечаевРоссия
Нечаев Алексей Викторович
Петровский б-р, д. 8, стр. 2, Москва, 127051
С. А. Лешина
Россия
Лешина Светлана Александровна
Петровский б-р, д. 8, стр. 2, Москва, 127051
А. Г. Клепикова
Россия
Клепикова Арина Геннадиевна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Л. А. Гайдерова
Россия
Гайдерова Лидия Александровна, канд. мед. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. Г. Корнилова
Россия
Корнилова Ольга Геннадьевна, д-р фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Н. Ю. Вельц
Россия
Вельц Наталья Юрьевна, канд. биол. наук, доцент
Петровский б-р, д. 8, стр. 2, Москва, 127051
К. В. Горелов
Россия
Горелов Кирилл Витальевич
Славянская пл., д. 4, стр. 1, Москва, 109074
В. А. Поливанов
Россия
Поливанов Виталий Анатольевич
Славянская пл., д. 4, стр. 1, Москва, 109012
Дополнительные файлы
Рецензия
Для цитирования:
Нечаев А.В., Лешина С.А., Клепикова А.Г., Гайдерова Л.А., Корнилова О.Г., Вельц Н.Ю., Горелов К.В., Поливанов В.А. Нежелательные реакции при терапии внутривенными иммуноглобулинами: анализ данных российской национальной базы фармаконадзора. Безопасность и риск фармакотерапии. 2024;12(4):420-431. https://doi.org/10.30895/2312-7821-2024-12-4-420-431
For citation:
Nechaev A.V., Leshina S.A., Klepikova A.G., Gaiderova L.A., Kornilova O.G., Velts N.Yu., Gorelov K.V., Polivanov V.A. Adverse Reactions to Intravenous Immunoglobulin Therapy: An Analysis of the Russian National Pharmacovigilance Database. Safety and Risk of Pharmacotherapy. 2024;12(4):420-431. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-4-420-431




































