Перейти к:
Оценка безопасности лекарственных средств в отношении сердечно-сосудистой системы в доклинических исследованиях in vivo: обзор
https://doi.org/10.30895/2312-7821-2025-475
Резюме
ВВЕДЕНИЕ. Оценка безопасности лекарственных средств в отношении сердечно-сосудистой системы с использованием моделей in vivo является необходимым этапом доклинических исследований, которая проводится либо в исследованиях фармакологической безопасности, либо в рамках токсикологических исследований. В дизайне исследований фармакологической безопасности в первую очередь подразумевается оценка потенциала исследуемого вещества замедлять реполяризацию желудочков сердца без углубленного изучения возможного структурного повреждения сердца и сосудов. При этом в токсикологических исследованиях, как правило, не оцениваются электрофизиологические параметры. В нормативной документации Евразийского экономического союза и Международного совета по гармонизации (ICH) отсутствуют подробные указания по использованию специфических маркеров нарушений функционирования сердечно-сосудистой системы.
ЦЕЛЬ. Разработка комплексного подхода по оценке кардио- и васкулотоксичности лекарственных препаратов в доклинических исследованиях in vivo.
ОБСУЖДЕНИЕ. Для оценки функционального состояния сердечно-сосудистой системы могут быть использованы как мелкие лабораторные животные (грызуны), так и более крупные, такие как кролики, хорьки, собаки, карликовые свиньи и приматы. Токсические эффекты изучаемых лекарственных препаратов в отношении сердца и сосудов у животных могут проявляться в виде изменений в физиологическом, биохимическом или структурном статусах систем или органов, поэтому оценка функционального состояния сердечно-сосудистой системы должна опираться на совокупность инструментальных, лабораторных и гистологических методов. В первую очередь применимы физиологические и лабораторные исследования. Рекомендовано проводить электрокардиографию, измерение частоты сердечных сокращений и артериального давления, а также количественно оценивать маркеры нарушения функций и структурного повреждения клеток. Для более глубокого анализа рекомендуется применять гистологические и иммуногистохимические исследования тканей сердца и сосудов, чтобы оценить изменения на тканевом и клеточном уровнях.
ВЫВОДЫ. Эффективным способом обнаружения нарушений сердечно-сосудистой системы является применение комплексного подхода, который, с одной стороны, позволяет всесторонне оценить возможные токсические проявления лекарственного средства, а с другой — увеличивает трансляционной потенциал данных, получаемых на доклиническом этапе исследований.
Ключевые слова
Для цитирования:
Султанова К.Т., Мирошников М.В., Бородина А.Ю., Симонова Е.В., Устенко Ж.Ю., Мазукина Е.В., Крышень К.Л., Матичин А.А., Макарова М.Н., Макаров В.Г. Оценка безопасности лекарственных средств в отношении сердечно-сосудистой системы в доклинических исследованиях in vivo: обзор. Безопасность и риск фармакотерапии. 2025;13(3):263-278. https://doi.org/10.30895/2312-7821-2025-475
For citation:
Sultanova K.T., Miroshnikov M.V., Borodina A.Yu., Simonova E.V., Ustenko Zh.Yu., Mazukina E.V., Kryshen K.L., Matichin A.A., Makarova M.N., Makarov V.G. Cardiovascular Safety Assessment of Medicines in Preclinical In vivo Studies: A Review. Safety and Risk of Pharmacotherapy. 2025;13(3):263-278. (In Russ.) https://doi.org/10.30895/2312-7821-2025-475
ВВЕДЕНИЕ
Необходимым этапом доклинических исследований разрабатываемых лекарственных средств является выявление потенциального токсического действия на организм экспериментальных животных, то есть оценка влияния на функциональное состояние систем и органов. В соответствии с рекомендациями Международного совета по гармонизации технических требований к лекарственным средствам для медицинского применения (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH) S7A1, S7B2, а также рекомендациями Коллегии Евразийской экономической комиссии от 27.10.2020 № 183 в рамках проведения доклинических исследований необходимо изучить потенциальные нежелательные фармакодинамические эффекты лекарственных препаратов на физиологические функции организма. До начала клинических исследований проводят так называемую «основную батарею» тестов и оценивают влияние разрабатываемого препарата на центральную нервную, дыхательную и сердечно-сосудистую системы, при этом акцент делается на острых функциональных эффектах без тщательного фармакологического профилирования. Так, в дизайне исследований фармакологической безопасности в первую очередь подразумевается оценка потенциала исследуемого вещества замедлять реполяризацию желудочков сердца без углубленного изучения возможного структурного повреждения сердца и сосудов, например, при помощи лабораторных или гистологических исследований. При этом в токсикологических исследованиях не предусмотрено измерение артериального давления, частоты сердечных сокращений или параметров электрокардиограммы.
Токсические эффекты изучаемых лекарственных препаратов у животных могут проявляться в виде изменений в физиологическом, биохимическом или структурном статусе систем или органов [1]. Именно поэтому оценка функционального состояния сердечно-сосудистой системы должна опираться на совокупность инструментальных, лабораторных и гистологических методов.
Ранние исследования по оценке влияния исследуемого вещества на сердечно-сосудистую систему проводят in vitro, что позволяет получить сведения о его влиянии на продолжительность потенциала действия и ионные токи в сердце, в частности на ионные каналы hERG (калиевые каналы, кодируемые геном hERG, human Ether-à-go-go-related gene) [2]. Блокировка hERG-каналов сердца может привести к опасным последствиям: нарушению реполяризации желудочков сердца и желудочковой тахиаритмии [3]. Данные исследования играют важную роль при оценке потенциала удлинения интервала QT и выяснении клеточных механизмов, влияющих на реполяризацию миокарда. Потребность в исследованиях in vivo для определения гемодинамических и электрофизиологических эффектов препаратов сохраняется, поскольку пока отсутствуют альтернативные подходы.
Для оценки функционального состояния сердечно-сосудистой системы могут быть использованы как мелкие лабораторные животные (грызуны), так и более крупные, такие как собаки, карликовые свиньи и приматы [4][5]. Использование мышей и крыс в качестве модели in vivo, вероятно, в наибольшей степени подходит для раннего фармакологического тестирования, так как данные лабораторные животные являются стандартными для проведения токсикологических исследований и могут быть источником первичных данных о тестируемом соединении. Однако необходимо учитывать, что ионные механизмы реполяризации у крыс и мышей отличаются от ионных механизмов более крупных видов животных, а также человека, поэтому для более углубленного изучения используются морские свинки, кролики, хорьки, собаки, карликовые свиньи и приматы4.
Комплексная стратегия по оценке безопасности разрабатываемых лекарственных средств in vivo, выходящая за общепринятые подходы к изучению токсических и фармакологических свойств, позволит с большей вероятностью выявить и изучить нежелательные эффекты, которые могут иметь значение для безопасного применения препарата.
Цель работы — разработка комплексного подхода по оценке кардио- и васкулотоксичности лекарственных препаратов в доклинических исследованиях in vivo.
В ходе работы были систематизированы и проанализированы методы оценки токсического воздействия лекарственных препаратов на функциональное состояние сердечно-сосудистой системы лабораторных животных. Обобщены научные публикации о предпосылках к проведению, методологии, преимуществах, недостатках и перспективах оценки кардио- и васкулотоксичности в доклинических исследованиях. Поиск публикаций выполняли в базах данных PubMed, eLIBRARY.RU и поисковой системе Google Scholar. В обзор включали полнотекстовые публикации, доступные для поиска по состоянию на 20.08.2024. В приоритете были статьи, опубликованные за последние 5 лет. Ключевые слова для поиска на русском и английском языках: «функциональная активность», «кардиотоксичность», «артериальное давление», «кардиомаркеры», «тропонины», «гистологические исследования», «доклинические исследования», «лабораторные животные».
ОСНОВНАЯ ЧАСТЬ
Инструментальные методы
При оценке фармакологической безопасности лекарственных средств в отношении сердечно-сосудистой системы в рамках основной батареи тестов необходимо измерить артериальное давление (АД) и частоту сердечных сокращений (ЧСС), провести электрокардиографию5 [6]. В качестве дополнительных (уточняющих) исследований рассматривают проведение эхокардиографии с оценкой сердечного выброса и сократимости желудочков сердца [6][7]. При проведении исследований in vivo рекомендовано использовать бодрствующих животных6, в отношении которых не выполнялась анестезия. Одним из главных условий при использовании животных, в отношении которых не выполнялась анестезия, является предотвращение развития у животных дискомфорта и боли. Для этого необходимо проводить предварительное длительное приучение животных к этим процедурам. В связи с этим допустимо и даже целесообразно для регистрации параметров вводить животных в состояние наркоза. Это позволит снизить межиндивидуальную вариативность параметров, обусловленную стрессом, двигательной активностью животных, а также сократит временные затраты на выполнение манипуляций. При этом для учета возможного влияния средств для наркоза на оцениваемые параметры необходимо проводить регистрацию их исходных значений (до вмешательства) и включать в эксперимент контрольную группу животных.
Электрокардиография. Электрокардиограммы (ЭКГ), полученные от лабораторных животных, находящихся в сознании, часто сопровождаются высокой частотой сердечных сокращений, электрическим шумом, вызванным движением животных. Все эти переменные увеличивают сложность проведения точного и последовательного анализа ЭКГ, который изначально затруднен у лабораторных животных ввиду нечетких сигналов при снятии ЭКГ [8]. Анестезия или седация нивелируют эти переменные и дают некоторые преимущества по сравнению с использованием животных, находящихся в сознании. Для определения потенциальных индивидуальных особенностей животного важно проводить регистрацию исходных значений анализируемых параметров. При выборе доз анестезирующих средств, имеющих достаточную эффективность при наименее выраженном влиянии на регистрируемые параметры, необходимо ориентироваться на референтные интервалы, собственные данные или данные литературы. Кроме того, в руководстве ICH S7A отражена целесообразность использования групп отрицательного и положительного контроля при проведении исследований, что поможет определить чувствительность модельной системы и отличить патологию, возникающую в результате применения тестируемого вещества, от индивидуальных особенностей животного и артефактов [9].
Для проведения электрофизиологических исследований наиболее подходящими видами лабораторных животных считаются собаки, приматы и карликовые свиньи, допустимо использовать морских свинок, кроликов, хорьков. Мышей и крыс часто используют в токсикологических и фармакодинамических исследованиях, а также «гибридных» вариантах — при включении части конечных точек исследований фармакологической безопасности в их дизайн. При этом необходимо учитывать специфические электрокардиографические характеристики мелких грызунов, в частности трудноразличимые зубец Q и сегмент ST или наличие J-волны (идентифицируется как наклонная часть сегмента ST) [10].
ЭКГ, несмотря на трудоемкость процесса ее регистрации и анализа, признана наиболее важным показателем и основным биомаркером оценки безопасности в отношении сердечно-сосудистой системы при проведении доклинических исследований. В нормативной документации7 отражена необходимость оценки такого показателя проводимости сердца, как интервал QT (время от начала комплекса QRS до конца волны T). При задержке реполяризации желудочков и удлинении интервала QT у людей повышается риск развития желудочковых тахиаритмий. В связи с этим большое значение придают изучению потенциальных проаритмических эффектов лекарственных препаратов, которые связаны с удлинением интервала QT8. Помимо интервала QT наиболее часто определяют продолжительность интервалов PR, продолжительность и морфологию зубца P, комплекса QRS, зубцов T и U, что позволяет получить представление об анатомической области, которая может быть изменена под действием исследуемого препарата [11].
Учитывая важность данного метода, следует указать, что даже небольшие несоответствия в размещении меток на ЭКГ увеличивают вариабельность анализируемых значений и могут повлиять на интерпретацию данных ЭКГ, а впоследствии и на чувствительность статистического анализа, который имеет решающее значение для обнаружения небольших, но значимых изменений.
Еще один неинвазивный метод регистрации ЭКГ — мониторирование по Холтеру — суточная непрерывная регистрация ЭКГ, которая может проводиться как в покое, так и при физической нагрузке. Данный электрофизиологический метод ввиду размеров самого оборудования пригоден для крупных животных, таких как собаки, свиньи. Для обезьян мониторирование может быть технически затруднено ввиду высокой подвижности животных, не информативна также запись суточного ЭКГ у кошек в связи с большим количеством регистрируемых помех [12–14]. Перед установкой электродов необходимо подготовить кожу животного: выбрить шерсть и обезжирить поверхность. После этого на кожу грудной клетки крепятся одноразовые самоклеящиеся электроды, которые обеспечивают надежное соединение с регистрирующим устройством. Также для удобства и комфорта животного используются жилетки или эластичные бинты, которые помогают скрыть провода от животного и обеспечивают более плотное прилегание электродов к коже. Холтеровское мониторирование в ветеринарии используется для диагностики нарушений ритма и проводимости, кардиомиопатии, а также для оценки эффективности антиаритмической терапии. В доклинических же исследованиях данный метод пока не получил широкого распространения из-за высокой стоимости оборудования.
Частота сердечных сокращений — еще один электрофизиологический показатель сердечной деятельности, который используется для первичной дифференциации нормального ритма сердца и его разнообразных нарушений. Зачастую регистрацию ЧСС у лабораторных животных проводят в комплексе с измерением ЭКГ. Во временнóй области непосредственную ЧСС можно определить в любой момент времени или в интервалах между последовательными комплексами QRS, то есть между двумя основными волнами деполяризации (интервалы R–R), а затем преобразовать эти данные в значения ЧСС [15].
Артериальное давление. В то время как проведение и анализ данных ЭКГ сопряжен с некоторыми трудностями, измерение АД требует относительно простых стратегий регистрации и интерпретации данных. Наиболее распространенным методом измерения АД является манжетная сфигмоманометрия, когда измерение проводится при помощи видоспецифичных тонометров с использованием методики наложения манжеты (аускультация) вокруг периферической артерии конечности или хвоста животного. Соответствующий размер и положение манжеты являются важными факторами для получения точных результатов. При использовании слишком узкой или слишком свободной манжеты наблюдается тенденция к завышению значений АД, слишком широкой или слишком тугой манжеты — тенденция к занижению значений АД [16].
Значения АД, регистрируемые у лабораторных животных, могут варьировать в зависимости от анатомического участка, на котором располагается манжета. Систолическое АД увеличивается к периферии в результате отражения волн давления от меньших артериол из-за более прочной мышечной стенки и более высокого сопротивления, тогда как диастолическое АД незначительно снижается, а среднее АД остается практически постоянным [11]. Если измерение проводится на крупном виде животных, то есть возможность оценить систолическое, диастолическое и вычислить среднее АД, а на грызунах, как правило, определяют только систолическое АД с использованием хвостовой манжеты [17].
Разработаны методы инвазивного измерения АД, в частности использование артериального периферического катетера. Однако прямое измерение АД сопряжено с трудоемкостью процесса установки и рисками, связанными с размещением катетера в периферической артерии, включая ишемическое повреждение, кровотечение, артериальную эмболизацию и инфекцию. Также отметим, что подобный метод может быть использован преимущественно на крупных животных [18].
Эхокардиография является еще одним неинвазивным методом оценки сердечной деятельности, который дает информацию о морфологии сердца с оценкой его структурных изменений (например, гипертрофии и дилатационной кардиомиопатии) и о функциональных возможностях (сократимости левого желудочка, ударном объеме и др.) [7][19]. При проведении эхокардиографии у грызунов и некрупных животных возможно использование неонатальных фазированных датчиков, для более крупных видов, например собак, обезьян, карликовых свиней, возможно использование педиатрического датчика.
Лабораторные методы
Кардиоспецифические маркеры, определяемые в сыворотке или плазме крови, — группа показателей, которые можно оценивать при изучении воздействия препарата на сердечно-сосудистую систему [20]. Важно отметить, что использование лабораторных методов для оценки функционального состояния сердечно-сосудистой системы в ходе доклинических исследований или изучения влияния эндогенных/экзогенных веществ, не является обязательным. Они могут использоваться в качестве дополнительных или уточняющих исследований (ICH S7A).
Идеальный сердечный биомаркер должен обладать высокой специфичностью, его уровень должен быстро повышаться и снижаться после повреждения и коррелировать с его величиной, не зависеть от функционирования других органов, а также определяться стандартными и экономически доступными методами [21]. В контексте доклинических исследований должна быть как возможность определения кардиомаркеров у лабораторных животных, так и целесообразность их использования в клинической практике, что обеспечит высокую трансляционность данных. Однако маркера, который сочетал бы в себе все перечисленные критерии, в настоящее время не существует.
Все используемые маркеры кардиотоксичности имеют определенные недостатки, наиболее частые из которых — низкая органоспецифичность, а также их белковая природа и, следовательно, видоспецифичность, что, в свою очередь, определяет высокую стоимость исследований. Сдерживающими факторами использования маркеров специфической токсичности также являются их короткое время жизни, сложность прогнозирования времени забора крови и ограниченный трансляционный потенциал [22].
Биомаркеры, используемые для выявления и идентификации повреждений сердца, подразделяются на характеризующие структурное (непосредственное) повреждение и некроз кардиомиоцитов (например, тропонины, сердечный белок, связывающий жирные кислоты) и указывающие на нарушения функциональной активности сердца (например, натрийуретические пептиды).
Маркеры структурных повреждений и некроза кардиомиоцитов. Тропонин — регуляторный глобулярный белок, состоящий из трех субъединиц, который участвует в процессе мышечного сокращения. Тропонин содержится в скелетных и сердечной мышцах, но отсутствует в гладкой мускулатуре [23].
Управление по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA) одобрило использование в доклинических исследованиях сердечных тропонинов (cardiac-specific troponins, сTn) T и I (сTnI и сTnT) при оценке потенциального повреждения миокарда у крыс, собак и обезьян [24]. Белки сTnI и сTnT обнаруживаются только в сердечной мышце, что определяет их высокую органоспецифичность, они способны высвобождаться в кровь при повреждении миокарда (некроз кардиомиоцитов), а повышение их содержания в крови коррелирует с объемом поражения [25]. Уровень тропонинов в ответ на повреждение увеличивается, в целом, схожим образом у разных видов лабораторных животных: в первые 2–3 ч после повреждения, коррелируя с гистопатологическими изменениями в миокарде [26–29]. В зависимости от модели патологического состояния сердечно-сосудистой системы повышенная концентрация тропонинов у экспериментальных животных может сохраняться до 10 сут. Это обеспечивает довольно продолжительный период диагностической значимости их уровня (диагностическое окно), который включает в себя периоды выведения креатинкиназы и лактатдегидрогеназы.
Несмотря на описанные возможности, использование cTn в качестве маркеров кардиотоксичности лекарственных препаратов предусматривает и некоторые ограничения. Так, методы обнаружения разработаны и оптимизированы в основном для людей, а не для лабораторных животных [30]. Кроме того, cTn быстро выводится из крови некоторых видов лабораторных животных, например таких, как мыши и крысы, что требует корректировки временных точек отбора крови [31].
Наряду с тропонинами при повреждении миокарда в крови появляются и другие цитоплазматические белки, сигнализирующие об ишемии и некрозе кардиомиоцитов — например миоглобин (Mb) и белок, связывающий жирные кислоты (heart-type fatty-acid-binding protein, H-FABP). Мb и H-FABP являются ранними и чувствительными маркерами повреждения миокарда у человека, поступают в кровь в течение первых часов после повреждения. Однако оба этих показателя сами по себе недостаточно специфичны в качестве маркеров повреждений миокарда, достигают пика содержания в крови через 3–5 ч и к концу 24-часового периода обычно приходят в норму, кроме того, они представлены и в других тканях. Таким образом, измерение Мb и H-FABP целесообразнее проводить в составе мультимаркерной панели [32][33].
Для выявления повреждения кардиомиоцитов у людей и животных используется целый ряд маркеров: ферменты аспарагиновая трансаминаза (АСТ), лактатдегидрогеназа (ЛДГ), креатинкиназа (изоформа MB, CK–MB). Однако эти ферменты локализуются не только в клетках миокарда, они присутствуют и в других тканях организма. Так, АСТ находится во всех клетках организма, главным образом в клетках сердца и печени и, в меньшей степени, в почках и мышцах [34]. ЛДГ также содержится практически во всех клетках организма, наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах [35]. Существует пять разных изоформ данного фермента, которые отличаются молекулярной структурой и расположением в организме. Для миокарда основными являются изоформы 1 и 2, однако они также присутствуют в эритроцитах и корковом веществе почек. Изоформа креатинкиназы MB почти полностью находится в сердечной мышце, однако этот изофермент также обнаруживается в скелетных мышцах [36].
Отсутствие тканевой специфичности имеет большее значение для использования этих ферментов в качестве биомаркеров у животных, поскольку стресс и ограничения физической подвижности животных во время выполнения манипуляций могут вызывать легкое или умеренное высвобождение мышечных компонентов. Кроме того, кардиотоксичные препараты часто бывают миотоксичны, что в совокупности усложняет выявление органов-мишеней токсического действия. Но, несмотря на все ограничения, данные ферменты можно использовать как вспомогательные маркеры в доклинических экспериментах.
Маркеры функциональных изменений сердца. Потенциальными биомаркерами для идентификации кардиотоксичных соединений могут служить предсердный и мозговой натрийуретические пептиды — ANP и BNP, предшественники которых, proANP и proBNP соответственно, синтезируются в кардиомиоцитах предсердий и желудочков сердца и высвобождаются в ответ на их растяжение, вызванное повышением давления или нейрогормональными стимулами. В процессе секреции молекулы proANP и proBNP расщепляются на активные ANP и BNP и N-терминальные фрагменты (NT-proANP и NT-proBNP соответственно), при этом их секретируемые количества находятся в тесной корреляционной связи, а период полураспада у NT-proANP и NT-proBNP (~2,5 и 15,5 мин соответственно) более длителен, чем у ANP и BNP (~0,5 и 6 мин соответственно) [37].
Пептид NT-proBNP — биомаркер, наиболее часто используемый в доклинических токсикологических исследованиях. NT-proBNP является чувствительным и специфичным биомаркером при диагностике сердечной недостаточности у людей и животных. Уровень BNP также повышен при дилатационной и гипертрофической кардиомиопатии, диастолической дисфункции и системной гипертензии. Потенциальная ценность сывороточных натрийуретических пептидов как биомаркеров для дифференциации путей развития гипертрофии сердца при доклинической оценке безопасности лекарственных средств показана в исследованиях на крысах [37]. Так, повышение уровней NT-proANP и NT-proBNP наблюдалось при лекарственно-индуцированной гипертрофии сердца, но не при гипертрофии, вызванной физической нагрузкой у крыс.
Следует отметить, что уровень натрийуретических пептидов значительно повышается и при ряде некардиальных состояний, связанных с увеличением объема циркулирующей в сосудах крови и артериального давления. Если в организме задерживается жидкость, то левый желудочек работает с большей нагрузкой и его стенки растягиваются, в результате этого концентрация в крови BNP и NT-proBNP значительно увеличивается. Чаще всего такие изменения происходят при сердечной недостаточности, но могут наблюдаться при тромбоэмболии легочной артерии, циррозе печени, заболеваниях почек [38].
В результате анализа источников литературы было выявлено, что у большинства лабораторных животных детекция рассматриваемых маркеров происходит в течение 5–24 ч после моделирования повреждения. При моделировании сердечных заболеваний у лабораторных животных для получения общей характеристики как структурных, так и функциональных воздействий на сердце целесообразно проводить совместное определение как натрийуретических пептидов, так и специфических маркеров структурного повреждения сердца (табл. 1).
Таблица 1. Биомаркеры, используемые для выявления и идентификации повреждений сердца в доклинических исследованиях (по [20][24–38])
Table 1. Biomarkers used to detect and identify cardiac damage in preclinical studies (adapted from [20][24–38])
|
Свойство Parameter |
Tn |
ANP |
BNP |
H-FABP |
CK–МВ CK–MB |
Миоглобин Myoglobin |
АСТ AST |
ЛДГ1/ЛДГ2 LDH1/LDH2 |
|
Специфичность ткани Tissue specificity |
Абсолютная Absolute |
Абсолютная Absolute |
Абсолютная Absolute |
Умеренная Moderate |
Умеренная Moderate |
Низкая Low |
Низкая Low |
Умеренная Moderate |
|
Циркуляция в крови в норме Presence in circulating blood under normal conditions |
Отсутствует No |
Отсутствует No |
Отсутствует No |
Присутствует Yes |
Присутствует Yes |
Присутствует Yes |
Присутствует Yes |
Присутствует Yes |
|
Стабильность в крови Stability in blood |
Высокая High |
Высокая High |
Высокая High |
Низкая Low |
Умеренная Moderate |
Низкая Low |
Высокая High |
Высокая High |
|
Активность использования в доклинических исследованиях Frequency of use in preclinical studies |
Высокая High |
Высокая или умеренная High or moderate |
Высокая или умеренная High or moderate |
Низкая Low |
Умеренная Moderate |
Низкая Low |
Высокая High |
Умеренная Moderate |
|
Предпочтительная тест-система в доклинических исследованиях Pr linical studies |
Крысы, собаки, приматы Rats, dogs, primates |
Крысы, кролики, кошки, собаки, карликовые свиньи, приматы Rats, rabbits, cats, dogs, minipigs, primates |
Крысы, кошки, собаки, карликовые свиньи, приматы Rats, cats, dogs, minipigs, primates |
Мыши, крысы Mice, rats |
Мыши, крысы, кошки, собаки, карликовые свиньи, приматы Mice, rats, cats, dogs, minipigs, primates |
Мыши, крысы Mice, rats |
Мыши, крысы, кролики, хорьки, кошки, собаки, карликовые свиньи, приматы Mice, rats, rabbits, ferrets, cats, dogs, minipigs, primates |
Мыши, крысы, кролики, хорьки, кошки, собаки, карликовые свиньи, приматы Mice, rats, rabbits, ferrets, cats, dogs, minipigs, primates |
Таблица составлена авторами / The table is prepared by the authors
Примечание. Tn — тропонины; ANP — предсердный натрийуретический пептид; BNP — мозговой натрийуретический пептид; H-FABP — белок, связывающий жирные кислоты; CK–MB — изоформа креатинкиназы MB; АСТ — аспарагиновая трансаминаза; ЛДГ1/ЛДГ2 — изоформы лактатдегидрогеназы 1 и 2.
Note. Tn, troponins; ANP, atrial natriuretic peptide; BNP, brain natriuretic peptide; H-FABP, heart-type fatty-acid-binding protein; CK–MB, creatine kinase–myocardial band; AST, aspartate aminotransferase; LDH1/LDH2, lactate dehydrogenase isoenzymes 1 and 2.
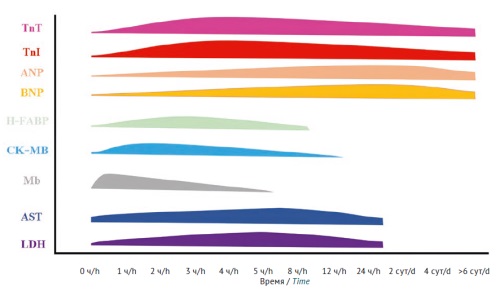
Схема детекции кардиомаркеров в крови лабораторных животных в ответ на острое повреждение, отражающая ориентировочные временные диапазоны повышения и снижения маркеров (рис. 1), составлена по результатам анализа большого количества источников литературы и является усредненной [20][24–44]. Данная схема подготовлена на основании данных, полученных из исследований с использованием крыс, собак и приматов, для других видов ее можно рассматривать как ориентировочную.
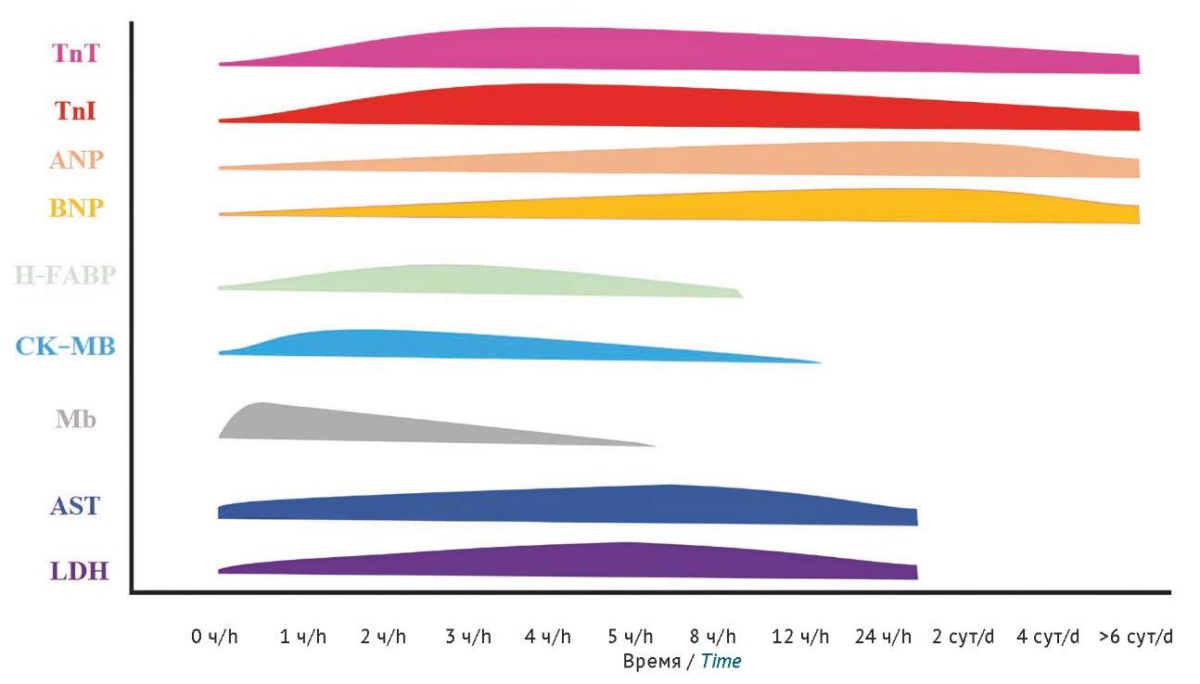
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Сводная информация об изменении уровня сердечных маркеров в крови лабораторных животных в ответ на острое повреждение [20][24–44]. TnT — тропонин T; TnI — тропонин I; ANP — предсердный натрийуретический пептид; BNP — мозговой натрийуретический пептид; H-FABR — белок, связывающий жирные кислоты; CK–MB — изоформа креатинкиназы MB; Mb — миоглобин; AST — аспарагиновая трансаминаза; LDH — лактатдегидрогеназа
Fig. 1. Summary of changes in the levels of cardiac markers in the blood of laboratory animals in response to acute injury [20][24–44]. TnT, troponin T; TnI, troponin I; ANP, atrial natriuretic peptide; BNP, brain natriuretic peptide; H-FABP, heart-type fatty-acid-binding protein; CK–MB, creatine kinase–myocardial band; Mb, myoglobin; AST, aspartate aminotransferase; LDH, lactate dehydrogenase
Наибольшее диагностическое окно характерно для тропонинов, которые чаще всего у лабораторных животных можно детектировать как в течение первых 24 ч, так и позже. Натрийуретические пептиды также детектируются в крови на протяжении нескольких суток. H-FABP, CK–MB и Mb являются ранними маркерами сердечной патологии как у человека, так и у многих видов лабораторных животных, поэтому пик их активности приходится на первые 1–6 ч с момента воздействия кардиотоксиканта. Пик повышения концентрации АСТ и ЛДГ у многих лабораторных животных — 5–12 ч. В целом на скорость появления и увеличение концентрации кардиомаркеров в крови большое влияние будет оказывать конкретный дизайн исследования, выбранный способ моделирования патологического состояния (в случае фармакодинамических исследований), а при лекарственно-индуцированном поражении — класс препарата, его доза и кратность введения. Оптимальный вариант отбора образцов крови в определенные промежутки времени, например через 2, 4, 6, 8, 12, 16, 24 ч и так далее. Это позволит оценить изменение концентрации исследуемого маркера в динамике и не пропустить повышение и снижение его уровня. При многократном введении кардиотоксичных веществ длительность периода определения кардиомаркеров в крови должна быть увеличена.
Маркеры повреждения сосудов. Оценка потенциального повреждения сосудов является важной частью исследования безопасности в процессе разработки лекарственных препаратов. Система крово- и лимфообращения обеспечивает в организме процессы метаболизма, в частности транспорт различных веществ, что подвергает сосуды высокому риску воздействия лекарственных агентов. Выявление лекарственно-индуцированного повреждения сосудов (ЛИПС) — важная, но очень сложная задача, поскольку специфические циркулирующие биомаркеры раннего повреждения сосудов у человека на сегодняшний день не определены [45].
Консорциум по тестовому прогнозированию безопасности (Predictive Safety Testing Consortium, PSTC) создал рабочую группу по сосудистому повреждению (Vascular Injury Working Group, VIWG) для разработки и квалификации трансляционных биомаркеров ЛИПС [46], которая выделила несколько наиболее перспективных из них.
ЛИПС обычно характеризуется повреждением эндотелия и гладкомышечных клеток сосудов, а также воспалением. В связи с этим выявление васкулотоксичности может основываться на оценке специфических биомаркеров, связанных с высвобождением молекул адгезии эндотелиальных клеток и/или маркеров их активации (ангиопоэтин-2, эндотелин-1, Е-селектин, тромбоспондин-1 и VEGF-α), а также определении неспецифических белков острой фазы воспаления (Timp-1, липокалин-2, KC/GRO (Cxcl1), α-1 кислый гликопротеин 1 и общий оксид азота) [38].
Целесообразно также проведение клинического анализа крови и оценка уровня электролитов (калия, натрия и хлора) в сыворотке крови. Клинический анализ крови позволяет диагностировать большинство заболеваний, связанных с сердечно-сосудистой системой, включая инфаркт миокарда, инсульт, воспалительные процессы и многие другие патологии. Баланс электролитов является важным показателем общего состояния здоровья, в частности функционирования почек и сердца [38].
Морфологические методы
Морфологические методы исследования применимы, если лекарственный препарат способен опосредовать дегенерацию и некроз кардиомиоцитов. Если кардиотоксичное соединение влияет только на процессы проводимости и сократимости, как правило, значимых морфологических изменений в миокарде не обнаруживается [47].
Наиболее распространенными подходами для оценки кардиотоксичности являются регистрация массы сердца, оценка морфологии путем стандартного гистологического исследования (с окраской гематоксилином и эозином) или в сочетании с гистохимическими методами, а также иммуногистохимическое исследование [47].
Введение некоторых препаратов может приводить к изменению массы сердца из-за гипертрофии или атрофии кардиомиоцитов [47][48]. Изменение массы сердца может быть единственным признаком, указывающим на гипертрофию или атрофию, однако эти данные может быть сложно интерпретировать ввиду наличия биологической вариабельности определяемого параметра, отсутствия точных видовых референтных интервалов массовых коэффициентов органов, что определяет необходимость установления внутрилабораторных референтных интервалов масс органов и их массовых коэффициентов [49–54].
Стандартное гистологическое исследование позволяет выявить морфологические изменения, связанные с действием препарата, и их характер, а также предоставить информацию о взаимосвязи этих изменений с дозой и продолжительностью введения [48][55].
Для обеспечения наилучшей оценки изменений сердца в токсикологических исследованиях важно стандартизировать отбор проб [56][57]. Так, например, у крыс и мышей рекомендуется рассекать сердце продольно, через оба желудочка, что обеспечивает попадание всех необходимых структур в область среза [58].
Основными морфофункциональными структурами, представляющими интерес при морфологическом изучении влияния препарата на сердечно-сосудистую систему, считаются сосочковые мышцы, субэндокардиальная область, клапаны и коронарные артерии [56]. Для крупных животных рекомендуют проводить оценку состояния стенки обоих предсердий и желудочков, межжелудочковой перегородки, атриовентрикулярных и аортального клапанов. Дополнительно в списке могут присутствовать синоатриальный и атриовентрикулярный узел для оценки проводящей системы сердца [56][57].
Морфологические критерии изменений миокарда включают в себя обнаружение дегенерации/некроза кардиомиоцитов, вакуолизации кардиомиоцитов, кровоизлияний, отложения пигментов и белковых веществ, очагов минерализации, фиброза, воспалительных очагов (рис. 2–6, опубликованы на сайте журнала9) [47][48][55][56][59–62]. При оценке морфологических изменений крайне важно отличать их от спонтанных и фоновых изменений, характерных для животных [55][56].
Немаловажным этапом является не просто регистрация самого факта наличия микроскопических находок — следует отмечать степень тяжести поражений и их распределение (очаговые, многоочаговые, диффузные), локализацию (правый желудочек, левый желудочек, межжелудочковая перегородка и т.д.), а также дополнительные модификаторы патологии, если они имеются (например, тип воспаления) [63]. Кроме того, степень тяжести поражения можно оценить путем количественного измерения площади очага дегенерации/некроза или фиброза. Для оценки размера очага поражения оптимальным считается исследование 6–8 гистологических препаратов от животного [64].
Трифенилтетразолия хлорид (TTC) — один из широко используемых и доступных индикаторов для визуализации ишемических повреждений и оценки поражения сердца, в частности инфаркта, у животных. Анализ с применением TTC в исследованиях кардиотоксичности препаратов имеет преимущество перед стандартным гистологическим исследованием, позволяя выявлять структурно не измененные, но функционально скомпрометированные кардиомиоциты [65]. Бесцветный ТТС ферментативно восстанавливается в живых тканях при участии различных дегидрогеназ до окрашенного в красный цвет соединения 1,3,5-трифенилформазан, в результате чего неповрежденные ткани миокарда окрашиваются в темно-красный цвет, в то время как в зонах некроза ТТС остается в исходной форме, и эти участки миокарда будут более бледными (рис. 7, опубликован на сайте журнала10).
Иммуногистохимическое исследование может применяться для определения маркеров, которые обнаруживаются в интересующей ткани и утрачиваются при разрушении клеток (например, тропонины сTnI и сTnT), часто используют мембранные CD-маркеры, отражающие течение воспалительного процесса, а также маркеры, которые накапливаются в поврежденной ткани, например комплемент и фибрин [66].
Поражение сосудов (рис. 8, опубликован на сайте журнала11) — также часто встречающаяся находка при оценке безопасности лекарственных средств [66]. Интерпретация найденных сосудистых изменений осложняется наличием спонтанной сосудистой патологии у лабораторных животных (узелковый полиартериит, спонтанный полиартериит биглей и др.) [66][67].
Несмотря на разнообразие механизмов развития ЛИПС, клеточный ответ в целом развивается одинаково во всех случаях. Независимо от последовательности событий и их патофизиологии активация и повреждение эндотелиальных клеток, повреждение мышечной стенки и воспаление, характеризующиеся сосудистой утечкой, инфильтратами воспалительных клеток, являются постоянными признаками всех основных типов ЛИПС [66]. Таким образом, стандартное гистологическое исследование может успешно применяться для установления факта наличия повреждения сосудов, но не позволит выяснить механизмы его развития.
Для успешной идентификации ЛИПС рабочей группой по сосудистому повреждению (VIWG) разработаны рекомендации по отбору органов. Стандартный набор органов для рутинной оценки включает в себя аорту, сердце, место введения, почки, печень, скелетную мышцу, брыжейку и семенники. При этом брыжейку рекомендуют отбирать методом валика, аорту и скелетную мускулатуру — в продольном и поперечном сечении, а для сердца рекомендуется изготовить несколько срезов, чтобы повысить вероятность обнаружения поражения коронарных артерий [66]. Список может быть расширен при необходимости.
Среди микроскопических находок, которые характеризуют ЛИПС, отмечают медиальный некроз, воспалительную инфильтрацию медии и адвентиции, а также кровоизлияния [59].
Строго специфичных иммуногистохимических маркеров для ЛИПС на данный момент также не обнаружено, однако некоторые маркеры используются для оценки сосудистого повреждения и в совокупности с другими данными могут позволить сделать суждение о ЛИПС. Среди них CD31 — трансмембранный гликопротеин, являющийся маркером эндотелиальных клеток и участвующий в миграции лейкоцитов в воспалительный очаг, а также фактор фон Виллебранда, который демонстрирует обильное внеклеточное иммунопозитивное окрашивание при прогрессировании повреждения сосудов и свидетельствует о разрушении эндотелиальных клеток [68].
Кавеолин-1 (caveolin-1, CAV-1) и антитела к гладкой мускулатуре (smooth muscle antibodies, SMA) являются иммуногистохимическими маркерами повреждения гладкомышечных клеток сосудов, так как они присутствуют в нормальных клетках и отсутствуют в поврежденных [68][69]. Как маркеры нарушения межклеточных контактов в клетках стенки сосуда часто используются ZO-1, claudin, connexin 43. Иммунореактивность этих белков снижается или пропадает в местах повреждения сосудов [69]. Кроме того, иммуногистохимический метод позволяет обнаружить в стенке сосуда депозиты веществ, накапливающихся при патологии стенки сосудов или окружающих тканей, таких как комплемент C3, фибрин/фибриноген, иммунные комплексы [69–71].
Все перечисленные иммуногистохимические маркеры могут помочь подтвердить повреждение сосудов и установить морфологические особенности, однако не являются строго специфичными для ЛИПС и требуют комплексной оценки. Следует отметить, что при использовании данного метода возможна только полуколичественная оценка выраженности иммуногистохимического окрашивания, что накладывает ограничения на его использование.
Оценка функционального состояния сердечно-сосудистой системы в доклинических исследованиях является важнейшей составляющей изучения фармакологической безопасности. Ввиду структурной и функциональной сложности, а также значимости рассматриваемой системы невозможно составить всеобъемлющий и универсальный план оценки ее состояния, но возможно выделить основные (критические) значимые паттерны (блоки), на которые по мнению авторов следует обратить внимание. Обобщенный перечень методов оценки функционального состояния сердечно-сосудистой системы на доклиническом этапе представлен на рисунке 9.
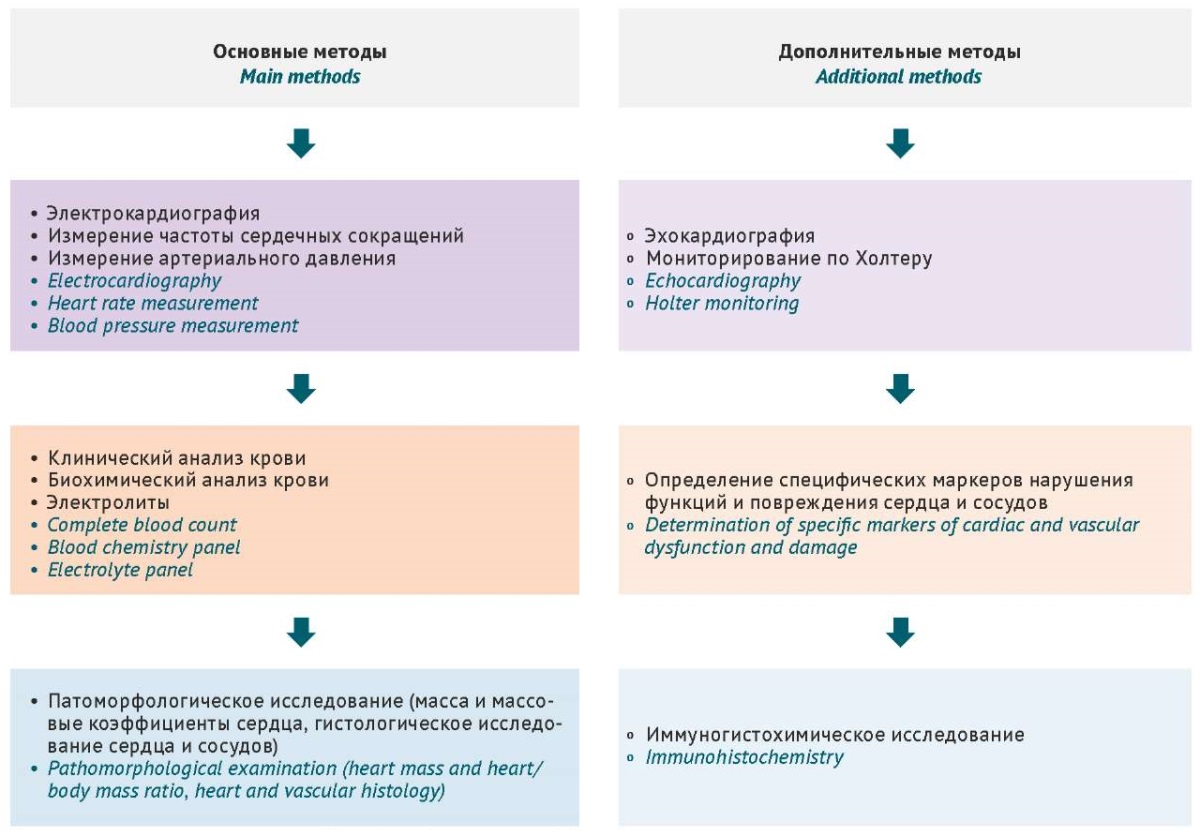
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 9. Схема комплексной оценки функционального состояния сердечно-сосудистой системы лабораторных животных
Fig. 9. Schematic representation of comprehensive cardiovascular function assessment in laboratory animals
ЗАКЛЮЧЕНИЕ
Оценка влияния лекарственных средств на сердечно-сосудистую систему представляет собой один из ключевых аспектов доклинических исследований, требующий всестороннего и детального подхода. Оценку кардиотоксичности целесообразно начинать с использования инструментальных методов, наиболее информативными среди которых являются электрокардиография, измерение ЧСС и АД, что входит в минимальный перечень обязательных тестов для оценки фармакологической безопасности (ICH S7А, ICH S7В). В дополнение к инструментальным методам диагностики рекомендуется проводить лабораторные исследования. Оптимальным решением будет использование одного специфического маркера, например тропонина I или T, а также нескольких дополнительных маркеров на выбор, таких как ЛДГ, АСТ, CK–MB. Кроме того, целесообразно провести общий анализ крови и оценить электролитный состав крови. В то же время следует принимать во внимание временной промежуток, в течение которого происходит нарастание концентрации интересующих показателей.
Для более углубленного анализа рекомендуется применять гистологические и иммуногистохимические исследования сердца и сосудов, что позволит оценить изменения на тканевом и клеточном уровнях.
Таким образом, предложенный подход позволяет оценить возможные токсические проявления лекарственного средства на биохимическом, структурном или физиологическом уровнях, что делает возможным проведение полной и корректной оценки потенциальной кардио- и васкулотоксичности новых лекарственных средств, а также увеличивает трансляционный потенциал данных, получаемых на доклиническом этапе исследований.
Дополнительная информация. Рисунки 2–8 размещены на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2025-475-fig
Additional information. Figures 2–8 are posted on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2025-475-fig
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: К.Т. Султанова — концепция работы, написание текста рукописи, формулировка выводов; М.В. Мирошников — работа с источниками литературы, написание текста рукописи, формулировка выводов; А.Ю. Бородина, Е.В. Симонова, Ж.Ю. Устенко — работа с источниками литературы, написание текста рукописи; Е.В. Мазукина, К.Л. Крышень, А.А. Матичин — подготовка финальной версии текста рукописи, формулировка выводов; М.Н. Макарова — участие в формулировке выводов, критический пересмотр содержания рукописи; В.Г. Макаров — утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Kira T. Sultanova conceptualised the study, drafted the manuscript, and formulated the conclusions. Mihail V. Miroshnikov worked with literature sources, drafted the manuscript, and formulated the conclusions. Antonina Yu. Borodina, Elizaveta V. Simonova, and Zhanna Yu. Ustenko worked with literature sources and drafted the manuscript. Elizaveta V. Mazukina, Kirill L. Kryshen, and Aleksandr A. Matichin prepared the final version of the manuscript and formulated the conclusions. Marina N. Makarova formulated the conclusions and critically revised the manuscript. Valery G. Makarov approved the final version of the manuscript for publication.
1. ICH S7A Safety pharmacology studies for human pharmaceuticals. CPMP/ICH/539/00. ICH; 2001.
2. ICH S7B Non-clinical evaluation of the potential for delayed ventricular repolarization (QT interval prolongation) by human pharmaceuticals. CPMP/ICH/423/02. ICH; 2005.
3. Рекомендация Коллегии Евразийской экономической комиссии от 27.10.2020 № 18 «О Руководстве по исследованию фармакологической безопасности лекарственных препаратов для медицинского применения».
4. Там же.
5. ICH S7A Safety pharmacology studies for human pharmaceuticals. CPMP/ICH/539/00. ICH; 2001.
6. Рекомендация Коллегии Евразийской экономической комиссии от 27.10.2020 № 18 «О Руководстве по исследованию фармакологической безопасности лекарственных препаратов для медицинского применения».
7. ICH S7B Non-clinical evaluation of the potential for delayed ventricular repolarization (QT interval prolongation) by human pharmaceuticals. CPMP/ICH/423/02. ICH; 2005.
8. Там же.
9. https://doi.org/10.30895/2312-7821-2025-475-fig
10. https://doi.org/10.30895/2312-7821-2025-475-fig
11. https://doi.org/10.30895/2312-7821-2025-475-fig
Список литературы
1. Mladěnka P, Applová L, Patočka J, Costa VM, Remiao F, Pourová J. Comprehensive review of cardiovascular toxicity of drugs and related agents. Med Res Rev. 2018;38(4):1332–403. https://doi.org/10.1002/med.21476
2. Guth BD. Preclinical cardiovascular risk assessment in modern drug development. Toxicol Sci. 2007;97(1):4–20. https://doi.org/10.1093/toxsci/kfm026
3. Sanguinetti MC, Tristani-Firouzi M. hERG potassium channels and cardiac arrhythmia. Nature. 2006;440(7083):463–9. https://doi.org/10.1038/nature04710
4. Gralinski MR. The dog’s role in the preclinical assessment of QT interval prolongation. Toxicol Pathol. 2003;31(Suppl):11–6. https://doi.org/10.1080/0192623039017488
5. Heyen JR, Vargas HM. The use of nonhuman primates in cardiovascular safety assessment. In: Bluemel J, Schenck E, Korte S, Weinbauer GF, eds. The nonhuman primate in nonclinical drug development and safety assessment. Academic Press; 2015. P. 551–78. https://doi.org/10.1016/B978-0-12-417144-2.00029-9
6. Енгалычева ГН, Сюбаев РД, Горячев ДВ. Исследования фармакологической безопасности лекарственных средств: экспертная оценка полученных результатов. Ведомости Научного центра экспертизы средств медицинского применения. 2017;7(2):92–7. EDN: YSDMLV
7. Sarazan RD, Mittelstadt S, Guth B, Koerner J, Zhang J, Pettit S. Cardiovascular function in nonclinical drug safety assessment: Current issues and opportunities. Int J Toxicol. 2011;30(3):272–86. https://doi.org/10.1177/1091581811398963
8. Ross RA, Foley CM, Jones HM, Osinski MA. A method for assessing and monitoring consistency of nonclinical ECG analysis. J Pharmacol Toxicol Methods. 2022;116:107189. https://doi.org/10.1016/j.vascn.2022.107189
9. Ewart L, Milne A, Adkins D, Benjamin A, Bialecki R, Chen Y, et al. A multi-site comparison of in vivo safety pharmacology studies conducted to support ICH S7A & B regulatory submissions. J Pharmacol Toxicol Methods. 2013;68(1):30–43. https://doi.org/10.1016/j.vascn.2013.04.008
10. Arini PD, Liberczuk S, Mendieta JG, Santa María M, Bertrán GC. Electrocardiogram delineation in a Wistar rat experimental model. Comput Math Methods Med. 2018;2018(1):2185378. https://doi.org/10.1155/2018/2185378
11. Authier S, Pugsley MK, Troncy E, Curtis MJ. Arrhythmogenic liability screening in cardiovascular safety pharmacology: Commonality between non-clinical safety pharmacology and clinical thorough QT (TQT) studies. J Pharmacol Toxicol Methods. 2010;62(2):83–8. https://doi.org/10.1016/j.vascn.2010.06.005
12. Mavropoulou A, Oliveira P, Willis R. Holter monitoring in dogs: 24 h vs. 48 h. Vet J. 2021;272:105628. https://doi.org/10.1016/j.tvjl.2021.105628
13. Lyhne MK, Debes KP, Helgogaard T, Vegge A, Kildegaard J, Pedersen-Bjergaard U, et al. Electrocardiography and heart rate variability in Göttingen minipigs: Impact of diurnal variation, lead placement, repeatability and streptozotocin-induced diabetes. J Pharmacol Toxicol Methods. 2022;118:107221. https://doi.org/10.1016/j.vascn.2022.107221
14. Nakayama S, Koie H, Kato-Tateishi M, Pai C, Ito-Fujishiro Y, Kanayama K, et al. Establishment of a new formula for QT interval correction using a large colony of cynomolgus monkeys. Exp Anim. 2020;69(1):18–25. https://doi.org/10.1538/expanim.19-0009
15. Kahankova R, Kolarik J, Brablik J, Barnova K, Simkova I, Martinek R. Alternative measurement systems for recording cardiac activity in animals: A pilot study. Animal Biotelemetry. 2022;10(1):15. https://doi.org/10.1186/s40317-022-00286-y
16. Skelding A, Valverde A. Non-invasive blood pressure measurement in animals: Part 1 — techniques for measurement and validation of non-invasive devices. Can Vet J. 2020;61(4):368–74. PMID: 32255821
17. Wang Y, Thatcher SE, Cassis LA. Measuring blood pressure using a noninvasive tail cuff method in mice. Methods Mol Biol. 2017;1614:69–73. https://doi.org/10.1007/978-1-4939-7030-8_6
18. Tuohy PP, Raisis AL, Drynan EA. Agreement of invasive and non-invasive blood pressure measurements in anaesthetised pigs using the SurgiVet V9203. Res Vet Sci. 2017;115:250–4. https://doi.org/10.1016/j.rvsc.2017.05.022
19. Terzi OS, Toksöz C, Akbaba M, Emrealp G. The use of two dimensional speckle tracking echocardiography in veterinary cardiology. Atatürk Üniv Vet Bilim Derg. 2021;16(2):176–81. https://doi.org/10.17094/ataunivbd.828343
20. Kim K, Chini N, Fairchild DG, Engle SK, Reagan WJ, Summers SD, et al. Evaluation of cardiac toxicity biomarkers in rats from different laboratories. Toxicol Pathol. 2016;44(8):1072–83. https://doi.org/10.1177/0192623316668276
21. Oyama MA. Using cardiac biomarkers in veterinary practice. Clin Lab Med. 2015;35(3):555–66. https://doi.org/10.1016/j.cll.2015.05.005
22. Walker DB. Serum chemical biomarkers of cardiac injury for nonclinical safety testing. Toxicol Pathol. 2006;34(1):94–104. https://doi.org/10.1080/01926230500519816
23. Wang Z, Raunser S. Structural biochemistry of muscle contraction. Annu Rev Biochem. 2023;92(1):411–33. https://doi.org/10.1146/annurev-biochem-052521-042909
24. O’Brien PJ, Reagan WJ, York MJ, Jacobsen MC. Review of qualification data for cardiac troponins. FDA, CDER; 2011.
25. Pan DS, Li B, Wang SL. Evaluation of biomarkers for doxorubicin-induced cardiac injury in rats. Exp Ther Med. 2022;24(6):1–13. https://doi.org/10.3892/etm.2022.11648
26. York M, Scudamore C, Brady S, Chen C, Wilson S, Curtis MJ, et al. Characterization of troponin responses in isoproterenol-induced cardiac injury in the Hanover Wistar rat. Toxicol Pathol. 2007;35(4):606–17. https://doi.org/10.1080/01926230701389316
27. Clements P, Brady S, York M, Berridge B, Mikaelian I, Nicklaus R, et al. Time course characterization of serum cardiac troponins, heart fatty acid–binding protein, and morphologic findings with isoproterenol-induced myocardial injury in the rat. Toxicol Pathol. 2010;38(5):703–14. https://doi.org/10.1177/0192623310374969
28. O’Brien PJ. Blood cardiac troponin in toxic myocardial injury: Archetype of a translational safety biomarker. Expert Rev Mol Diagn. 2006;6(5):685–702. https://doi.org/10.1586/14737159.6.5.685
29. Reagan WJ, Barnes R, Harris P, Summers S, Lopes S, Stubbs M, et al. Assessment of cardiac troponin I responses in nonhuman primates during restraint, blood collection, and dosing in preclinical safety studies. Toxicol Pathol. 2017;45(2):335–43. https://doi.org/10.1177/0192623316663865
30. Apple FS, Murakami MM, Ler R, Walker D, York M; HESI Technical Committee of Biomarkers Working Group on Cardiac Troponins. Analytical characteristics of commercial cardiac troponin I and T immunoassays in serum from rats, dogs, and monkeys with induced acute myocardial injury. Clin Chem. 2008;54(12):1982–9. https://doi.org/10.1373/clinchem.2007.097568
31. Muslimovic A, Fridén V, Tenstad O, Starnberg K, Nyström S, Wesén E, et al. The liver and kidneys mediate clearance of cardiac troponin in the rat. Sci Rep. 2020;10(1):6791. https://doi.org/10.1038/s41598-020-63744-8
32. Alhadi HA, Fox KA. Do we need additional markers of myocyte necrosis: The potential value of heart fatty-acid-binding protein. QJM. 2004;97(4):187–98. https://doi.org/10.1093/qjmed/hch037
33. O’Brien PJ, Smith DE, Knechtel TJ, Marchak MA, Pruimboom-Brees I, Brees DJ, et al. Cardiac troponin I is a sensitive, specific biomarker of cardiac injury in laboratory animals. Lab Anim. 2006;40(2):153–71. https://doi.org/10.1258/002367706776319042
34. Gavazza A, Fruganti A, Turinelli V, Marchegiani A, Spaterna A, Tesei B, et al. Canine traditional laboratory tests and cardiac biomarkers. Front Vet Sci. 2020;7:320. https://doi.org/10.3389/fvets.2020.00320
35. Klein R, Nagy O, Tóthová C, Chovanova F. Clinical and diagnostic significance of lactate dehydrogenase and its isoenzymes in animals. Vet Med Int. 2020;2020:5346483. https://doi.org/10.1155/2020/5346483
36. Kolmanova E, Bartosova L, Khazneh E, Parak T, Suchy P. Comparison of the specificity of cardiac troponin I and creatine kinase MB in isoproterenol-induced cardiotoxicity model in rats. Acta Veterinaria Brno. 2015;84(4):343–50. https://doi.org/10.2754/avb201584040343
37. Dunn ME, Manfredi TG, Agostinucci K, Engle SK, Powe J, King NM, et al. Serum natriuretic peptides as differential biomarkers allowing for the distinction between physiologic and pathologic left ventricular hypertrophy. Toxicol Pathol. 2017;45(2):344–52. https://doi.org/10.1177/0192623316634231
38. Aulbach AD, Amuzie CJ. Biomarkers in nonclinical drug development. In: Faqi AS, ed. A comprehensive guide to toxicology in nonclinical drug development. Academic Press; 2024. P. 463–87. https://doi.org/10.1016/B978-0-323-85704-8.00035-9
39. Tümer KÇ, Özdemİr H, Eröksüz H. Evaluation of cardiac troponin I in serum and myocardium of rabbits with experimentally induced polymicrobial sepsis. Exp Anim. 2020;69(1):54–61. https://doi.org/10.1538/expanim.19-0046
40. Tonomura Y, Mori Y, Torii M, Uehara T. Evaluation of the usefulness of biomarkers for cardiac and skeletal myotoxicity in rats. Toxicology. 2009;266(1–3):48–54. https://doi.org/10.1016/j.tox.2009.10.014
41. Engle SK, Jordan WH, Pritt ML, Chiang AY, Davis MA, Zimmermann JL, et al. Qualification of cardiac troponin I concentration in mouse serum using isoproterenol and implementation in pharmacology studies to accelerate drug development. Toxicol Pathol. 2009;37(5):617–28. https://doi.org/10.1177/0192623309339502
42. Brady SM. The assessment of cardiac biomarkers in rat models of cardiotoxicity. London: University of London; 2008.
43. Dunn ME, Coluccio D, Hirkaler G, Mikaelian I, Nicklaus R, Lipshultz SE, et al. The complete pharmacokinetic profile of serum cardiac troponin I in the rat and the dog. Toxicol Sci. 2011;123(2):368–73. https://doi.org/10.1093/toxsci/kfr190
44. Minomo H, Torikai Y, Furukawa T, Uchino H, Kadokura H, Nakama K, et al. Characteristics of troponins as myocardial damage biomarkers in cynomolgus monkeys. J Toxicol Sci. 2009;34(6):589–601. https://doi.org/10.2131/jts.34.589
45. Bendjama K, Guionaud S, Aras G, Arber N, Badimon L, Bamberger U, et al. Translation strategy for the qualification of drug-induced vascular injury biomarkers. Toxicol Pathol. 2014;42(4):658–71. https://doi.org/10.1177/0192623314527644
46. Sauer J-M, Walker EG, Porter AC. The predictive safety testing consortium: Safety biomarkers, collaboration, and qualification. J Med Dev Sci. 2016;1(1):34–45. https://doi.org/10.18063/jmds.2015.01.007
47. McInnes E, ed. Pathology for toxicologists: Principles and practices of laboratory animal pathology for study personnel. Chichester: John Wiley & Sons; 2017.
48. Reagan WJ, York M, Berridge B, Schultze E, Walker D, Pettit S. Comparison of cardiac troponin I and T, including the evaluation of an ultrasensitive assay, as indicators of doxorubicin-induced cardiotoxicity. Toxicol Pathol. 2013;41(8):1146–58. https://doi.org/10.1177/0192623313482056
49. Луговик ИА, Макарова МН. Токсикологические исследования. Референтные интервалы массовых коэффициентов внутренних органов на выборке, состоящей из 1000 аутбредных крыс. Лабораторные животные для научных исследований. 2021;(1):3–11. https://doi.org/10.29296/2618723X-2021-01-01
50. Рощина ЕА. Референсные интервалы по массовым коэффициентам органов кроликов и их абсолютным значениям. Лабораторные животные для научных исследований. 2022;(1):34–42. https://doi.org/10.29296/2618723X-2022-01-05
51. Бородина АЮ. Референтные интервалы массовых коэффициентов внутренних органов морских свинок. Лабораторные животные для научных исследований. 2023;(3):68–73. https://doi.org/10.57034/2618723X-2023-03-05
52. Бородина АЮ, Султанова КТ. Референтные интервалы массовых коэффициентов внутренних органов хорьков и их абсолютные значений. Ветеринарный фармакологический вестник. 2024;(2):8–20. https://doi.org/10.17238/issn2541-8203.2024.2.8
53. Симонова ЕВ, Савватейкина АИ, Султанова КТ, Макарова МН, Мазукина ЕВ. Референтные интервалы по массовым коэффициентам органов карликовых свиней и их абсолютным значениям. Ветеринарная патология. 2024;23(2):41–50. https://doi.org/10.23947/2949-4826-2024-23-2-41-50
Об авторах
К. Т. СултановаРоссия
Султанова Кира Тимуровна, канд. мед. наук
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
М. В. Мирошников
Россия
Мирошников Михаил Владимирович, канд. мед. наук
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
А. Ю. Бородина
Россия
Бородина Антонина Юрьевна
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
Е. В. Симонова
Россия
Симонова Елизавета Владимировна
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
Ж. Ю. Устенко
Россия
Устенко Жанна Юрьевна, канд. вет. наук
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
Е. В. Мазукина
Россия
Мазукина Елизавета Владимировна
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
К. Л. Крышень
Россия
Крышень Кирилл Леонидович, канд. биол. наук
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
А. А. Матичин
Россия
Матичин Александр Алексеевич
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
М. Н. Макарова
Россия
Макарова Марина Николаевна, д-р мед. наук
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
В. Г. Макаров
Россия
Макаров Валерий Геннадьевич, д-р мед. наук, профессор
ул. Заводская, д. 3, к. 245, Всеволожский район, г.п. Кузьмоловский, Ленинградская обл., 188663
Дополнительные файлы
|
|
1. Рис.1 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(2MB)
|
Метаданные ▾ | |

|
2. Рисунки 2–8 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Султанова К.Т., Мирошников М.В., Бородина А.Ю., Симонова Е.В., Устенко Ж.Ю., Мазукина Е.В., Крышень К.Л., Матичин А.А., Макарова М.Н., Макаров В.Г. Оценка безопасности лекарственных средств в отношении сердечно-сосудистой системы в доклинических исследованиях in vivo: обзор. Безопасность и риск фармакотерапии. 2025;13(3):263-278. https://doi.org/10.30895/2312-7821-2025-475
For citation:
Sultanova K.T., Miroshnikov M.V., Borodina A.Yu., Simonova E.V., Ustenko Zh.Yu., Mazukina E.V., Kryshen K.L., Matichin A.A., Makarova M.N., Makarov V.G. Cardiovascular Safety Assessment of Medicines in Preclinical In vivo Studies: A Review. Safety and Risk of Pharmacotherapy. 2025;13(3):263-278. (In Russ.) https://doi.org/10.30895/2312-7821-2025-475
JATS XML