Перейти к:
Локальное введение плазмиды pCMV-VEGF165, кодирующей VEGF, стимулирует регенерацию тканей после холодовой травмы у крыс
https://doi.org/10.30895/2312-7821-2025-13-2-198-212
Резюме
ВВЕДЕНИЕ. Отморожения представляют собой относительно распространенные травмы, сопровождающиеся высоким уровнем инвалидизации, лечение которых является трудоемким и длительным. Генотерапевтический препарат плазмиды pCMV-VEGF165, кодирующей фактор роста эндотелия сосудов (VEFG), разработанный для терапевтического ангиогенеза, может быть перспективным средством для стимуляции восстановления микроциркуляции и ускорения заживления повреждений при местной холодовой травме. Для проверки этой гипотезы необходимо проведение экспериментального исследования на животных.
ЦЕЛЬ. Оценка эффективности применения препарата на основе генетической конструкции — плазмиды pCMV-VEGF165 для коррекции нарушений при холодовой травме конечности у крыс.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование были включены 42 белые нелинейные лабораторные половозрелые крысы-самки. Местную холодовую травму III–IV степени моделировали в области тыльной поверхности левой задней стопы крыс наложением неодимового магнита, охлажденного в жидком азоте. Исследуемый препарат (дезоксирибонуклеиновая кислота плазмидная сверхскрученная кольцевая двуцепочечная в дозе 60 мкг) и плацебо (вода для инъекций) вводили животным паравульнарно на 2 и 7 сутки после моделирования отморожения. Оценивали общее состояние животных, состояние поврежденного участка стопы, размер раневой поверхности, скорость заживления, массу животных, после плановой эвтаназии — массу дистальных отделов задних конечностей.
РЕЗУЛЬТАТЫ. Начиная с 7 суток отмечалась статистически достоверная более быстрая регенерация тканей в области холодовой травмы у крыс в группе исследуемого препарата: уменьшение площади раневой поверхности составило в среднем 47,36% [25,55; 55,45], тогда как в группе контроля — в среднем на 28,95±18,55% (р<0,05). Достоверность различий в темпах регенерации поврежденных тканей между экспериментальными группами сохранялась на 10 сутки (58,70±15,35% против 42,01±17,41% соответственно, p<0,05). В более поздние сроки статистически достоверные различия между группами в скорости заживления раневой поверхности отсутствовали, что, вероятно, связанно с особенностями заживления ран в экспериментальной модели. Заживление раневого дефекта у грызунов происходило преимущественно посредством контракции.
ВЫВОДЫ. Локальное паравульнарное введение препарата плазмиды pCMV-VEGF165 в дозе 60 мкг на 2 и 7 сутки после моделирования холодовой травмы у крыс способствует минимизации повреждений, ускоряет регенерацию тканей под струпом и рубцевание.
Ключевые слова
Для цитирования:
Щеблыкина О.В., Костина Д.А., Архипов В.В., Патраханов Е.А., Должиков А.А., Гуреев В.В., Жернакова Н.И., Осипова О.А., Покровский М.В. Локальное введение плазмиды pCMV-VEGF165, кодирующей VEGF, стимулирует регенерацию тканей после холодовой травмы у крыс. Безопасность и риск фармакотерапии. 2025;13(2):198-212. https://doi.org/10.30895/2312-7821-2025-13-2-198-212
For citation:
Shcheblykina O.V., Kostina D.A., Arkhipov V.V., Patrakhanov E.A., Dolzhikov A.A., Gureev V.V., Zhernakova N.I., Osipova O.A., Pokrovskii M.V. Local Administration of pCMV-VEGF165 Plasmid Encoding VEGF Stimulates Tissue Regeneration after Cold Injury in Rats. Safety and Risk of Pharmacotherapy. 2025;13(2):198-212. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-2-198-212
ВВЕДЕНИЕ
Травмы, вызванные воздействием низких температур, представляют собой серьезную проблему как в мирное, так и в военное время, что обусловлено не только их относительной распространенностью, но и трудностью лечения, длительным восстановлением трудоспособности и высоким уровнем инвалидизации. От 30 до 60% пациентов, перенесших глубокие отморожения, становятся инвалидами из-за необходимости проведения ампутаций и экзартикуляций1.
Определяющим фактором в патогенезе холодовой травмы конечностей является состояние микроциркуляторного русла [1]. При охлаждении тканей сосуды спазмируются, а затем, когда происходит отогревание, спазм сменяется паретическим расширением. Это приводит к стазу и значительному ухудшению кровотока как в микроциркуляторном русле, так и в крупных сосудах вследствие развития ишемии эндотелия. В результате возникает отек тканей, что усугубляет расстройства микроциркуляции и способствует агрегации форменных элементов крови и образованию тромбов [2]. В условиях, когда ткани уже не находятся в состоянии гипотермии, их потребность в кислороде и обмене веществ возрастает. Эта повышенная потребность в кислороде наряду с недостаточным кровообращением в конечности приводит к тяжелой гипоксии и некробиотическим изменениям, известным как реперфузионный синдром [3]. Фактически гибель тканей происходит из-за воздействия внешнего тепла, которое активирует обменные процессы в поверхностных слоях при отсутствии кровотока в более глубоких тканях. Это подчеркивает критическую важность восстановления нормального кровообращения. В результате через несколько суток после травмы могут развиться глубокие некрозы, степень которых возрастает при тромбозе крупных сосудов. Кроме того, значительное влияние на патогенез местного холодового поражения оказывают вторичные нарушения микроциркуляции, вызванные прогрессирующим отеком тканей, который приводит к их сжатию в костно-фасциальных оболочках и компрессионной ишемии. Важно подчеркнуть, что в ранние сроки после воздействия холода на ткани наблюдается высокая степень обратимости патологических процессов. Поэтому экстренные лечебные меры, основанные на понимании патогенеза, могут предотвратить возникновение необратимых изменений или значительно снизить их масштаб2.
Препарат с международным непатентованным наименованием дезоксирибонуклеиновая кислота плазмидная [сверхскрученная кольцевая двуцепочечная] («Неоваскулген®») разработан для снижения частоты ампутации и смертности в популяции пациентов с хронической ишемией конечности. Он представляет собой высокоочищенную сверхскрученную форму плазмиды pCMV-VEGF165, кодирующей эндотелиальный фактор роста сосудов (vascular endothelial growth factor, VEGF). При проникновении молекул этой плазмиды внутрь клеток млекопитающих происходит выработка VEGF, стимулирующего клетки эндотелия, что приводит к росту кровеносных сосудов (васкуляризации) в области введения3. Эндотелиальные клетки участвуют в таких разнообразных процессах, как регуляция гемостаза, модуляция воспаления, поддержание гемоваскулярного гомеостаза, регуляция ангиогенеза, тонуса сосудов и их проницаемости [4]. Таким образом, стимулируя эндотелиальные клетки, VEGF играет центральную роль в процессе ангиогенеза.
Отморожение и ишемия конечности имеют схожие патогенетические механизмы, связанные с нарушением кровоснабжения тканей, гипоксией и повреждением микроциркуляторного русла [5]. Препарат «Неоваскулген®», разработанный для терапевтического ангиогенеза, может быть перспективным средством для стимуляции восстановления микроциркуляции при ишемии пораженных тканей в зоне холодовой травмы. Это подтверждается как схожестью патогенеза ишемии и отморожения, так и положительными результатами клинического применения препарата off-label при лечении отморожения стопы II–III степени [6]. Для проверки гипотезы эффективности терапевтического ангиогенеза с использованием препарата плазмиды pCMV-VEGF165 для стимуляции регенераторных процессов, снижения частоты и тяжести отсроченных осложнений при местной холодовой травме требуется проведение экспериментального исследования.
Цель работы — оценка эффективности применения препарата на основе генетической конструкции — плазмиды pCMV-VEGF165 для коррекции нарушений при холодовой травме конечности у крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Исследование проводили на 42 белых нелинейных лабораторных половозрелых крысах-самках массой 275±25 г. Крысы получены от филиала «Столбовая» Федерального государственного бюджетного учреждения науки «Научный центр биомедицинских технологий Федерального медико-биологического агентства» (Московская область, Чеховский район, пос. Столбовая). Экспериментальное исследование проводили с соблюдением этических принципов обращения с лабораторными животными в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Все процедуры с животными в исследовании были рассмотрены и утверждены внутренней комиссией по уходу и использованию животных на предмет соответствия этическим принципам обращения с животными (протокол заседания локального этического комитета НИИ фармакологии живых систем НИУ «БелГУ» от 18.03.2024 № 03/24).
Крыс содержали в поликарбонатных клетках на подстиле из опилок лиственных пород древесины. На всем протяжении исследования животных содержали на стандартной лабораторной диете (гранулированный корм для лабораторных грызунов, АО «БиоПро», Россия), водопроводной фильтрованной воде ad libitum, в контролируемых условиях окружающей среды (18–26 °C, относительная влажность 30–70%). В комнатах содержания животных поддерживали 12-часовой цикл освещения4.
В экспериментальные группы были отобраны животные без признаков отклонений внешнего вида методом стратифицированной рандомизации с учетом массы тела так, чтобы отклонение индивидуального значения массы от среднего значения было не более 20%. Каждому животному был присвоен индивидуальный номер. Идентификацию животных проводили с использованием индивидуальных меток на теле.
Исследуемый препарат. Препарат дезоксирибонуклеиновая кислота плазмидная [сверхскрученная кольцевая двуцепочечная] («Неоваскулген®», АО «НекстГен», Россия) представляет собой лиофилизат для приготовления раствора для внутримышечного введения, содержащий дезоксирибонуклеиновую кислоту плазмидную сверхскрученную pCMV-VEGF165. Для приготовления раствора для внутримышечного введения непосредственно перед применением к содержимому флакона добавляли 2 мл воды для инъекций комнатной температуры и оставляли до полного растворения препарата. Приготовленный раствор исследуемого препарата непосредственно перед введением осматривали на прозрачность и отсутствие нерастворенных частиц, а также определяли его температуру: перед введением раствор должен быть комнатной температуры (22–25 ºС)5. В качестве плацебо использовали растворитель, применяемый для приготовления исследуемого препарата, — воду для инъекций.
Моделирование холодовой травмы. В эксперименте смоделирована местная холодовая травма III–IV степени. После предварительной наркотизации (Ксила 5 мг/кг + Золетил 10 мг/кг внутрибрюшинно) дорсальную поверхность левой задней конечности животного выбривали электрическими ножницами, затем наносили крем для депиляции на 3 мин, чтобы удалить остатки волос. Неодимовый магнит (диаметр 15 мм, толщина 2 мм) охлаждали в жидком азоте (–196 °C) в течение 5 мин, а другой идентичный магнит помещали в пенополистирол при комнатной температуре. Левую заднюю конечность крысы фиксировали на магните, вмонтированном в пенопласт, с помощью пленки. Затем охлажденный магнит помещали на тыльную сторону стопы с помощью пинцета, в результате чего посредством магнитной силы охлажденный магнит плотно прижимался к коже [7]. Время экспозиции охлажденного магнита на коже составляло 1 мин, после чего магнит удаляли, лапу освобождали. Замороженную кожу отогревали при комнатной температуре (22 °C). После восстановления от наркоза животных возвращали в клетки, не перевязывая раны.
Дизайн эксперимента. Согласно данным мировой статистики, большинство жертв обморожения — мужчины [8]. Однако эти различия могут быть обусловлены большей активностью мужчин на открытом воздухе, а не генетически детерминированными факторами. Было отмечено, что женщины подвержены большему риску развития гипотермии, чем мужчины [9][10], что определило выбор для исследования крыс-самок. Механизмы этих различий остаются недостаточно изученными. Для обеспечения однородности экспериментальной группы в работе использовали крыс одного пола. Использование нелинейных крыс в исследовании обусловлено их генетическим разнообразием, что позволяет лучше моделировать индивидуальные различия в ответе на терапию и повышает репрезентативность результатов для потенциального применения у человека.
Количество используемых животных было минимизировано в соответствии с принципами гуманного обращения и соблюдения этических норм, что соответствует современным требованиям к проведению экспериментов. Используемая выборка обеспечивала не менее 6 наблюдений на каждую контрольную точку, что является минимально необходимым условием для проведения достоверного статистического анализа и получения статистически значимых результатов. Группы были сформированы следующим образом:
- контрольная группа (n=18) получала инъекцию плацебо (вода для инъекций) на 2 и 7 сут после моделирования патологии;
- экспериментальная группа (n=18) получала инъекцию исследуемого препарата плазмиды pCMV-VEGF165 на 2 и 7 сут после моделирования патологии;
- интактная группа (n=6) — животные, не подвергшиеся холодовому воздействию.
На 2 и 7 сут после моделирования отморожения крысам в экспериментальной группе в края раны (паравульнарно) вводили раствор 60 мкг препарата плазмиды pCMV-VEGF165 в 0,1 мл воды для инъекций: по 0,025 мл в четыре точки — справа, слева, сверху и снизу от раны на расстоянии 2 мм под углом 45º иглой 30G (0,3×4 мм). Расчет дозы препарата для локального введения осуществляли с учетом различий метаболизма человека и лабораторных грызунов6. Крысам контрольной группы в те же сроки (2 и 7 сут) аналогичным способом вводили воду для инъекций в эквиобъемных количествах (по 0,025 мл в каждую точку).
В ходе исследования на 1, 2, 3, 7, 10, 14, 21, 28 и 60 сут после моделирования патологии у животных регистрировали изменения в общем состоянии и проявление клинических признаков отморожения с оценкой ранозаживляющего действия исследуемого препарата. Животных осматривали в клетке и на открытой площадке для выявления наличия патологических симптомов и тяжести общего состояния, а также описывали локальный статус места, подвергшегося воздействию низкой температуры, по следующим параметрам: изменение цвета кожных покровов, наличие пузырей с характеристикой их содержимого; оценивали степень отека мягких тканей, наличие и размеры зоны некроза, наличие нарушений чувствительности (болевой, тактильной и температурной) и движений.
Место отморожения осматривали и фотографировали на 1, 2, 3, 7, 10, 14, 21 и 28 сут после моделирования патологии. Конечность животного размещали поверх миллиметровой бумаги, использующейся в качестве постоянной площади для стандартизации размера раны, чтобы гарантировать точность последующего контурного количественного анализа. Область раневой поверхности определяли путем прослеживания края раны с помощью компьютерной мыши с высоким разрешением в программе QuPath 0.5.1 [11].
Скорость заживления ран в каждый момент времени, зафиксированный на изображении, рассчитывали по формуле (1):
 . (1)
. (1)
Массу тела животного регистрировали дважды: при формировании экспериментальных групп непосредственно перед началом эксперимента и некропсией.
Также на 10, 21 и 60 сут случайным образом были отобраны по 6 крыс из контрольной и экспериментальной групп. У выбранных животных после наркотизации (Ксила 5 мг/кг + Золетил 10 мг/кг внутрибрюшинно) отбирали кровь из левого желудочка сердца для биохимического исследования, затем их подвергали эвтаназии (обескровливание). Кровь собирали в пробирки без антикоагулянта и центрифугировали после свертывания для получения сыворотки. Сыворотку замораживали и хранили при температуре от –15 до –25 °С до проведения биохимического анализа. В сыворотке крови с помощью автоматического биохимического анализатора MNCHIP Celercare V5 (Китай) с использованием соответствующих для каждого параметра наборов реагентов определяли активность аланиновой трансаминазы (АЛТ), аспарагиновой трансаминазы (АСТ), креатинкиназы, уровни общего билирубина, общего белка, глюкозы, креатинина, мочевины, концентрацию ионов калия (K+). Выбор критериев для биохимического анализа основан на клинических рекомендациях по лечению пациентов с общим переохлаждением и/или отморожениями7, анализ проведен с целью определения тяжести состояния и выявления осложнений.
При некропсии исследовали внешнее состояние тел с регистрацией всех отклонений от нормы. У каждого вскрытого животного были дезартикулированы обе нижние конечности на уровне голеностопных суставов. Определяли массу каждой конечности. Дизайн эксперимента представлен на рисунке 1 (опубликован на сайте журнала)8.
Статистическая обработка данных. Для проверки нормальности распределения использовался критерий Шапиро–Уилка. В случае нормального распределения данные представляли в виде среднего значения и стандартного отклонения (M±SD), а при ненормальном распределении вычисляли медиану и межквартильный интервал (Ме [ Q1; Q3], где Q1 — 25%, Q3 — 75%). Для анализа межгрупповых различий применяли как параметрические, так и непараметрические методы в зависимости от типа распределения. При нормальном распределении для сравнения двух выборок использовали критерий Стьюдента, а для более чем двух выборок — методы дисперсионного анализа с проверкой равенства дисперсий и последующими апостериорными тестами. Если распределение было ненормальным, применяли U-тест Манна–Уитни для двух независимых выборок, тест Уилкоксона для двух зависимых выборок, а для множественных сравнений использовали H-тест Краскела–Уоллиса (для независимых выборок) или тест Фридмана (для зависимых выборок) с корректировкой уровня значимости. Различия считали статистически значимыми при уровне p<0,059. Статистический анализ проводили с использованием программ IBM SPSS Statistics 26 и Microsoft Excel 2010.
РЕЗУЛЬТАТЫ
Общее состояние животных и скорость заживления раневой поверхности
После снятия охлажденного магнита отмечалась выраженная бледность кожи дистального отдела левой задней конечности, наибольшее побледнение наблюдалось в зоне непосредственного контакта с холодом (рис. 2). Пассивные движения в межфаланговых и плюснефаланговых суставах пораженной конечности были невозможны, движения в голеностопном суставе ограничены. Наблюдаемая клиническая картина характера для дореактивного периода местной холодовой травмы10.
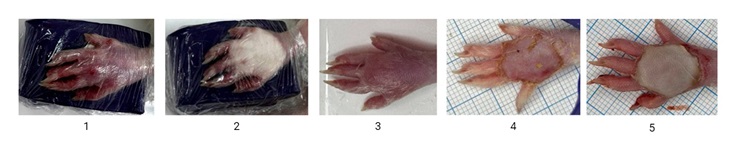
Фотографии выполнены авторами / The photos are taken by the authors
Рис. 2. Моделирование отморожения дистального отдела задней левой конечности у крыс. 1 — фиксация лапы на магните до криовоздействия; 2 — вид конечности непосредственно после нанесения охлажденного магнита; 3 — вид конечности через 15 мин после отогревания при комнатной температуре; 4 — вид конечности спустя 24 ч после криовоздействия; 5 — вид конечности спустя 48 ч после криовоздействия
Fig. 2. Modelling of frostbite in the left hind paw in rats, with paw photos taken after paw fixation to a magnet before application of a frozen magnet (1); immediately after removal of the frozen magnet (2); after 15 minutes of warming at room temperature (3); 24 hours after exposure to cold (4); 48 hours after exposure to cold (5)
Через 15 мин после снятия охлажденного магнита наблюдались признаки отогревания тканей (ранний реактивный период). Отмечалось нарастание гиперемии кожных покровов пораженной конечности. На фоне выраженной гиперемии с цианотичным оттенком наблюдалось быстрое нарастание отека. Отек увеличивался в течение 1,5 сут, однако зона отека ограничивалась голеностопным суставом, не распространяясь на более проксимальные отделы конечности. Участок кожи, находившийся непосредственно под охлажденным магнитом, приобрел темно-фиолетовую окраску. Болевая, тактильная и температурная чувствительность в зоне холодового воздействия отсутствовала.
Размеры раны у животных контрольной и экспериментальной групп на 1 сут не имели достоверных различий и составляли в среднем 1,01±0,25 см². Площадь раневой поверхности в каждой группе в контрольные периоды наблюдения (1, 2, 3, 7, 10, 14, 21, 28 сут) после моделирования отморожения представлена в таблице 1.
Таблица 1. Площадь раневой поверхности на пораженной конечности у крыс после моделирования отморожения
Table 1. Wound area on the injured limb in rats after frostbite modelling
Сутки наблюдения Оbservation day | Количество животных в каждой группе Number of animals per group | Площадь раневой поверхности, см² Wound area, cm² | |
Контрольная группа Control group | Экспериментальная группа Test group | ||
1 | 18 | 1,00±0,22 | 1,02±0,28 |
2* | 18 | 1,15±0,24 | 1,31±0,29 |
3 | 18 | 1,17±0,26 | 1,24±0,34 |
7* | 18 | 0,79 [0,70; 1,09] | 0,71±0,24 |
10 | 18 | 0,65±0,19 | 0,53±0,21 |
14 | 12 | 0,49±0,19 | 0,42±0,21 |
21 | 12 | 0,17±0,17 | 0,13±0,15 |
28 | 6 | 0,05±0,03 | 0,04 [0,01; 0,24] |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Данные представлены в виде среднего значения и стандартного отклонения (M±SD) в случае нормального распределения или медианы и межквартильного интервала (Ме [Q1; Q3]) при ненормальном распределении.
* Локальное введение препарата плазмиды pCMV-VEGF165 (экспериментальная группа) или плацебо (контрольная группа).
Note. The data are presented as the mean and standard deviation (M±SD) values for normal distributions and as the median and interquartile range (Me [Q1; Q3]) values for abnormal distributions.
* Local administration of the pCMV-VEGF165 plasmid product (test group) or placebo (control group).
На 1 сут после криовоздействия пораженная конечность была отечна и имела розово-синюшную окраску. Отек ограничивался голеностопным суставом. Движения в суставах стопы были резко ограничены из-за отека. По центру тыльной поверхности плюсны определялся раневой дефект округлой формы темно-фиолетового цвета с отслоенным эпидермисом, обеднением волосяного покрова в области раны, участками белесоватого струпа по краям раны. Не отмечалось образования пузырей или экссудации.
На 2 сут отмечалось увеличение раневого дефекта в среднем на 20% относительно 1 сут. Пораженная конечность была отечна. На тыльной поверхности плюсны наблюдался участок серо-голубого цвета, соответствующий месту контакта с охлажденным магнитом — глубокий некроз кожи с образованием белесоватого струпа, без экссудации. В пределах раневой поверхности отмечалась утрата волосяного покрова. Наблюдались чувствительные нарушения в виде грубой гипестезии в пальцах стопы до полной анестезии в зоне раневой поверхности. По периферии раневого дефекта наблюдался воспалительный валик с формированием зон демаркации, локальное отслоение струпа по краям раны, умеренно кровоточащее. Клиническая картина соответствовала позднему реактивному периоду местной холодовой травмы.
Отсутствие пузырей при наличии резкого отека, потери всех видов чувствительности и образования некротического струпа в течение 48 ч указывает на IV степень отморожения11.
Исследуемый препарат и плацебо впервые вводили животным на 2 сут после моделирования отморожения. Динамика заживления раневого дефекта в экспериментальных группах представлена на рисунке 3 и в таблице 2 (опубликована на сайте журнала12). Клиническая картина на 3 сут после моделирования патологии соответствовала позднему реактивному периоду местной холодовой травмы, достоверных различий выявлено не было. Характерные примеры заживления ран в группах контроля и исследуемого препарата представлены на рисунке 4.
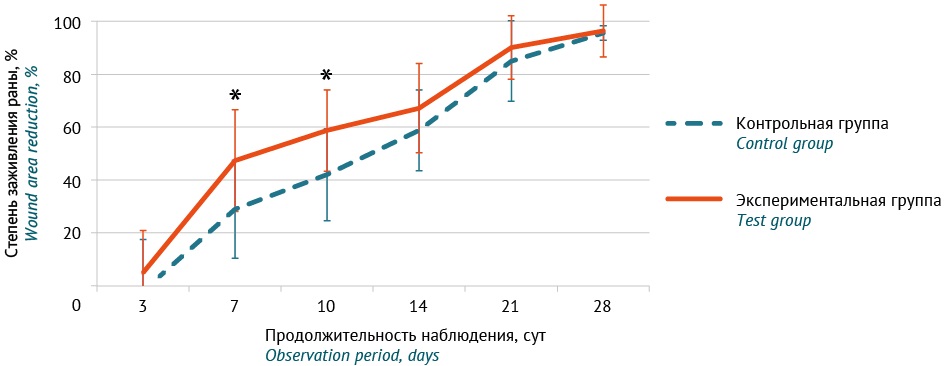
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 3. Динамика заживления раневой поверхности на пораженной конечности у крыс после моделирования отморожения и локального введения препарата плазмиды pCMV-VEGF165 (экспериментальная группа) или плацебо (контрольная группа). * Уровень значимости р<0,05 при сравнении с результатами группы контроля, t-критерий Стьюдента для независимых выборок при нормальном распределении данных, U-критерий Манна–Уитни при распределении отличном от нормального
Fig. 3. Limb wound healing in rats as a function of time after frostbite modelling and local administration of the pCMV-VEGF165 product (test group) or placebo (control group). * p<0.05 compared with the control group (using Student’s t-test for independent samples with normal data distribution and the Mann–Whitney U-test for samples with a non-normal distribution)

Рис. 4. Характерные примеры заживления раневой поверхности на пораженной конечности у крыс после моделирования отморожения и локального введения препарата плазмиды pCMV-VEGF165 (экспериментальная группа) или плацебо (контрольная группа)
Fig. 4. Typical examples of limb wound healing in rats after frostbite modelling and local administration of the pCMV-VEGF165 plasmid product (test group) or placebo (control group)
Начиная с 7 сут отмечалась статистически достоверная более быстрая регенерация тканей у животных в группе, получавшей препарат плазмиды pCMV-VEGF165, по сравнению с плацебо. К 7 сут в группе исследуемого препарата наблюдали уменьшение площади раневой поверхности в среднем на 47%, в то время как в группе контроля — в среднем на 29%.
При осмотре на 7 сут пораженная конечность у крыс в обеих группах была нормальной окраски, сохранялась пастозность мягких тканей. В зоне местного холодового повреждения отмечался сухой некроз тыльной поверхности стопы с четкими краями, сформированной зоной демаркации. Волосяной покров в пределах раны отсутствовал. У части животных отмечалось частичное отхождение струпа. В дне раны были видны сухожилия пальцев стопы. Рана не кровоточила. Активной экссудации не наблюдалось.
В группе контроля грануляция тканей под струпом ткани была вялой, наблюдались наложения фибрина, тогда как в группе, получавшей препарат плазмиды pCMV-VEGF165, ткани под струпом и по краям раны активно гранулировали. Наблюдаемая клиническая картина на 7 сут после моделирования патологии соответствовала восстановительному периоду местной холодовой травмы.
На 7 сут после моделирования отморожения повторно вводили паравульнарно исследуемый препарат и плацебо.
К 10 сут после криовоздействия на тыльной поверхности плюсны пораженной стопы у животных в обеих группах наблюдался участок сухого некроза, однако, в отличие от 7 сут, у животных как в экспериментальной, так и контрольной группах отмечалось угасание грануляций. Появились участки краевой эпителизации. Линия демаркации сохранялась. Волосяной покров в границах раны отсутствовал. Отмечались нарастание отека конечности и тенденция к расширению зоны некроза на прилежащие ткани как по площади, так и по глубине: некротический процесс затрагивал сухожилия в дне раны. Конечность была бледная, с синюшным оттенком.
При оценке скорости заживления раневого дефекта на 10 сут сохранялась достоверность различий в темпах регенерации поврежденных тканей в группах. Регенерация тканей в группе исследуемого препарата была достоверно более быстрой, чем у животных в контрольной группе: уменьшение зоны раневой поверхности относительно показателей 2 сут в среднем составило 59 и 42% соответственно.
На 14 сут после холодовой травмы у большинства животных в обеих группах рана очистилась от некротизированных тканей (83% в экспериментальной группе, 58% в группе контроля, статистический анализ с использованием точного критерия Фишера не выявил значимых различий между группами p>0,05). Наблюдались вялые краевые грануляции с небольшой экссудацией. Дно раны было образовано сухожилиями с налетом фибрина. Отек конечности значительно уменьшился, сохранялась пастозность. Пораженная конечность была бледно-розовой окраски с синюшным оттенком. У животных в группе, получавшей препарат плазмиды pCMV-VEGF165, грануляции были более выраженными, наблюдались участки краевой эпителизации. По сравнению со 2 сут наблюдения раневой дефект был закрыт в среднем на 67%, в то время как в группе контроля наблюдалось уменьшение раневой поверхности на 59%, однако различия не были статистически достоверными.
Через 21 сут после криовоздействия отмечалось уменьшение размеров раны в среднем на 85% в группе контроля и на 90% в экспериментальной группе. Площадь раневого дефекта тыльной поверхности плюсны составляла 0,17±0,17 см2 в группе контроля и 0,13±0,15 см2 в группе, получавшей препарат плазмиды pCMV-VEGF165, однако различия не были статистически достоверными. Сохранялась пастозность пораженной конечности у крыс в обеих группах, рана заживала путем краевой эпителизации и контракции окружающей кожи. Волосяной покров в зоне эпителизации отсутствовал.
К 28 сут наблюдения отмечалось полное или практически полное заживление раны: на 95,57±2,74% в группе контроля и 96,38% [ 79,52; 99,31] в группе исследуемого препарата. Конечность была нормальной бледно-розовой окраски, несколько пастозна, волосяной покров в зоне эпителизации отсутствовал. Клиническая картина соответствовала завершению восстановительного периода патогенеза местной холодовой травмы и началу периода отдаленных последствий. Достоверных различий в показателях между группами зафиксировано не было.
К 60 сут после моделирования холодовой травмы у животных в обеих группах наблюдались лишь слабо заметные рубцы на тыльной поверхности дистальных отделов левых задних лап. Также следует отметить, что у 5 (28%) животных контрольной группы и 2 (11%) животных из экспериментальной группы в период между 3 и 10 сут наблюдения развился некроз фаланг пальцев стопы, что, вероятно, связано с развитием ишемии. Отношение шансов (OR) развития некроза в контрольной группе по сравнению с экспериментальной составило 3,08 (95% ДИ: 0,51–18,50).
Динамика массы тела животных
Показатели массы тела животных контрольной и экспериментальной групп в контрольные точки измерений представлены в таблице 3 (опубликована на сайте журнала13). На момент начала эксперимента масса крыс составляла в среднем 275,72±16,54 г. На 10 сут наблюдалось статистически значимое снижение массы тела крыс в обеих группах относительно данных на начало эксперимента. Снижение массы тела было более выражено у животных контрольной группы, чем группы исследуемого препарата, однако различия не были статистически достоверными. На 21 сут не наблюдалось значимых различий между массой тела крыс до отморожения в обеих группах.
К последней некропсии (60 сут) животные обеих экспериментальных групп отличались достоверно большим весом по сравнению с днем начала эксперимента. В группе исследуемого препарата в среднем наблюдалась значительная прибавка в весе: вес животных увеличился в среднем на 10%, в то время как у животных контрольной группы — на 6%. Вероятно, более быстрая регенерация раневого дефекта, а также снижение тяжести отсроченных осложнений положительно сказались на общем состоянии животных группы, получавших препарат плазмиды pCMV-VEGF165. Однако различия в показателях массы на 60 сут наблюдения между группами не имели статистической достоверности.
Биохимические показатели крови
При анализе ключевых параметров (уровни глюкозы, общего белка, билирубина) статистически достоверной разницы между группами не отмечалось. Показатели активности АЛТ и АСТ статистически достоверно различались у крыс обеих групп (табл. 4, опубликована на сайте журнала14), однако оно не имело клинической значимости (показатели были в пределах нормы для животных данного пола и возраста).
На 10 сут эксперимента в группах с отморожением конечности по сравнению с интактными животными было отмечено статистически достоверное увеличение сывороточных концентраций мочевины и креатинина. На 21 сут высокий уровень мочевины сохранялся, а уровень креатинина снижался до показателей интактных животных. Также обращает на себя внимание тенденция к нарастанию концентрации ионов калия в сыворотке крови к 21 сут эксперимента в группе контроля — его уровень составил 5,26±0,58 против 4,59±0,41 ммоль/л в экспериментальной группе.
Статистически достоверной разницы активности креатинкиназы у интактных животных и в группе контроля не наблюдалось, тогда как в группе исследуемого препарата как на 10, так и на 21 сут эксперимента отмечалось статистически значимое снижение указанного показателя более чем в 3,7 и 2 раза соответственно относительно результатов как интактной, так и контрольной групп.
Патоморфологическое исследование
При проведении некропсии не было выявлено видимых патологий внутренних органов ни у одного из исследуемых животных. Волосяной покров в областях, не подвергавшихся воздействию охлажденного магнита, имел нормальный вид, без признаков патологического облысения, кожа оставалась эластичной, тургор нормальным.
У крыс, подвергнутых некропсии на 10 сут эксперимента, на тыльной стороне дистальных отделов задних левых конечностей определялась округлая рана, покрытая коричневатым струпом различной плотности. В случае отделения струпа дно раны выполнено пястными костями и тыльными межкостными мышцами, что соответствовало IV степени отморожения. У животных в группе контроля ткани под струпом гранулировали вяло, наблюдались наложения фибрина, в отличие от группы исследуемого препарата, где ткани под струпом и по краям раны активно гранулировали.
При взвешивании ампутированных задних лап (табл. 5, опубликована на сайте журнала15) выявлено статистически значимое повышение массы конечностей, подвергнутых криовоздействию, относительно интактных конечностей за счет отека (2,12±0,15 против 1,67±0,10 г, p<0,05, в группе контроля и 2,31±0,29 против 1,85±0,21 г, p<0,05, в группе животных, получавших препарат плазмиды pCMV-VEGF165). При этом достоверных различий между массой лап, подвергнутых криовоздействию, контрольной и экспериментальных групп не было.
У крыс, подвергнутых некропсии на 21 сут, значительных макроскопических различий между группами отмечено не было. На тыльной стороне дистальных отделов задних левых конечностей животных как в экспериментальной, так и контрольной группах, в половине случаев определялся плотноватый рубец без четких границ с нарушением волосяного покрова; во второй половине наблюдений в том же месте определялась небольшая округлая рана с плотным, хорошо фиксированным темно-коричневым струпом. У животных в обеих группах на 21 сут так же, как и у крыс, подвергнутых некропсии на 10 сут, отмечались достоверные различия в массе интактных лап и лап после криовоздействия: 1,66±0,10 против 1,91±0,18 г, р<0,05, в группе контроля; 1,75±0,09 против 2,09±0,22 г, р<0,05, в экспериментальной группе. Однако статистически значимых различий массы конечностей крыс контрольной и экспериментальной групп, подвергнутых криовоздействию, выявлено не было (р>0,05).
Макроскопические изменения лап животных на 60 сут характеризовались слабо заметными рубцами на тыльной поверхности левых стоп. Масса лап, подвергнутых криовоздействию, достоверно отличалась от интактных в обеих группах (1,85±0,13 против 1,66±0,082 г, р<0,05, в группе контроля; 1,89±0,12 против 1,72±0,07 г, р<0,05, для экспериментальной группы), однако между группами значимых различий выявлено не было.
ОБСУЖДЕНИЕ
Экспериментальная модель контактного повреждения, вызванного плотным прикладыванием охлажденного магнита (–196 °C) к коже тыльной поверхности левой стопы крыс в течение 1 мин, приводит к формированию местной холодовой травмы IV степени, что подтверждается результатами клинического осмотра: отсутствие пузырей при наличии резкого отека, потеря всех видов чувствительности и образование некротического струпа в течение 48 ч после криовоздействия, а также визуализация сухожилий пальцев стопы в дне раны после отхождения струпа. Характер течения моделируемого патологического процесса соответствует типичным для холодовой травмы периодам16:
1-й период — дореактивный, от момента снижения температуры тканей под действием низкой температуры до начала согревания тканей;
2-й период — ранний реактивный, после согревания тканей (через 10–15 мин после окончания криовоздействия) и до восстановления кровообращения, продолжается до 48 ч;
3-й период — поздний реактивный, со 2 до 7 сут;
4-й период — восстановительный, с 7 сут до полного восстановления кожного покрова (до 21–28 сут);
5-й период — отдаленных последствий, после восстановления кожного покрова (с 28 сут).
В настоящем исследовании впервые проведена экспериментальная проверка гипотезы о терапевтической эффективности стимуляции ангиогенеза при коррекции последствий отморожений с использованием локального введения препарата на основе генетической конструкции — плазмиды pCMV-VEGF165. Полученные данные на крысиной модели местной холодовой травмы демонстрируют перспективность данного подхода, открывая новые возможности для разработки инновационных методов лечения повреждений, вызванных воздействием низких температур.
Крысы являются релевантной моделью для изучения эффектов человеческого VEGF165, учитывая высокую степень сходства аминокислотных последовательностей и консервативность биологических функций VEGF. Сравнение аминокислотных последовательностей показывает, что человеческий VEGF165 и крысиный VEGF164 имеют до 90% идентичности. Человеческий VEGF165 состоит из 191 аминокислоты17. Крысиный VEGF164 состоит из 190 аминокислот18. Последовательности cигнального пептида (первые 26 аминокислот) идентичны у крысы и человека. Зрелый белок в обоих случаях начинается с аминокислоты 27 (Ala) после удаления сигнального пептида. Основные функциональные домены VEGF (например, участки связывания с рецепторами VEGFR1 и VEGFR2) высококонсервативны между видами. Активность VEGF (ангиогенез, стимуляция пролиферации эндотелиальных клеток) сохраняется у разных видов, включая крыс и человека [12][13]. Исследования на крысах с использованием человеческого VEGF165 демонстрируют схожие эффекты в стимуляции ангиогенеза и регенерации тканей, что подтверждает релевантность модели [14][15]. Использование крыс в качестве модели для изучения VEGF165 человека имеет высокий трансляционный потенциал, так как результаты таких исследований могут быть экстраполированы на клинические испытания у людей [16].
В результате настоящего исследования было показано, что двукратное (на 2 и 7 сут после моделирования повреждения) паравульнарное введение исследуемого препарата плазмиды pCMV-VEGF165 в дозе 60 мкг (в 100 мкл воды для инъекций) достоверно снижает тяжесть течения моделированной патологии и улучшает исход холодовой травмы. По результатам клинического осмотра применение исследуемого препарата уже начиная с 7 сут приводило к статистически достоверной более быстрой регенерации тканей по сравнению с группой, получавшей плацебо: отмечено уменьшение площади раневой поверхности в среднем на 47%, в то время как в группе контроля раневой дефект снизился в среднем на 29%. Ускорение процессов репарации в группе исследуемого препарата обусловлено его стимулирующим влиянием на развитие грануляционной ткани, при осмотре отмечалась более активная грануляция тканей под струпом и по краям раны в группе pCMV-VEGF165.
Также следует отметить, что исследуемый препарат плазмиды pCMV-VEGF165 способствовал снижению риска развития некроза фаланг пальцев стопы. Отношение шансов (OR) развития некроза в контрольной группе по сравнению с экспериментальной составило 3,08 (95% ДИ: 0,51–18,50). Это указывает на тенденцию к снижению риска развития некроза в группе исследуемого препарата, однако различия не достигли статистической значимости. Таким образом, исследуемый препарат может оказывать положительное влияние на снижение частоты некроза, но для подтверждения этого вывода требуется проведение дополнительных исследований с бóльшим объемом выборки.
Отсутствие статистически достоверных различий в клинических показателях между группами в более поздние сроки (14, 21, 28 сут), вероятно, связанно с особенностями заживления ран в моделях на грызунах посредством контракции, поскольку рыхлая окружающая кожа способствует быстрому уменьшению размеров раневого дефекта у крыс [7][17]. В настоящем исследовании наблюдали заживление ран у экспериментальных животных путем краевой эпителизации и контракции окружающей кожи. В отличие от этого, заживление раны у человека происходит главным образом из-за пролиферации нового эпителия по краям раны [18]. Таким образом, клиническое использование препарата плазмиды pCMV-VEGF165 у человека, вероятно, сократит период заживления местной холодовой травмы [6].
Данное предположение находит подтверждение в исследовании клинического применения препарата «Неоваскулген®» off-label при лечении отморожения стопы левой нижней конечности II–III степени у пациента с угрозой дезартикуляции большого, где на конкретном примере из реальной клинической практики показана возможность включения реваскуляризирующей генотерапии в комплекс лечебных мероприятий у пациента с отморожением стопы II–III степени [6]. По мнению авторов, применение этого препарата способствовало сокращению сроков стационарного лечения и реабилитации по сравнению со стандартным протоколом лечения при аналогичных отморожениях и позволило избежать необходимости проведения инвалидизирующей операции.
В настоящем исследовании отмечено статистически значимое снижение массы тела в обеих группах на 10 сут. Вероятно, симптомы общей интоксикации, а также наличие раневого дефекта, обуславливающего ограничение движений в пораженной конечности и снижение общей активности, провоцировали отказ от пищи у экспериментальных животных и потерю мышечной массы. К моменту второй некропсии (21 сут) не наблюдалось значимых различий между массой тела крыс в исследуемых группах. Улучшение общего самочувствия, а также закрытие раневого дефекта, вероятно, позволили восполнить ранее развившийся дефицит массы тела.
С целью оценки тяжести состояния и выявления возможных осложнений в рамках данного исследования был проведен биохимический анализ крови животных, перенесших отморожение. Выбор критериев для биохимического анализа был основан на клинических рекомендациях по лечению пациентов с общим переохлаждением и/или отморожениями. Анализ результатов биохимических показателей крови свидетельствует о благоприятном профиле безопасности исследуемого препарата.
Наблюдаемую динамику представленных биохимических показателей можно объяснить следующим образом: отморожение способствует развитию повреждений и снижению массы мышечной ткани, нарушению функции почек, а также катаболизму белка [19][20]. Применение препарата плазмиды pCMV-VEGF165 на 2 и 7 сут эксперимента приводит к менее выраженным негативным последствиям со стороны указанных органов, тканей и систем ввиду уменьшения объема повреждения мышечной ткани и замедления катаболических процессов19.
Снижение активности креатинкиназы у крыс в группе исследуемого препарата pCMV-VEGF165 можно объяснить, вероятно, уменьшением активности животного при отморожении. Высокий уровень креатинкиназы в группе контроля (сопоставимый с показателями интактных животных) может свидетельствовать о непосредственном повреждении мышц в области нанесения холодовой травмы, а низкий уровень этого фермента в группе животных, получавших исследуемый препарат, — о потенциальном защитном эффекте при экспериментальном отморожении [21]. Однако следует отметить достаточно большой разброс данных, что говорит о необходимости проведения дополнительных исследований с бо́льшим числом наблюдений.
Таким образом, исходя из проведенного анализа клинических наблюдений, тенденций заживления повреждений и лабораторных данных, а также результатов некропсии, можно сделать обоснованный вывод о положительном воздействии локального введения генетической конструкции pCMV-VEGF165 при коррекции экспериментальной холодовой травмы.
ЗАКЛЮЧЕНИЕ
Применение исследуемой генетической конструкции плазмиды pCMV-VEGF165 в дозе 60 мкг (в 100 мкл воды для инъекций) при двукратном (на 2 и 7 сут после моделирования повреждения) паравульнарном (по 0,025 мл справа и слева, сверху и снизу от раны на расстоянии 2 мм) введении крысам по результатам клинического осмотра, анализа динамики заживления, лабораторных данных и результатов некропсии способствует снижению степени некроза, вероятности спонтанных ампутаций, ускоряет процессы эпителизации и формирование рубцовой ткани.
Для обоснования гипотезы о терапевтическом ангиогенезе в дальнейшем необходимо углубить изучение молекулярных механизмов действия препарата плазмиды pCMV-VEGF165, включая анализ экспрессии гена VEGF и активации ангиогенных сигнальных путей, что позволит подтвердить биологическую активность конструкции. Важно оценить степень неоваскуляризации в области раны с использованием гистологических и визуализационных методов, чтобы напрямую связать наблюдаемые эффекты заживления с усилением ангиогенеза. Для повышения эффективности и минимизации потенциальных побочных эффектов необходимы дополнительные исследования по оптимизации дозировки и режима введения, а также долгосрочные наблюдения для более полной оценки безопасности препарата. Эти шаги помогут не только уточнить механизмы действия препарата плазмиды pCMV-VEGF165, но и подготовить научную базу для перехода к клиническим испытаниям, открывая новые возможности для применения терапевтического ангиогенеза в регенеративной медицине.
Дополнительная информация. Рисунок 1 и таблицы 2–5 размещены на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2025-13-2-198-212-fig-tabl
Additional information. Figure 1 and tables 2–5 are posted on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2025-13-2-198-212-fig-tabl
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: О.В. Щеблыкина — дизайн исследования, проведение экспериментальной работы, статистическая обработка и анализ данных, написание текста рукописи; Д.А. Костина — дизайн исследования, проведение экспериментальной работы, интерпретация полученных данных, написание текста рукописи; В.В. Архипов — идея и дизайн экспериментального исследования, интерпретация результатов, формулировка выводов; Е.А. Патраханов — проведение экспериментальной работы, подготовка графических материалов; А.А. Должиков — анализ данных литературы и нормативных документов, критический пересмотр содержания рукописи; В.В. Гуреев — интерпретация результатов, критический пересмотр содержания рукописи; Н.И. Жернакова — экспертный анализ результатов, доработка текста рукописи; О.А. Осипова — экспертный анализ и интерпретация результатов; М.В. Покровский — дизайн и планирование эксперимента, общее научное руководство, анализ полученных результатов, утверждение окончательного варианта рукописи для публикации.
Соответствие принципам этики. Исследование было одобрено локальным этическим комитетом НИУ «БелГУ» НИИ Фармакологии живых систем (протокол заседания от 18.03.2024 № 03/24)
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Olesya V. Shcheblykina designed the study, conducted the experiments, performed statistical processing and analysis of the data obtained, and drafted the manuscript. Daria A. Kostina designed the study, conducted the experiments, interpreted the data obtained, and drafted the manuscript. Vladimir V. Arkhipov conceived the main idea of the study, designed the study, interpreted the results, and formulated the conclusions. Evgeny A. Patrakhanov conducted the experiments and prepared the graphical materials. Aleksandr A. Dolzhikov analysed literature data and regulatory documents and critically revised the manuscript. Vladimir V. Gureev interpreted the results and critically revised the manuscript. Nina I. Zhernakova carried out an expert analysis of the results and finalised the manuscript. Olga A. Osipova carried out an expert analysis of the results and interpreted the results. Mikhail V. Pokrovskii designed and planned the experiments, provided general scientific guidance, analysed the results obtained, and approved the final version of the manuscript for publication.
Ethics approval. The Bioethics Committee of the Research Institute of Pharmacology of Living Systems, Belgorod State National Research University, approved the study under meeting minutes No. 03/24 of 18 March 2024.
1. Отморожение. Гипотермия. Другие эффекты воздействия низкой температуры. Клинические рекомендации. Минздрав России; 2021.
2. Там же.
3. Инструкция по медицинскому применению лекарственного препарата «Неоваскулген®».
4. Рекомендация Коллегии Евразийской экономической комиссии от 14.11.2023 № 33 «О Руководстве по работе с лабораторными (экспериментальными) животными при проведении доклинических (неклинических) исследований».
5. Инструкция по медицинскому применению лекарственного препарата «Неоваскулген®».
6. Крылов А.А. Современные подходы к лечению пациентов с критической ишемией нижних конечностей атеросклеротического генеза при фоновом сахарном диабете: дисс. … канд. мед. наук. Рязань; 2018.
7. Отморожение. Гипотермия. Другие эффекты воздействия низкой температуры. Клинические рекомендации. Минздрав России; 2024.
8. https://doi.org/10.30895/2312-7821-2025-13-2-198-212-fig-tabl
9. Гланц С. Медико-биологическая статистика. М.: Практика; 1999.
10. Отморожение. Гипотермия. Другие эффекты воздействия низкой температуры. Клинические рекомендации. Минздрав России; 2024.
11. Отморожение. Гипотермия. Другие эффекты воздействия низкой температуры. Клинические рекомендации. Минздрав России; 2024.
12. https://doi.org/10.30895/2312-7821-2025-13-2-198-212-fig-tabl
13. https://doi.org/10.30895/2312-7821-2025-13-2-198-212-fig-tabl
14. https://doi.org/10.30895/2312-7821-2025-13-2-198-212-fig-tabl
15. https://doi.org/10.30895/2312-7821-2025-13-2-198-212-fig-tabl
16. Отморожение. Гипотермия. Другие эффекты воздействия низкой температуры. Клинические рекомендации. Минздрав России; 2024.
17. UniProt ID: P15692.
18. UniProt ID: P16612.
19. Демидюк ДИ, ред. Helixbook. Справочник по медицинским лабораторным исследованиям. М.: Практическая медицина; 2016.
Список литературы
1. Rodway GW, Cochran A, Giesbrecht GG, McDevitt M, Imray CH, Johnson EL et al. Wilderness Medical Society Clinical practice guidelines for the prevention and treatment of frostbite: 2019 update. Wilderness Environ Med. 2019;30(4S):S19–S32. https://doi.org/10.1016/j.wem.2019.05.002
2. Murphy JV, Banwell PE, Roberts AH, McGrouther DA. Frostbite: Pathogenesis and treatment. J Trauma. 2000;48(1):171–8. https://doi.org/10.1097/00005373-200001000-00036
3. Михайличенко МИ, Фигурский СА, Мудров ВА, Доржеев ВВ, Михайличенко ЮВ, Шаповалов КГ. Рабдомиолиз в патогенезе местной холодовой травмы. Тромбоз, гемостаз и реология. 2023;4:68–74. https://doi.org/10.25555/THR.2023.4.1079
4. Shcheblykin DV, Bolgov AA, Pokrovskii MV, Stepenko JV, Tsuverkalova JM, Shcheblykina OV, et al. Endothelial dysfunction: Developmental mechanisms and therapeutic strategies. Research Results in Pharmacology. 2022;8(4):115–39. https://doi.org/10.3897/rrpharmacology.8.80376
5. Wang W, Liu P, Zhu W, Li T, Wang Y, Wang Y, et al. Skin organoid transplantation promotes tissue repair with scarless in frostbite. Protein Cell. 2024;4:pwae055. https://doi.org/10.1093/procel/pwae055
6. Ищенко РВ, Фисталь ЭЯ, Филимонов ДА, Покровский МВ, Архипов ВВ, Налетов СВ и др. Применение препарата Неоваскулген off-label при лечении отморожения стопы II–III степени: клинический случай. Безопасность и риск фармакотерапии. 2024;12(4):409–19. https://doi.org/10.30895/2312-7821-2024-429
7. Aizawa T, Kuwabara M, Kubo S, Aoki S, Azuma R, Kiyosawa T. Protective effect of extract of Ginkgo biloba 761 against frostbite injury in rats. Plast Reconstr Surg. 2019;143(6):1657–64. https://doi.org/10.1097/PRS.0000000000005648
8. Handford C, Buxton P, Russell K, Imray CE, McIntosh SE, Freer L, et al. Frostbite: A practical approach to hospital management. Extrem Physiol Med. 2014;3(1):7. https://doi.org/10.1186/2046-7648-3-7
9. DeGroot DW, Castellani JW, Williams JO, Amoroso PJ. Epidemiology of U.S. Army cold weather injuries, 1980-1999. Aviat Space Environ Med. 2003;74(5):564–70. PMID: 12751587
10. Есина ДД, Филиппова ЕБ, Мургаева НВ. О различиях терморегуляции у лиц разного пола. Известия Российской Военно-медицинской академии. 2022;41(S2):154–6. EDN: NVIBZP
11. Bankhead P, Loughrey MB. Fernández JA, Dombrowski Y, McArt DG, Dunne PD, et al. QuPath: Open source software for digital pathology image analysis. Scientific Reports. 2017;7:16878. https://doi.org/10.1038/s41598-017-17204-5
12. Ferrara N, Davis-Smyth T. The biology of vascular endothelial growth factor. Endocrine Reviews. 1997;18(1):4–25. https://doi.org/10.1210/edrv.18.1.0287
13. Holmes K, Roberts OL, Thomas AM, Cross MJ. Vascular endothelial growth factor receptor-2: Structure, function, intracellular signalling and therapeutic inhibition. Cellular Signalling. 2007;19(10):2003–12. https://doi.org/10.1016/j.cellsig.2007.05.013
14. Klabukov I, Balyasin M, Krasilnikova O, Tenchurin T, Titov A, Krasheninnikov M, et al. Angiogenic modification of microfibrous polycaprolactone by pCMV-VEGF165 plasmid promotes local vascular growth after implantation in rats. Int J Mol Sci. 2023;24(2):1399. https://doi.org/10.3390/ijms24021399.
15. Еремин ПС, Деев РВ, Бозо ИЯ, Дешевой ЮБ, Лебедев ВГ, Еремин ИИ и др. Заживление тканей в области тяжелого местного лучевого поражения кожи при генноопосредованной индукции ангиогенеза препаратом «Неоваскулген». Журнал анатомии и гистопатологии. 2020;9(2):26–34. https://doi.org/10.18499/2225-7357-2020-9-2-26-34
16. Червяков ЮВ, Староверов ИН, Московский ИА, Лончакова ОМ, Истомин АВ. Десятилетние результаты консервативного лечения пациентов с атеросклерозом артерий инфраингвинальной зоны с применением плазмидной генно-инженерной конструкции VEGF165. Кардиология и сердечно-сосудистая хирургия. 2023;16(1):110–7. https://doi.org/10.17116/kardio202316011110
17. Davidson JM. Animal models for wound repair. Arch Dermatol Res. 1998;290(Suppl):S1–11. https://doi.org/10.1007/pl00007448
18. Greenhalgh DG. Models of wound healing. J Burn Care Rehabil. 2005;26:293–305. https://doi.org/10.1097/01.bcr.0000169885.66639.b5
19. Liskutin T, Batey J, Li R, Schweigert C, Mestril R. Increased heat shock protein expression decreases inflammation in skeletal muscle during and after frostbite injury. Curr Mol Med. 2020;20(9):733–40. https://doi.org/10.2174/1566524020666200407083131
20. Михайличенко ММ, Шаповалов КГ, Мудров ВА, Михайличенко СИ, Михайличенко АВ, Ханина ЮС, Михайличенко ЮВ. Преренальное поражение почек у больных с местной холодовой травмой. Acta Biomedica Scientifica. 2022;7(4):62–70. https://doi.org/10.29413/ABS.2022-7.4.7
21. Myles WS, Brown TE. Serum creatine phosphokinase levels in rats following cold injury. International Journal of Biometeorology. 1973;17(2):177–84. https://doi.org/10.1007/bf01809805
Об авторах
О. В. ЩеблыкинаРоссия
Щеблыкина Олеся Викторовна, канд. мед. наук
ул. Победы, д. 85, г. Белгород, 308015
Д. А. Костина
Россия
Костина Дарья Александровна, канд. мед. наук
ул. Победы, д. 85, г. Белгород, 308015
В. В. Архипов
Россия
Архипов Владимир Владимирович, д-р мед. наук, доцент
ул. Победы, д. 85, г. Белгород, 308015
Е. А. Патраханов
Россия
Патраханов Евгений Александрович
ул. Победы, д. 85, г. Белгород, 308015
А. А. Должиков
Россия
Должиков Александр Анатольевич, д-р мед. наук, профессор
ул. Победы, д. 85, г. Белгород, 308015
В. В. Гуреев
Россия
Гуреев Владимир Владимирович, д-р мед. наук, профессор
ул. Победы, д. 85, г. Белгород, 308015
Н. И. Жернакова
Россия
Жернакова Нина Ивановна, д-р мед. наук, профессор
ул. Победы, д. 85, г. Белгород, 308015
О. А. Осипова
Россия
Осипова Ольга Александровна, д-р мед. наук, профессор
ул. Победы, д. 85, г. Белгород, 308015
М. В. Покровский
Россия
Покровский Михаил Владимирович, д-р мед. наук, профессор
ул. Победы, д. 85, г. Белгород, 308015
Дополнительные файлы

|
1. Рисунок 1, таблицы 2–5 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(249KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Щеблыкина О.В., Костина Д.А., Архипов В.В., Патраханов Е.А., Должиков А.А., Гуреев В.В., Жернакова Н.И., Осипова О.А., Покровский М.В. Локальное введение плазмиды pCMV-VEGF165, кодирующей VEGF, стимулирует регенерацию тканей после холодовой травмы у крыс. Безопасность и риск фармакотерапии. 2025;13(2):198-212. https://doi.org/10.30895/2312-7821-2025-13-2-198-212
For citation:
Shcheblykina O.V., Kostina D.A., Arkhipov V.V., Patrakhanov E.A., Dolzhikov A.A., Gureev V.V., Zhernakova N.I., Osipova O.A., Pokrovskii M.V. Local Administration of pCMV-VEGF165 Plasmid Encoding VEGF Stimulates Tissue Regeneration after Cold Injury in Rats. Safety and Risk of Pharmacotherapy. 2025;13(2):198-212. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-2-198-212





































