Перейти к:
Реализация концепции 3Rs при контроле качества биологических препаратов: современное состояние и перспективы (обзор)
https://doi.org/10.30895/2312-7821-2025-13-2-229-240
Резюме
ВВЕДЕНИЕ. В рамках концепции «Replacement, reduction and refinement of animal testing» (3Rs) во многих странах увеличивается количество альтернативных методов без использования животных для исследовательских целей, разработки и контроля качества лекарственных средств. Однако внедрение в перечень испытаний альтернативных методов in vitro вместо методов in vivo при выпуске новых серий биологических лекарственных препаратов, в первую очередь вакцин, является сложной задачей. Процесс интеграции принципов 3Rs в регуляторные и производственные стандарты требует анализа, в том числе с учетом специфики национальных систем.
ЦЕЛЬ. Анализ степени интегрированности принципов 3Rs в процесс контроля качества биологических лекарственных средств в мировой практике и оценка существующих препятствий и возможностей для успешной реализации перехода к контролю качества препаратов без применения животных в Российской Федерации.
ОБСУЖДЕНИЕ. К основным преимуществам биологических методов in vitro по сравнению с in vivo при контроле качества препаратов относятся меньшая вариабельность, более высокая специфичность, сокращение сроков проведения испытаний. Анализ результатов оценки регуляторными органами и производителями лекарственных средств возможностей и препятствий при реализации концепции 3Rs выявил основные аргументы при замене методов in vivo: этический аспект, актуальность сокращения времени тестирования, снижение вариабельности. Интеграция методов in vitro сдерживается недостаточностью информации об альтернативных методах, а также отсутствием гармонизации нормативной базы по внедрению 3Rs. На примере внедрения принципов 3Rs в Европейскую фармакопею показано исключение всех общих испытаний по оценке безопасности биологических лекарственных средств на животных. Всемирной организацией здравоохранения разработано руководство по поэтапному отказу от испытаний на животных для контроля качества биологических продуктов.
ВЫВОДЫ. Основные проблемы интеграции принципов 3Rs заключаются в сложности подтверждения корреляции между методами in vivo и in vitro, в том числе при проведении однозначного сравнения указанных методов, отсутствии гармонизации требований регуляторных органов, а также содействия последних производителям в принятии альтернативных методов. Международная гармонизация нормативных требований необходима для эффективного решения обозначенных проблем и успешного внедрения 3Rs в процедуры контроля качества биологических лекарственных препаратов при выпуске в разных странах, включая Российскую Федерацию.
Ключевые слова
Для цитирования:
Гайдерова Л.А., Алпатова Н.А., Головинская О.В., Гуськов А.М., Липатова Э.К., Лаврова М.Н. Реализация концепции 3Rs при контроле качества биологических препаратов: современное состояние и перспективы (обзор). Безопасность и риск фармакотерапии. 2025;13(2):229-239. https://doi.org/10.30895/2312-7821-2025-13-2-229-240
For citation:
Gaiderova L.A., Alpatova N.A., Golovinskaya O.V., Guskov A.M., Lipatova E.K., Lavrova M.N. Implementation of the 3Rs Concept in Quality Control of Biologicals: Status and Prospects (Review). Safety and Risk of Pharmacotherapy. 2025;13(2):229-239. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-2-229-240
ВВЕДЕНИЕ
Концепция «Replacement, reduction and refinement of animal testing» (3Rs) как методологическая и этическая основа современных исследований на животных получает все большее признание в международном научном сообществе, но степень ее практического применения в разных странах различна [1].
Принципы 3Rs первые были сформулированы в 1959 г. британскими учеными W.M.S. Russell и R.L. Burch [2]. Авторы предложили новый подход к проведению испытаний in vivo (3Rs), позволяющий улучшить обращение с лабораторными животными и повысить качество научных исследований с их использованием. Были введены такие новые термины, как «replacement» (замена), «reduction» (сокращение) и «refinement» (совершенствование), которые впоследствии получили несколько иное толкование и стали широко применяться как стандарты этичного обращения с животными не только в науке, но и при разработке и контроле качества лекарственных средств (ЛС) [3][4].
В настоящее время 3Rs ассоциируются с методами, позволяющими сократить количество животных и минимизировать их потенциальные боль и страдания в биомедицинских исследованиях. В современной интерпретации «замена» — это разработка и внедрение альтернативных методов без использования животных, например биологических методов in vitro, иммуноферментного анализа, физико-химических методов и др.; «сокращение» — это поиск методов, требующих минимального количества лабораторных животных для получения достаточного и воспроизводимого объема данных; «совершенствование» — повышение благополучия животных, сведение к минимуму их боли и страданий посредством применения усовершенствованных технологий [5].
На данный момент испытания in vivo применяются на разных этапах жизненного цикла биологических лекарственных препаратов (БЛП): разработка (оценка биологических свойств и безопасности), внутрипроизводственный, выпускающий, регистрационный и пострегистрационный контроли (оценка критических показателей качества (critical quality attribute, CQA), таких как активность и безопасность) [6][7]. В статье будут рассмотрены в основном вопросы применения принципов 3Rs при контроле на этапах производства и выпуска ЛС.
Важность замены тестов in vivo признана европейскими и международными регуляторными органами. В поддержку реализации программы 3Rs опубликовано несколько нормативных документов1. Методы in vitro считаются более совершенными не только благодаря своей высокой специфичности и точности, но и за счет меньших финансовых затрат и сокращения сроков испытаний [7][8]. Однако замена тестов для контроля качества партий БЛП при выпуске, как правило, затруднительна [6][9]. В качестве основных препятствий для внедрения альтернативных методов рассматриваются отсутствие гармонизации регуляторных требований, сложность подтверждения корреляции между методами in vivo и in vitro, в том числе при проведении сравнительных исследований, проблемы при внесении регуляторных изменений и др. [9–11].
Цель работы — анализ степени интегрированности принципов 3Rs в процесс контроля качества биологических лекарственных средств в мировой практике и оценка существующих препятствий и возможностей для успешной реализации перехода к контролю качества препаратов без использования животных в Российской Федерации.
ОСНОВНАЯ ЧАСТЬ
Область применения биологических методов in vivo
Начиная с 1990-х гг. большое внимание уделяется стандартам гуманного обращения с животными, которые распространились как на исследовательскую деятельность, так и на контроль качества в процессе разработки и производства ЛС [12–14]. При этом в соответствии с требованиями регуляторных органов большинства стран относительно доклинических испытаний на этапе разработки оценка потенциальной токсичности ЛС на животных является обязательной. Это позволяет гарантировать безопасность будущих лекарственных препаратов (ЛП). Кроме того, в доклиническую фазу с помощью биологических моделей изучают механизмы действия и биологическую активность БЛП, их фармакокинетические и фармакодинамические свойства [5][15].
В процессе производства и при выпуске ЛС биологические методы in vivo применяются при контроле безопасности и специфической активности следующих групп препаратов: вакцин для использования человеком, биологических и биотехнологических препаратов, антибиотиков и радиофармацевтических препаратов2. Отмечается, что для проведения таких испытаний задействуется более 10 млн особей животных в год [16].
Сравнение методов in vivo и in vitro
При оценке безопасности и активности в процессе производства и на этапе выпускающего контроля качества вакцин, которые давно применяются в медицинской практике (например, против дифтерии, столбняка и коклюша), ранее использовались тесты in vivo, поскольку возможности аналитических методов in vitro были сильно ограничены. В настоящее время спектр физико-химических, иммунохимических и биологических методов с использованием клеточных культур, применимых для оценки критических показателей качества БЛП, достаточно широк [1].
Наряду с этическими аспектами (причинение боли и страданий лабораторным животным) существуют аспекты научного, регуляторного и экономического характера относительно целесообразности использования биологических моделей при контроле качества БЛП [6][7][15].
С научной точки зрения при включении испытаний in vivo в спецификацию БЛП на момент выпуска необходимо учитывать высокую вариабельность биологических тестов, степень релевантности ответных реакций организмов животного и человека, а также соответствие данных тестов современным нормативным требованиям к контролю качества ЛС. Так, из-за межвидовых различий применимость животных для оценки безопасности и активности ЛП, предназначенных для человека, в настоящее время вызывает все больше сомнений у исследователей и разработчиков ЛС [15].
Существенным недостатком тестов in vivo является их вариабельность и, как следствие, довольно широкие диапазоны нормативных требований и критериев приемлемости [16–18]. Например, диапазон нормативных требований теста Национального института здоровья (National Institutes of Health, NIH) для оценки активности вакцины против бешенства согласно требованиям Европейской фармакопеи (Ph. Eur.) составляет от 25 до 400%, в то время как альтернативный метод иммуноферментного анализа (enzyme-linked immunosorbent assay, ELISA) на основе G-белка демонстрирует более высокую точность (от 93 до 107% при 95% доверительном интервале) [6][19].
Кроме того, из-за высокой вариабельности тестов, когда активность близка к нижней границе нормы, производители вынуждены прибегать к выпуску партий БЛП с увеличенным содержанием целевого антигена, чтобы гарантировать соблюдение нормативных требований [7].
Еще одним примером, когда использование методов in vitro предпочтительно, являются тесты на наличие посторонних вирусов, которые находят применение при характеристике банков клеток, а также при внутрипроизводственном контроле партий БЛП [20]. При использовании метода секвенирования нового поколения (next-generation sequencing, NGS) показана более высокая чувствительность к обнаружению посторонних вирусов, чем в испытаниях in vivo [21].
С экономической точки зрения биологические методы in vivo являются дорогостоящими, требуют значительных временных затрат и человеческих ресурсов. Например, срок выполнения испытаний по оценке активности вакцины составляет от нескольких недель до нескольких месяцев [6][15]. Кроме того, из-за высокой вариабельности ответов in vivo существует риск получения неприемлемых результатов испытаний и, следовательно, признания непригодными партий продукта, которые на самом деле являются безопасными и активными. В данном случае проведение повторных испытаний и расследование причин несоответствия приводит к задержке поступления препарата в оборот [7].
В свою очередь, тесты in vitro способны оценивать все соответствующие CQA с достаточной точностью (при условии, что продукт был надлежащим образом охарактеризован), поэтому любые отклонения в процессе производства с большой долей вероятности будут выявлены на ранней стадии, до этапа контроля активности ЛП при выпуске [7][16].
Также в тестах in vitro, например при определении наличия посторонних вирусов, реже регистрируются как ложноположительные, так и ложноотрицательные результаты, что позволяет сократить сроки проведения испытания за счет времени, которое затрачивается на выяснение причин несоответствия результатов при испытании БЛП на животных [22].
Дополнительное увеличение сроков и расходов наблюдается, если национальные контрольные лаборатории (National Control Laboratories, NCL) проводят пострегистрационный независимый контроль партии перед выпуском не одновременно с производителем или если результаты испытаний, полученные NCL и производителем, различаются [23][24].
С точки зрения глобального регулирования степень гармонизации требований относительно оценки безопасности и/или активности препаратов с применением 3Rs недостаточна [15][25]. Во-первых, требования регуляторных органов разных стран к испытаниям и/или спецификации при выпуске партии могут иметь отличия для препаратов одного наименования разных производителей. Во-вторых, такая ситуация возможна и в отношении препарата одного производителя, зарегистрированного в нескольких странах [16][25]. В-третьих, в отдельных регионах стандарты проведения одного и того же испытания могут иметь свою специфику (например, линии животных и/или сроки проведения испытания могут отличаться), что может оказывать влияние на результаты и определение критериев их приемлемости [6][15]. В-четвертых, при регистрации одного и того же БЛП в нескольких странах неизбежно дублирование испытаний на животных [23].
Следует отметить, что соответствие процесса производства действующим Правилам надлежащей производственной практики (Good Manufacturing Practice, GMP) гарантирует стабильность качества выпускаемых ЛС, поэтому подтверждать безопасность и активность БЛП, изготовленных с соблюдением GMP, в испытаниях на животных не всегда целесообразно [26][27].
В связи с вышеизложенным тесты in vivo считаются менее подходящими для контроля последовательности производственного процесса и подтверждения постоянства качества продукта от партии к партии. Отмечается, что методы in vitro для подтверждения стабильности производства вакцин надлежащего качества являются перспективными [11][26].
Принципы 3Rs в рекомендациях ВОЗ
Руководящая роль Всемирной организации здравоохранения (ВОЗ) признается как регуляторными органами, так и производителями ЛС разных стран. Однако ее рекомендации относительно использования животных при контроле качества БЛП давно не обновлялись. Поэтому в 2019 г. Экспертный комитет по биологической стандартизации (Expert Committee on Biological Standardisation, ECBS) предложил проект по пересмотру документов, касающихся БЛП, чтобы гармонизировать их с положениями концепции 3Rs и таким образом ускорить внедрение разработанных и научно обоснованных методов in vitro на этапе контроля качества при выпуске [15].
Реализация проекта осуществляется в два этапа. Задачи первого этапа, завершенного в 2023 г., включали: пересмотр текущих рекомендаций ВОЗ для БЛП; взаимодействие с производителями, контролирующими организациями и регуляторными органами для оценки возможностей и препятствий успешной интеграции принципов 3Rs; разработку комплексных рекомендаций по внедрению гармонизированного подхода 3Rs в процессы производства и контроля уже зарегистрированных БЛП [28].
Второй этап проекта продолжается в настоящее время, он должен завершиться утверждением руководства ВОЗ, а также включением поправок, согласующихся с принципами 3Rs, в уже существующие рекомендации ВОЗ по проведению испытаний при внутрипроизводственном и выпускающем контроле качества вакцин и других БЛП [29].
Внедрение принципов 3Rs при контроле и тестировании партий БЛП — взгляд регуляторных органов и производителей
С целью выявления возможностей и препятствий для успешной интеграции 3Rs со стороны национальных регуляторных органов (National Regulatory Authorities, NRA), NCL и производителей БЛП экспертами ECBS ВОЗ были разработаны и разосланы специальные вопросники. Ответы были получены из стран Европы, Азиатско-Тихоокеанского региона, Северной и Южной Америки: 13 наборов данных от NRA, 29 — от NCL [23] и 30 — от производителей ЛС [24].
В разделе вопросника, посвященном текущей практике контроля качества БЛП, все респонденты NRA подчеркнули важность использования методов in vitro (при условии их доступности и научной обоснованности) на этапах внутрипроизводственного и выпускающего контроля качества, однако только 38% участников обсуждали данную тему с производителями БЛП, а 62% указали, что в их странах испытания на животных при контроле качества БЛП обязательны [23].
Несмотря на то что со стороны разработчиков также отмечено стремление к сокращению количества испытаний in vivo и подтверждено наличие положительного опыта взаимодействия с NRA, степень внедрения альтернативных методов остается низкой. Так, производителями была представлена информация о контроле качества 154 биологических препаратов, в ходе которого было проведено 416 испытаний на животных, выполненных 20 различными методами: на биологических моделях оценивали активность (в 29,3% случаев), аномальную токсичность (20,5%), наличие посторонних вирусов (11,2%), специфическую токсичность (11%) и пирогенность (9,3%) [24].
Эффективная реализация требований GMP к производству БЛП во многих странах показала возможность отказа от оценки качества препаратов по показателю «Аномальная токсичность» на животных (abnormal toxicity test, ATT). Известно, что ECBS ВОЗ в 2018 г. рекомендовал не включать ATT во все будущие рекомендации и руководства по биологическим продуктам [30]. Это согласуется с требованиями Управления по контролю качества пищевых продуктов и лекарственных средств (Food and Drug Administration, FDA) США и Европейской фармакопеи, которые исключили данный тест ранее3 [25]. Несмотря на то что 85% участников из NRA ответили, что им известно о нововведении, ATT по-прежнему применяется при контроле БЛП. При этом в 69% случаев NRA получают результаты теста без запроса со своей стороны [23]. Также установлено, что большинство производителей БЛП (80%) информированы об отмене испытаний на аномальную токсичность, но при этом 57% продолжают оценивать данный показатель качества [30]. Вероятно, это связано с тем, что производители поставляют свою продукцию в несколько регионов мира, при этом единый регуляторный подход в отношении АТТ не сформирован. Кроме того, отдельные руководства ВОЗ еще не актуализированы и указанный тест в них значится [24].
Многие респонденты NRA (61%) указали, что предоставляют данные о результатах контроля качества партии БЛП другим странам в своем регионе. Представители NCL также производят обмен результатами испытаний на аномальную токсичность одних и тех же партий БЛП [23]. В данном случае согласованность контролирующих организаций способствует тому, что испытания одной и той же партии не дублируются, а, следовательно, сокращается количество задействованных животных, минимизируются временные и трудозатраты.
Тем не менее 75% NCL при вводе в оборот партий БЛП, произведенных в их стране, повторяют контроль, который уже был выполнен изготовителем, поскольку именно они, согласно документам ВОЗ, признаны ответственными за тестирование выпускаемой партии БЛП. С препаратами зарубежного производства ситуация иная: 52% NCL проводят повторное тестирование партии БЛП, уже прошедшей выпускающий контроль на предприятии-изготовителе, а 48% принимают сертификат анализа и/или сводный протокол в качестве достаточного обоснования [23].
Разделы вопросника, представлявшие основной интерес для его составителей, были посвящены тому, как национальные регуляторы (NRA и NCL) и производители оценивают возможности и препятствия для принятия 3Rs. В целом были отмечены высокая осведомленность респондентов о подходах 3Rs и положительная динамика в их продвижении. Так, например, 60% производителей, знакомых с концепцией, указали, что применяют ее на практике, остальные же 40% выразили опасения, что данные, полученные альтернативными методами in vitro, либо могут быть не приняты регуляторными органами, либо не будут соответствовать нормативным требованиям, однако подтвердили, что готовы заменить применяемые ими методики в будущем [24].
Наиболее значимым обоснованием в пользу замены испытаний in vivo и производители, и регуляторы признали этический аспект, далее отмечались актуальность сокращения времени тестирования партии БЛП, достаточно низкая вариабельность данных, получаемых методами in vitro, и др. [24][29], а в качестве основных препятствий для интеграции методов без использования животных были выделены: отсутствие информации о существующих альтернативных методах и опыта в их разработке, а также недостаточное обоснование того, что данные методы имеют преимущества по сравнению с тестами in vivo [23][24].
Среди факторов, которые будут способствовать принятию решения о внедрении тестов in vitro, представители NRA выделили следующие: включение конкретного метода in vitro в национальную/региональную фармакопею, проведение валидации метода in vitro производителем, принятие метода in vitro ВОЗ, наличие ссылки на метод in vitro в другой национальной фармакопее [23][25].
Одним из способов доказательства пригодности новых методов для использования по назначению может быть создание специальных программ компании-производителя для разработки моделей и методов и/или внедрения методов без использования животных. Половина опрошенных производителей заявила об опыте применения таких программ на практике [24].
Результаты опроса показали, что возможность отказа от методик испытаний на животных при контроле качества БЛП во многом зависит от гармонизации подходов к внедрению 3Rs и сотрудничества между производителями и регуляторными органами. Так, подавляющее большинство опрошенных сошлись во мнении, что разработка руководства ВОЗ по внедрению 3Rs и пересмотр рекомендаций ВОЗ по отдельным препаратам необходимы, поскольку отсутствие руководящих документов не позволяет ввести методы in vitro в процесс контроля качества и установить требования к испытаниям партий при выпуске БЛП в разных странах. Безусловно, для реализации проекта ECBS ВОЗ требуется время, но готовность принять замещение методов и позитивный опыт взаимодействия по этому вопросу являются важными шагами.
Проект руководства ВОЗ по внедрению принципов 3Rs
В ноябре 2024 г. на официальном сайте ВОЗ был размещен проект Руководства по поэтапному отказу от испытаний на животных при контроле качества биологических продуктов (проект Руководства)4, включающий рекомендации как для разработчиков БЛП, так и для регуляторных органов.
Тесты in vivо являются неотъемлемой частью разработки биологических ЛС, но ВОЗ признает имеющиеся ограничения для их применения и отмечает, что технологические достижения последних лет способствуют поиску, обоснованию и внедрению альтернативных методов. В проекте Руководства основное внимание уделено вопросам замены методов in vivo или их исключения в случаях, когда замену осуществить невозможно. Однако подчеркивается, что при определенных обстоятельствах, когда испытания на животных неизбежны, следует применять подходы «reduction» и «refinement», насколько это возможно с научной точки зрения [29].
Также в Руководстве отмечается, что продвижение методов in vitro как более чувствительных в большей степени будет гарантировать стабильность производства, а также позволит минимизировать риск нарушения сроков поставок БЛП и потенциально снизить затраты как производителей, так и контрольных лабораторий. Кроме того, для сокращения количества животных, задействованных в испытаниях, следует рассматривать обмен результатами между контрольными лабораториями разных стран [23].
В рамках подготовки проекта пересмотрен 81 документ ВОЗ, в 63-х из которых были предусмотрены испытания на животных, например для оценки наличия посторонних вирусов, нейровирулентности, пирогенности, определения активности и специфической токсичности биологических продуктов.
Руководство ВОЗ по интеграции стратегии 3Rs будет способствовать гармонизации рекомендаций по контролю качества БЛП для производителей, регуляторных органов и контрольных лабораторий, а также повышению качества тестирования партий биологических препаратов при выпуске с меньшим акцентом на использование животных.
Реализация концепции 3Rs в требованиях фармакопей
Европейский директорат по качеству лекарственных средств и здравоохранения (European Directorate for the Quality of Medicines and HealthCare, EDQM) активно применяет концепцию 3Rs в своей деятельности5. Комиссия Ph. Eur. учитывает ее принципы как при пересмотре, так и при разработке новых общих глав и монографий. В настоящее время ни одна из монографий Ph. Eur. для ЛС, полученных из крови и плазмы человека, не содержит требований о проведении испытаний на животных. Ряд человеческих вакцин прошел переоценку релевантности испытаний на животных, введены методы in vitro в качестве замены испытаниям in vivo6 [31].
Достигнуты определенные успехи в данной области: исключено испытание на аномальную токсичность из требований ведущих фармакопей; разработаны альтернативные методы для оценки активности инактивированных вакцин против бешенства; для оценки чувствительности к гистамину бесклеточных коклюшных вакцин; для испытания на реверсию токсичности дифтерийных и столбнячных компонентов комплексных вакцин; для испытания на специфическую безопасность (отсутствие остаточной токсичности) дифтерийного и столбнячного компонентов комплексных вакцин и др. [32][33].
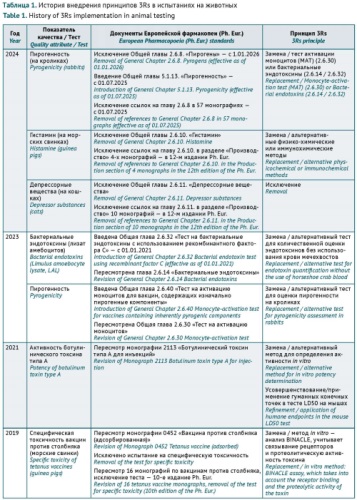
В 2024 г. из Ph. Eur. исключены 3 общие главы, описывающие испытания на животных, такие как 2.6.8. «Пирогены» (испытания на кроликах), 2.6.10. «Гистамин» (испытания на морских свинках) и 2.6.11. «Депрессорные вещества» (испытания на кошках). Вместе с исключением общей главы 2.6.9. «Аномальная токсичность» в 2017 г., из Ph. Eur. исключены все общие испытания по оценке безопасности БЛП на животных. Данное решение вступит в силу с 1 января 2026 г.7. Сведения о внедрении подходов 3Rs в Ph. Eur., начиная с 2012 года, представлены в таблице 1 (опубликована на сайте журнала8).
Программа биологической стандартизации Ph. Eur., в рамках которой проводятся исследования по валидации новых фармакопейных методов и созданию референтных препаратов для контроля качества биологических лекарственных средств, содействует применению подхода 3Rs. До настоящего времени 25 проектов из 170 были посвящены разработке или внедрению альтернативных методов без использования животных9.
В Европейскую фармакопею в 2019 г. включена общая глава 5.2.14 «Замена метода(ов) in vivo методом(ами) in vitro для контроля качества вакцин»10 (10-е издание Ph. Eur.), а также известно, что соответствующие главы были включены в Британскую фармакопею (2019 г.) [16] и Фармакопею Евразийского экономического союза (2024 г.)11.
Основные положения общей главы 5.2.14 Европейской фармакопеи
Как отмечалось ранее, альтернативные методы in vitro имеют ряд преимуществ по сравнению с тестами на животных. Однако при попытке замены методов их сравнение «один к одному» может оказаться затруднительным из-за присущей методам in vivo изменчивости и отсутствия результатов их валидации. Так, при контроле качества давно зарегистрированных вакцин изучение правильности, воспроизводимости, предела обнаружения и других валидационных характеристик биологических методов не было предусмотрено12, хотя ценность этих методов в обеспечении активности и безопасности препаратов исторически доказана.
В общей главе представлены рекомендации по внедрению методов in vitro в случаях, когда проведение прямого сравнения тестов не представляется возможным по причинам, не связанным с пригодностью одного или нескольких методов13. Также отмечается, что при переходе к системе контроля качества, основанной на методах in vitro, следует учитывать, что показатели качества продукта, скорее всего, будут оцениваться по-новому. При этом альтернативные стратегии тестирования должны обеспечивать уверенность в том, что критические параметры, подтверждающие безопасность и активность БЛП, контролируются должным образом.
Согласно требованиям Ph. Eur. замена тестов in vivo на тесты in vitro для оценки качества вакцин возможна после обоснования применимости последних для контроля соответствующих качественных характеристик препарата, их валидации, а также проведения сравнительных исследований.
Общая глава содержит критерии в отношении процесса замены методов для оценки активности вакцин:
- методы in vitroдолжны надлежащим образом контролировать постоянство производства. Для подтверждения их способности оценивать CQA вакцин и поддерживать качество вновь выпускаемых вакцин на уровне тех партий, безопасность и активность которых была подтверждена при клинических исследованиях и/или рутинном применении в практике, необходим достаточный объем данных;
- способность методов in vitroопределять содержание и функциональность антигена должна быть подтверждена. При внедрении одного метода in vitro целесообразно применять нейтрализующие моноклональные антитела, нацеленные на конформационные эпитопы антигена. Если одного метода in vitro недостаточно для определения содержания и функциональности антигена в полном объеме, целесообразно использовать несколько методов in vitro;
- при разработке метода in vitroследует применять образцы вакцин с разной концентрацией, а также образцы, подвергнутые разным типам стрессовых условий, для оценки потенциала нового метода при изучении стабильности препарата;
- методам in vitro, обладающим более высокой чувствительностью, отдается предпочтение при подтверждении постоянства качества вакцин в процессе производства14[16].
Отсутствие возможности доказать соответствие между альтернативными методами не всегда означает, что метод in vitro является непригодным, скорее всего, он обнаруживает такие изменения в профиле продукта, которые не были определены методом in vivo. В данном случае альтернативный метод является более подходящим для оценки влияния изменений в производстве на качество препарата.
Международные и национальные организации, занимающиеся реализацией концепции 3Rs
Несмотря на то что принципы 3Rs не являются обязательными, Концепция 3Rs во многих странах стала стандартом в законодательстве и реализуется различными государственными и общественными организациями. Принципы 3Rs включены в нормативные акты и руководства по проведению исследований на животных [1][34]. Данный подход отражается в рекомендациях ВОЗ, международных документах, таких как Европейская директива 2010/63/EU15, ряде национальных законодательных актов, правилах и руководствах, действующих по всему миру [5][27].
Различные международные и национальные организации участвуют в продвижении данной концепции, способствуя разработке альтернативных методов и проведению валидационных исследований:
- Рабочая группа по вакцинам Европейского директората по качеству лекарственных средств и здравоохранению (European Directorate for the Quality of Medicines and Healthcare's Vaccines Working Group (EDQM));
- Национальный центр Великобританиипо замене и сокращению животных в исследованиях (National Centre for the Replacement, Refinement and Reduction of Animals in Research, NC3Rs);
- Европейская референс-лаборатория по альтернативным методам испытаний на животных (European Union Reference Laboratory for alternatives to animal testing (EURL ECVAM));
- Европейская сеть лабораторийпо валидации альтернативных методов (European Union Network of Laboratories for the Validation of Alternative Methods (EU-NETVAL));
- Национальный институт здравоохранения, США (National Institutes of Health (NIH), USA);
- Межведомственный центр по оценке альтернативных токсикологических методов, США (Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM), USA);
- Индийская фармакопейная комиссия по замене испытаний in vivo (Indian Pharmacopoeia Commission (IPC) on replacement of in vivotesting);
- Китайский центр развития сельских технологий Министерства наукии технологий (China Rural Technology Development Centre of the Ministry of Science and Technology of the People’s Republic of China);
- Национальный консультативный комитетпо исследованиям на лабораторных животных, Сингапур (National Advisory Committee for Laboratory Animal Research (NACLAR), Singapore);
- Международный исследовательский проект Консорциума VAC2VAC (International research project of the VAC2VAC Consortium);
- Ассоциацияпо оценке безопасности без использования животных при Обществе защиты животных (Animal-Free Safety Assessment Association (AFSA), Humane Society International (HSI)) [1].
Указанные организации играют важную роль в продвижении альтернативных методов и достижении их регуляторного признания. Распространение принципов 3Rs преобладает в Европе, однако страны Азиатско-Тихоокеанского региона также принимают важность согласованности подходов к внедрению концепции. Благодаря гармонизации требований испытания для подтверждения качества ЛС, принятые регуляторными органами западных стран, могут применяться для оценки качества лекарственных препаратов в других регионах мира.
Гармонизация подходов и требований регуляторных органов ведущих стран к внедрению альтернативных методов испытаний представляет особую значимость для фармацевтических компаний, поскольку будет на международном уровне способствовать принятию вносимых ими изменений в нормативную документацию.
ЗАКЛЮЧЕНИЕ
В последние годы предприняты значительные усилия для продвижения методов без использования животных в испытаниях и нормативно-правовой базе в качестве нового стандарта. Принятие требований при внедрении принципов 3Rs не исключает полностью испытания на животных из оценки качества лекарственных средств, но вносит ясность в процедуру признания альтернативных методов, которые должны быть научно обоснованы и иметь доказанную надежность в обеспечении безопасности и активности препарата при медицинском применении. Обозначены такие важные стратегии замены, как стандартизация требований, содействие обмену результатами испытаний, а также исключение тестов на животных при наличии адекватных альтернативных методов.
В настоящее время отмечается активизация действий как регуляторных органов, так и производителей лекарственных средств разных стран, включая Россию, по разработке новых надежных методов in vitro, сокращению количества животных, задействованных в испытаниях, и совершенствованию методик с целью минимизации страданий животных.
Международное сотрудничество с участием всех заинтересованных сторон (научных кругов, промышленности и регуляторных органов) является ключевым моментом в переходе к контролю при выпуске биологических лекарственных препаратов без использования животных.
Дополнительная информация. Таблица 1 размещена на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2025-13-2-229-239-tabl
Additional information. Table 1 is published on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2025-13-2-229-239-tabl
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Л.А. Гайдерова — концепция и дизайн исследования; Н.А. Алпатова — идея исследования, сбор и систематизация данных, написание рукописи, формулировка выводов; О.В. Головинская — анализ и интерпретация результатов; А.М. Гуськов — сбор и систематизация данных литературы; Э.К. Липатова — подбор данных литературы; М.Н. Лаврова — утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Lidia A. Gaiderova conceptualised and designed the study. Natalia A. Alpatova conceived the study idea, drafted the manuscript, and formulated the conclusions. Оlga V. Golovinsksya analysed and interpreted the study results. Alexander M. Guskov collected and analysed data. Elvira K. Lipatova collected the data. Мarina N. Lavrova approved the final version of the manuscript for publication.
1. Guideline on the principles of regulatory acceptance of 3Rs (replacement, reduction, refinement) testing approaches. EMA/CHMP/CVMP/JEG-3Rs/450091/2012. EMA; 2016.
Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Off J Eur Union. 2010;276:33–79.
General chapter 5.2.14 Substitution of in vivo methods by in vitro methods for the quality control of vaccines. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2023.
2. https://www.edqm.eu/en/alternatives-to-animal-testing
3. Revocation of general safety test regulations that are duplicative of requirements in biologics license applications. Final rule. Fed Regist. 2015;80(127):37971–4. PMID: 26155602
https://www.edqm.eu/en/d/181388?p_l_back_url=%2Fen%2Fsearch%3Fq%3DSuppression%2Bof%2Bthe%2BTest%2Bfor%2BAbnormal%2BToxicity%2Bfrom%2Bthe%2BEuropean%2BPharmacopoeia
4. Guidelines on the phasing out of animal tests for the quality control of biological products. Draft version.
5. https://www.edqm.eu/en/alternatives-to-animal-testing
6. Там же.
7. Там же.
8. https://doi.org/10.30895/2312-7821-2025-13-2-229-239-tabl
9. https://www.edqm.eu/en/bsp-programme-for-3rs
10. 5.2.14 Substitution of in vivo method(s) by in vitro method(s) for the quality control of vaccines. European Pharmacopoeia. 10th ed. 2019.
11. 2.3.1.8. Замена методов in vivo на методы in vitro для контроля качества вакцин. Фармакопея Евразийского экономического союза. Т. 1. Ч. 3. М.; 2024.
12. ICH Topic Q2(R2). Guideline on validation of analytical procedures.
13. 5.2.14 Substitution of in vivo method(s) by in vitro method(s) for the quality control of vaccines. European Pharmacopoeia. 10th ed. 2019.
14. Там же.
15. Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Off J Eur Union. 2010;276:33–79.
Список литературы
1. Poh WT, Stanslas J. The new paradigm in animal testing — “3Rs alternatives”. Regul Toxicol Pharmacol. 2024;153:105705. https://doi.org/10.1016/j.yrtph.2024.105705
2. Russell WMS, Burch RL, Hume CW. The principles of humane experimental technique. London: Methuen & Co Ltd.; 1959.
3. Tannenbaum J, Bennett BT. Russell and Burch’s 3Rs then and now: The need for clarity in definition and purpose. J Am Assoc Lab Anim Sci. 2015;54(2):120–32. PMID: 25836957
4. Halder M. Three Rs potential in the development and quality control of immunobiologicals. ALTEX. 2001;18(Suppl.1):13–47. PMID: 11854853
5. Grimm H, Biller-Andorno N, Buch T, Dahlhoff M, Davies G, Cederroth CR, et al. Advancing the 3Rs: Innovation, implementation, ethics and society. Front Vet Sci. 2023;10:1185706. https://doi.org/10.3389/fvets.2023.1185706
6. Hoefnagel MHN, Stickings P, Smith D, Jungbäck C, Van Molle W, Tesolin L. Rational arguments for regulatory acceptance of consistency testing: Benefits of non-animal testing over in vivo release testing of vaccines. Expert Rev Vaccine. 2023;22(1):369–77. https://doi.org/10.1080/14760584.2023.2198601
7. Schutte K, Szczepanska A, Halder M, Cussler K, Sauer UG, Stirling C, et al. Modern science for better quality control of medicinal products “Towards global harmonization of 3Rs in biologicals”: The report of an EPAA workshop. Biologicals. 2017;48:55–65. https://doi.org/10.1016/j.biologicals.2017.05.006
8. Uhlrich S, Coppens E, Moysan F, Nelson S, Nougarede N. 3Rs in quality control of human vaccines: Opportunities and barriers. In: Kojima H, Seidle T, Spielmann H. Alternatives to animal testing: Proceedings of Asian Congress. Springer Singapore; 2019. P. 76–82. https://doi.org/10.1007/978-981-13-2447-5_10
9. Bruysters MW, Schiffelers MJ, Hoonakker M, Jungbaeck C, Ragan I, Rommel E, et al. Drivers and barriers in the consistency approach for vaccine batch release testing: Report of an international workshop. Biologicals. 2017;48:1–5. https://doi.org/10.1016/j.biologicals.2017.06.006
10. Akkermans A, Chapsal JM, Coccia EM, Depraetere H, Dierick J-F, Duangkhae P, et al. Animal testing for vaccines. Implementing replacement, reduction and refinement: Challenges and priorities. Biologicals. 2020;68:92–107. https://doi.org/10.1016/j.biologicals.2020.07.010
11. van den Biggelaar RH, Hoefnagel MH, Vandebriel RJ, Sloots A, Hendriksen CF, van Eden W, et al. Overcoming scientific barriers in the transition from in vivo to non-animal batch testing of human and veterinary vaccines. Expert Rev Vaccines. 2021;20(10):1221–33. https://doi.org/10.1080/14760584.2021.1977628
12. Hendriksen CF, Garthoff B, Aggerbeck H, Bruckner L, Castle P, Cussler K, et al. Alternatives to animal testing in the quality control of immunobiologicals: Current status and future prospects. The report and recommendations of ECVAM Workshop 4. Altern Lab Anim. 1994;22(6):420–34. https://doi.org/10.1177/026119299402200606
13. Ohno Y. ICH guidelines — implementation of the 3Rs (refinement, reduction, and replacement): Incorporating best scientific practices into the regulatory process. ILAR J. 2002;43(Suppl):95–8. https://doi.org/10.1093/ilar.43.suppl_1.s95
14. Beken S, Kasper P, van der Laan JW. Regulatory acceptance of alternative methods in the development and approval of pharmaceuticals. Adv Exp Med Biol. 2016;856:33–64. https://doi.org/10.1007/978-3-319-33826-2_3
15. Lilley E, Isbrucker R, Ragan I, Holmes A. Integrating 3Rs approaches in WHO guidelines for the batch release testing of biological. Biologicals. 2021;74:24–7. https://doi.org/10.1016/j.biologicals.2021.10.002
16. Zhang X, Wu X, He Q, Wang J, Mao Q, Liang Zh, Xu M. Research progress on substitution of in vivo method(s) by in vitro method(s) for human vaccine potency assays. Expert Rev Vaccines. 2023;22(1):270–7. https://doi.org/10.1080/14760584.2023.2178421
17. Stalpers CA, Retmana IA, Pennings JL, Vandebriel RJ, Hendriksen CF, Akkermans AM, Hoefnagel MH. Variability of in vivo potency tests of Diphtheria, Tetanus and acellular Pertussis (DTaP) vaccines. Vaccine. 2021;39(18):2506–16. https://doi.org/10.1016/j.vaccine.2021.03.078
18. Stalpers CA, Retmana IA, Pennings JL, Vandebriel RJ, Hendriksen CF, Akkermans AM, Hoefnagel MH. Corrigendum to “Variability of in vivo p otency t ests o f D iphtheria, Tetanus a nd a cellular P ertussis (DTaP) vaccines” [Vaccine. 2021;39(18):2506–16]. Vaccine. 2022;40(23):3272–3. https://doi.org/10.1016/j.vaccine.2022.04.047
19. Chabaud-Riou M, Moreno N, Guinchard F, Nicolai MC, Niogret-Siohan E, Sève N, et al. G-protein based ELISA as a potency test for rabies vaccines. Biologicals. 2017;46:124–9. https://doi.org/10.1016/j.biologicals.2017.02.002
20. Gombold J, Karakasidis St, Niksa P, Podczasy J, Neumann K, Richardson J, et al. Systematic evaluation of in vitro and in vivo adventitious virus assays for the detection of viral contamination of cell banks and biological products. Vaccine. 2014;32(24):2916–26. https://doi.org/10.1016/j.vaccine.2014.02.021
21. Charlebois RL, Sathiamoorthy S, Logvinoff C, Gisonni-Lex L, Mallet L, Ng SH. Sensitivity and breadth of detection of high-throughput sequencing for adventitious virus detection. NPJ Vaccines. 2020;5(1):61. https://doi.org/10.1038/s41541-020-0207-4
22. Barone PW, Keumurian FJ, Neufeld C, Koenigsberg A, Kiss R, Leung J, et al. Historical evaluation of the in vivo adventitious virus test and its potential for replacement with next generation sequencing (NGS). Biologicals. 2023;81:101661. https://doi.org/10.1016/j.biologicals.2022.11.003
23. Lilley E, Bruysters M, Das P, Gill S, Isbrucker R, Jones D, Holmes A. Integrating 3Rs approaches in WHO guidelines for the batch release testing of biologicals: Responses from a survey of National Control Laboratories and National Regulatory Authorities. Biologicals. 2023;84:101721. https://doi.org/10.1016/j.biologicals.2023.101721
24. Lilley E, Coppens E, Das P, Galaway F, Isbrucker R, Sheridan S, et al. Integrating 3Rs approaches in WHO guidelines for the batch release testing of biologicals: Responses from a survey of vaccines and biological therapeutics manufacturers. Biologicals. 2023;81:101660. https://doi.org/10.1016/j.biologicals.2022.11.002
25. Viviani L, Halder M, Gruber M, Bruckner L, Cussler K, Sanyal G, et al. Global harmonization of vaccine testing requirements: Making elimination of the ATT and TABST a concrete global achievement. Biologicals. 2020;63:101–5. https://doi.org/10.1016/j.biologicals.2019.10.007
26. Stirling C. Consistency as tool to support in vitro batch potency testing in GMP production. Dev Biol (Basel). 2012;134:115–8. PMID: 22888603
27. De Mattia F, Chapsal JM, Descamps J, Halder M, Jarrett N, Kross I, et al. The consistency approach for quality control of vaccines — a strategy to improve quality control and implement 3Rs. Biologicals. 2011;39(1):59–65. https://doi.org/10.1016/j.biologicals.2010.12.001
28. Lilley E, Isbrucker R, Holmes A. Integrating 3Rs approaches in WHO guidelines for the batch release testing of biologicals: Reports from a series of NC3Rs stakeholder workshops. Biologicals. 2025;89:101777. https://doi.org/10.1016/j.biologicals.2024.101777
29. Lilley E, Isbrucker R, Holmes A. Integrating 3Rs approaches in WHO guidelines for the batch release testing of biologicals: Summary of NC3Rs final report to WHO Expert Committee for Biological Standardisation. Biologicals. 2025;89:101778. https://doi.org/10.1016/j.biologicals.2024.101778
30. Lei D, Schmidt H, Knezevic I, Zhou T, Kang HN, Kopp S. Removal of the innocuity test from The International Pharmacopoeia and WHO recommendations for vaccines and biological products. Biologicals. 2020;66:17–20. https://doi.org/10.1016/j.biologicals.2020.05.003
31. Lang C, Kolaj-Robin O, Cirefice G, Taconet L, Pel E, Jouette S, Charton E. Replacement, Reduction, Refinement — Animal welfare progress in European Pharmacopoeia monographs: Activities of the European Pharmacopoeia Commission from 2007 to 2017. Pharmeur Bio Sci Notes. 2018;2018:12–36. PMID: 29845933
32. Viviani L, Reid K, Gastineau T, Milne C, Smith D, Levis R, et al. Accelerating Global Deletion of the Abnormal Toxicity Test for vaccines and biologicals. Planning common next steps. A workshop Report. Biologicals. 2022;78:17–26. https://doi.org/10.1016/j.biologicals.2022.06.003
33. Bratos M, Kolaj-Robin O, Antoni M, Charton E. Ph. Eur. testing for histamine and depressor substances using guinea-pigs and cats: The end of an era. Strategy for removal of animal tests for histamine and depressor substances and their vestiges from the Ph. Eur. Pharmeur Bio Sci Notes. 2024;2024:12–26. PMID: 38533690
34. Bayne K, Turner PV. Animal welfare standards and international collaborations. ILAR J. 2019;60(1):86–94. https://doi.org/10.1093/ilar/ily024
Об авторах
Л. А. ГайдероваРоссия
Гайдерова Лидия Александровна, канд. мед. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
Н. А. Алпатова
Алпатова Наталья Александровна, д-р биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
О. В. Головинская
Головинская Ольга Вячеславовна, канд. мед. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
А. М. Гуськов
Гуськов Александр Михайлович
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
Э. К. Липатова
Липатова Эльвира Константиновна
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
М. Н. Лаврова
Лаврова Марина Николаевна, канд. фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
Дополнительные файлы

|
1. Таблица 1. История внедрения принципов 3Rs в испытаниях на животных | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(178KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Гайдерова Л.А., Алпатова Н.А., Головинская О.В., Гуськов А.М., Липатова Э.К., Лаврова М.Н. Реализация концепции 3Rs при контроле качества биологических препаратов: современное состояние и перспективы (обзор). Безопасность и риск фармакотерапии. 2025;13(2):229-239. https://doi.org/10.30895/2312-7821-2025-13-2-229-240
For citation:
Gaiderova L.A., Alpatova N.A., Golovinskaya O.V., Guskov A.M., Lipatova E.K., Lavrova M.N. Implementation of the 3Rs Concept in Quality Control of Biologicals: Status and Prospects (Review). Safety and Risk of Pharmacotherapy. 2025;13(2):229-239. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-2-229-240