Мультиомические технологии в прогнозировании нейротоксичности ламотриджина: современные возможности (обзор)
https://doi.org/10.30895/2312-7821-2025-498
Резюме
ВВЕДЕНИЕ. Ламотриджин (ЛТД) — один из наиболее часто назначаемых противоэпилептических препаратов второго поколения. Препарат имеет низкий тератогенный потенциал, однако обладает генетически и метаболически детерминированными нейротоксическим, гепатотоксическим, дерматотоксическим эффектами и в некоторых случаях может вызвать полиорганную недостаточность. Понимание механизмов действия ЛТД с учетом фармакогеномики и фармакометаболомики, определяющих особенности его метаболизма, транспорта и элиминации у конкретного пациента позволит обеспечить индивидуализацию терапии и повысить ее безопасность.
ЦЕЛЬ. Разработка подхода к терапии ламотриджином эпилепсии и других неврологических и психических заболеваний с учетом фармакогеномики и фармакометаболомики для снижения риска нейротоксичности препарата.
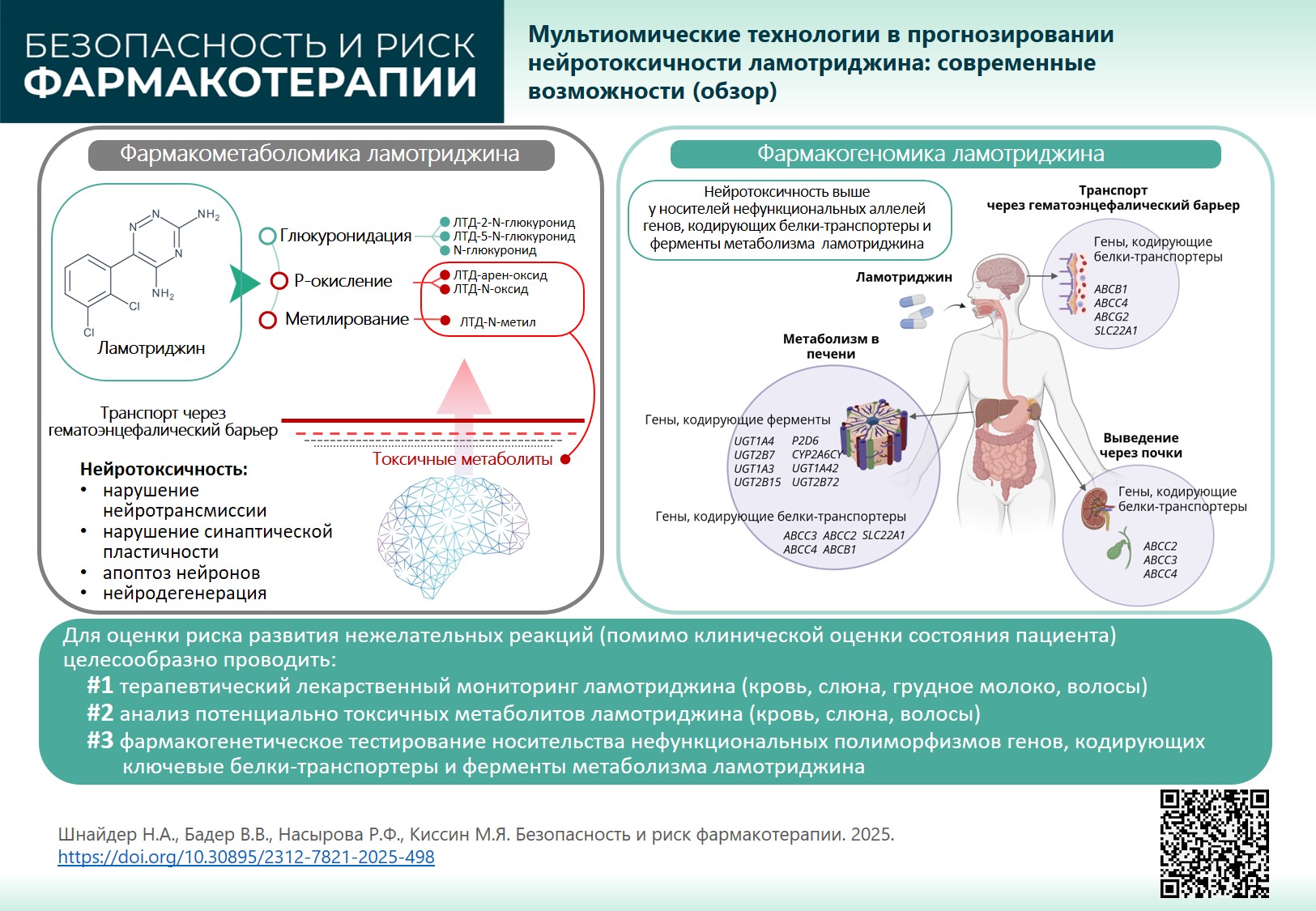
ОБСУЖДЕНИЕ. Метаболизм ЛТД осуществляется в печени глюкуронидацией (основной путь) и Р-окислением (второстепенный путь). В результате образуются как нейтральные, так и токсические (реактивные) метаболиты ЛТД, которые могут длительно циркулировать в крови, проникать через поврежденный гематоэнцефалический барьер у пациентов с терапевтически резистентными эпилептическими приступами и оказывать нейротоксический эффект, запуская или поддерживая механизмы нейродегенерации: нарушение нейротрансмиссии, синаптической пластичности, апоптоз нейронов. Большое значение в нейротоксичности ЛТД играют транспортные белки, участвующие в эффлюксе (выведении) токсических метаболитов из головного мозга в системный кровоток, а также из гепатоцитов в желудочно-кишечный тракт с желчью и через почки с мочой. Генетически детерминированное замедление эффлюкса препарата через гематоэнцефалический барьер (фармакогеномика) повышает нейротоксический потенциал ЛТД.
ВЫВОДЫ. Для оценки риска ЛТД-индуцированных нежелательных реакций наряду с клинической оценкой состояния пациента целесообразно проводить: 1) терапевтический лекарственный мониторинг (кровь, волосы, слюна, грудное молоко); 2) анализ потенциально токсичных метаболитов (кровь, слюна, волосы); 3) фармакогенетическое тестирование носительства нефункциональных полиморфизмов генов, кодирующих ключевые белки-транспортеры и ферменты, участвующие в метаболизме ЛТД. Внедрение результатов фармакогенетического и фармакометаболического тестирования в клиническую практику эпилептолога позволит снизить риск нейротоксичности ЛТД.
Ключевые слова
Об авторах
Н. А. ШнайдерРоссия
Шнайдер Наталья Алексеевна, д-р мед. наук, профессор
ул. Бехтерева, д. 3, Санкт-Петербург, 192019;
ул. Партизана Железняка, д. 1, г. Красноярск, 660022
В. В. Бадер
Россия
Бадер Виолетта Владимировна
ул. Бехтерева, д. 3, Санкт-Петербург, 192019;
наб. Обводного канала, д. 9, Санкт-Петербург, 191167
Р. Ф. Насырова
Россия
Насырова Регина Фаритовна, д-р мед. наук
ул. Бехтерева, д. 3, Санкт-Петербург, 192019;
пр. Ленина, д. 92, г. Тула, 300012
М. Я. Киссин
Россия
Киссин Михаил Яковлевич, д-р мед. наук, профессор
наб. Обводного канала, д. 9, Санкт-Петербург, 191167;
ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
Список литературы
1. Panebianco M, Bresnahan R, Marson AG. Lamotrigine add-on therapy for drug-resistant focal epilepsy. Cochrane Database Syst Rev. 2023;12(12):CD001909. https://doi.org/10.1002/14651858.CD001909.pub4
2. Campbell R, Beall J. Pharmacogenomics of lamotrigine: A possible link to serious cutaneous adverse reactions. Ment Health Clin. 2015;5(2):78–81. https://doi.org/10.9740/mhc.2015.03.078
3. Shilkina OS, Zobova SN, Domoratskaya EA, Dmitrenko DV. Clinical and genetic characteristics of juvenile myoclonic epilepsy. Personalized Psychiatry and Neurology. 2021;1(2):95–105. https://doi.org/10.52667/2712-9179-2021-1-2-95-105
4. Besag FMC, Vasey MJ, Sharma AN, Lam ICH. Efficacy and safety of lamotrigine in the treatment of bipolar disorder across the lifespan: A systematic review. Ther Adv Psychopharmacol. 2021;11:20451253211045870. https://doi.org/10.1177/20451253211045870
5. Hashimoto Y, Kotake K, Watanabe N, et al. Lamotrigine in the maintenance treatment of bipolar disorder. Cochrane Database Syst Rev. 2021;9(9):CD013575. https://doi.org/10.1002/14651858.CD013575.pub2
6. Katayama Y, Terao T, Kamei K, et al. Therapeutic window of lamotrigine for mood disorders: A naturalistic retrospective study. Pharmacopsychiatry. 2014;47(3):111–4. https://doi.org/10.1055/s-0034-1375618
7. Дмитренко ДВ, Шнайдер НА, Егорова АТ. Эпилепсия и беременность. М.: ГЭОТАР-Медиа; 2022. https://doi.org/10.33029/9704-6359-8-EPI-2022-1-296
8. Goo Y, der Nederlanden AM, Bleasel A, et al. Dose monitoring of lamotrigine monotherapy in pregnancy: Are pregnant women with epilepsy currently optimally managed? A systematic review. Ther Drug Monit. 2024;46(2):181–94. https://doi.org/10.1097/FTD.0000000000001186
9. Hope OA, Harris KM. Management of epilepsy during pregnancy and lactation. BMJ. 2023;382:e074630. https://doi.org/10.1136/bmj-2022-074630
10. Anderson GD. Pregnancy-induced changes in pharmacokinetics: A mechanistic-based approach. Clin Pharmacokinet. 2005;44(10):989–1008. https://doi.org/10.2165/00003088-200544100-00001
11. Viale L, Allotey J, Cheong-See F, et al. Epilepsy in pregnancy and reproductive outcomes: A systematic review and meta-analysis. Lancet. 2015;386(10006):1845–52. https://doi.org/1016/S0140-6736(15)00045-8
12. Berry-Noronha A, Manoleehakul P, Rottler A, et al. Risk of adverse pregnancy outcomes associated with antiseizure medications and their indications: A systematic review and meta-analysis. Neurology. 2025;104(3):e210233. https://doi.org/10.1212/WNL.0000000000210233
13. Qian Y, Wu W, Ke C, et al. Toward precision dosing of lamotrigine during pregnancy: Physiologically based pharmacokinetic modeling and simulation. CPT Pharmacometrics Syst Pharmacol. 2025;14(5):929–40. https://doi.org/10.1002/psp4.70007
14. Yan R, Tuo J, Tai Z, et al. Management of anti-seizure medications in lactating women with epilepsy. Front Neurol. 2022;13:1005890. https://doi.org/10.3389/fneur.2022.1005890
15. Hasser C, Ameresekere M, Girgis C, et al. Striking the balance: Bipolar disorder in the perinatal period. Focus (Am Psychiatr Publ). 2024;22(1):3–15. https://doi.org/10.1176/appi.focus.20230020
16. Nordmo E, Aronsen L, Wasland K, et al. Severe apnea in an infant exposed to lamotrigine in breast milk. Ann Pharmacother. 2009;43(11):1893–97. https://doi.org/10.1345/aph.1M254
17. Clark CT, Klein AM, Perel JM, et al. Lamotrigine dosing for pregnant patients with bipolar disorder. Am J Psychiatry. 2013;170(11):1240–7. https://doi.org/10.1176/appi.ajp.2013.13010006
18. Nucera B, Brigo F, Trinka E, Kalss G. Treatment and care of women with epilepsy before, during, and after pregnancy: A practical guide. Ther Adv Neurol Disord. 2022;15:17562864221101687. https://doi.org/10.1177/17562864221101687
19. Arfman IJ, Wammes-van der Heijden EA, Ter Horst PGJ, et al. Therapeutic drug monitoring of antiepileptic drugs in women with epilepsy before, during, and after pregnancy. Clin Pharmacokinet. 2020;59(4):427–45. https://doi.org/10.1007/s40262-019-00845-2
20. Shawahna R, Zaid L. Concentrations of antiseizure medications in breast milk of lactating women with epilepsy: A systematic review with qualitative synthesis. Seizure. 2022;98:57–70. https://doi.org/10.1016/j.seizure.2022.03.017
21. Babu M, Snyder M. Multi-omics profiling for health. Mol Cell Proteomics. 2023;22(6):100561. https://doi.org/10.1016/j.mcpro.2023.100561
22. Zhou Y, Wang X, Li H, et al. Polymorphisms of ABCG2, ABCB1 and HNF4α are associated with lamotrigine trough concentrations in epilepsy patients. Drug Metab Pharmacokinet. 2015;30(4):282–7. https://doi.org/10.1016/j.dmpk.2015.05.002
23. Römermann K, Helmer R, Löscher W. The antiepileptic drug lamotrigine is a substrate of mouse and human breast cancer resistance protein (ABCG2). Neuropharmacology. 2015;93:7–14. https://doi.org/10.1016/j.neuropharm.2015.01.015
24. Ажигова АМ, Брутян АГ, Власов ПН. Фармакогеномика ламотриджина (обзор литературы). Анналы клинической и экспериментальной неврологии. 2021;15(2):59–72. https://doi.org/10.25692/ACEN.2021.2.8
25. Zelcer N, van de Wetering K, de Waart R, et al. Mice lacking Mrp3 (Abcc3) have normal bile salt transport, but altered hepatic transport of endogenous glucuronides. J Hepatol. 2006;44(4):768–75. https://doi.org/10.1016/j.jhep.2005.07.022
26. Dickens D, Owen A, Alfirevic A, et al. Lamotrigine is a substrate for OCT1 in brain endothelial cells. Biochem Pharmacol. 2012;83(6):805–14. https://doi.org/10.1016/j.bcp.2011.12.032
27. Vázquez M, Fagiolino P. The role of efflux transporters and metabolizing enzymes in brain and peripheral organs to explain drug-resistant epilepsy. Epilepsia Open. 2022;1(l1):S47–S58. https://doi.org/10.1002/epi4.12542
28. Mitra-Ghosh T, Callisto SP, Lamba JK, et al. PharmGKB summary: Lamotrigine pathway, pharmacokinetics and pharmacodynamics. Pharmacogenet Genomics. 2020;30(4):81–90. https://doi.org/10.1097/FPC.0000000000000397
29. Ademuwagun IA, Rotimi SO, Syrbe S, et al. Voltage gated sodium channel genes in epilepsy: Mutations, functional studies, and treatment dimensions. Front Neurol. 2021;12:600050. https://doi.org/10.3389/fneur.2021.600050
30. Pejanovic-Skobic N, Markovic I, Bozina N, Basic S. Lack of association of SCN2A rs17183814 polymorphism with the efficacy of lamotrigine monotherapy in patients with focal epilepsy from Herzegovina area, Bosnia and Herzegovina. Epilepsy Res. 2019;158:106221. https://doi.org/10.1016/j.eplepsyres.2019.106221
31. Glauser TA, Holland K, O’Brien VP, et al. Pharmacogenetics of antiepileptic drug efficacy in childhood absence epilepsy. Ann Neurol. 2017;81(3):444–53. https://doi.org/10.1002/ana.24886
32. Robakis TK, Holtzman J, Stemmle PG, et al. Lamotrigine and GABAA receptor modulators interact with menstrual cycle phase and oral contraceptives to regulate mood in women with bipolar disorder. J Affect Disord. 2015;175:108–15. https://doi.org/10.1016/j.jad.2014.12.040
33. Costa B, Vale N. Understanding lamotrigine’s role in the CNS and possible future evolution. Int J Mol Sci. 2023;24(7):6050. https://doi.org/10.3390/ijms24076050
34. Paraskevas GP, Triantafyllou NI, Kapaki E, et al. Add-on lamotrigine treatment and plasma glutamate levels in epilepsy: Relation to treatment response. Epilepsy Res. 2006;70(2–3):184–9. https://doi.org/10.1016/j.eplepsyres.2006.05.004
35. Zhao T, Zhang HL, Feng J, et al. Impact of UGT1A4 and UGT2B7 polymorphisms on lamotrigine plasma concentration in patients with bipolar disorder. Pharmacogenet Genomics. 2024;34(8):261–7. https://doi.org/10.1097/FPC.0000000000000543
36. Petrenaite V, Öhman I, Jantzen FPT, Ekström L. Effect of UGT1A4, UGT2B7, UGT2B15, UGT2B17 and ABC1B polymorphisms on lamotrigine metabolism in Danish patients. Epilepsy Res. 2022;182:106897. https://doi.org/10.1016/j.eplepsyres.2022.106897
37. Kim SC, Kim MG. Meta-analysis of the Influence of UGT genetic polymorphisms on lamotrigine concentration. Basic Clin Pharmacol Toxicol. 2019;124(2):163–9. https://doi.org/10.1111/bcpt.13120
38. Liu L, Zhao L, Wang Q, et al. Influence of valproic acid concentration and polymorphism of UGT1A4*3, UGT2B7 –161C > T and UGT2B7*2 on serum concentration of lamotrigine in Chinese epileptic children. Eur J Clin Pharmacol. 2015;71(11):1341–7. https://doi.org/10.1007/s00228-015-1925-9
39. Wang Q, Zhao L, Liang M, et al. Effects of UGT2B7 genetic polymorphisms on serum concentrations of valproic acid in Chinese children with epilepsy comedicated with lamotrigine. Ther Drug Monit. 2016;38(3):343–9. https://doi.org/10.1097/FTD.0000000000000271
40. Edavana VK, Dhakal IB, Williams S, et al. Potential role of UGT1A4 promoter SNPs in anastrozole pharmacogenomics. Drug Metab Dispos. 2013;41(4):870–7. https://doi.org/10.1124/dmd.112.048157
41. Reimers A, Sjursen W, Helde G, Brodtkorb E. Frequencies of UGT1A4*2 (P24T) and *3 (L48V) and their effects on serum concentrations of lamotrigine. Eur J Drug Metab Pharmacokinet. 2016;41(2):149–55. https://doi.org/10.1007/s13318-014-0247-0
42. Petrenaite V, Öhman I, Ekström L, et al. UGT polymorphisms and lamotrigine clearance during pregnancy. Epilepsy Res. 2018;140:199–208. https://doi.org/10.1016/j.eplepsyres.2018.01.011
43. Wang Z, Wong T, Hashizume T, et al. Human UGT1A4 and UGT1A3 conjugate 25-hydroxyvitamin D3: metabolite structure, kinetics, inducibility, and interindividual variability. Endocrinology. 2014;155(6):2052–63. https://doi.org/10.1210/en.2013-2013
44. Mimura Y, Maruo Y, Ohta Y, et al. Effect of common exon variant (p.P364L) on drug glucuronidation by the human UDP-glucuronosyltransferase 1 family. Basic Clin Pharmacol Toxicol. 2011;109(6):486–93. https://doi.org/10.1111/j.1742-7843.2011.00754.x
45. Blanca Sánchez M, Herranz JL, Leno C, et al. UGT2B7 –161C>T polymorphism is associated with lamotrigine concentration-to-dose ratio in a multivariate study. Ther Drug Monit. 2010;32(2):177–84. https://doi.org/10.1097/FTD.0b013e3181ceecc6
46. Singkham N, Towanabut S, Lertkachatarn S, Punyawudho B. Influence of the UGT2B7 –161C>T polymorphism on the population pharmacokinetics of lamotrigine in Thai patients. Eur J Clin Pharmacol. 2013;69(6):1285–91. https://doi.org/10.1007/s00228-012-1449-5
47. Milosheska D, Lorber B, Vovk T, et al. Pharmacokinetics of lamotrigine and its metabolite N-2-glucuronide: Influence of polymorphism of UDP-glucuronosyltransferases and drug transporters. Br J Clin Pharmacol. 2016;82(2):399–411. https://doi.org/10.1111/bcp.12984
48. Provenzani A, Labbozzetta M, Notarbartolo M, et al. Rash and multiorgan dysfunction following lamotrigine: could genetic be involved? Int J Clin Pharm. 2015;37(5):682–6. https://doi.org/10.1007/s11096-015-0158-4
49. Rowland A, Elliot DJ, Williams JA, et al. In vitro characterization of lamotrigine N2-glucuronidation and the lamotrigine-valproic acid interaction. Drug Metab Dispos. 2006;34(6):1055–62. https://doi.org/10.1124/dmd.106.009340
50. Lu W, Uetrecht JP. Possible bioactivation pathways of lamotrigine. Drug Metab Dispos. 2007;35(7):1050–6. https://doi.org/10.1124/dmd.107.015271
51. Chen H, Grover S, Yu L, et al. Bioactivation of lamotrigine in vivo in rat and in vitro in human liver microsomes, hepatocytes, and epidermal keratinocytes: characterization of thioether conjugates by liquid chromatography/mass spectrometry and high field nuclear magnetic resonance spectroscopy. Chem Res Toxicol. 2010;23(1):159–70. https://doi.org/10.1021/tx9003243
52. Nasyrova RF, Shnayder NA, Osipova SM, et al. Genetic predictors of antipsychotic efflux impairment via blood-brain barrier: Role of transport proteins. Genes (Basel). 2023;14(5):1085. https://doi.org/10.3390/genes14051085
53. Klarica Domjanović I, Lovrić M, Trkulja V, et al. Interaction between ABCG2 421C>A polymorphism and valproate in their effects on steady-state disposition of lamotrigine in adults with epilepsy. Br J Clin Pharmacol. 2018;84(9):2106–19. https://doi.org/10.1111/bcp.13646
54. Shen CH, Zhang YX, Lu RY, et al. Specific OCT1 and ABCG2 polymorphisms are associated with lamotrigine concentrations in Chinese patients with epilepsy. Epilepsy Res. 2016;127:186–90. https://doi.org/10.1016/j.eplepsyres.2016.09.004
55. Qu J, Zhou BT, Yin JY, et al. ABCC2 polymorphisms and haplotype are associated with drug resistance in Chinese epileptic patients. CNS Neurosci Ther. 2012;18(8):647–51. https://doi.org/10.1111/j.1755-5949.2012.00336.x
56. Sasaki T, Hirota T, Ryokai Y, et al. Systematic screening of human ABCC3 polymorphisms and their effects on MRP3 expression and function. Drug Metab Pharmacokinet. 2011;26(4):374–86. https://doi.org/10.2133/dmpk.dmpk-10-rg-103
57. Nies AT, Jedlitschky G, König J, et al. Expression and immunolocalization of the multidrug resistance proteins, MRP1-MRP6 (ABCC1-ABCC6), in human brain. Neuroscience. 2004;129(2):349–60. https://doi.org/10.1016/j.neuroscience.2004.07.051
58. Rius M, Nies AT, Hummel-Eisenbeiss J, et al. Cotransport of reduced glutathione with bile salts by MRP4 (ABCC4) localized to the basolateral hepatocyte membrane. Hepatology. 2003;38(2):374–84. https://doi.org/10.1053/jhep.2003.50331
59. Berthier J, Arnion H, Saint-Marcoux F, Picard N. Multidrug resistance-associated protein 4 in pharmacology: Overview of its contribution to pharmacokinetics, pharmacodynamics and pharmacogenetics. Life Sci. 2019;231:116540. https://doi.org/10.1016/j.lfs.2019.06.015
60. Баженова АЯ, Миронов КО, Кравченко АВ, Акимкин ВГ. Фармакогенетические эффекты однонуклеотидных полиморфизмов, влияющих на метаболизм антиретровирусных препаратов. ВИЧ-инфекция и иммуносупрессии. 2022;14(3):65–76. https://doi.org/10.22328/2077-9828-2022-14-3-65-76
61. Pucci V, Bugamelli F, Baccini C, Raggi MA. Analysis of lamotrigine and its metabolites in human plasma and urine by micellar electrokinetic capillary chromatography. Electrophoresis. 2005;26(4–5):935–42. https://doi.org/10.1002/elps.200410208
62. Wood KE, Palmer KL, Krasowski MD. Correlation of elevated lamotrigine and levetiracetam serum/plasma levels with toxicity: A long-term retrospective review at an academic medical center. Toxicol Rep. 2021;8:1592–8. https://doi.org/10.1016/j.toxrep.2021.08.005
63. Close BR, Banks CJ. Seizures secondary to lamotrigine toxicity in a two-year-old. Ann Pharmacother. 2010;44(6):1112–5. https://doi.org/10.1345/aph.1M617
64. Moore PW, Donovan JW, Burkhart KK, Haggerty D. A case series of patients with lamotrigine toxicity at one center from 2003 to 2012. Clin Toxicol (Phila). 2013;51(7):545–9. https://doi.org/10.3109/15563650.2013.818685
65. Chiew AL, Isbister GK, Nguyen K, et al. Clinical effects of acute lamotrigine overdose (ATOM-10). Clin Toxicol (Phila). 2025;63(5):310–6. https://doi.org/10.1080/15563650.2025.2471906
66. Насырова РФ, Незнанов НГ, ред. Клиническая психофармакогенетика. СПб: ДЕАН; 2019.
67. Alyahya B, Friesen M, Nauche B, Laliberté M. Acute lamotrigine overdose: a systematic review of published adult and pediatric cases. Clin Toxicol (Phila). 2018;56(2):81–9. https://doi.org/10.1080/15563650.2017.1370096
68. Chou M, Lai L, Neveu M, Ritchie A. Toxic optic neuropathy associated with lamotrigine and levetiracetam dual therapy. BMJ Case Rep. 2024;17(3):e256961. https://doi.org/10.1136/bcr-2023-256961
69. Шнайдер НА, Гречкина ВВ, Архипов ВВ, Насырова РФ. Фармакогенетически-информированная фармакометаболомика как инновационный подход к оценке безопасности и риска фармакотерапии препаратами вальпроевой кислоты. Безопасность и риск фармакотерапии. 2023;11(4):450–62. https://doi.org/10.30895/2312-7821-2023-386
70. Min KL, Ryu JY, Chang MJ. Development and clinical applications of the dried blood spot method for therapeutic drug monitoring of anti-epileptic drugs. Basic Clin Pharmacol Toxicol. 2019;125(3):215–36. https://doi.org/10.1111/bcpt.13269
71. Milosavljevic F, Manojlovic M, Matkovic L, et al. Pharmacogenetic variants and plasma concentrations of antiseizure drugs: A syste matic review and meta-analysis. JAMA Netw Open. 2024;7(8):e2425593. https://doi.org/10.1001/jamanetworkopen.2024.25593
72. Cao H, Jiang Y, Sun Q, et al. Simultaneous monitoring of seven antiepileptic drugs by dried blood spot and dried plasma spot sampling: method validation and clinical application of a LC-MS/MS-based technique. J Pharm Biomed Anal. 2024;243:116099. https://doi.org/10.1016/j.jpba.2024.116099
73. Pelcová M, Ďurčová V, Šmak P, et al. Non-invasive therapeutic drug monitoring: LC-MS validation for lamotrigine quantification in dried blood spot and oral fluid/saliva. J Pharm Biomed Anal. 2025;262:116877. https://doi.org/10.1016/j.jpba.2025.116877
74. Kuczynska J, Karas-Ruszczyk K, Zakrzewska A, et al. Comparison of plasma, saliva, and hair lamotrigine concentrations. Clin Biochem. 2019;74:24–30. https://doi.org/10.1016/j.clinbiochem.2019.09.009
75. Шнайдер НА, Гречкина ВВ, Архипов ВВ, Насырова РФ. Роль фармакогенетического тестирования в оценке риска и безопасности применения вальпроатов: этнический аспект (обзор). Безопасность и риск фармакотерапии. 2024;12(2):14–36. https://doi.org/10.30895/2312-7821-2024-12-2-14-36
76. Amaro-Álvarez L, Cordero-Ramos J, Calleja-Hernández MÁ. Exploring the impact of pharmacogenetics on personalized medicine: A systematic review. Farm Hosp. 2024;48(6):299–309. https://doi.org/10.1016/j.farma.2023.12.004
77. Gosselin S, Ghannoum M, Hoffman RS. Hemodialysis for lamotrigine poisoning. Am J Emerg Med. 2020;38(2):403–4. https://doi.org/10.1016/j.ajem.2019.158385
78. Agrawal A, Nogar JN, Koenig S. Management of lamotrigine overdose using hemodialysis. Am J Emerg Med. 2019;37(8):1603.e1–1603.e2. https://doi.org/10.1016/j.ajem.2019.05.026
Дополнительные файлы
Рецензия
Для цитирования:
Шнайдер Н.А., Бадер В.В., Насырова Р.Ф., Киссин М.Я. Мультиомические технологии в прогнозировании нейротоксичности ламотриджина: современные возможности (обзор). Безопасность и риск фармакотерапии. https://doi.org/10.30895/2312-7821-2025-498
For citation:
Shnayder N.A., Bader V.V., Nasyrova R.F., Kissin M.Ya. Multi-Omics in Predicting Lamotrigine Neurotoxicity: Current Opportunities (Review). Safety and Risk of Pharmacotherapy. (In Russ.) https://doi.org/10.30895/2312-7821-2025-498