Перейти к:
Фармакогенетические предикторы лекарственного поражения печени, ассоциированного с антибиотиками у детей: результаты наблюдательного исследования
https://doi.org/10.30895/2312-7821-2024-392
Резюме
ВВЕДЕНИЕ. Механизмы развития лекарственно-индуцированного заболевания (ЛИЗ) печени у детей, ассоциированного с применением антибиотиков, в настоящее время изучены недостаточно. Наличие у пациентов определенных генотипов повышает вероятность развития ЛИЗ печени, в связи с чем актуальной задачей является выявление у детей ассоциированных с этим заболеванием фармакогенетических маркеров.
ЦЕЛЬ. Выявление фармакогенетических биомаркеров при впервые возникающем лекарственном поражении печени у детей, связанном с применением тигециклина и меропенема.
МАТЕРИАЛЫ И МЕТОДЫ. В проспективном наблюдательном исследовании в ГБУЗ «Морозовская ДГКБ ДЗМ» в период с 01.02.2020 по 01.09.2021 оценена частота и изучена структура нежелательных реакций (НР), связанных с применением антибиотиков, у 100 детей в возрасте от 0 до 17 лет (44 мальчика, 56 девочек) в критических состояниях. Пациентам, у которых были выявлены НР (n=30), проведено фармакогенетическое тестирование для изучения возможного механизма их развития. ДНК выделяли из соскоба буккального эпителия с помощью панели iPLEX Pro PGx (Agena Bioscience) в модификации «VeriDose® Core Panel». Исследовано 68 однонуклеотидных полиморфизмов (single nucleotide polymorphisms, SNPs) и коротких инсерционно-делеционных полиморфизмов (short insertions and deletions, INDELs), включавших в себя 5 анализов вариаций числа копий (copy number variant, CNV).
РЕЗУЛЬТАТЫ. Шансы развития ЛИЗ печени, ассоциированного с применением меропенема и тигециклина, были выше у носителей гомозиготного генотипа цитохрома CYP3A5*3/*3 (ОШ: 12,6; 95% ДИ: 1,9–79,4, r=6,54, р=0,011) по сравнению с пациентами с гетерозиготным генотипом CYP3A5*1А/*3. В отсутствие гетерозиготного генотипа CYP3A5*1А/*3 шансы развития ЛИЗ печени на фоне применения меропенема и тигециклина были еще более высокими (ОШ: 17,14; 95% ДИ: 1,79–16,3, r=6,24, р=0,013). Точность прогностического значения выявления генотипа CYP3A5*3/*3 для прогнозирования риска развития ЛИЗ печени, ассоциированного с применением этих антибиотиков, составила 76,7%, чувствительность — 82% и специфичность — 74%. У детей с ЛИЗ печени на фоне применения меропенема и тигециклина чаще, чем у детей с иными НР, выявлялось гетерозиготное носительство полиморфизма rs4149056 генотипа SLCO1B1*1/*5 (r=9,8, р=0,002).
ВЫВОДЫ. Показана прогностическая значимость выявления гомозиготного генотипа цитохрома CYP3A*3/*3 как индикатора потенциального риска развития ЛИЗ печени, ассоциированного с применением меропенема и тигециклина у детей в критических состояниях.
Исследование зарегистрировано на платформе ClinicalTrials.gov, идентификатор NCT04141657, дата регистрации 24.10.2019.
Ключевые слова
Для цитирования:
Власова А.В., Шубина Ю.Ф., Газиев И.Р., Сычев Д.А. Фармакогенетические предикторы лекарственного поражения печени, ассоциированного с антибиотиками у детей: результаты наблюдательного исследования. Безопасность и риск фармакотерапии. 2024;12(2):167-177. https://doi.org/10.30895/2312-7821-2024-392
For citation:
Vlasova A.V., Shubina Yu.F., Gaziev I.R., Sychev D.A. Pharmacogenomic Predictors of Antibiotic-Associated Drug-Induced Liver Injury in Critically Ill Children: Observational Study Results. Safety and Risk of Pharmacotherapy. 2024;12(2):167-177. (In Russ.) https://doi.org/10.30895/2312-7821-2024-392
ВВЕДЕНИЕ
Лекарственно-индуцированное заболевание (ЛИЗ) печени при проведении антибиотикотерапии является самой частой нежелательной реакцией (НР), но механизм его развития окончательно не установлен [1][2]. По итогам 30 лет исследований фармакокинетики антибиотиков появились доказательства необходимости проведения фармакогенетических исследований при их применении [3]. Предполагается, что наличие у пациентов некоторых генотипов повышает вероятность развития ЛИЗ печени. Так, было показано, что присутствие генотипа HLA B*5701 генов системы человеческих лейкоцитарных антигенов (human leukocyte antigens, HLA) в 80,6 раза повышает риск развития ЛИЗ, вызванного флуклоксациллином, а отсутствие данного гаплотипа HLA имеет 88% отрицательную прогностическую значимость [4][5]. Следует отметить, что особенности фармакогенетических показателей, способных повлиять на развитие ЛИЗ печени, недостаточно изучены [6][7]. Влияние генотипа HLA на шансы развития ЛИЗ печени у детей, в отличие от взрослых, не было очевидным [8]. Получены противоречивые данные о значимости гетерозиготного носительства аллеля SLCO1B1*5 в развитии флуклоксациллин- и ко-амоксициллин-индуцированного поражения печени у детей [9].
Ранее нами была описана клиническая картина холестатического идиосинкразического поражения печени, связанного с применением антибиотиков у детей в критических состояниях: шансы развития впервые возникающего ЛИЗ печени были более высокими при применении тигециклина (отношение шансов (ОШ): 4,07; 95% доверительный интервал (ДИ: 1,32–12,50) и меропенема (ОШ: 1,84; 95% ДИ: 1,01–3,36), чем при применении других препаратов [10]. Поэтому поиск фармакогенетических биомаркеров, ассоциированных с риском развития ЛИЗ печени на фоне антибиотикотерапии у детей, является актуальной проблемой.
Цель работы — выявление фармакогенетических биомаркеров при впервые возникающем лекарственном поражении печени у детей, связанном с применением тигециклина и меропенема.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективном наблюдательном исследовании, проводившемся в ГБУЗ «Морозовская ДГКБ ДЗМ», оценена частота и изучена структура НР, ассоциированных с применением антибиотиков у 100 детей (44 мальчика, 56 девочек) в возрасте от 0 до 17 лет включительно в критическом состоянии с нозокомиальной инфекцией. Средний возраст детей составил 5,36±5,50 года, значимых различий по полу и возрасту не отмечено. Период проведения исследования — с 01.02.2020 по 01.09.2021, при этом с 20.02.2020 до 30.11.2020 на время приема стационаром пациентов с новой коронавирусной инфекцией COVID-19 набор пациентов в исследование был приостановлен.
Включение пациентов в исследование проводилось на момент развития инфекции, при этом у 81 ребенка инфекция манифестировала во время пребывания в отделении реанимации и интенсивной терапии (ОРИТ) на фоне течения основного заболевания или состояния после оперативного вмешательства, у 19 детей инфекция, вызванная резистентными возбудителями, стала причиной госпитализации в ОРИТ.
Критериями включения пациентов в исследование были наличие:
- инфекции с факторами риска полирезистентных возбудителей — типы II–IV при стратификации по СКАТ1;
- симптомокомплекса по критериям соответствия нозокомиальной инфекции, определенной, вероятной или возможной на основе микробиологических данных по определению Центров по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention, CDC)2и Европейского центра профилактики и контроля заболеваний (European Centre for Disease Prevention and Control, ECDC)3;
- положительных результатов микробиологического исследования биологического материала с выделением этиологически значимого микроорганизма с высоковероятным нозокомиальным происхождением;
- применение антибиотиков меропенем и тигециклин.
Критерии невключения в исследование: наличие новой коронавирусной инфекции COVID-19; наличие онкологических заболеваний; внебольничные инфекции без факторов риска полирезистентных возбудителей — тип I при стратификации по СКАТ; терминальные стадии недостаточности органов и систем как конкурирующие с инфекцией за основной диагноз или состояние. Другие критерии исключения: дети, находящиеся под опекой.
Предыдущая/сопутствующая терапия при включении в исследование не учитывалась.
Все пациенты имели показания к применению антимикробных препаратов в соответствии с установленными критериями соответствия стандартному случаю определения нозокомиальной инфекции, вызванной резистентными микроорганизмами, по критериям CDC и ECDC4.
Оценочные процедуры в рамках проспективного наблюдательного протокола. Основой протокола оценочных процедур настоящего исследования безопасности фармакотерапии у детей явились руководящие принципы Европейского агентства по лекарственным средствам (European Medicines Agency, ЕМА) по определению целей, дизайна исследований и методических инструментов для выбора педиатрической дозы [11].
Для выявления и анализа проявлений ЛИЗ печени для всех включенных пациентов в рамках проспективного наблюдательного протокола был использован метод глобальных триггеров (ГТ) (Global Trigger Tool), разработанный в Институте усовершенствования здравоохранения (Institute for Healthcare Improvement, IHI) [12–14].
Триггеры, потребовавшие усиленного мониторинга и дифференциальной диагностики: аланиновая трансаминаза (АЛТ) ≥3 высших пороговых норм (ВПН), но менее ≤8 ВПН; билирубин ≥2 ВПН (или более 35% от уровня прямого билирубина); международное нормализованное отношение (МНО) ≥1,5; фибриноген ≤1,2 г/л; заместительная почечная терапия; судорожный синдром, возникший впервые в жизни; увеличение интервала QT или QTc (корригированного интервала QT) ≥25%. Триггеры, потребовавшие отмены предполагаемого значимого препарата: QTc ≥600 мс или увеличение интервала QT или QTc на 50% и более; симптомы поражения печени или гиперчувствительность; АЛТ ≥8 ВПН; закон Xая: АЛТ ≥3 ВПН и билирубин ≥2 ВПН (>35% прямой) или МНО >1,5 [13][15][16].
Биохимические исследования выполнены на автоматическом биохимическом анализаторе серии AU 5800 производства Beckman Coulter, США, с использованием реагентов и расходных материалов того же производителя.
Материалом исследования полиморфизмов генов являлась ДНК, выделенная из соскоба буккального эпителия. Изучение полиморфизмов проведено с использованием панели iPLEX Pro PGx (Agena Bioscience) в модификации «VeriDose® Core Panel», позволяющей провести детекцию наиболее релевантных вариантов в основных генах ABCB1, CYP1A2, CYP2B6, CYP2C19, CYP2D6, CYP3A4, CYP3A5, DRD2, F2, F5, GLP1R, MTHFR, OPRM1, PNPLA5, SLCO1B1, SULT4A1, VKORC1, участвующих в путях метаболизма как антимикробных препаратов, так и других лекарственных средств, широко применяемых для сопутствующей терапии. Панель предоставляет информацию о 68 однонуклеотидных полиморфизмах (Single Nucleotide Polymorphisms, SNPs) и коротких инсерционно-делеционных полиморфизмах (short insertions and deletions, INDELs), включавших в себя 5 анализов вариаций числа копий (copy number variant, CNV).
Этическая экспертиза. На первоначальном этапе планирования исследования в 2019 г. был сформирован протокол на платформе ClinicalTrials.gov ID: NCT04141657, Unique Protocol ID: 07819001. Протокол наблюдательного клинического исследования одобрен локальным независимым этическим комитетом (ЛНЭК) ГБУЗ «Морозовская ДГКБ ДЗМ».
Статистическая обработка данных. Для установления значимости параметров как предикторов безопасности фармакотерапии применялись методы параметрической и непараметрической статистики. Для проведения статистической обработки результатов исследования использован пакет компьютерных программ IBM SPSS Statistics v26. Оценку различий в группах проводили методами непараметрической статистики. При анализе были использованы непараметрические критерии χ² Пирсона, изучение отношения шансов. Носители разных аллелей полиморфных вариантов были разбиты на две группы: гомозиготы «дикого» типа и носители полиморфного аллеля в гомо- и гетерозиготном состоянии. Распределение частот генотипов в исследуемых группах оценивалось на соответствие равновесию Харди–Вайнберга (р>0,05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проявления НР на фоне применения антибиотиков были выявлены у 30 из 100 детей, включенных в исследование. Пациенты с НР были распределены на подгруппы: подгруппа 1 — «ЛИЗ печени» (n=11); подгруппа 2 — «иные НР» (n=19). Более подробно характеристика всех НР была нами представлена ранее [13].
Подгруппа 1 «ЛИЗ печени» включала 11 пациентов, критериями ЛИЗ печени были иктеричность кожных покровов и слизистых оболочек на фоне крайней выраженности биохимических признаков закона Xая [16]: активность АЛТ ≥8 ВПН, уровень билирубина более 2 ВПН (>35% прямой), МНО >1,5, уровень фибриногена ≤1,2 г/л. Клиническая картина у этих 11 детей соответствовала идиосинкразическому холестатическому гепатиту — ЛИЗ печени. В данной группе ЛИЗ печени ассоциировалось с применением тигециклина (ОШ: 4,07; 95% ДИ: 1,32–12,50) и меропенемом (ОШ: 1,84; 95% ДИ: 1,01–3,36). ЛИЗ печени сопровождалось развитием летального исхода у 5 пациентов или разрешилось у 6 пациентов в течение нескольких недель после появления [13].
Подгруппа 2 «иные НР» состояла из 19 пациентов. У 8 из этих детей были выявлены отклонения биохимических показателей крови (повышение уровней креатинина и цистатина С) без клинических проявлений нарушения функции печени, у 3 — нефротоксичность. Клинические проявления НР со стороны сердечно-сосудистой системы были зарегистрированы у 2 детей, желудочно-кишечного тракта — у 2 детей, нейротоксические и гематологические отклонения (эозинофилия) — у 2 детей. Ассоциации развития НР с применением конкретных антибиотиков или препаратов для сопутствующей терапией у пациентов в данной подгруппе выявлено не было. Развитие иных НР сопровождались летальным исходом у 7 пациентов, выздоровлением — у 12.
На следующем этапе было изучено влияние фармакогенетических маркеров на реализацию ЛИЗ печени, ассоциированного с антибиотиками, для чего провели анализ шансов развития ЛИЗ печени у 30 пациентов, у которых были выявлены НР на фоне применения антибиотиков (табл. 1). Частота встречаемости аллелей генов в системе транспортеров и некоторых важных молекул соответствовала закону Харди–Вайнберга.
Таблица 1. Носительство фармакогенетических маркеров панели iPLEX Pro PGx (Agena Bioscience) у детей, у которых были выявлены нежелательные реакции при применении антибиотиков, и оценка на соответствие равновесию Харди–Вайнберга (количество пациентов n=30)
Table 1. Carriage of pharmacogenetic markers of the iPLEX Pro PGx panel (Agena Bioscience) in children who had antibiotic-associated adverse drug reactions, with Hardy–Weinberg equilibrium assessment (number of patients n=30)
|
Полиморфизм Polymorphism |
Генотип Genotype |
Количество носителей генотипа, чел. Number of carriers, pers |
Частота генотипа, % Genotype prevalence, % |
Равновесие Харди–Вайнберга Hardy–Weinberg equilibrium |
|
|
Критерий χ² Пирсона Pearson’s χ² |
Уровень значимости р Significance level, p |
||||
|
ABCB1 rs1045642 |
АА |
11 |
38 |
2,6 |
0,26 |
|
AG |
10 |
34 |
|||
|
GG |
8 |
28 |
|||
|
COMT rs4680 |
A/A |
6 |
20 |
0,5 |
0,7 |
|
A/G |
17 |
57 |
|||
|
G/G |
7 |
23 |
|||
|
DRD2 rs1800497 |
WT/WT |
20 |
67 |
0,5 |
1,2 |
|
Taq1A/WT |
10 |
33 |
|||
|
F2 rs1799963 |
WT/WT |
28 |
93 |
0,03 |
0,9 |
|
G20210/WT |
2 |
7 |
|||
|
F5 rs6025 |
WT/WT |
27 |
90 |
0,08 |
0,9 |
|
R506Q/WT |
3 |
10 |
|||
|
GLP1R rs1042044 |
A/A |
6 |
21 |
0,017 |
0,9 |
|
A/C |
14 |
48 |
|||
|
C/C |
9 |
31 |
|||
|
GLP1R rs6923761 |
G/G |
13 |
43 |
0,89 |
0,63 |
|
A/G |
17 |
57 |
|||
|
GLP1R rs2300615 |
T/T |
18 |
62 |
1,59 |
0,45 |
|
G/T |
11 |
38 |
|||
|
MTHFR rs1801133 |
G/G |
19 |
66 |
1,26 |
0,53 |
|
A/G |
10 |
34 |
|||
|
MTHFR rs1801131 |
T/T |
18 |
60 |
0,14 |
0,93 |
|
G/T |
10 |
33 |
|||
|
G/G |
2 |
7 |
|||
|
OPRM1 rs1799971 |
A/A |
23 |
77 |
0,52 |
0,77 |
|
A/G |
7 |
23 |
|||
|
PNPLA5 rs5764010 |
C/C |
23 |
77 |
0,52 |
0,77 |
|
C/T |
7 |
23 |
|||
|
SLCO1B1 rs4149056 |
*1/*1 |
24 |
80 |
0,37 |
0,83 |
|
*1/*5 |
6 |
20 |
|||
|
SULT4A1 rs763120 |
T/T |
22 |
76 |
0,55 |
0,76 |
|
C/T |
7 |
24 |
|||
|
VKORC1 rs9923231 |
*1/*3 |
18 |
62 |
1,77 |
0,41 |
|
*1/*2 |
8 |
28 |
|||
|
*2/*3 |
3 |
10 |
|||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
У детей — носителей аллелей цитохрома Р-450 (таблица 2 «Носительство фармакогенетических маркеров панели iPLEX Pro PGx (Agena Bioscience) для цитохрома Р-450 у детей, у которых были выявлены нежелательные реакции при применении антибиотиков (количество пациентов n=30)», опубликована на сайте журнала4) наименьшую долю в исследуемой популяции составили носители минорных аллелей изофермента CYP2D6 — 5 (16,7%) пациентов, наибольшую — носители полиморфизмов генов изофермента CYP3A5 — 30 (100%) пациентов, CYP2B6 — 29 (97%) пациентов, CYP1А2 — 28 пациентов (94%) и CYP3A4 — 26 (86%) пациентов (рис. 1).
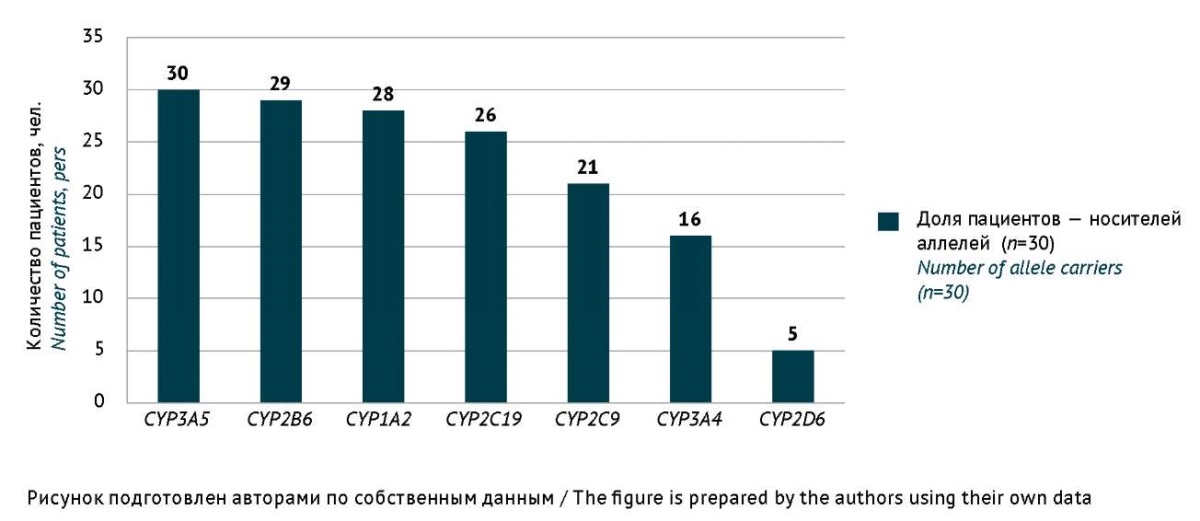
Рис. 1. Полиморфизмы цитохрома Р-450 у детей, у которых были выявлены нежелательные реакции при применении антибиотиков (количество пациентов n=30)
Fig. 1. Cytochrome P450 polymorphisms in children who had antibiotic-associated adverse drug reactions (number of patients n=30)
Результаты исследования фармакогенетических маркеров с целью выявления их влияния на развитие ЛИЗ печени, ассоциированного с применением меропенема и тигециклина, представлены в таблицах 2–4. Шансы развития ЛИЗ печени, ассоциированного с меропенемом и тигециклином, были выше у носителей гомозиготного генотипа цитохрома CYP3A5*3/*3 (ОШ: 12,6; 95% ДИ: 1,9–79,4, коэффициент корреляции r=6,54, уровень значимости р=0,011) по сравнению с пациентами с гетерозиготным генотипом CYP3A5*1А/*3 (табл. 3). В отсутствие гетерозиготного генотипа CYP3A5*1А/*3 шансы развития YЛИЗ печени, ассоциированного с меропенемом и тигециклином, были еще более высокими (ОШ: 17,14; 95% ДИ: 1,79–16,3, r=6,24, р=0,013).
Таблица 3. Оценка риска развития лекарственно-индуцированного заболевания печени при применении меропенема и тигециклина у детей, ассоциированного с генотипом CYP3A5
Table 3. Assessment of the risk of DILI in children receiving meropenem and tigecycline, depending on the CYP3A5 genotype
|
Генотип Genotype |
ЛИЗ печени DILI (n=11) |
Иные НР Other ADRs (n=19) |
Критерий χ² Пирсонаа Pearson’s χ² а |
Уровень значимости p Significance level, p |
|
|
CYP3A5*1А/*3 |
Нет No |
10 |
7 |
6,24 |
0,013 |
|
Есть Yes |
1 |
12 |
|||
|
Оценка риска для CYP3A5*1А/*3 (0/1): ОШ 17,1; 95% ДИ 1,79–16,3 Risk assessment for CYP3A5*1А/*3 (0/1): OR 17.1; 95% CI: 1.79–16.3 |
|||||
|
CYP3A5*3/*3 |
Нет No |
2 |
14 |
6,54 |
0,011 |
|
Есть Yes |
9 |
5 |
|||
|
Оценка риска для CYP3A5*3/*3 (0/1): ОШ 12,6; 95% ДИ 1,99–79,4 Risk assessment for CYP3A5*3/*3 (0/1): OR 12.6; 95% CI: 1.99–79.4 |
|||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ЛИЗ — лекарственно-индуцированное заболевание печени; n — количество пациентов; НР — нежелательные реакции; ОШ — отношение шансов; ДИ — доверительный интервал.
а С поправкой на непрерывность.
Note. DILI, drug-induced liver injury; n, number of patients; ADR, adverse drug reaction; OR, odds ratio; CI, confidence interval.
а Corrected for continuity.
Точность прогностического значения детекции генотипа CYP3A5*3/*3 для прогнозирования риска развития ЛИЗ печени, ассоциированного с меропенемом и тигециклином, составила 76,7%, чувствительность — 82% и специфичность — 74%.
У детей с ЛИЗ печени по сравнению с пациентами, у которых развились иные НР, чаще выявлялось гетерозиготное носительство полиморфизма rs4149056 генотипа SLCO1B1*1/*5 (r=9,8, р=0,002), однако оценка рисков была невозможна, поскольку в подгруппе пациентов с иными НР не было ни одного носителя данного генотипа (табл. 4). Требуются дополнительные исследования.
Таблица 4. Оценка риска развития лекарственно-индуцированного заболевания печени при применении меропенема и тигециклина у детей, ассоциированного с генотипом SLCO1B1
Table 4. Assessment of the risk of DILI in children receiving meropenem and tigecycline, depending on the SCO1B1 genotype
|
Генотип, полиморфизм Genotype, polymorphism |
Наличие генотипа Carriage |
ЛИЗ печени DILI (n=11) |
Иные НР Other ADRs (n=19) |
Критерий χ² Пирсонаа Pearson’s χ² а |
Уровень значимости p Significance level, p |
|
SLCO1B1*1/*5 rs4149056 |
Нет No |
5 |
19 |
9,8 |
0,002 |
|
Есть Yes |
6 |
0 |
|||
|
Оценка риска невозможна (в подгруппе пациентов, не имеющих ЛИЗ печени, не было ни одного носителя данного генотипа) Risk assessment is impossible (none of the patients without DILI had this genotype) |
|||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ЛИЗ — лекарственно-индуцированное заболевание печени; n — количество пациентов; НР — нежелательные реакции.
а С поправкой на непрерывность.
Note. DILI, drug-induced liver injury; n, number of patients; ADR, adverse drug reaction.
а Corrected for continuity.
В подгруппе пациентов, у которых развились ЛИЗ печени (n=11), по сравнению с подгруппой пациентов с иными НР (n=19), для носителей аллелей генотипов транспортера ни один из полиморфизмов генов ABCB1, COMT, DRD2, F2, F5, MTHFR, OPRM1, PNPLA5, SULT4A1, VKORC1 значимого влияния на развитие лекарственно-индуцированных состояний не показал (табл. 5).
Таблица 5. Статистический анализ шансов развития лекарственно-индуцированного заболевания печени у детей, ассоциированного с применением антибиотиков, в зависимости от наличия генетических полиморфизмов для транспортеров и важных молекул
Table 5. Statistical analysis of odds of antibiotic-associated DILI in children, depending on genetic polymorphisms of transporters and important molecules
|
Генотип, полиморфизмы Genotype, polymorphisms |
ЛИЗ печени DILI (n=11) |
Иные НР Other ADRs (n=19) |
Критерий χ² Пирсона Pearson’s χ² |
Уровень значимости p Significance level, p |
|
ABCB1 АА+AG |
8 |
13 |
0,507 |
0,269 |
|
ABCB1 GG |
2 |
6 |
||
|
APOE E2/E3+E3/E4 |
8 |
13 |
0,617 |
0,61 |
|
APOE E3/E3 |
1 |
3 |
||
|
COMT A/A+A/G |
9 |
14 |
0,612 |
0,014 |
|
COMT G/G |
2 |
5 |
||
|
MTHFR rs1801131 G/T+T/T |
10 |
18 |
0,685 |
0,232 |
|
MTHFR rs1801131 G/G |
1 |
1 |
||
|
DRD2 WT/WT |
7 |
13 |
0,072 |
0,789 |
|
DRD2 Taq1A/WT |
4 |
6 |
||
|
F2 WT/WT |
10 |
19 |
0,787 |
0,181 |
|
F2 G20210/WT |
2 |
0 |
||
|
GLP1R rs1042044 A/A+A/С |
10 |
10 |
0,216 |
0,171 |
|
GLP1R rs1042044 С/С |
6 |
3 |
||
|
GLP1R rs2300615 T/T |
5 |
13 |
0,036 |
0,850 |
|
GLP1R rs2300615 G/T |
5 |
6 |
||
|
F5 WT/WT |
10 |
17 |
0,016 |
0,900 |
|
F5 R506Q/WT |
2 |
1 |
||
|
OPRM1 A/A |
8 |
15 |
0,151 |
0,698 |
|
OPRM1 A/G |
2 |
5 |
||
|
PNPLA5 C/C |
9 |
14 |
0,258 |
0,612 |
|
PNPLA5 C/T |
2 |
5 |
||
|
SULT4A1 T/T rs763120 |
9 |
13 |
0,639 |
0,424 |
|
SULT4A1 C/T rs763120 |
1 |
6 |
||
|
VKORC1*1/*1 *1/*2 rs9923231 |
6 |
20 |
0,954 |
0,064 |
|
VKORC1*2/*3 rs9923231 |
1 |
2 |
||
|
CYP1A2*1A/*1A+*1A/*1L или (or) *1C/*1F+*1F/*1F |
8 |
10 |
0,599 |
0,439 |
|
CYP1A2*1A/*1F |
2 |
7 |
||
|
CYP2B6*1/*1+*1/*6 |
8 |
16 |
0,775 |
0,945 |
|
CYP2B6*6/*6 |
2 |
3 |
||
|
CYP2C19*1/*1+*2/*2+*1/*2+*1/*4А |
5 |
15 |
0,599 |
0,439 |
|
CYP2C19*1/*17+*17/*17 |
3 |
6 |
||
|
CYP2C9*1/*1+*1/*2 |
5 |
12 |
0,164 |
0,685 |
|
CYP2C9*1/*3 |
2 |
2 |
||
|
CYP3A4*1/*1 |
2 |
12 |
3,701 |
0,054 |
|
CYP3A4*1/*2 |
1 |
1 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ЛИЗ — лекарственно-индуцированное заболевание печени; n — количество пациентов; НР — нежелательные реакции.
Note. DILI, drug-induced liver injury; n, number of patients; ADR, adverse drug reaction.
ОБСУЖДЕНИЕ
Выявлена прогностическая значимость как индикатора гомозиготного генотипа цитохрома CYP3A*3/*3 потенциальной группы риска развития ЛИЗ печени, ассоциированного с применением меропенема и тигециклина у детей в критических состояниях. Высокий риск развития ЛИЗ печени при наличии данного генотипа, по-видимому, может быть обусловлен дополнительным фактором — отсутствием экспрессии в тканях печени CYP3A5, основного цитохрома, участвующего с самым значимым вкладом (до 50%) в процессе инактивации лекарственных препаратов [17]. Ранее исследователями было показано влияние экспрессии гомозиготного полиморфизма у носителей CYP3A5*3/*3 на способность печени к окислительному метаболизму ксенобиотиков у онкологических пациентов. Так, у детей с нейробластомой было выявлено 4,3-кратное увеличение риска смерти для гомозиготных носителей CYP3A5*3/*3 по сравнению с гетерозиготными или носителями дикого типа и высказаны предположения о серьезных ограничениях в инактивации лекарственных препаратов как причины увеличения рисков неблагоприятного исхода у детей [18].
Важным моментом является также выявление гетерозиготного носительства полиморфизма rs4149056 генотипа SLCO1B1*1/*5 у детей в подгруппе с ЛИЗ печени, тогда как в подгруппе у детей с развитием иных НР генотип SLCO1B1*1/*5 отсутствовал. Однако оценка рисков в этом случае была невозможна, так как в подгруппе пациентов с иными НР не было ни одного носителя данного генотипа. Имеются предположения, что изменения в структуре белка, обеспечивающего транспорт органических анионов OATP1B1, которые опосредуют поглощение и выведение конъюгированного билирубина через синусоидальные мембраны печени в желчь, также могут оказывать влияние на развитие ЛИЗ печени [19][20]. В 2022 г. группой исследователей изучалась связь гепатотоксичности препарата амоксициллин+клавулановая кислота для арабской популяции взрослых с преобладанием в ней генотипа SLCO1B1*1/*5 [21].
ОГРАНИЧЕНИЯ ИССЛЕДОВАНИЯ
В проведенном наблюдательном проспективном исследовании были изучены случаи развития НР в малой выборке пациентов в критических состояниях. Включение пациентов в исследование было сопряжено со значительными сложностями в связи с необходимостью соблюдения критериев включения для уязвимой группы пациентов с полиорганной недостаточностью.
Следует отметить ограничение возможностей проведения сравнения в детской популяции в настоящем протоколе исследования в рамках существующих консорциумов по фармакогенетике, поскольку имеющиеся данные — единичные, касаются пациентов, имеющих хотя бы одно хроническое заболевание, и набор контрольной группы и групп сравнения в рамках соблюдения этических аспектов затруднен.
ЗАКЛЮЧЕНИЕ
В проспективном наблюдательном исследовании показана прогностическая значимость выявления гомозиготного генотипа цитохрома CYP3A*3/*3 как индикатора потенциального риска развития ЛИЗ печени, ассоциированного с применением меропенема и тигециклина у детей в критических состояниях. Также показано, что у детей с ЛИЗ печени, возникшими при применении меропенема и тигециклина, чаще выявлялось гетерозиготное носительство генотипа SLCO1B1*1/*5 полиморфизма rs4149056 по сравнению с пациентами с иными НР. Поскольку в подгруппе пациентов с иными НР не было ни одного носителя генотипа SLCO1B1*1/*5 полиморфизма rs4149056, сравнительная оценка рисков между группами была невозможна.
Необходимо проведение дальнейших исследований, направленных на выявление фармакогенетических особенностей у детей с ЛИЗ печени, связанными с применением антибиотиков.
Дополнительная информация. Таблица 2 размещена на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2024-392-tabl2
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.В. Власова — концепция и дизайн исследования, сбор и обработка материала, анализ данных литературы, написание и редактирование текста рукописи; Ю.Ф. Шубина и И.Р. Газиев — сбор и обработка материала, статистическая обработка данных, редактирование текста рукописи; Д.А. Сычев — утверждение окончательного варианта рукописи для публикации.
Соответствие принципам этики. Проведение наблюдательного исследования одобрено локальным этическим комитетом ГБУЗ «Морозовская ДГКБ ДЗМ», г. Москва (протокол от 14.11.2019 № 149) и Комитетом по этике научных исследований ФГБОУ ДПО РМАНПО Минздрава России, г. Москва (протокол от 11.08.2022 № 14). Протокол наблюдательного исследования зарегистрирован на международной платформе ClinicalTrials.gov (ClinicalTrials.gov ID: NCT04141657, Unique Protocol ID: 07819001, Official Title: Observational Prospective Multidirectional Study on the Safety of Antimicrobial Pharmacotherapy in Intensive Care Unit (ICU) Children Aged 0–17).
Additional information. Table 2 is posted on the website of the journal Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2024-392-tabl2
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Anna V. Vlasova conceptualised and designed the study, collected and processed the material, analysed literature data, drafted and edited the manuscript. Yuliya F. Shubina and Ivan R. Gaziev collected and processed the material, carried out statistical data processing, and edited the manuscript. Dmitry A. Sychev approved the final version of the manuscript for publication.
Ethics approval. The protocol of this observational clinical study was approved by the local ethics committee of the Morozov Children’s City Clinical Hospital in Moscow (meeting minutes No. 149 of 14 November 2019) and the Research Ethics Committee of the Russian Medical Academy of Continuous Professional Education in Moscow (meeting minutes No. 14 of 11 August 2022). The study protocol was registered at ClinicalTrials.gov (ClinicalTrials.gov ID: NCT04141657, Unique Protocol ID: 07819001, Official Title: Observational Prospective Multidirectional Study on the Safety of Antimicrobial Pharmacotherapy in Intensive Care Unit (ICU) Children Aged 0–17).
1. Яковлев СВ, Брико НИ, Сидоренко СВ, Проценко ДН. Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи: Российские клинические рекомендации. М.: Перо; 2018.
2. https://www.cdc.gov/hai/vap/vap.html
3. https://www.ecdc.europa.eu/en/search?s=VAP
4. https://doi.org/10.30895/2312-7821-2024-392-tabl2
Список литературы
1. Yu Y, Nie X, Song Z, Xie Y, Zhang X, Du Z, et al. Signal detection of potentially drug-induced liver injury in children using electronic health records. Front Pediatr. 2020;8:171. https://doi.org/10.3389/fped.2020.00171
2. Yu Z, Zhao Y, Jin J, Zhu J, Yu L, Han G. Prevalence and risk factors of tigecycline-induced liver injury: a multicenter retrospective study. Int J Infect Dis. 2022;120:59–64. https://doi.org/10.1016/j.ijid.2022.04.024
3. Baietto L, Corcione S, Pacini G, Perri GD, D’Avolio A, De Rosa FG. A 30-years review on pharmacokinetics of antibiotics: is the right time for pharmacogenetics? Curr Drug Metab. 2014;15(6):581–98. https://doi.org/10.2174/1389200215666140605130935
4. Daly AK, Day CP. Genetic association studies in drug-induced liver injury. Semin Liver Dis. 2009;29(4):400–11. https://doi.org/10.1055/s-0029-1240009
5. Zed PJ, Haughn C, Black KJL, Fitzpatrick EA, Ackroyd-Stolarz S, Murphy NG, et al. Medication-related emergency department visits and hospital admissions in pediatric patients: a qualitative systematic review. J Pediatr. 2013;163(2):477–83. https://doi.org/10.1016/j.jpeds.2013.01.042
6. Ersulo TA, Yizengaw MA, Tesfaye BT. Incidence of adverse drug events in patients hospitalized in the medical wards of a teaching referral hospital in Ethiopia: a prospective observational study. BMC Pharmacol Toxicol. 2022;23(1):30. https://doi.org/10.1186/s40360-022-00570-w
7. Lucena MI, Molokhia M, Shen Y, Urban TJ, Aithal GP, Andrade RJ, et al. Susceptibility to amoxicillin-clavulanate-induced liver injury is influenced by multiple HLA class I and II alleles. Gastroenterology. 2011;141(1):338–47. https://doi.org/10.1053/j.gastro.2011.04.001
8. Alshabeeb M, Alomar FA, Khan A. Impact of SLCO1B1*5 on flucloxacillin and co-amoxiclav-related liver injury. Front Pharmacol. 2022;13:882962. https://doi.org/10.3389/fphar.2022.882962
9. Власова АВ, Шубина ЮФ, Сычев ДА. Лекарственное поражение печени, ассоциированное с антибиотиками, у детей в критических состояниях: проспективное наблюдательное исследование. Безопасность и риск фармакотерапии. 2024. https://doi.org/10.30895/2312-7821-2023-389
10. Manolis E, Musuamba FT, Karlsson KE. The European Medicines Agency experience with pediatric dose selection. J Clin Pharmacol. 2021;61:S22–S27. https://doi.org/10.1002/jcph.1863
11. Иващенко ДВ, Буромская НИ, Савченко ЛМ, Шевченко ЮС, Сычев ДА. Значение метода глобальных триггеров для выявления неблагоприятных событий, связанных с оказанием медицинской помощи в педиатрии. Медицинский совет. 2018;(17):56–65. https://doi.org/10.21518/2079-701X-2018-17-56-65
12. Власова АВ, Смирнова ЕВ, Горев ВВ, Сычев ДА. Нежелательные реакции детей на антимикробные препараты: ограничения метода спонтанных сообщений и возможности метода глобальных триггеров лекарственно-индуцированных состояний. Фарматека. 2023;30(1/2):18–31. https://doi.org/10.18565/pharmateca.2023.1-2.18-31
13. Classen DC, Resar R, Griffin F, Federico F, Frankel T, Kimmel N, et al. “Global Trigger Tool” shows that adverse events in hospitals may be ten times greater than previously measured. Health Aff (Millwood). 2011;30(4):581–9. https://doi.org/10.1377/hlthaff.2011.0190
14. Katarey D, Verma S. Drug-induced liver injury. Clin Med. 2016;16(Suppl 6):S104–S109. https://doi.org/10.7861/clinmedicine.16-6-s104
15. Yu Y, Mao YM, Chen CW, Chen JJ, Chen J, Cong WM, et al. CSH guidelines for the diagnosis and treatment of drug-induced liver injury. Hepatol Int. 2017;11(3):221–41. https://doi.org/10.1007/s12072-017-9793-2
16. Aleo MD, Luo Y, Swiss R, Bonin PD, Potter DM, Will Y. Human drug-induced liver injury severity is highly associated with dual inhibition of liver mitochondrial function and bile salt export pump. Hepatology. 2014;60(3):1015–22. https://doi.org/10.1002/hep.27206
17. Darwish MH, Farah RA, Farhat GN, Torbey PH, Ghandour FA, Bejjani-Doueihy NA, Dhaini HR. Association of CYP3A4/5 genotypes and expression with the survival of patients with neuroblastoma. Mol Med Rep. 2015;11(2):1462–8. https://doi.org/10.3892/mmr.2014.2835
18. Kameyama Y, Yamashita K, Kobayashi K, Hosokawa M, Chiba K. Functional characterization of SLCO1B1 (OATP-C) variants, SLCO1B1*5, SLCO1B1*15 and SLCO1B1*15+C1007G, by using transient expression systems of HeLa and HEK293 cells. Pharmacogenet Genomics. 2005;15(7):513–22. https://doi.org/10.1097/01.fpc.0000170913.73780.5f
19. Jindal C, Kumar S, Choudhari G, Goel H, Mittal B. Organic anion transporter protein (OATP1B1) encoded by SLCO1B1 gene polymorphism (388A>G) and susceptibility in gallstone disease. Indian J Med Res. 2009;129(2):170–5. PMID: 19293444
20. Alshabeeb M, Alomar FA, Khan A. Impact of SLCO1B1*5 on flucloxacillin and co-amoxiclav-related liver injury. Front Pharmacol. 2022;13:882962. https://doi.org/10.3389/fphar.2022.882962
Об авторах
А. В. ВласоваРоссия
Власова Анна Викторовна, канд. мед. наук, доцент
4-й Добрынинский пер., д. 1/9, Москва, 119049;
Баррикадная ул., д. 2/1, стр. 1, Москва, 125993
Ю. Ф. Шубина
Россия
Шубина Юлия Федоровна, канд. мед. наук, доцент
4-й Добрынинский пер., д. 1/9, Москва, 119049
И. Р. Газиев
Россия
Газиев Иван Рубенович
4-й Добрынинский пер., д. 1/9, Москва, 119049
Д. А. Сычев
Россия
Сычев Дмитрий Алексеевич, академик РАН, д-р мед. наук, профессор
Баррикадная ул., д. 2/1, стр. 1, Москва, 125993
Дополнительные файлы

|
1. Таблица 2. Носительство фармакогенетических маркеров панели iPLEX Pro PGx (Agena Bioscience) для цитохрома Р-450 у детей, у которых были выявлены нежелательные реакции при применении антибиотиков (количество пациентов n=30) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(111KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Власова А.В., Шубина Ю.Ф., Газиев И.Р., Сычев Д.А. Фармакогенетические предикторы лекарственного поражения печени, ассоциированного с антибиотиками у детей: результаты наблюдательного исследования. Безопасность и риск фармакотерапии. 2024;12(2):167-177. https://doi.org/10.30895/2312-7821-2024-392
For citation:
Vlasova A.V., Shubina Yu.F., Gaziev I.R., Sychev D.A. Pharmacogenomic Predictors of Antibiotic-Associated Drug-Induced Liver Injury in Critically Ill Children: Observational Study Results. Safety and Risk of Pharmacotherapy. 2024;12(2):167-177. (In Russ.) https://doi.org/10.30895/2312-7821-2024-392




































