Перейти к:
Влияние оротата магния на состояние грудного отдела аорты лабораторных кроликов, получающих левофлоксацин
https://doi.org/10.30895/2312-7821-2024-393
Резюме
ВВЕДЕНИЕ. Фторхинолоны — антибактериальные средства, применение которых ограничивается рис ком нежелательных реакций, в том числе риском поражения аорты. Повреждение других соединительнотканных структур (хрящей, сухожилий) при терапии фторхинолонами ассоциируется с дефицитом магния.
ЦЕЛЬ. Анализ влияния оротата магния на состояние грудной аорты лабораторных кроликов при терапии левофлоксацином.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование было включено 3 группы кроликов по 10 животных. В контрольной группе животные получали перорально раствор-носитель, в группе левофлоксацина — левофлоксацин 150 мг/кг/сут, группа левофлоксацина/магния — левофлоксацин 150 мг/кг/сут и магния оротат 140 мг/кг/сут. Препараты вводили в течение 14 сут, после чего у животных производили отбор венозной крови для определения сывороточных уровней матриксной металлопротеиназы 9, тканевого ингибитора матриксных металлопротеиназ 1, их соотношения, концентрации магния. Аутоптат грудного отдела аорты подвергали морфологическому исследованию и механическому испытанию на одноосное растяжение. Данные представлены в формате среднее ± стандартное отклонение.
РЕЗУЛЬТАТЫ. Не выявлено изменения уровней сывороточного содержания матриксной металлопротеиназы 9, тканевого ингибитора матриксных металлопротеиназ 1, их соотношения и концентрации магния. Обнаружены фокусы умеренной фрагментации эластических волокон средней оболочки аорты в 5 из 10 образцов животных группы левофлоксацина, в 1 из 10 образцов — группы левофлоксацина/магния и ни у одного кролика из контрольной группы (р=0,013). У получавших левофлоксацин животных доля эластических мембран в средней оболочке аорты была значимо ниже, чем у остальных кроликов (p=0,015; сравнение с контролем: р=0,022), а сами мембраны были тоньше в среднем на 1,4 мкм (16%) (p=0,010, сравнение с контролем: p=0,022, сравнение с группой левофлоксацина/магния: p=0,019). Ковариационный анализ подтвердил различие характера зависимости прочности аорты от количества эластических мембран средней оболочки между тремя группами.
ВЫВОДЫ. Применение левофлоксацина в дозе 150 мг/кг/сут в течение 14 сут уменьшает содержание эластина в средней оболочке сосуда, снижает толщину, прочность мембран и повышает степень их фрагментации, что сопровождается падением предела прочности сосуда. Дополнительное применение оротата магния в дозе 140 мг/кг/сут сохраняет структуру эластических элементов средней оболочки аорты и предотвращает снижение прочности аорты. Полученный результат свидетельствует о роли дефицита магния в повреждении аорты, индуцированном фторхинолонами.
Ключевые слова
Для цитирования:
Изможерова Н.В., Зайцев Д.В., Базарный В.В., Бахтин В.М., Полушина Л.Г., Копенкин М.А., Толстых Д.В., Мухлынина Е.А. Влияние оротата магния на состояние грудного отдела аорты лабораторных кроликов, получающих левофлоксацин. Безопасность и риск фармакотерапии. 2024;12(3):341-351. https://doi.org/10.30895/2312-7821-2024-393
For citation:
Izmozherova N.V., Zaytsev D.V., Bazarny V.V., Bakhtin V.M., Polushina L.G., Kopenkin M.A., Tolstykh D.V., Mukhlynina E.A. Magnesium Orotate Influence on Thoracic Aorta in Laboratory Rabbits Receiving Levofloxacin. Safety and Risk of Pharmacotherapy. 2024;12(3):341-351. (In Russ.) https://doi.org/10.30895/2312-7821-2024-393
ВВЕДЕНИЕ
Фторхинолоны — антибактериальные средства, ингибирующие топоизомеразы II и IV и обладающие широким спектром активности. Их применение ограничивается риском развития тяжелых нежелательных реакций [1], в том числе повреждения аорты по типу аневризмы, диссекции и разрыва [2–4]. Абсолютный риск развития аортопатий при использовании фторхинолонов не превышает 0,3% [2–4], однако он существенно выше, чем при использовании антибактериальных средств других классов [3][5].
Механизм развития повреждения аорты при терапии фторхинолонами изучен не полностью. В ряде работ отмечена способность этих препаратов повышать активность матриксных металлопротеиназ (ММП) и индуцировать деградацию внеклеточного матрикса средней оболочки аорты (media), что сопровождается снижением ее механической прочности и развитием повреждения [6][7].
Способность фторхинолонов повреждать другие соединительнотканные структуры, такие как хрящи [8] и сухожилия [9], хорошо описана в литературе. Имеющиеся экспериментальные данные указывают на то, что в основе механизма повреждения соединительной ткани при терапии фторхинолонами лежит нарушение обмена магния за счет образования прочных комплексных соединений [10–12]. Магний является эссенциальным для соединительной ткани элементом, регулирующим процессы пролиферации фибробластов, синтеза белка [13], функционирования мембранных интегринов [14] и формирования внеклеточного матрикса [15].
В экспериментах на животных введение препаратов магния позволяло снизить интенсивность повреждения сухожилий и хрящей [16]. Между тем в литературе не было обнаружено работ, связанных с исследованием способности препаратов магния предотвращать развитие индуцированного фторхинолонами повреждения аорты. Наиболее часто используемым в современной практике фторхинолоном является левофлоксацин [17]. Терапия данным препаратом ассоциируется с наиболее высокими рисками поражения аорты [3][5], в связи с чем исследование его свойств является актуальным.
Цель работы — анализ влияния оротата магния на состояние грудной аорты лабораторных кроликов при терапии левофлоксацином.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на 30 кроликах породы «Советская шиншилла» обоего пола в возрасте 5 мес. Все работы с животными выполняли в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях ETS № 123 от 18.03.1986, а также директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Исследование одобрено на заседании локального этического комитета (ЛЭК) ФГБОУ ВО УГМУ Минздрава России (протокол заседания ЛЭК от 25.10.2019 № 2).
Животные были рандомизированы на 3 группы по 10 особей (5 самцов и 5 самок) в каждой:
1) контрольная группа: получали раствор-носитель (гидроксипропилметилцеллюлоза 1%, сахароза 10%) в дозе 1 мг/кг перорально;
2) группа левофлоксацина: получали левофлоксацин в растворе-носителе в дозе 150 мг/ кг/ сут перорально;
3) группа левофлоксацина/магния: получали левофлоксацин 150 мг/кг/сут и магния оротат 140 мг/кг/сут перорально.
Использованная в эксперименте доза левофлоксацина (150 мг/кг/сут) эквивалентна дозе 50 мг/кг/сут для человека и превышает среднюю терапевтическую дозировку в 7 раз, коэффициент межвидового пересчета кролик/человек составляет 3,2 [18]. Высокая доза выбрана для эффективного моделирования в эксперименте сравнительно редко развивающегося поражения аорты. Аналогичный подход к исследованию повреждения сухожилий и хрящей использовался в работах K. Pfister [16], J. Vormann и соавт. [19], R. Stahlmann и соавт. [20]. Дозировка оротата магния 140 мг/кг/сут эквивалентна терапевтической дозе для человека (44 мг/кг/сут), коэффициент межвидового пересчета кролик/человек составляет 3,2 [18].
Препараты вводили на протяжении 14 сут, на 15-е сут у животных отбирали кровь из ушной вены для проведения биохимического анализа сыворотки. Животных вводили в глубокий наркоз (тилетамин 4 мг/кг + золазепам 4 мг/кг + ксилазин 1,6 мг/кг) и выводили из эксперимента введением 2 мл лидокаина 10% внутривенно. В ходе аутопсии у животных вскрывали грудную клетку, выделяли грудную аорту, восходящий отдел которой фиксировали в растворе формалина 10% нейтральном (производитель «БиоВитрум», Россия) для последующего гистологического исследования; образец нисходящего отдела аорты длиной 6–7 см помещали в раствор натрия хлорида 0,9% для проведения механического испытания на одноосное растяжение.
В сыворотке крови определяли концентрацию матриксной металлопротеиназы 9 (ММП-9) и тканевого ингибитора матриксных металлопротеиназ 1 (ТИМП-1); рассчитывали соотношение концентраций ММП-9/ТИМП-1. Исследование проводили методом твердофазного гетерогенного иммуноферментного анализа с использованием тест-систем Rabbit (ELISA Kit for Matrix Metalloproteinase 9 (MMP9) (SEA553Rb); ELISA Kit for Tissue Inhibitors Of Metalloproteinase 1 (TIMP1) (SEA552Rb), Cloud-Clone Corp., Китай). Использовали аппаратный комплекс, включающий планшетный иммуноферментный анализатор Multiskan GO (Thermo Scientific, Япония); планшетный промыватель Wellwash (Thermo Scientific, Япония), шейкер-термостат ST-3L (ELMI, Латвия).
Содержание магния в сыворотке измеряли фотометрическим методом с ксилидиловым синим с помощью наборов «Магний-Ново» производства АО «Вектор-Бест» (Россия). Использован биохимический анализатор BS-240 PRO (Mindray, Китай).
Поперечные срезы восходящего отдела аорты окрашивали гематоксилином и эозином, а также по Вейгерту1 для выявления эластических волокон. Микрофотографии срезов для морфометрического исследования выполняли на микроскопе Primo Star с камерой AxioCam ERc 5s с помощью прилагаемого программного обеспечения AxioVision Rel. 4.8 (Carl Zeiss, Германия). Обработку полученных изображений проводили в свободно распространяемой программе ImageJ 1.54d (National Institutes of Health, США). Оценивали толщину средней оболочки аорты (media), количество эластических мембран, долю эластических мембран в средней оболочке, рассчитывали среднюю толщину эластической мембраны в соответствии с протоколом, представленным в статье T. Hirose и соавт. [21]. Фрагментацию эластических мембран средней оболочки полуколичественно оценивали от 0 (норма) до 4 баллов (тяжелая) в соответствии с методикой, представленной в работе G.S. Carr-White и соавт. [22].
Образцы грудного отдела аорты подвергали механическому испытанию на одноосное растяжение на разрывной машине AG-X 50kN (Shimadzu, Япония), результаты этого исследования были опубликованы авторами ранее [23].
Статистическую обработку данных выполняли в программе Jamovi 2.3.26. Анализ был проведен без учета половой принадлежности животных. Нормальность распределения признаков подтверждена с помощью критерия Колмогорова—Смирнова. Данные представлены как среднее ± стандартное отклонение (М±SD). Различие данных оценивали с помощью дисперсионного анализа (ANOVA), χ² Пирсона, парные сравнения проводили с использованием критерия Тьюки. Корреляцию анализировали с помощью критерия Пирсона. Совместное влияние качественных и количественных факторов на зависимый признак оценивали с помощью ковариационного анализа (ANCOVA). Критический уровень значимости p<0,050.
РЕЗУЛЬТАТЫ
Для оценки процессов деструкции и репарации соединительной ткани измеряли сывороточные концентрации ММП-9 и ТИМП-1. ММП-9 — маркер повреждения соединительнотканных структур, ТИМП-1 — специфический ингибитор ММП, защищающий ткани от разрушения, а соотношение ММП-9/ТИМП-1 позволяет оценить баланс процессов повреждения и защиты. Значимых различий исследуемых биохимических параметров между животными в трех группах выявлено не было (табл. 1).
Таблица 1. Биохимические показатели сыворотки крови кроликов (количество животных в каждой группе n=10)
Table 1. Biochemical parameters of rabbit sera (number of animals per group: n=10)
|
Параметр Parameter |
Группа животных Group of animals |
Уровень значимости p (ANOVA) Statistical significance, p (ANOVA) |
||
|
Контроль Control |
Левофлоксацин Levofloxacin |
Левофлоксацин / магний Levofloxacin / magnesium |
||
|
ММП-9, пг/мл MMP-9, pg/mL |
124,8±30,1 |
101,8±38,4 |
94,3±30,8 |
0,232 |
|
ТИМП-1, нг/мл TIMP-1, ng/mL |
26,1±9,1 |
20,7±6,8 |
24,4±7,2 |
0,359 |
|
ММП-9 / ТИМП-1, 10-3 MMP-9 / TIMP-1, 10-3 |
6,5±5,2 |
5,3±2,1 |
4,3±1,2 |
0,451 |
|
Магний, ммоль/л Magnesium, mmol/L |
0,95±0,10 |
0,93±0,11 |
0,94±0,12 |
0,992 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Данные представлены в формате среднее ± стандартное отклонение (М±SD); ММП-9 — матриксная металлопротеиназа 9; ТИМП-1 — тканевый ингибитор матриксных металлопротеиназ 1.
Note. The data are presented as mean ± standard deviation values (М±SD). MMP-9, matrix metalloproteinase-9; TIMP-1, tissue inhibitor of matrix metalloproteinase-1.
По результатам гистологического исследования достоверных различий между контрольной и опытными группами не выявлено. Как в контрольной, так и в опытных группах имелись проявления атеросклероза на различных стадиях, в том числе осложненные пристеночным тромбозом, и артефакты, связанные с приготовлением гистологических препаратов.
Для количественной оценки состояния средней оболочки аорты проведено морфометрическое исследование. На рисунке 1 представлены микрофотографии средней оболочки аорты животного из контрольной группы и получавшего левофлоксацин. Фокусы умеренной фрагментации (1 балл) эластических мембран обнаружены в 5 из 10 образцов аорты животных из группы левофлоксацина, в 1 из 10 образцов — левофлоксацина/магния и не выявлены ни у одного животного из контрольной группы (χ²=8,75, 2 степени свободы, р=0,013).
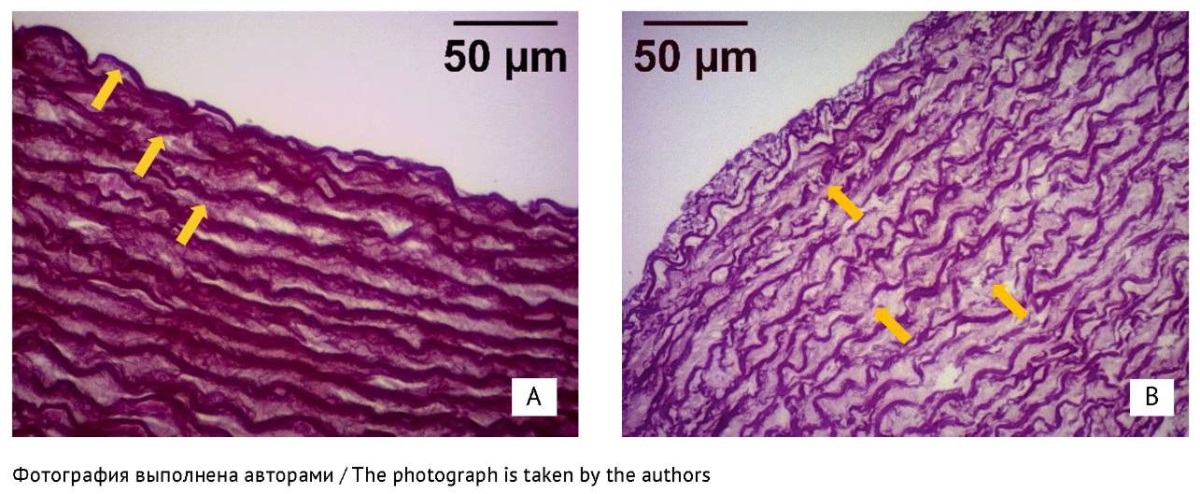
Рис. 1. Микрофотографии образцов тканей средней оболочки аорты кроликов. Окраска по Вейгерту, увеличение ×40. Стрелками обозначены эластические мембраны. А — контрольная группа; В — группа левофлоксацина, обнаруживаются участки умеренной фрагментации и расщепления эластических мембран, отек средней оболочки.
Fig. 1. Microphotographs of rabbit aortic media samples. Weigert’s stain, magnification ×40. Arrows indicate elastic membranes. A, control group; B, levofloxacin group, with visible areas of moderate elastic membrane fragmentation and splitting and medial swelling.
При проведении количественной морфометрии не было обнаружено различия толщины средней оболочки аорты и количества эластических мембран (табл. 2). У кроликов, получавших только левофлоксацин, доля эластических мембран в средней оболочке аорты была достоверно ниже, чем у остальных животных (ANOVA: p=0,015; апостериорное сравнение с контролем: р=0,022), мембраны были тоньше в среднем на 1,4 мкм (16%) (ANOVA: p=0,010, апостериорное сравнение с контролем: p=0,022, апостериорное сравнение с группой левофлоксацина/магния: p=0,019).
Таблица 2. Морфометрические параметры аорты кроликов (количество животных в каждой группе n=10)
Table 2. Morphometric parameters of the rabbit aorta (number of animals per group: n=10)
|
Параметр Parameter |
Группа животных Group of animals |
Уровень значимости p (ANOVA) Statistical significance, p (ANOVA) |
||
|
Контроль Control |
Левофлоксацин Levofloxacin |
Левофлоксацин / магний Levofloxacin / magnesium |
||
|
Толщина средней оболочки аорты, мкм Aortic media thickness, μm |
338,4±96,0 |
394,6±19,3 |
418,4±23,7 |
0,084 |
|
Количество мембран, ед. Number of membranes, pcs |
26,5±8,0 |
29,6±6,4 |
30,0±4,3 |
0,419 |
|
Доля эластических мембран в средней оболочке аорты, % Elastic membranes percentage in the aortic media, % |
59,8±11,4 |
47,5±8,2 |
55,1±6,3 |
0,015* |
|
Средняя толщина эластической мембраны, мкм Mean elastic membrane thickness, μm |
7,6±1,1 |
6,4±0,8 |
7,7±1,1 |
0,010* |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Данные представлены в формате среднее ± стандартное отклонение (М±SD).
* Значимое различие при p<0,05.
Note. The data are presented as mean ± standard deviation values (М±SD).
* Significant differences, p<0.05.
В ходе ранее выполненного механического испытания [23] была оценена работа разрушения образцов аорты. У животных контрольной группы данный параметр тесно коррелировал с количеством эластических мембран в средней оболочке (коэффициент корреляции r=0,89, p<0,001), у животных других групп корреляция отсутствовала. Различия связи количества мембран и работы разрушения между группами анализировали с помощью ANCOVA: работу рассматривали как переменную отклика, а группу животных и число мембран — как независимые предикторы, в анализ включали также фактор их взаимодействия. Построенная ковариационная модель (рис. 2) хорошо согласовывалась с данными (объясненная доля дисперсии R²=0,555, p=0,001). Взаимодействие факторов «группа животных» и «количество мембран» было значимо (p=0,015), что подтверждает различие характера зависимости прочности аорты от количества эластических мембран средней оболочки аорты. С учетом того, что общее количество эластических мембран в образцах ткани у животных трех групп не различалось, можно предположить, что снижение прочности мембран возникло только у животных, получавших левофлоксацин без магния.
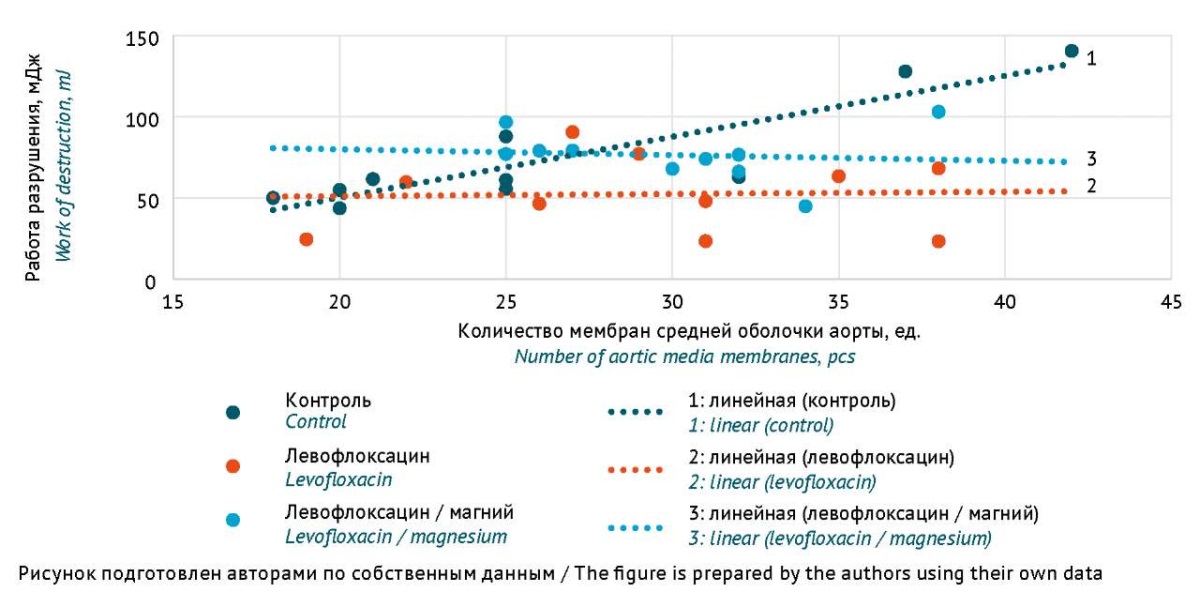
Рис. 2. Зависимость работы разрушения от количества эластических мембран в образцах ткани средней оболочки аорты (количество животных в каждой группе n=10)
Fig. 2. Work of destruction in aortic media samples as a function of the number of elastic membranes in the samples (number of animals per group: n=10)
ОБСУЖДЕНИЕ
Концентрации ММП-9 и ТИМП-1 в сыворотке крови, а также их соотношение являются маркерами деструкции соединительной ткани. Снижение секреции ТИМП и активация ММП рассматриваются как основные механизмы повреждения аорты при терапии фторхинолонами [7][24][25]. В настоящей работе у кроликов при применении левофлоксацина не выявлено изменения сывороточных концентраций ММП-9 и ТИМП-1. В литературе также не было обнаружено работ, демонстрирующих изменение сывороточных концентраций этих белков. В то же время повышение секреции ММП и снижение синтеза ТИМП продемонстрировано в исследованиях на клеточных культурах и тканях животных. В работе D.G. Guzzardi и соавт. [7] в клеточных культурах, подвергавшихся воздействию ципрофлоксацина, показано увеличение синтеза различных изоформ ММП, снижение образования ТИМП и рост отношения ММР-9/ТИМП-2. В работе S.A. LeMair и соавт. [25] показано увеличение экспрессии и активности ММП-9 в тканях аорты мышей, получавших ципрофлоксацин, при отсутствии изменения содержания ТИМП-1. Применение левофлоксацина повышало экспрессию ММП-3 и ММП-13 в культуре клеток фиброзного кольца крыс [26]. Вероятно, действие левофлоксацина и других фторхинолонов сопровождается повышением экспрессии и активности ММП на уровне соединительнотканных структур без увеличения секреции этих белков в кровь.
В проведенных нами ранее исследованиях левофлоксацин значимо снижал предел прочности аорты, наблюдалась также тенденция к уменьшению работы разрушения образцов [23][27]. Подобное изменение предела прочности описано также для стенок аневризмы аорты в работе D.A. Vorp и соавт. [28]. Образцы аорты кроликов, получавших левофлоксацин, демонстрировали в основном неупругое поведение, характерное для тканей с микроскопической гетерогенностью [29]. При морфометрическом исследовании аорты кроликов, получавших только левофлоксацин, обнаружены фокусы умеренной фрагментации эластических мембран, показано снижение их толщины и относительного содержания в средней оболочке. Примечательно, что в работе N. Pagès и соавт. [30] описано, что у мышей с модельным дефицитом магния также наблюдались изменения волокон стенки аорты. Обнаруженные изменения считаются одним из важнейших элементов патогенеза аневризмы и диссекции [31].
Применение оротата магния способствовало сохранению прочностных свойств стенки аорты, упругости при ответе на растяжение, а также микроструктуры средней оболочки. В литературе не было найдено исследований влияния препаратов магния на прочностные и морфологические свойства аорты в условиях действия фторхинолонов. Между тем, показано протективное действие магния на другие соединительнотканные структуры. В работе K. Pfister и соавт. [16] показано, что восполнение дефицита магния и витамина Е снижало токсичность ципрофлоксацина по отношению к суставным хрящам. M. Egerbacher и соавт. [32] в опыте in vitro показали способность магния уменьшать повреждение клеток суставного хряща собак под действием ципрофлоксацина.
Отсутствие изменения сывороточных уровней магния в исследуемых группах объясняется наличием в организме механизмов поддержания постоянства его содержания в крови. Сывороточная концентрация не может служить отражением содержания магния в тканях, поскольку в крови сосредоточен только 1% от всего организменного пула Mg²+ [33]. Полученный результат хорошо согласуется с известной ролью магния в функционировании соединительной ткани. Ионы Mg²+ стабилизируют пространственную конформацию нуклеиновых кислот и являются кофакторами всех ферментов, участвующих в их обмене [34]. Дефицит магния ассоциируется со снижением скорости синтеза белка в клетке вследствие нарушения функционирования транспортных рибонуклеиновых кислот [35]. Анализ результатов работ H. Rubin и соавт. [13][36][37] показал, что магний играет ключевую роль в процессах протеогенеза, влияя на скорость клеточной пролиферации.
Ионы магния способствуют изменению пространственной конформации интегринов фибробластов в высокоаффинное состояние, что обеспечивает их адгезию на компонентах внеклеточного матрикса и поддержание структурной целостности соединительной ткани [14][38][39]. Кроме того, данное взаимодействие необходимо для регуляции пролиферативной и синтетической функции клеток за счет активации киназы фокальных контактов (focal adhesion kinase, FAK) [40] и связанного с ней сигнального пути MAPK (mitogen-activated protein kinase, путь протеинкиназ, активируемых митогенами) [41].
Показана способность ионов магния снижать экспрессию ММП в соединительнотканных структурах [42–44], однако механизм этого явления изучен недостаточно.
В работе N. Pagès и соавт. [30] продемонстрировано, что у мышей с модельным дефицитом магния стенка аорты была тоньше, чем у животных контрольной группы, а коллагеновые и эластические волокна подверглись тяжелым изменениям. Результаты зимографического анализа показали повышенную экспрессию ММП-2 и ММП-9 в стенке сосуда.
Таким образом, полученные в настоящей работе результаты свидетельствуют о протективном действии оротата магния по отношению к стенке грудного отдела аорты в условиях действия левофлоксацина.
ЗАКЛЮЧЕНИЕ
Введение кроликам левофлоксацина в дозе 150 мг/ кг/ сут в течение 14 сут уменьшает относительное содержание в средней оболочке аорты эластических элементов, снижает толщину эластических мембран, приводит к их умеренной фрагментации, что сопровождается снижением прочности сосуда. Дополнительное применение оротата магния в дозе 140 мг/кг/сут сохраняет структуру эластических элементов оболочки аорты и позволяет предотвратить снижение ее прочности. Полученный в работе результат демонстрирует потенциальную возможность профилактики развития нежелательных реакций со стороны аорты при терапии фторхинолонами с помощью препаратов магния.
Дальнейшие исследования могут быть направлены на изучение влияния фторхинолонов на содержание магния в тканях аорты и форменных элементах крови, а также на оценку возможности использования препаратов магния для профилактики нежелательных реакций со стороны тканей аорты при терапии другими фторхинолонами, например ципрофлоксацином и моксифлоксацином.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.В. Изможерова — разработка концепции и дизайна работы, интерпретация результатов исследования, написание текста рукописи; Д.В. Зайцев — дизайн работы, сбор данных, критический пересмотр текста рукописи; В.В. Базарный — дизайн работы, сбор данных, критический пересмотр текста рукописи, интерпретация результатов исследования; В.М. Бахтин — разработка концепции и дизайна работы, сбор, анализ данных, интерпретация результатов исследования, написание текста рукописи; Л.Г. Полушина, М.А. Копенкин, Д.В. Толстых — сбор данных, интерпретация результатов; Е.А. Мухлынина — сбор и анализ данных.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Nadezhda V. Izmozherova conceptualised and designed the study, interpreted the study results, and drafted the manuscript. Dmitry V. Zaytsev designed the study, collected data, and critically reviewed the manuscript. Vladimir V. Bazarnyi designed the study, collected data, critically reviewed the manuscript, and interpreted the study results. Viktor M. Bakhtin conceptualised and designed the study, collected and analysed data, interpreted the study results, and drafted the manuscript. Larisa G. Polushina, Maksim A. Kopenkin, and Dmitrii V. Tolstykh collected data and interpreted the study results. Elena A. Mukhlynina collected and analysed data.
Соответствие принципам этики. Все работы с животными выполняли в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях ETS № 123 от 18.03.1986, и директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Исследование одобрено на заседании локального этического комитета (ЛЭК) ФГБОУ ВО УГМУ Минздрава России (протокол заседания ЛЭК от 25.10.2019 № 2).
Благодарности. Гистологическое исследование выполнено с использованием оборудования Центра коллективного пользования Института иммунологии и физиологии Уральского отделения РАН.
Ethics approval. Animal experiments were conducted in accordance with the European Convention for the Protection of Vertebrate Animals Used for Experimental and Other Scientific Purposes (ETS document No. 123 of 18.03.1986) and the Directive 2010/63/EU of the European Parliament and of the Council of 22.09.2010 on the protection of animals used for scientific purposes. The study was approved by the Ural State Medical University’s local ethics committee under meeting minutes No. 2 of 25.10.2019.
Acknowledgements. Histological examination was performed using the equipment of the Shared Research Center of Scientific Equipment of the Institute of Immunology and Physiology of the Ural Branch of the Russian Academy of Sciences.
1. Меркулов ГА. Курс патологогистологической техники. Л.: Медгиз; 1956.
Список литературы
1. Tanne JH. FDA adds “black box” warning label to fluoroquinolone antibiotics. BMJ. 2008;337(7662):135. https://doi.org/10.1136/BMJ.A816
2. Gopalakrishnan C, Bykov K, Fischer MA, Connolly JG, Gagne JJ, Fralick M. Association of fluoroquinolones with the risk of aortic aneurysm or aortic dissection. JAMA Intern Med. 2020;180(12):1596–605. https://doi.org/10.1001/JAMAINTERNMED.2020.4199
3. Sommet A, Bénévent J, Rousseau V, Chebane L, Douros A, Montastruc JL, et al. What fluoroquinolones have the highest risk of aortic aneurysm? A case/non-case study in VigiBase®. J Gen Intern Med. 2019;34(4):502–3. https://doi.org/10.1007/S11606-018-4774-2
4. Meng L, Huang J, Jia Y, Huang H, Qiu F, Sun S. Assessing fluoroquinolone-associated aortic aneurysm and dissection: data mining of the public version of the FDA adverse event reporting system. Int J Clin Pract. 2019;73(5):e13331. https://doi.org/10.1111/IJCP.13331
5. Bennett AC, Bennett CL, Witherspoon BJ, Knopf KB. An evaluation of reports of ciprofloxacin, levofloxacin, and moxifloxacin-association neuropsychiatric toxicities, long-term disability, and aortic aneurysms/dissections disseminated by the Food and Drug Administration and the European Medicines Agency. Expert Opin Drug Saf. 2019;18(11):1055–63. https://doi.org/10.1080/14740338.2019.1665022
6. Takagi H, Hari Y, Nakashima K, Kuno T, Ando T. Matrix metalloproteinases and acute aortic dissection: “Et tu, Brute?” Interact Cardiovasc Thorac Surg. 2020;30(3):465–76. https://doi.org/10.1093/ICVTS/IVZ286
7. Guzzardi DG, Teng G, Kang S, Geeraert PJ, Pattar SS, Svystonyuk DA, et al. Induction of human aortic myofibroblast-mediated extracellular matrix dysregulation: a potential mechanism of fluoroquinolone-associated aortopathy. J Thorac Cardiovasc Surg. 2019;157(1):109–19.e2. https://doi.org/10.1016/J.JTCVS.2018.08.079
8. Yu PH, Hu CF, Liu JW, Chung CH, Chen YC, Sun CA, Chien WC. The incidence of collagen-associated adverse events in pediatric population with the use of fluoroquinolones: a nationwide cohort study in Taiwan. BMC Pediatr. 2020;20(1):64. https://doi.org/10.1186/S12887-020-1962-0
9. Alves C, Mendes D, Marques FB. Fluoroquinolones and the risk of tendon injury: a systematic review and meta-analysis. Eur J Clin Pharmacol. 2019;75(10):1431–43. https://doi.org/10.1007/S00228-019-02713-1
10. Shakibaei M, De Souza P, Van Sickle D, Stahlmann R. Biochemical changes in Achilles tendon from juvenile dogs after treatment with ciprofloxacin or feeding a magnesium-deficient diet. Arch Toxicol. 2001;75(6):369–74. https://doi.org/10.1007/s002040100243
11. Bisaccia DR, Aicale R, Tarantino D, Peretti GM, Maffulli N. Biological and chemical changes in fluoroquinolone-associated tendinopathies: a systematic review. Br Med Bull. 2019;130(1):39–49. https://doi.org/10.1093/BMB/LDZ006
12. Бахтин ВМ, Изможерова НВ, Белоконова НА. Комплексообразование фторхинолонов с ионами магния. Бюллетень сибирской медицины. 2022;21(3):6–12. https://doi.org/10.20538/1682-0363-2022-3-6-12
13. Rubin H. The membrane, magnesium, mitosis (MMM) model of cell proliferation control. Magnes Res. 2005;18(4):268–74. PMID: 16548142
14. Zhang K, Chen JF. The regulation of integrin function by divalent cations. Cell Adh Migr. 2012;6(1):20–9. https://doi.org/10.4161/CAM.18702
15. de Baaij JHF, Hoenderop JGJ, Bindels RJM. Magnesium in man: implications for health and disease. Physiol Rev. 2015;95(1):1–46. https://doi.org/10.1152/PHYSREV.00012.2014
16. Pfister K, Mazur D, Vormann J, Stahlmann R. Diminished ciprofloxacin-induced chondrotoxicity by supplementation with magnesium and vitamin E in immature rats. Antimicrob Agents Chemother. 2007;51(3):1022–7. https://doi.org/10.1128/AAC.01175-06
17. Ушкалова ЕА, Зырянов СК. Ограничения на применение фторхинолонов при неосложненных инфекциях и проблемы безопасности. Клиническая микробиология и антимикробная терапия. 2017;19(3):208–13. EDN: ZWZREB
18. Гуськова ТА, Хохлов АЛ, Романов БК, Аляутдин РН, Синицина ОА, Спешилова СА и др. Безопасность лекарств: от доклиники к клинике. М.–Ярославль; Аверс Плюс; 2018. EDN: XMBDBR
19. Vormann J, Förster C, Zippel U, Lozo E, Günther T, Merker HJ et al. Effects of magnesium deficiency on magnesium and calcium content in bone and cartilage in developing rats in correlation to chondrotoxicity. Calcif Tissue Int. 1997;61(3):230–8. https://doi.org/10.1007/s002239900328
20. Stahlmann R, Förster C, Shakibaei M, Vormann J, Günther T, Merker HJ. Magnesium deficiency induces joint cartilage lesions in juvenile rats which are identical to quinolone-induced arthropathy. Antimicrob Agents Chemother. 1995;39(9):2013–8. https://doi.org/10.1128/AAC.39.9.2013
21. Hirose T, Shimazaki T, Takahashi N, Fukada T, Watanabe T, Tangkawattana P, et al. Morphometric analysis of thoracic aorta in Slc39a13/Zip13-KO mice. Cell Tissue Res. 2019;376(1):137–41. https://doi.org/10.1007/s00441-018-2977-9
22. Carr-White GS, Afoke A, Birks EJ, Hughes S, O’Halloran A, Glennen S, et al. Aortic root characteristics of human pulmonary autografts. Circulation. 2000;102(19 Suppl 3):III15–21. https://doi.org/10.1161/01.CIR.102.SUPPL_3.III-15
23. Бахтин ВМ, Изможерова НВ. Влияние оротата магния на прочность грудной аорты лабораторных кроликов, получающих левофлоксацин. В кн.: Актуальные вопросы современной медицинской науки и здравоохранения: сборник статей VIII Международной научно-практической конференции молодых ученых и студентов. Екатеринбург; 2023. С. 2951–6. EDN: SXTKYY
24. Lee CC, Lee MG, Hsieh R, Porta L, Lee WC, Lee SH, Chang SS. Oral fluoroquinolone and the risk of aortic dissection. J Am Coll Cardiol. 2018;72(12):1369–78. https://doi.org/10.1016/j.jacc.2018.06.067
25. LeMaire SA, Zhang L, Luo W, Ren P, Azares AR, Wang Y, et al. Effect of ciprofloxacin on susceptibility to aortic dissection and rupture in mice. JAMA Surg. 2018;153(9):e181804. https://doi.org/10.1001/JAMASURG.2018.1804
26. Wei HK, Yang SD, Bai ZL, Zhang X, Yang DL, Ding WY. Levofloxacin increases apoptosis of rat annulus fibrosus cells via the mechanism of upregulating MMP-2 and MMP-13. Int J Clin Exp Med. 2015;8(11):20198. PMID: 26884932
27. Зайцев ДВ, Изможерова НВ, Бахтин ВМ. Влияние фторхинолонов на механическую прочность соединительнотканных структур лабораторных кроликов при одноосном растяжении. В кн.: Актуальные вопросы прочности. Екатеринбург; 2022. С. 376-8. EDN: HNLRWV
28. Vorp DA, Schiro BJ, Ehrlich MP, Juvonen TS, Ergin MA, Griffith BP. Effect of aneurysm on the tensile strength and biomechanical behavior of the ascending thoracic aorta. Ann Thorac Surg. 2003;75(4):1210–4.
29. Sugita S, Matsumoto T. Heterogeneity of deformation of aortic wall at the microscopic level: contribution of heterogeneous distribution of collagen fibers in the wall. Biomed Mater Eng. 2013;23(6):447–61. https://doi.org/10.3233/BME-130771
30. Pagès N, Gogly B, Godeau G, Igondjo-Tchen S, Maurois P, Durlach J, et al. Structural alterations of the vascular wall in magnesium-deficient mice. A possible role of gelatinases A (MMP-2) and B (MMP-9). Magnes Res. 2003;16(1):43–8. PMID: 12735482
31. Cocciolone AJ, Hawes JZ, Staiculescu MC, Johnson EO, Murshed M, Wagenseil JE. Elastin, arterial mechanics, and cardiovascular disease. Am J Physiol Heart Circ Physiol. 2018;315(2):H189–H205. https://doi.org/10.1152/AJPHEART.00087.2018
32. Egerbacher M, Wolfesberger B, Gabler C. In vitro evidence for effects of magnesium supplementation on quinolone-treated horse and dog chondrocytes. Vet Pathol. 2001;38(2):143–8. https://doi.org/10.1354/vp.38-2-143
33. Громова ОА, Калачева АГ, Торшин ИЮ, Грустливая УЕ, Прозорова НВ, Егорова ЕЮ и др. О диагностике дефицита магния. Часть 1. Архивъ внутренней медицины. 2014;2(16):5–10. EDN: RDQRDG
34. de Baaij JHF, Hoenderop JGJ, Bindels RJM. Magnesium in man: implications for health and disease. Phy siol Rev. 2015;95(1):1–46.
35. Bobkowski W, Nowak A, Durlach J. The importance of magnesium status in the pathophysiology of mitral valve prolapse. Magnes Res. 2005;18(1):35–52. PMID: 15945614
36. Rubin H. Central roles of Mg2+ and MgATP2in the regulation of protein synthesis and cell proliferation: significance for neoplastic transformation. Adv Cancer Res. 2005;93:1–58. https://doi.org/10.1016/S0065-230X(05)93001-7
37. Rubin H. The logic of the membrane, magnesium, mitosis (MMM) model for the regulation of animal cell proliferation. Arch Biochem Biophys. 2007;458(1):16–23. https://doi.org/10.1016/J.ABB.2006.03.026
38. Nunes AM, Minetti CASA, Remeta DP, Baum J. Magnesium activates microsecond dynamics to regulate integrin-collagen recognition. Structure. 2018;26(8):1080–90.e5. https://doi.org/10.1016/J.STR.2018.05.010
39. Förster C, Kociok K, Shakibaei M, Merker HJ, Vormann J, Günther T, et al. Integrins on joint cartilage chondrocytes and alterations by ofloxacin or magnesium deficiency in immature rats. Arch Toxicol. 1996;70(5):261–70. https://doi.org/10.1007/s002040050272
40. Egerbacher M, Wolfesberger B, Walter I, Seiberl G. Integrins mediate the effects of quinolones and magnesium deficiency on cultured rat chondrocytes. Eur J Cell Biol. 1999;78(6):391–7. https://doi.org/10.1016/S0171-9335(99)80081-8
41. Nie X, Sun X, Wang C, Yang J. Effect of magnesium ions/Type I collagen promote the biological behavior of osteoblasts and its mechanism. Regen Biomater. 2020;7(1):53–61. https://doi.org/10.1093/RB/RBZ033
42. Chen R, Zhou X, Yin S, Lu Z, Nie J, Zhou W, et al. [Study on the protective mechanism of autophagy on cartilage by magnesium sulfate]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2018;32(10):1340–5 (In Chinese). https://doi.org/10.7507/1002-1892.201804015
43. Yao H, Xu JK, Zheng NY, Wang JL, Mok SW, Lee YW, et al. Intra-articular injection of magnesium chloride attenuates osteoarthritis progression in rats. Osteoarthr Cartil. 2019;27(12):1811–21. https://doi.org/10.1016/J.JOCA.2019.08.007
44. Shibata M, Ueshima K, Harada M, Nakamura M, Hiramori K, Endo S, et al. Effect of magnesium sulfate pretreatment and significance of matrix metalloproteinase-1 and interleukin-6 levels in coronary re perfusion therapy for patients with acute myocardial infarction. Angiology. 1999;50(7):573–82. https://doi.org/10.1177/000331979905000707
Об авторах
Н. В. ИзможероваРоссия
Изможерова Надежда Владимировна, д-р мед. наук, доцент
ул. Репина, д. 3, г. Екатеринбург, 620028
ул. Академическая, д. 20, г. Екатеринбург, 620066
Д. В. Зайцев
Россия
Зайцев Дмитрий Викторович, д-р физ.-мат. наук
ул. Куйбышева, д. 30, г. Екатеринбург, 620144
В. В. Базарный
Россия
Базарный Владимир Викторович, д-р мед. наук, профессор
ул. Репина, д. 3, г. Екатеринбург, 620028
В. М. Бахтин
Россия
Бахтин Виктор Михайлович
ул. Репина, д. 3, г. Екатеринбург, 620028;
ул. Академическая, д. 20, г. Екатеринбург, 620066
Л. Г. Полушина
Россия
Полушина Лариса Георгиевна, канд. мед. наук
ул. Репина, д. 3, г. Екатеринбург, 620028
М. А. Копенкин
Россия
Копенкин Максим Александрович
ул. Репина, д. 3, г. Екатеринбург, 620028
Д. В. Толстых
Россия
Толстых Дмитрий Владимирович
ул. Репина, д. 3, г. Екатеринбург, 620028
Е. А. Мухлынина
Россия
Мухлынина Елена Артуровна, канд. биол. наук
ул. Первомайская, д. 106, г. Екатеринбург, 620049
Дополнительные файлы
Рецензия
Для цитирования:
Изможерова Н.В., Зайцев Д.В., Базарный В.В., Бахтин В.М., Полушина Л.Г., Копенкин М.А., Толстых Д.В., Мухлынина Е.А. Влияние оротата магния на состояние грудного отдела аорты лабораторных кроликов, получающих левофлоксацин. Безопасность и риск фармакотерапии. 2024;12(3):341-351. https://doi.org/10.30895/2312-7821-2024-393
For citation:
Izmozherova N.V., Zaytsev D.V., Bazarny V.V., Bakhtin V.M., Polushina L.G., Kopenkin M.A., Tolstykh D.V., Mukhlynina E.A. Magnesium Orotate Influence on Thoracic Aorta in Laboratory Rabbits Receiving Levofloxacin. Safety and Risk of Pharmacotherapy. 2024;12(3):341-351. (In Russ.) https://doi.org/10.30895/2312-7821-2024-393




































