Перейти к:
Антипсихотик-индуцированный паркинсонизм: шкала оценки риска и алгоритм персонализированной диагностики
https://doi.org/10.30895/2312-7821-2024-418
Резюме
ВВЕДЕНИЕ. Антипсихотик-индуцированный паркинсонизм (АИП) — неврологическая нежелательная реакция со стороны экстрапирамидной системы, возникающая на фоне приема антипсихотиков (АП), которая относится к несерьезным нежелательным реакциям. Однако при развитии АИП у пациентов с расстройствами шизофренического спектра значительно снижается качество жизни, поэтому актуальной задачей является ранняя диагностика и своевременная коррекция АИП.
ЦЕЛЬ. Разработать шкалу оценки риска и персонализированный алгоритм диагностики АИП как наиболее распространенной и клинически значимой неврологической нежелательной реакции у пациентов с расстройствами шизофренического спектра.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен анализ модифицируемых и немодифицируемых факторов риска развития АИП, шкал и опросников, которые используются для диагностики АИП, а также методов лабораторной диагностики АИП на основе информации из полнотекстовых публикаций на русском и английском языках, размещенных в базах данных eLIBRARY.RU, PubMed, Springer, ClinicalKey, Google Scholar. Предварительно выполнена сравнительная оценка эффективности использования валидных шкал риска развития АИП: шкала Симпсона–Ангуса (Simpson–Angus Scale, SAS), шкала оценки экстрапирамидных симптомов (Extrapyramidal Symptom Rating Scale, ESRS), унифицируемая шкала оценки болезни Паркинсона (Unified Parkinson’s Disease Rating Scale, UPDRS), шкала Хэн и Яра (H&Y Scale), рейтинговая шкала Д.Д. Вебстера (Webster Scale), рейтинговая шкала оценки паркинсонизма R.H. Mindham (Mindham Scale). Учтены такие характеристики, как продолжительность тестирования, степень достоверности оценки клинических проявлений АИП, возможность оценки факторов риска (предикторов) АИП, возможность оценки скорости развития АИП. Полученные результаты легли в основу разработки авторского рискометра АИП и алгоритма диагностики.
РЕЗУЛЬТАТЫ. Разработана авторская шкала диагностики и прогнозирования развития АИП, позволяющая оценить риск развития АИП. Для пациентов, имеющих высокий и средний риск развития АИП, определены направления персонализированной тактики ведения пациента. Представлен алгоритм диагностики АИП у пациентов с расстройствами шизофренического спектра в двух вариациях: с использованием прореактивного и реактивного фармакогенетического тестирования. Показано, что прореактивное фармакогенетическое тестирование позволяет определить риск развития АИП у пациента до применения основной терапии.
ВЫВОДЫ. Использование разработанной шкалы оценки риска и алгоритмов диагностики АИП может быть актуальным для практикующих неврологов, психиатров и клинических фармакологов. Разработка и внедрение в реальную клиническую практику новых инструментов для оценки риска, профилактики и диагностики АИП как наиболее распространенной неврологической нежелательной реакции при применении антипсихотических препаратов может обеспечить повышение качества лечебно-профилактической помощи пациентам с рассматриваемыми психическими расстройствами.
Ключевые слова
Для цитирования:
Шнайдер Н.А., Вайман Е.Э., Насырова Р.Ф. Антипсихотик-индуцированный паркинсонизм: шкала оценки риска и алгоритм персонализированной диагностики. Безопасность и риск фармакотерапии. 2025;13(1):70-85. https://doi.org/10.30895/2312-7821-2024-418
For citation:
Shnayder N.A., Vaiman E.E., Nasyrova R.F. Antipsychotic-Induced Parkinsonism: A Risk Assessment Scale and Personalised Diagnosis Algorithm. Safety and Risk of Pharmacotherapy. 2025;13(1):70-85. (In Russ.) https://doi.org/10.30895/2312-7821-2024-418
ВВЕДЕНИЕ
Антипсихотик-индуцированный паркинсонизм (АИП) — это неврологическая нежелательная реакция (НР), возникающая на фоне приема антипсихотических препаратов (АП), сопровождающаяся возникновением акинетико-ригидного синдрома с наличием типичной триады (акинезия, брадикинезия, тремор)1 [1]. Кроме АИП известны и другие ранние и поздние экстрапирамидные НР у пациентов с психическими расстройствами (рис. 1) [2]. Лица с АИП составляют значительную часть пациентов психиатрических стационаров и психоневрологических диспансеров с АП-индуцированными экстрапирамидными расстройствами, требующими неврологической помощи, что вносит существенный вклад в структуру общей заболеваемости и смертности населения во всем мире2.

Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Виды лекарственно-индуцированного экстрапирамидного синдрома (по данным [2])
Fig. 1. Types of drug-induced extrapyramidal syndrome (based on [2])
Согласно принятой дефиниции, НР — это патологическая реакция, неожиданно возникающая при применении обычных (средних терапевтических) доз лекарственных средств (ЛС). АИП можно отнести к предсказуемым НР — тип А по классификации Всемирной организации здравоохранения (ВОЗ)3. Степень тяжести АИП варьирует от легкой (несерьезные НР) до средней тяжести и тяжелой (серьезные НР, которые могут увеличить сроки госпитализации в круглосуточный психиатрический стационар и/или привести к инвалидизации пациента) [3].
Актуальность рассматриваемой проблемы объясняется достаточно высокой распространенностью паркинсонизма, ассоциированного с применением АП, которая по данным ранее опубликованного нами систематического обзора составляет 19% случаев, а в некоторых странах достигает 36% [3][4]. На распространенность АИП могут влиять модифицируемые и немодифицируемые факторы риска, включая генетическую предрасположенность, а также региональные особенности лекарственного обеспечения и приверженности практикующих психиатров к более частому использованию АП с высоким риском развития рассматриваемой неврологической НР [5]. Кроме того, актуальность проблемы АИП у пациентов с расстройствами шизофренического спектра объясняется быстрым темпом развития этой НР и ее несвоевременной диагностикой, что не позволяет провести своевременное лечение на ранних стадиях развития этой неврологической НР на фоне психофармакотерапии и приводит к увеличению сроков госпитализации, снижению или быстрой утрате трудоспособности, ухудшению качества жизни пациентов [5].
Отечественные [6] и зарубежные [7][8] ассоциативные генетические исследования продемонстрировали, что предрасположенность к развитию АИП зависит от носительства вариативных аллелей полиморфизмов генов-кандидатов, кодирующих ключевые ферменты биотрансформации (метаболизма) АП, генов, кодирующих белки-транспортеры, осуществляющие эффлюкс (выведение) АП через гематоэнцефалический барьер из головного мозга в кровь, а также генов, кодирующих мишени действия АП, прежде всего дофаминэргические рецепторы D2 и D3 типов (рис. 2) [2][9].

Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 2. Гены-кандидаты, перспективные для фармакогенетического тестирования антипсихотиков первой и новых генераций
Fig. 2. Candidate genes with the potential for pharmacogenetic testing of first- and new-generation antipsychotics
В настоящее время наиболее изученными генетическими предикторами развития АИП считаются вариативные аллели генов, кодирующих первую фазу метаболизма (Р-окисления) АП в печени [10][11], которые определяют пять метаболических фенотипов: распространенный (экстенсивный или нормальный) метаболизатор; промежуточный метаболизатор; медленный метаболизатор; быстрый метаболизатор; ультрабыстрый метаболизатор [12]. Кроме того, риск развития нейротоксических НР, к которым относится АИП, может быть ассоциирован и с носительством низкофункциональных/нефункциональных вариативных аллелей генов, кодирующих белки транспортеры [13]. У исследователей нет единого мнения о роли вариативных аллелей генов, кодирующих ключевые мишени (рецепторы, ферменты) действия АП [8][9][14].
Существующие классические подходы к диагностике АИП пока не включают результаты предиктивного фармакогенетического тестирования (ФГТ) [15][16], отсутствуют также системы поддержки принятия решений (СППР) при АИП для неврологов и психиатров. Для улучшения процесса опроса пациентов с расстройствами шизофренического спектра в психиатрии помимо Международной классификации болезней (МКБ)4,5 рутинно используются рекомендации, представленные в «Диагностическом и статистическом руководстве по психическим расстройствам» (Diagnostic and Statistical Manual of Mental Disorders, DSM-5)6, позволяющие получить более достоверную информацию как для постановки эффективного и точного диагноза психического расстройства, так и для диагностики НР (в том числе АИП). Кроме того, для диагностики АИП рекомендовано использовать неврологическое обследование, ориентированное на углубленное исследование очаговой симптоматики, характерной для поражения экстрапирамидной системы, и шкалы/опросники [17]. Для АИП характерна триада симптомов: мышечная ригидность, брадикинезия и тремор покоя (встречается редко). Ригидность вовлекает мышцы верхних и нижних конечностей, а также аксиальную мускулатуру. Пациенты предъявляют жалобы на жесткость (скованность) в мышцах. На ранней стадии АИП ригидность может осознаваться пациентом как боль, особенно в плече, нижней части спины. Также у пациентов с АИП может присутствовать постуральная неустойчивость, которая диагностируется путем толчковой пробы (пробы Тевенара), и флексорная поза (камптокормия)7.
В качестве вспомогательных методов диагностики АИП актуально использование валидных шкал и опросников [17]. Распространенными являются: шкала Симпсона–Ангуса (Simpson–Angus Scale, SAS) (пп. 1–9) [18], шкала оценки экстрапирамидных симптомов (Extrapyramidal Symptom Rating Scale, ESRS) (блок I, II, VI) [19], унифицированная шкала оценки болезни Паркинсона (Unified Parkinson’s Disease Rating Scale, UPDRS) (блок III, пп. 18–31) [20], шкала Хэн и Яра (H&Y Scale; оценка тяжести паркинсонизма от 0 до 5 стадии) [21], рейтинговая шкала Д.Д. Вебстера (Webster Scale) (пп. 1–10) [22] и рейтинговая шкала оценки паркинсонизма P.X. Майндхэма (Mindham Scale) (блоки I–V) [23]. Однако чувствительность и специфичность валидизированных шкал и опросников, применяющихся в психиатрической практике, могут быть недостаточными для оценки риска, прогноза и ранней диагностики АИП неврологом-консультантом психиатрических медицинских учреждений [17].
Правильность и своевременность постановки диагноза АИП у пациентов с расстройствами шизофренического спектра могут быть улучшены с помощью разработки шкал оценки риска АИП, персонализированных алгоритмов диагностики АИП и СППР для практикующих врачей. Внедрение в клиническую практику новых прогностических и диагностических инструментов позволит персонализировано оценить риск и динамику развития АИП, аддитивное влияние негенетических и генетических предикторов на развитие этой неврологической НР, межлекарственные взаимодействия, необходимость проведения дополнительных обследований и корректировки лечения [15]. Такой персонализированный подход согласуется с принципами предиктивной, превентивной и персонализированной медицины8.
Цель работы — разработать шкалу оценки риска и персонализированный алгоритм диагностики антипсихотик-индуцированного паркинсонизма как наиболее распространенной и клинически значимой неврологической НР у пациентов с расстройствами шизофренического спектра.
МАТЕРИАЛЫ И МЕТОДЫ
Поиск информации о факторах риска и методах диагностики АИП проводили в базах данных eLIBRARY.RU, PubMed, Springer, ClinicalKey, Google Scholar по ключевым словам и их комбинациям: «антипсихотик-индуцированный паркинсонизм», «лекарственно-индуцированный паркинсонизм», «антипсихотики», «риск развития», «диагностика», «шкалы», «фармакогенетическое тестирование», «терапевтический лекарственный мониторинг». Были проанализированы статьи, опубликованные в период с 15.12.2013 по 15.12.2023. Критерии включения: 1) полнотекстовые публикации, включая: оригинальные исследования, клинические случаи, систематические обзоры, метаанализы, Кокрейновские обзоры; 2) язык публикаций: русский, английский; 3) соответствие публикаций цели настоящего исследования; 4) клинические исследования с участием пациентов с расстройствами шизофренического спектра и АИП.
Критерии исключения: 1) тезисы конференций, постеры, аннотации публикаций без доступа к полной версии; 2) публикации на других иностранных языках, кроме английского; 3) оригинальные исследования на животной модели АИП; 4) статьи, опубликованные ранее декабря 2013 г.; 5) оригинальные статьи с сомнительными данными или выполненные на небольшой выборке пациентов (n<30).
Кроме того, были использованы данные ранее опубликованного нами систематического обзора наиболее часто используемых шкал и опросников для диагностики АИП (SAS, ESRS, UPDRS, H&Y Scale, Webster Scale, Mindham Scale), в котором были проанализированы возможности и ограничения этих диагностических инструментов, включая такие характеристики, как продолжительность тестирования, степень достоверности оценки клинических проявлений АИП, возможность оценки факторов риска (предикторов) АИП, возможность оценки скорости развития АИП [17]. Продемонстрировано, что шкалы SAS, ESRS, UPDRS, H&Y Scale, Webster Scale, Mindham Scale не могут обеспечить оценку риска АИП и улучшить скрининг АИП на ранних стадиях развития [9]. Кроме того, эти шкалы и опросники не позволяют оценить аддитивный вклад генетических и негенетических факторов риска развития АИП, выявить клинические особенности (формы АИП, включая акинетико-ригидную, смешанную и дрожательную), а также не позволяют оценить особенности течения и скорость прогрессирования АИП. Проанализированные шкалы не учитывают результаты современных методов лабораторной диагностики АИП, а в опросники эти показатели не включаются априори. Кроме того, использование ранее предложенных шкал и опросников трудозатратно для практикующих неврологов и психиатров, и в ряде случаев у врачей могут возникнуть сложности в интерпретации полученных результатов.
Результаты анализа шкал и опросников для диагностики АИП, а также результаты собственных исследований по инициативным темам «Изучение влияния генетической вариабельности рецепторов дофамина 2 и 3 типов на возникновение нежелательных реакций экстрапирамидного спектра» (номер государственной регистрации АААА-А16-116091550002-2, протокол Проблемной комиссии от 26.10.2021 № 9/2021) и «Антипсихотик-индуцированные экстрапирамидные нарушения: клинические и генетические предикторы» (протокол Проблемной комиссии от 26.10.2021 № 9/2021), проведенных на базе ФГБУ «НМИЦ ПН им. В.М. Бехтерева» Минздрава России, легли в основу разработки авторской шкалы оценки риска АИП (рискометра) и алгоритма персонализированной диагностики АИП. Настоящий этап исследования выполнен в рамках государственного задания Национального медицинского исследовательского центра психиатрии и неврологии им. В.М. Бехтерева Министерства здравоохранения Российской Федерации (XSOZ 2024 0012).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенного анализа данных литературы установлено, что пациенты пожилого возраста более подвержены риску развития АИП, а у женщин АИП развивается в 2 раза чаще по сравнению с мужчинами [24–26]. Генетическая теория АИП развивается уже более 40 лет. На основе данных ранее проведенных ассоциативных генетических исследований продемонстрировано, что риск развития АИП повышается у пациентов — носителей генетических полиморфизмов (однонуклеотидных вариантов и тандемных повторов) широкого круга генов-кандидатов, включая: rs1799732, rs1800497, rs6275 гена DRD2; rs167771 гена DRD3; rs4680 гена СOMT; rs6311 гена 5HTR2A; rs6318, rs3813929 гена HTR2C; rs2179652, rs2746073, rs4606, rs1819741, rs1152746, rs1933695 гена RGS2; rs4795390 гена PPP1R1B; rs6265 гена BDNF; rs12678719 гена ZFPM2; rs938112 гена LSMAP; rs2987902 гена ABL1; HLA-B44 гена HLAB; rs16947, rs1135824, rs3892097, rs2837173, rs5030867, rs5030865, rs1065852, rs5030863, rs5030862, rs28371706, rs28371725 и rs1080983 гена CYP2D6 [9][27]. Среди модифицируемых факторов риска АИП выделяют характеристики АП [3][28] и сопутствующие заболевания [3][26][29–32] (рис. 3).
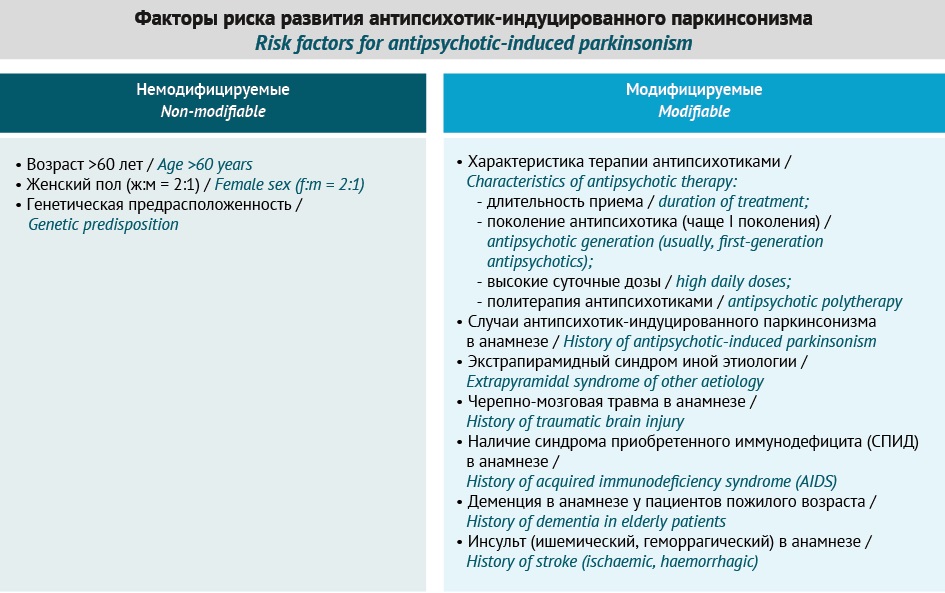
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 3. Факторы риска развития антипсихотик-индуцированного паркинсонизма
Fig. 3. Risk factors for antipsychotic-induced parkinsonism
В рамках лабораторной диагностики АИП актуально определение уровня гомованилиновой кислоты или 3-метокси-4-гидроксифенилуксусной кислоты (ГМК), ФГТ и терапевтический лекарственный мониторинг (ТЛМ) [2].
Определение уровня ГМК в ликворе и моче — высокоэффективный метод лабораторной и дифференциальной диагностики АИП и болезни Паркинсона. ГМК представляет собой основной продукт обмена катехоламинов, в том числе дофамина, и ранее предложена в качестве специфического и высоко чувствительного биомаркера АИП [33]. На старте терапии АП уровень ГМК в ликворе кратковременно повышается в случае развития острого/подострого АИП. Однако на фоне хронической терапии АП уровень ГМК в ликворе (в норме 1,4–8,8 мг/мл) может снижаться из-за развития толерантности к АП. Поэтому важно проводить исследование уровня ГМК на старте терапии АП. В связи с тем что люмбальная пункция является инвазивной процедурой [33], предложены малоинвазивные и неинвазивные методы исследования ГМК [34]. Наиболее удобным в рамках клинической практики является исследование уровня ГМК в суточной моче (в норме 0–15 мг/сут).
Чувствительный и информативный метод молекулярно-генетической диагностики для прогноза и профилактики АИП — ФГТ, которое позволяет исследовать носительство вариативных аллелей генов-кандидатов, ответственных за фармакокинетику и фармакодинамику АП, а также генов — мишеней действия АП (рис. 2) [35]. Результаты прореактивного (предиктивного) ФГТ позволяют определить, в какую группу риска развития АИП (низкий, средний, высокий) входит конкретный пациент, и выбрать персонализированную стратегию профилактики АИП. Результаты реактивного ФГТ могут помочь уточнить причины развития АИП и выбрать персонализированную стратегию коррекции этой неврологической НР [36].
Другим лабораторным методом диагностики является ТЛМ, который позволяет исследовать уровень АП и/или его активного метаболита(ов) в сыворотке/плазме крови. Наиболее информативно проведение ТЛМ в трех точках: 1-я точка — до приема АП во время максимального снижения стационарной концентрации АП в крови, непосредственно перед очередным введением этого ЛС; 2-я точка — на концентрационном максимуме АП (пиковая концентрация АП), который измеряют, как правило, спустя 2–3 ч после перорального приема, или спустя 1 ч после внутримышечной инъекции ЛС, или через 30 мин после внутривенного введения ЛС; 3-я точка — перед вторым приемом АП (при приеме АП 2 раза/сут), где определяется остаточная концентрация ЛС [37–43]. Для определения взаимосвязи между развитием АИП и концентрацией АП в крови полученные показатели ТЛМ сравнивают с данными таблиц терапевтической пороговой концентрации АП (табл. 1).
Таблица 1. Рекомендованный уровень терапевтического лекарственного мониторинга с учетом терапевтической пороговой концентрации антипсихотиков в сыворотке крови (по данным [44] с изм.)
Table 1. Levels of recommendation for therapeutic drug monitoring based on therapeutic thresholds for antipsychotic serum concentrations (adapted from [44])
|
Название антипсихотического препарата Antipsychotic agent |
Терапевтическая пороговая концентрация (мкг/л) Therapeutic threshold concentration (µg/L) |
Уровень рекомендации терапевтического лекарственного мониторинга* Level of recommendation for therapeutic drug monitoring* |
|
Азенапин / Asenapine |
1–5 |
4 |
|
Амисульприд / Amisulpride |
100–320 |
1 |
|
Арипипразол / Aripiprazole |
100–350 |
2 |
|
Брексипипразол / Brexipiprazole |
40–140 |
3 |
|
Галоперидол / Haloperidol |
5–15 |
1 |
|
Зипрасидон / Ziprasidone |
50–200 |
2 |
|
Зотепин / Zotepine |
10–150 |
3 |
|
Илоперидон / Iloperidone |
15–40 |
3 |
|
Карипразин / Cariprazine |
10–20 |
3 |
|
Кветиапин / Quetiapine |
100–500 |
2 |
|
Клозапин / Clozapine |
350–600 |
1 |
|
Луразидон / Lurasidone |
15–40 |
3 |
|
Оланзапин / Olanzapine |
20–80 |
1 |
|
Палиперидон / Paliperidone |
20–60 |
2 |
|
Рисперидон / Risperidone |
20–60 |
2 |
|
Сертиндол / Sertindole |
50–100 |
2 |
|
Хлорпромазин / Chlorpromazine |
30–300 |
2 |
Таблица модифицирована авторами / The table is modified by the authors
* Уровни рекомендаций: 1 — настоятельно рекомендуется, установлен терапевтический диапазон; 2 — рекомендовано; 3 — возможно использование; 4 — вероятно полезно использование.
* Levels of recommendation: 1, strongly recommended (established therapeutic range); 2, recommended; 3, useful; 4, probably useful.
Американская психиатрическая ассоциация (American Psychiatric Association)9 рекомендует с целью профилактики и диагностики ранних проявлений АИП у пациентов с расстройствами шизофренического спектра проведение ТЛМ для исключения высоких концентраций АП в крови каждые 3–12 мес. в зависимости от индивидуальных (персональных) факторов риска: фенотип (медленный или промежуточный метаболизатор и/или медленный транспортер) [45] и поколения назначенного АП. При назначении АП первого поколения рекомендуется проведение ТЛМ каждые 6 мес., а при применении АП новых поколений — каждые 12 мес. Частоту проведения ТЛМ в рамках скрининга АИП следует увеличить в 2 раза у пожилых пациентов и пациентов с фенотипом «медленный метаболизатор» [46].
На основе результатов изучения данных о модифицируемых и немодифицируемых факторах риска развития АИП [3][24–26][28–32] нами разработана авторская шкала оценки риска (рискометр) АИП (табл. 2). Интерпретация результатов была проведена с использованием шкалы перцентилей (Гальтон, 1885) [47], где низкий риск оценивался от 0 до 25%, средний риск — от 26 до 75%, высокий риск — от 76 до 100%.
Таблица 2. Шкала оценки риска (рискометр) антипсихотик-индуцированного паркинсонизма
Table 2. Risk assessment scale (riskometer) for antipsychotic-induced parkinsonism
|
Фактор риска (предиктор) Risk factor (predictor) |
Критерий оценки (балл) Evaluation criterion (score) |
|
Пол пациента / Patient sex · мужской / male · женский / female |
0 1 |
|
Возраст пациента / Patient age · моложе 60 лет / under 60 years old · 60 лет и старше / over 60 years old |
0 1 |
|
Наличие экстрапирамидного синдрома у родителей пациента History of extrapyramidal syndrome in the patient’s parents |
1 |
|
Наличие АИП при ранее назначаемой АП-терапии или препаратов других фармакологических групп History of AIP associated with previously prescribed APs or products from other pharmacological classes |
1 |
|
Наличие экстрапирамидного синдрома иной этиологии (в том числе на фоне болезни Паркинсона, гепатолентикулярной дегенерации) History of extrapyramidal syndrome of other aetiology (including associated with Parkinson’s disease, hepatolenticular degeneration) |
1 |
|
Черепно-мозговая травма в анамнезе / History of traumatic brain injury · отсутствует / absent · присутствует / present |
0 1 |
|
Наличие деменции в анамнезе / History of dementia · дебют в возрасте до 60 лет / debut before the age of 60 years · дебют в возрасте после 60 лет / debut after the age of 60 years |
0 1 |
|
Инсульт в анамнезе / History of stroke · отсутствие инсульта (ишемического, геморрагического) в анамнезе / no history of stroke (ischaemic, haemorrhagic) · наличие инсульта (ишемического, геморрагического) в анамнезе / history of stroke (ischaemic, haemorrhagic) |
0
1 |
|
СПИД в анамнезе / History of AIDS · отсутствует / absent · присутствует / present |
0 1 |
|
Прием АП / AP use by the patient · пациент АП не принимает / no APs · пациент принимает АП новых генераций / new-generation APs · пациент принимает АП первой генерации / first-generation APs |
0 1 2 |
|
Синдром «кролика» (орофациальный тремор) / Rabbit syndrome (orofacial tremor) · отсутствует / absent · присутствует / present |
0 1 |
|
Брадикинезия и гипокинезия / Bradykinesia and hypokinesia · отсутствуют / absent · минимальная замедленность движений / minimal slowness of movement · небольшое, но очевидное замедление движений или уменьшение их амплитуды / slight but obvious slowness or decreased amplitude of movement · умеренная замедленность движений / moderate slowness · выраженная замедленность движений / severe slowness |
0 1 2 3 4 |
|
Мышечная ригидность / Muscle rigidity: · отсутствует / absent · легкая ригидность или определяемая лишь при разнонаправленных движениях / slight rigidity or rigidity detectable only with multidirectional movements · легкая или умеренная ригидность / mild or moderate rigidity · выраженная ригидность, но возможен полный объем движений / marked rigidity with full range of motion · тяжелая ригидность / severe rigidity |
0 1
2
3 4 |
|
Мышечный тонус / Muscle tone · в норме / normal · гипотонус / hypotonia · гипертонус по экстрапирамидному типу / extrapyramidal hypertonia · гипертонус по пирамидному типу / pyramidal hypertonia · гипертонус по смешанному типу / mixed hypertonia |
0 1 2 3 4 |
|
Постуральная неустойчивость / Postural instability · отсутствует / absent · ретропульсия, но пациент самостоятельно восстанавливает равновесие / retropulsion is present, but the patient independently restores balance · пациент не может сохранять равновесие самостоятельно, без поддержки падает / the patient cannot maintain balance independently and falls without support · выражена неустойчивость, пациент теряет равновесие спонтанно / instability is pronounced; the patient loses balance spontaneously · пациент не может стоять без посторонней помощи / the patient cannot stand without assistance |
0 1
2
3
4 |
|
Тремор покоя / Resting tremor · отсутствует / absent · незначительный и непостоянный тремор / insignificant and transient tremor · постоянный тремор небольшой амплитуды или периодический тремор средней амплитуды / constant tremor of small amplitude or periodic tremor of medium amplitude · почти постоянный тремор средней амплитуды / almost constant tremor of medium amplitude · почти постоянный тремор большой амплитуды / almost constant tremor of large amplitude |
0 1 2
3 4
|
|
Тремор действия или постуральный / Action or postural tremor: · отсутствует / absent · легкий тремор действия / slight action tremor · тремор действия средней амплитуды / action tremor of medium amplitude · сочетание тремора действия и постурального тремора средней амплитуды / combination of action tremor and postural tremor of medium amplitude · тремор действия большой амплитуды, мешает приему пищи / action tremor of large amplitude, interfering with food intake |
0 1 2 3 4
|
|
Проявления экстрапирамидного синдрома / Manifestations of extrapyramidal syndrome · односторонние проявления / unilateral manifestations · двусторонние проявления / bilateral manifestations |
0 1 |
|
Констипация / Constipation: · отсутствует / absent · присутствует / present |
0 1 |
|
Суточный уровень (экскреция) гомованилиновой кислоты в моче / Daily urine level (excretion) of homovanillic acid · ниже 15 мг/сут / below 15 mg/day · выше 15 мг/сут / above 15 mg/day |
0 1 |
|
Результаты ФГТ для прогнозирования скорости метаболизма АП с печеночным или преимущественно печеночным путем биотрансформации [10][12] / PGx testing results for predicting the rate of metabolism of APs that undergo hepatic or primarily hepatic biotransformation · быстрый метаболизатор / fast metaboliser · экстенсивный (распространенный) метаболизатор / extensive (normal) metaboliser · промежуточный метаболизатор / intermediate metaboliser · медленный метаболизатор / poor metaboliser |
–1 0
1 2 |
|
Результаты ФГТ для прогнозирования скорости эффлюкса АП (выведение лекарства из головного мозга в кровь [13] / PGx testing results for predicting the rate of AP efflux (removal of the medicine from the brain to blood) · быстрый транспортер / fast transporter · экстенсивный (распространенный) транспортер / extensive (normal) transporter · промежуточный транспортер / intermediate transporter · медленный транспортер / poor transporter |
–1
0 1 2 |
Таблица составлена авторами / The table is prepared by the authors
Примечание. Уровень гомованилиновой кислоты определяется при дебюте антипсихотик-индуцированного паркинсонизма (АИП). ФГТ — фармакогенетическое тестирование, АП — антипсихотик.
Интерпретация результатов:
0–11 баллов — низкий риск развития АИП (возможный АИП);
12–32 балла — средний риск развития АИП (вероятный АИП);
33–43 балла — высокий риск развития АИП (определенный АИП).
Note. The level of homovanillic acid is determined at the onset of antipsychotic-induced parkinsonism (AIP). PGx, pharmacogenetic testing; AP, antipsychotic agent.
Interpretation of results:
0–11 points, low risk of AIP (possible AIP);
12–32 points, medium risk of AIP (probable AIP);
33–43 points, high risk of AIP (definite AIP).
Тип ФГТ может влиять на стратегию ведения пациентов с расстройствами шизофренического спектра, получающими АП, прежне всего на прогнозирование, профилактику и диагностику АИП у конкретного пациента [48]. С учетом этого нами были разработаны два варианта персонализированного алгоритма диагностики АИП в зависимости от типа проводимого ФГТ (табл. 3): прореактивного (рис. 4) или реактивного (рис. 5).
Таблица 3. Типы фармакогенетического тестирования
Table 3. Types of pharmacogenetic testing
|
Параметр Parameter |
Фармакогенетическое тестирование Pharmacogenetic testing |
|
|
Прореактивное Pro-reactive |
Реактивное Reactive |
|
|
Тип исследования Type of testing |
Прогностическое или предиктивное исследование носительства аллелей риска генов-кандидатов, ассоциированных с нарушением фармакокинетики и/или фармакодинамики лекарственного средства Prognostic or predictive testing for carriage of risk alleles of candidate genes associated with impaired pharmacokinetics and/or pharmacodynamics of a medicinal product |
Подтверждающее исследование носительства аллелей риска генов-кандидатов, ассоциированных с нарушением фармакокинетики и/или фармакодинамики лекарственного средства Confirmatory testing for carriage of risk alleles of candidate genes associated with impaired pharmacokinetics and/or pharmacodynamics of a medicinal product |
|
Время проведения исследования Time of testing |
Рекомендовано проведение до назначения лекарственного средства или на старте терапии (на стадии титрации дозы). Проводится ДО развития нежелательных лекарственных реакций Recommended before prescribing or when starting therapy (at the dose titration stage). Carried out BEFORE the development of adverse drug reactions |
Рекомендовано проведение после назначения лекарственного средства или после старта терапии (после стадии титрации дозы). Проводится ПОСЛЕ развития нежелательных лекарственных реакций Recommended after prescribing or starting therapy (after the dose titration stage). Carried out AFTER the development of adverse drug reactions |
Таблица составлена авторами / The table is prepared by the authors
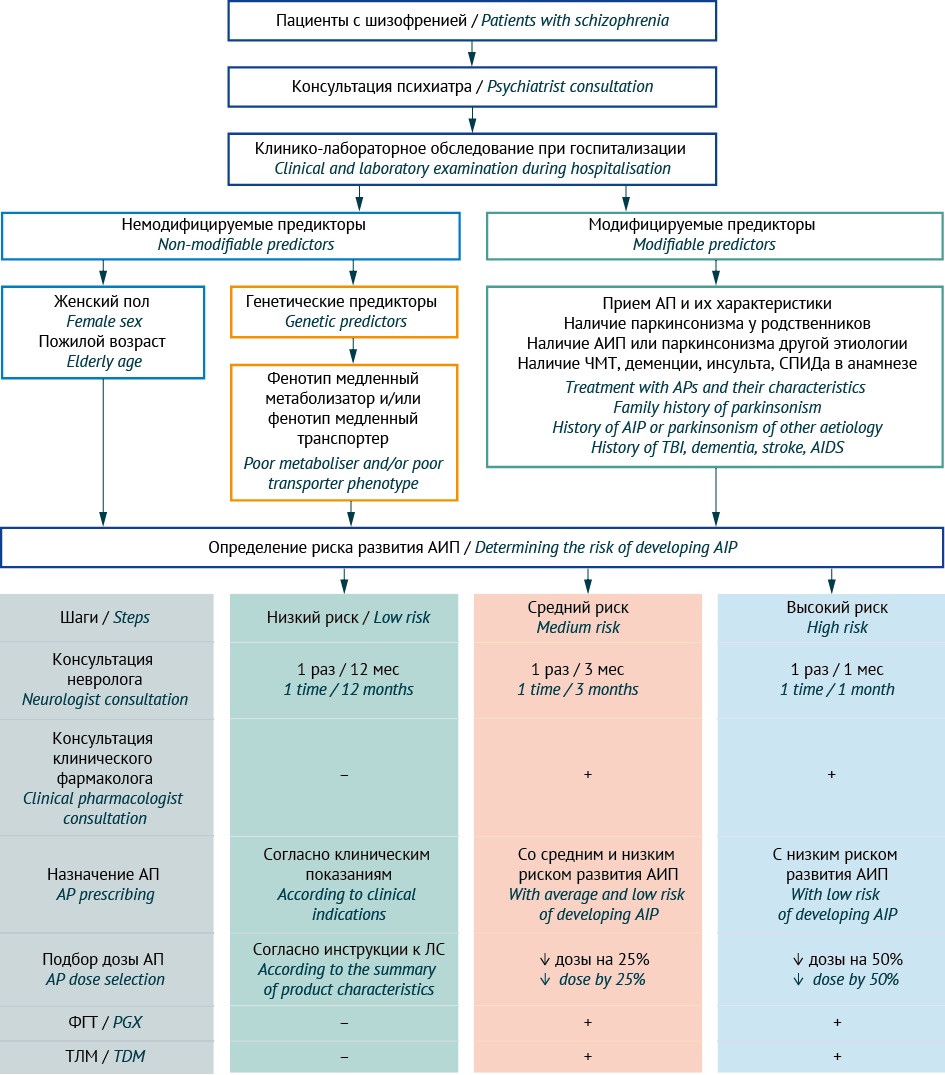
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 4. Алгоритм персонализированной диагностики антипсихотик-индуцированного паркинсонизма у пациентов с расстройствами шизофренического спектра с использованием прореактивного фармакогенетического тестирования. ФГТ — фармакогенетическое тестирование; АП — антипсихотик; АИП — антипсихотик-индуцированный паркинсонизм; ЧМТ — черепно-мозговая травма; ЛС — лекарственное средство; ТЛМ — терапевтический лекарственный мониторинг; «+» — использование показано; «–» — использование не показано
Fig. 4. Algorithm for personalised diagnosis of antipsychotic-induced parkinsonism in patients with schizophrenia spectrum disorders based on pro-reactive pharmacogenetic testing. PGx, pharmacogenetic testing; AP, antipsychotic agent; AIP, antipsychotic-induced parkinsonism; TDM, therapeutic drug monitoring; +, recommended; –, not recommended
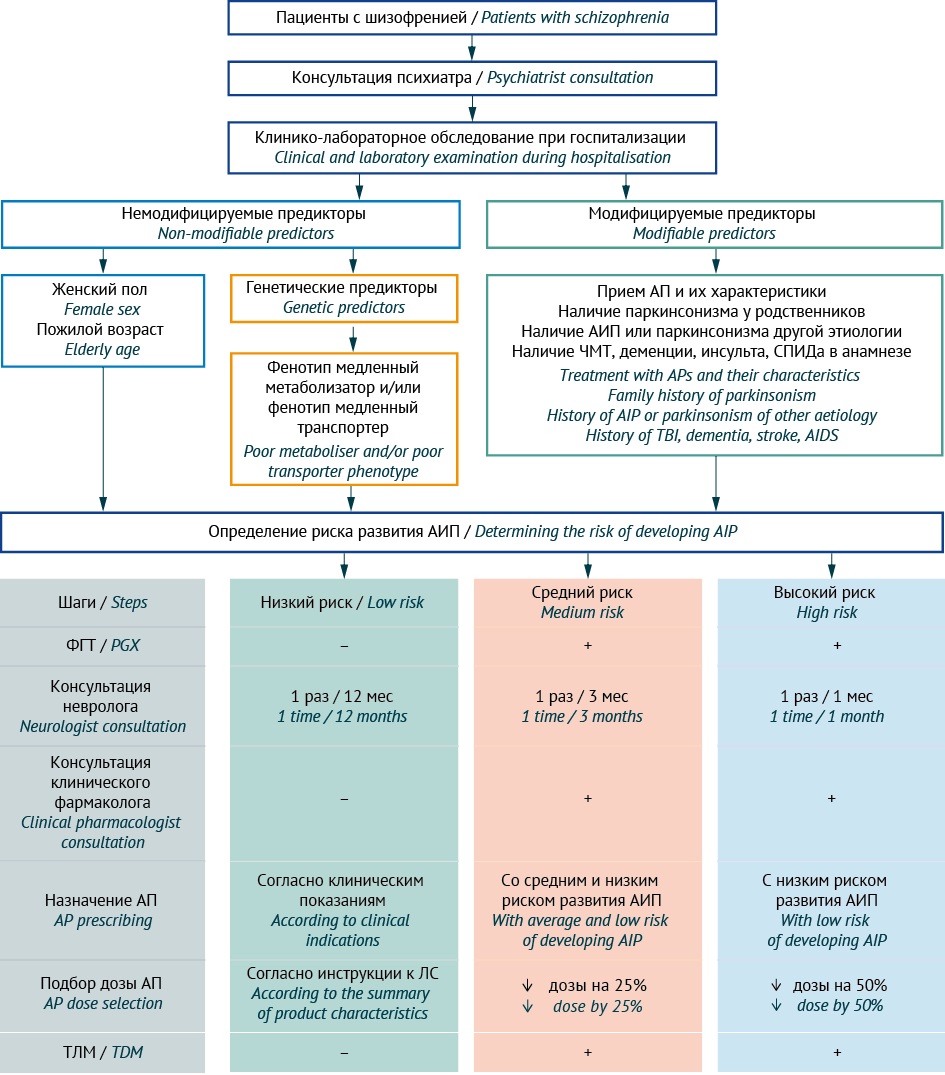
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 5. Алгоритм персонализированной диагностики антипсихотик-индуцированного паркинсонизма у пациентов с расстройствами шизофренического спектра с использованием реактивного фармакогенетического тестирования. ФГТ — фармакогенетическое тестирование; АП — антипсихотик; АИП — антипсихотик-индуцированный паркинсонизм; ЧМТ — черепно-мозговая травма; ЛС — лекарственное средство; ТЛМ — терапевтический лекарственный мониторинг; «+» — использование показано; «–» — использование не показано
Fig. 5. Algorithm for personalised diagnosis of antipsychotic-induced parkinsonism in patients with schizophrenia spectrum disorders based on reactive pharmacogenetic testing. PGx, pharmacogenetic testing; AP, antipsychotic agent; AIP, antipsychotic-induced parkinsonism; TDM, therapeutic drug monitoring; +, recommended; –, not recommended
Отличия предложенных нами вариантов персонализированного алгоритма диагностики АИП в следующем. Реактивное ФТГ назначают после развития АИП на фоне приема одного или нескольких АП и/или при повышении уровня принимаемого АП в крови выше верхней границы терапевтического коридора по данным ТЛМ или при повышении уровня ГМК в моче. Использование этого варианта алгоритма [15][49] может быть полезно для диагностики и коррекции АИП, а также для выбора дозы принимаемого АП или замены принимаемого АП на альтернативный АП с меньшим индивидуальным (персональным) риском АИП, но не позволяет провести профилактические мероприятия до развития АИП.
Вариант алгоритма с использованием прореактивного ФТГ, напротив, позволяет оценить риск АИП и провести профилактические мероприятия до назначения АП или на стадии титрования дозы до проведения ТЛМ как у наивного пациента, так и у пациентов с наличием в анамнезе случаев развития НР при приеме ЛС других фармакологических групп. Это дает возможность лечащему врачу своевременно и персонализировано принимать меры по профилактике АИП у пациентов, относящихся к группам среднего и высокого риска развития этой неврологической НР. Профилактические мероприятия могут включать отказ от назначения конкретного АП, метаболизм которого у пациента значительно замедлен (медленный метаболизатор — группа высокого риска), или снизить дозу этого АП в случае умеренного снижения его метаболизма (промежуточный метаболизатор — группа среднего риска). Таким образом, этот вариант алгоритма является наиболее полезным для прогноза и профилактики АИП как с клинической точки зрения (снижение частоты и тяжести АП-индуцированных НР), так и с экономической точки зрения (снижение затрат на терапию вследствие снижения суточной дозы АП на 25 и 50% у пациентов с фармакогенетическим профилем промежуточного и медленного метаболизатора соответственно, и уменьшение затрат на назначение ЛС — корректоров АИП).
ЗАКЛЮЧЕНИЕ
Безопасность и риск применения АП при лечении расстройств шизофренического спектра во многом определяются их возможностью индуцировать нейротоксические НР, в первую очередь АИП. Разработанная авторами шкала оценки риска (рискометр) АИП может помочь лечащему врачу персонализированно назначить антипсихотическую терапию с минимально возможным риском развития рассматриваемой неврологической НР у конкретного пациента. Данная шкала включает наиболее значимые факторы риска АИП, а также современные возможности лабораторной диагностики. Представленный рискометр прост в использовании, не занимает много времени в реальной клинической практике и может быть включен в электронную историю болезни пациента медицинских учреждений психиатрического профиля.
Представлен алгоритм персонализированной диагностики АИП, включающий два варианта в зависимости от времени проведения ФГТ (до развития АИП — преактивное ФГТ, после развития АИП — реактивное ФГТ). Наиболее перспективным в плане прогнозирования, профилактики и диагностики АИП является использование прореактивного ФГТ, учитывая возможность получения всех необходимых данных на старте психофармакотерапии. Использование реактивного ФТГ, которое назначается после развития АИП, также может быть актуально для дальнейшей персонализированной коррекции терапии в связи с появлением возможности выбора наиболее безопасного АП и его дозы, а также (в случае политерапии или комбинированной терапии) выбора нескольких АП и психотропных ЛС других фармакологических групп (антидепрессантов, нормотимиков, анксиолитиков) с учетом генетически детерминированных особенностей их метаболизма и межлекарственного взаимодействия у конкретного пациента.
Разработка и внедрение в реальную клиническую практику новых инструментов для оценки риска профилактики и диагностики АИП могут обеспечить повышение качества специализированной неврологической и психиатрической помощи пациентам с расстройствами шизофренического спектра.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.А. Шнайдер — концепция и дизайн исследования, разработка алгоритма, редактирование и утверждение окончательного варианта рукописи для публикации; Е.Э. Вайман — сбор и анализ данных литературы, анализ нормативных документов, написание текста рукописи; Р.Ф. Насырова — концепция и дизайн рискометра, руководство проектом.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Natalia A. Shnayder conceptualised and designed the study, developed the algorithm, edited and approved the final version of the manuscript for publication. Elena E. Vaiman collected and analysed literature data, analysed regulatory documents, and drafted the manuscript. Regina F. Nasyrova conceptualised and designed the riskometer and administered the project.
1. Левин ОС, Иллариошкин СН, Голубев ВЛ. Экстрапирамидные синдромы. Руководство для врачей. М.: МЕДпресс-информ; 2022.
2. Там же.
3. World Health Organisation. International Drug Monitoring: The Role of National Centres. Technical Report Series No. 498. WHO; 1972.
4. Международная классификация болезней 10-го пересмотра (МКБ-10). https://mkb-10.com/
5. ICD-11 for mortality and morbidity statistics. https://icd.who.int/browse/2024-01/mms/en
6. American Psychiatric Association. Diagnostic and statistical manual of mental disorders, fifth edition (DSM-5). https://dsm.psychiatryonline.org/doi/book/10.1176/appi.books.9780890425596
7. Николаева ТЯ, Шнайдер НА, Попова ТЕ, Таппахов АА, Сапронова МР. Паркинсонизм: клиника, диагностика, лечение: учебное пособие. Якутск: Изд-во СВФУ; 2017.
8. Приказ Министерства здравоохранения Российской Федерации от 24.04.2018 № 186 «Об утверждении Концепции предиктивной, превентивной и персонализированной медицины».
9. American Psychiatric Association. https://www.psychiatry.org/
Список литературы
1. Левин ОС, ред. Экстрапирамидные расстройства — вчера, сегодня, завтра. М.: МЕДпресс-информ; 2015.
2. Шнайдер НА, Вайман ЕЭ, Незнанов НГ, Насырова РФ. Фармакогенетика антипсихотик-индуцированных экстрапирамидных расстройств. СПб: Издательство ДЕАН; 2022.
3. Вайман ЕЭ, Шнайдер НА, Незнанов НГ, Насырова РФ. Лекарственно-индуцированный паркинсонизм. Социальная и клиническая психиатрия. 2021;31(1):96–103. EDN: MWEAHI
4. Mentzel CL, Bakker PR, van Os J, Drukker M, Matroos GE, Tijssen MAJ, vanHarten PN. Blink rate is associated with drug-induced parkinsonism in patients with severe mental illness but does not meet requirements to serve as a clinical test: The Curacao extrapyramidal syndromes study XIII. J Negat Results Biomed. 2017;16(1):15. https://doi.org/10.1186/s12952-017-0079-y
5. Левин ОС. Диагностика и лечение экстрапирамидных гиперкинезов. Лечащий врач. 2005;(6):20–6.
6. Иванова СА, Алифирова ВМ, Жукова ИА, Бойко АС, Федоренко ОЮ, Бохан Н.А. Ассоциация DRD3 гена с болезнью Паркинсона. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016;116(5):71–4. https://doi.org/10.17116/jnevro20161165171-74
7. Koning JP, Vehof J, Burger H, Wilffert B, Al Hadithy A, Alizadeh B, et al. Genetic Risk and Outcome in Psychosis (GROUP) investigators. Association of two DRD2 gene polymorphisms with acute and tardive antipsychotic-induced movement disorders in young Caucasian patients. Psychopharmacology (Berl). 2012;219(3):727–36. https://doi.org/10.1007/s00213-011-2394-1
8. Knol W, van Marum RJ, Jansen PA, Strengman E, Al Hadithy AF, Wilffert B, et al. Genetic variation and the risk of haloperidol-related parkinsonism in elderly patients: a candidate gene approach. J Clin Psychopharmacol. 2013;33(3):405–10. https://doi.org/10.1097/JCP.0b013e3182902708
9. Vaiman EE, Shnayder NA, Novitsky MA, Dobrodeeva VS, Goncharova PS, Bochanova EN, et al. Candidate genes encoding dopamine receptors as predictors of the risk of antipsychotic-induced parkinsonism and tardive dyskinesia in schizophrenic patients. Biomedicines. 2021;9:879. https://doi.org/10.3390/biomedicines9080879
10. Shnayder NA, Abdyrakhmanova AK, Nasyrova RF. Oxidation of antipsychotics. Encyclopedia. 2022;2:974–89. https://doi.org/10.3390/encyclopedia2020064
11. Preskorn SH. Drug-drug interactions (DDIs) in psychiatric practice, Part 9: Interactions mediated by drug-metabolizing cytochrome P450 enzymes. J Psychiatr Pract. 2020;26(2):126–34. https://doi.org/10.1097/PRA.0000000000000458
12. Шнайдер НА, Хасанова АК, Насырова РФ. Первая фаза метаболизма антипсихотиков в печени: роль окисления. Фармакогенетика и фармакогеномика. 2022;(1):15–30. https://doi.org/10.37489/2588-0527-2022-1-15-30
13. Nasyrova RF, Shnayder NA, Osipova SM, Khasanova AK, Efremov IS, Al-Zamil M, et al. Genetic predictors of antipsychotic efflux impairment via blood-brain barrier: Role of transport proteins. Genes. 2023;14:1085. https://doi.org/10.3390/genes14051085
14. Ravyn D, Ravyn V, Lowney R, Nasrallah HA. CYP450 pharmacogenetic treatment strategies for antipsychotics: A review of the evidence. Schizophr Res. 2013;149(1–3):1–14. https://doi.org/10.1016/j.schres.2013.06.035
15. Насырова РФ, Добродеева ВС, Скопин СД, Шнайдер НА, Незнанов НГ. Проблемы и перспективы внедрения фармакогенетического тестирования в реальной клинической практике в Российской Федерации. Вестник неврологии, психиатрии и нейрохирургии. 2020;(3):6–12. https://doi.org/10.33920/med-01-2003-01
16. Костюк ГП, Захарова НВ, Резник АМ, Суркова ЕИ, Ильинский ВВ. Перспективы применения фармакогенетических тестов в психиатрии и неврологии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019;119(9):131–5. https://doi.org/10.17116/jnevro2019119091131
17. Вайман ЕЭ, Шнайдер НА, Незнанов НГ, Насырова РФ. Методы диагностики лекарственно-индуцированного паркинсонизма: обзор отечественной и зарубежной литературы. Сибирский вестник психиатрии и наркологии. 2020;4(109):64–72. https://doi.org/10.26617/1810-3111-2020-4(109)-64-72
18. Temmingh HS, van den Brink W, Howells F, Sibeko G, Stein DJ. Methamphetamine use and antipsychotic-related extrapyramidal side-effects in patients with psychotic disorders. J Dual Diagn. 2020;16(2):208–17. https://doi.org/10.1080/15504263.2020.1714099
19. Chouinard G, Cosci F, Chouinard VA, Alphs L. The Extrapyramidal Symptom Rating Scale and its abbreviated version: A critical review of clinimetric properties. Psychother Psychosom. 2023;92(6):359–66. https://doi.org/10.1159/000535113
20. Martínez-Martín P, Rodríguez-Blázquez C, Mario Alvarez, Arakaki T, Arillo VC, Chaná P, et al. Parkinson’s disease severity levels and MDS-Unified Parkinson’s Disease Rating Scale. Parkinsonism Relat Disord. 2015;21(1):50–4. https://doi.org/10.1016/j.parkreldis.2014.10.026
21. Opara J, Małecki A, Małecka E, Socha T. Motor assessment in Parkinson’s disease. Ann Agric Environ Med. 2017;24(3):411–5. https://doi.org/10.5604/12321966.1232774
22. Kapoor S, Saluja A, Margekar SL, Agarwal M, Mondal S, Dhamija RK. Neurogenic supine hypertension and cardiovascular autonomic dysfunction in patients with Parkinson’s disease. Ann Indian Acad Neurol. 2023;26(1):33–8. https://doi.org/10.4103/aian.aian_476_22
23. Bersani G, Grispini A, Marini S, Pasini A, Valducci M, Ciani N. 5-HT2 antagonist ritanserin in neuroleptic-induced parkinsonism: A double-blind comparison with orphenadrine and placebo. Clin Neuropharmacol. 1990;13(6):500–6. https://doi.org/10.1097/00002826-199012000-00003
24. Rajput AH, Offord KP, Beard CM, Kurland LT. Epidemiology of parkinsonism: Incidence, classification, and mortality. Ann Neurol. 1984;16(3):278–82. https://doi.org/10.1002/ana.410160303
25. Kennedy PF, Hershon HI, McGuire RJ. Extrapyramidal disorders after prolonged phenothiazine therapy. Br J Psychiatry. 1971;118(546):509–18.
26. Левин ОС, Шиндряева НН, Аникина МА. Лекарственный паркинсонизм. Журнал неврологии и психиатрии. 2012;8:69–74. EDN: PDXMSD
27. Вайман ЕЭ, Шнайдер НА, Незнанов НГ, Насырова РФ. Гены-кандидаты развития антипсихотик-индуцированного паркинсонизма у пациентов с шизофренией. Обозрение психиатрии и медицинской психологии имени В.М. Бехтерева. 2021;57(4):15–35. https://doi.org/10.31363/2313-7053-2021-57-4-15-35
28. Micheli FE, Cersosimo MG. Drug-induced parkinsonism. Handb Clin Neurol. 2007;84:399–416. https://doi.org/10.1016/S0072-9752(07)84051-6
29. Caligiuri MR, Jeste DV, Lacro JP. Antipsychotic-induced movement disorders in the elderly: Epidemiology and treatment recommendations. Drugs Aging. 2000;17(5):363–84. https://doi.org/10.2165/00002512-200017050-00004
30. Thanvi B, Treadwell S. Drug induced parkinsonism: A common cause of parkinsonism in older people. Postgrad Med J. 2009;85(1004):322–6. https://doi.org/10.1136/pgmj.2008.073312
31. López-Sendón JL, Mena MA, de Yébenes JG. Drug-induced parkinsonism in the elderly: Incidence, management and prevention. Drugs Aging. 2012;29(2):105–18. https://doi.org/10.2165/11598540-000000000-00000
32. Van Gerpen JA. Drug-induced parkinsonism. Neurologist. 2002;8(6):363–70 https://doi.org/10.1097/00127893-200211000-00006
33. Stefani A, Pierantozzi M, Olivola E, Galati S, Cerroni R, D’Angelo V, et al. Homovanillic acid in CSF of mild stage Parkinson’s disease patients correlates with motor impairment. Neurochem Int. 2017;105:58–63. https://doi.org/10.1016/j.neuint.2017.01.007
34. Chia LG, Cheng FC, Kuo JS. Monoamines and their metabolites in plasma and lumbar cerebrospinal fluid of Chinese patients with Parkinson’s disease. J Neurol Sci. 1993;116(2):125–34. https://doi.org/10.1016/0022-510x(93)90316-q
35. Khasanova AK. Pharmacogenetic factors of clozapine-induced metabolic syndrome. Personalized Psychiatry and Neurology. 2023;3(2):38–47. https://doi.org/10.52667/2712-9179-2023-3-2-38-47
36. Neznanov NG. A paradigm shift to treat psychoneurological disorders. Personalized Psychiatry and Neurology. 2021;1(1):1–2.
37. Lara DV, Melo DO, Silva RAM, Santos PCJL. Pharmacogenetic testing in psychiatry and neurology: An overview of reviews. Pharmacogenomics. 2021;22(8):505–13. https://doi.org/10.2217/pgs-2020-0187
38. Redenšek S, Dolžan V. The role of pharmacogenomics in the personalization of Parkinson’s disease treatment. Pharmacogenomics. 2020;21(14):1033–43. https://doi.org/10.2217/pgs-2020-0031
39. Dahl ML. Cytochrome p450 phenotyping/genotyping in patients receiving antipsychotics: Useful aid to prescribing? Clin Pharmacokinet. 2002;41(7):453–70. https://doi.org/10.2165/00003088-200241070-00001
40. Bousman CA, Bengesser SA, Aitchison KJ, Amare AT, Aschauer H, Baune BT, et al. Review and consensus on pharmacogenomic testing in psychiatry. Pharmacopsychiatry. 2021;54(1):5–17. https://doi.org/10.1055/a-1288-1061
41. Eum S, Lee AM, Bishop JR. Pharmacogenetic tests for antipsychotic medications: Clinical implications and considerations. Dialogues Clin Neurosci. 2016;18(3):323–37. https://doi.org/10.31887/DCNS.2016.18.3/jbishop
42. Urban AE, Cubała WJ. Therapeutic drug monitoring of atypical antipsychotics. Psychiatr Pol. 2017;51(6):1059–77. https://doi.org/10.12740/PP/65307
43. Mauri MC, Paletta S, Di Pace C, Reggiori A, Cirnigliaro G, Valli I, et al. Clinical pharmacokinetics of atypical antipsychotics: An update. Clin Pharmacokinet. 2018;57(12):1493–528. https://doi.org/10.1007/s40262-018-0664-3
44. Потанин СС, Морозова МА, Бениашвили АГ, Бурминский ДС, Мирошниченко ИИ. Рекомендации по применению терапевтического лекарственного мониторинга антипсихотиков для индивидуализации подбора терапии при обострении шизофрении. Обозрение психиатрии и медицинской психологии имени В.М. Бехтерева. 2023;57(4):111–9. https://doi.org/10.31363/2313-7053-2023-778
45. Milosavljevic F, Bukvic N, Pavlovic Z, Miljevic C, Pešic V, Molden E, et al. Association of CYP2C19 and CYP2D6 poor and intermediate metabolizer status with antidepressant and antipsychotic exposure: A systematic review and meta-analysis. JAMA Psychiatry. 2021;78(3):270–80. https://doi.org/10.1001/jamapsychiatry.2020.3643
46. Luvsantseren S, Whirl-Carrillo M, Sangkuhl K, Shin N, Wen A, Empey P, et al. Variant interpretation in current pharmacogenetic testing. J Pers Med. 2020;10(4):204. https://doi.org/10.3390/jpm10040204
47. Aronson JK. Francis Galton and the invention of terms for quantiles. J Clin Epidemiol. 2001;54(12):1191–4. https://doi.org/10.1016/s0895-4356(01)00420-6
48. Ward KM, Citrome L. Antipsychotic-related movement disorders: Drug-induced parkinsonism vs. tardive dyskinesia — key differences in pathophysiology and clinical management. Neurol Ther. 2018;7(2):233–48. https://doi.org/10.1007/s40120-018-0105-0
49. Сычев ДА, Кутузова ЛС, Васькова ЛБ. Современный подход к персонализации дозирования варфарина: где и как можно сделать фармакогенетическое тестирование в России? Фармакогенетика и фармакогеномика. 2016;(1):24–8. EDN: WCLOWD
Об авторах
Н. А. ШнайдерРоссия
Шнайдер Наталья Алексеевна, д-р мед. наук, профессор
ул. Бехтерева, д. 3, Санкт-Петербург, 192019
Е. Э. Вайман
Россия
Вайман Елена Эдуардовна
ул. Бехтерева, д. 3, Санкт-Петербург, 192019
Р. Ф. Насырова
Россия
Насырова Регина Фаритовна, д-р мед. наук
ул. Бехтерева, д. 3, Санкт-Петербург, 192019
Дополнительные файлы
Рецензия
Для цитирования:
Шнайдер Н.А., Вайман Е.Э., Насырова Р.Ф. Антипсихотик-индуцированный паркинсонизм: шкала оценки риска и алгоритм персонализированной диагностики. Безопасность и риск фармакотерапии. 2025;13(1):70-85. https://doi.org/10.30895/2312-7821-2024-418
For citation:
Shnayder N.A., Vaiman E.E., Nasyrova R.F. Antipsychotic-Induced Parkinsonism: A Risk Assessment Scale and Personalised Diagnosis Algorithm. Safety and Risk of Pharmacotherapy. 2025;13(1):70-85. (In Russ.) https://doi.org/10.30895/2312-7821-2024-418




































