Перейти к:
Роль фармакогенетического тестирования в оценке риска и безопасности применения вальпроатов: этнический аспект (обзор)
https://doi.org/10.30895/2312-7821-2024-12-2-132-154
Резюме
ВВЕДЕНИЕ. Фармакогенетическое тестирование (ФГТ) играет важную роль в прогнозировании риска развития нежелательных реакций при применении препаратов вальпроевой кислоты (ВК), которые являются одними из наиболее часто назначаемых в неврологии и психиатрии. Однако чувствительность и специфичность скрининговых панелей ФГТ может быть недостаточной в связи с межиндивидуальными различиями метаболизма вальпроатов у пациентов различных этнических/расовых групп.
ЦЕЛЬ. Выявить направления для реализации персонализированного подхода к разработке панелей ФГТ для оценки безопасности и риска фармакотерапии вальпроатами в различных этнических и расовых группах популяции Российской Федерации.
ОБСУЖДЕНИЕ. Проведен анализ результатов популяционных исследований частот нефункциональных и низкофункциональных аллелей генов, кодирующих ключевые изоферменты Р-окисления ВК в печени, опубликованных в период 2012–2022 гг. и размещенных в базах данных eLIBRARY.RU, PubMed, Scopus, Google Scholar. Критерии отбора публикаций: наличие полнотекстовой версии на русском или английском языках, тип публикации — оригинальная статья, систематический обзор, метаанализ, Кокрейновский обзор, клинический случай. Показано, что персонализированная оценка риска и безопасности ВК может зависеть от частоты аллелей риска замедления P-окисления ВК в печени в различных расовых и этнических группах в мире в целом и в России в частности. Определены новые направления для реализации персонализированного подхода к разработке панелей ФГТ для оценки безопасности и риска фармакотерапии вальпроатами с учетом скорости Р-окисления ВК в печени у представителей различных этнических и расовых групп. Однако результаты проведенного обзора популяционных ассоциативных генетических исследований в мире демонстрируют, что прямая трансляция результатов зарубежных исследований в реальную клиническую практику в Российской Федерации путем разработки панелей ФГТ пока недостаточно ясна ввиду этнической и расовой неоднородности популяции и большой территориальной протяженности страны.
ВЫВОДЫ. Для повышения чувствительности и специфичности российских панелей ФГТ требуется проведение «мостовых» исследований, чтобы реплицировать полученные на других этнических группах ассоциации наиболее распространенных аллелей риска нарушения Р-окисления ВК для конкретной популяции регионов России.
Ключевые слова
Для цитирования:
Шнайдер Н.А., Гречкина В.В., Архипов В.В., Насырова Р.Ф. Роль фармакогенетического тестирования в оценке риска и безопасности применения вальпроатов: этнический аспект (обзор). Безопасность и риск фармакотерапии. 2024;12(2):132-154. https://doi.org/10.30895/2312-7821-2024-12-2-132-154
For citation:
Shnayder N.A., Grechkina V.V., Arkhipov V.V., Nasyrova R.F. Role of Pharmacogenetic Testing in the Risk and Safety Assessment of Valproates: The Ethnic Aspect (Review). Safety and Risk of Pharmacotherapy. 2024;12(2):132-154. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-2-132-154
ВВЕДЕНИЕ
Персонализированная оценка риска и безопасности вальпроевой кислоты (ВК) и ее соединений (вальпроатов), которые относятся к наиболее часто применяемым лекарственным средствам (ЛС) в неврологии и психиатрии, базируется на оценке результатов прореактивного, или предиктивного (до назначения ВК), или реактивного (после развития ВК-индуцированных нежелательных реакций (НР)) фармакогенетического тестирования (ФГТ) [1]. ФГТ — это исследование, направленное на выявление носительства полиморфных вариантов генов, включая однонуклеотидные варианты (ОНВ; single-nucleotide variant, SNV) и варианты числа копий (copy number variant, CNV), которые определяют межиндивидуальные различия терапевтического ответа на ЛС. В основе ФГТ лежит полимеразная цепная реакция (ПЦР). В качестве источника генетического материала (ДНК) для ПЦР чаще всего используются кровь или буккальный эпителий. Результаты ФГТ представляют собой идентифицированные генотипы пациента по тому или иному аллельному варианту генов-кандидатов, кодирующих ключевые ферменты метаболизма ЛС, белки-транспортеры ЛС и/или мишени действия ЛС (ферменты, рецепторы). Наличие у пациента определенных полиморфных вариантов генов, которые влияют на фармакокинетику и/или фармакодинамику ЛС, объясняет межиндивидуальные различия эффективности и безопасности применяемых ЛС [2–4].
По результатам ФГТ, целью которого является идентификация аллельных вариантов генов, кодирующих ферменты метаболизма ЛС в печени, предложено выделять пять фенотипов [5] в зависимости от скорости I фазы биотрансформации ЛС (Р-окисления с участием изоферментов цитохрома Р450) [6]: распространенные или экстенсивные метаболизаторы (ЭM); промежуточные метаболизаторы (ПM); медленные метаболизаторы (МM); быстрые метаболизаторы (БМ); ультрабыстрые метаболизаторы (УБM) [7] (рис. 1). Однако типы метаболизаторов различаются в зависимости от консорциума, не все разделяют типы ЭМ и БМ. Консорциум по внедрению клинической фармакогенетики (Clinical Pharmacogenetics Implementation Consortium, CPIC)1, являющийся совместным проектом PharmGKB2 и Исследовательской сети фармакогеномики (Pharmacogenomics Global Research Network, PGRN)3, выделяет также 5 градаций (как указано нами выше), тогда как Голландская рабочая группа по фармакогенетике (Dutch Pharmacogenetics Working Group, DPWG) — только 4 типа метаболизаторов: нормальный метаболизатор (НМ; normal metaboliser, NM), промежуточный метаболизатор (ПМ; intermediate metaboliser, IM), медленный метаболизатор (ММ; poor metaboliser, PM), ультрабыстрый метаболизатор (УБМ; ultra-rapid metaboliser, UM) [8].

Рис. 1. Возможные фенотипы пациентов, получающих препараты вальпроевой кислоты
по результатам фармакогенетического тестирования.
ОНВ — однонуклеотидный вариант, CYPs — изоферменты цитохрома Р450 печени;
ВК — вальпроевая кислота; НР — нежелательная реакция
Fig. 1. Possible phenotypes of patients receiving valproic acid products
according to the pharmacogenetic testing results.
SNVs, single-nucleotide variants; CYPs, hepatic cytochrome P450 isoenzymes;
VPA, valproic acid; ADRs, adverse drug reactions
Целью CPIC является «…определение функции аллеля, которая приводит к назначению фенотипа, который может повлиять на эффективность клинического назначения ЛС». Функция аллеля (по определению CPIC) может отличаться от биохимической функции, описанной в литературе [9]. Например, аллель может демонстрировать снижение функции в экспериментальных условиях (известный также как низкофункциональный аллель), но это снижение настолько мало в клинических условиях, что никаких изменений в назначении ЛС пациенту не требуется. В результате этот аллель может быть классифицирован CPIC как аллель нормальной функции (известный также как полнофункциональный аллель). В то же время следует отметить, что не у всех изоферментов цитохрома Р450 встречаются все 4 (5) типа метаболизма.
Метаболизм ВК осуществляется в печени по трем основным путям: 1) Р-окисление посредством изоферментов цитохрома P450 (CYPs); 2) глюкуронидация с участием изоферментов уридилглюкуронилтрансферазы; 3) ацетилирование в цикле трикарбоновых кислот (митохондриальное окисление) [10]. CYPs (в частности, CYP2A6, CYP2C9, CYP2B6, CYP3A4, CYP2D6) играют решающую роль в I фазе метаболизма (Р-окислении) ВК в гепатоцитах [11], поэтому генетически детерминированное изменение их функциональной активности ассоциировано с межиндивидуальной вариабельностью эффективности и безопасности применения вальпроатов в реальной клинической практике. Это объясняет важность ФГТ в прогнозировании и профилактике ВК-индуцированных НР, особенно при длительной терапии.
Панель ФГТ — это базовый генетический тест с использованием таргетного высокопроизводительного секвенирования ДНК, позволяющий исследовать часть генома пациента на наличие или отсутствие каузальных мутаций и/или ОНВ (аллелей риска), ассоциированных с индивидуальным профилем эффективности и безопасности фармакотерапии. Панель ФГТ предназначена для диагностики межиндивидуальных особенностей терапевтического ответа, ассоциированных с носительством аллелей риска в генах, ответственных за фармакокинетику и/или фармакодинамику ЛС [1].
Панели ФГТ, применяемые для оценки риска и безопасности ЛС в целом и ВК в частности, могут быть различных типов. Скрининговые панели используются для идентификации генетической предрасположенности к развитию лекарственно-индуцированных НР или терапевтической резистентности с использованием нескольких (обычно не более 10) наиболее распространенных и хорошо изученных ОНВ/полиморфизмов без учета или с учетом этнических/расовых аллельных частот в конкретной популяции. Расширенные панели ФГТ предназначены для идентификации носительства как распространенных, так и редких аллелей риска, ассоциированных с клинически значимыми изменениями фармакокинетики и фармакодинамики ЛС с или без учета этнических/расовых аллельных частот в конкретной популяции [12][13]. Таргетные панели ФГТ включают меньше генов, но представляют большую глубину (покрытие), под которой в секвенировании ДНК понимается количество уникальных считываний, которые включают данный нуклеотид в реконструированной последовательности (глубокое секвенирование относится к общей концепции стремления к большому количеству уникальных считываний каждой области последовательности ДНК). Кроме того, как вариант скрининговых панелей ФГТ могут быть использованы Hotspot панели, позволяющие идентифицировать так называемые «горячие точки» (мутации и генетические полиморфные варианты), которые наиболее часто встречаются в той или иной популяции. Конкурентные преимущества панелей ФГТ, особенно при наличии предварительной информации о низкой безопасности ВК или другого ЛС, могут варьировать за счет их стоимости, глубины (покрытия), скорости проведения исследования, времени анализа полученных результатов и их клинической интерпретации [1][14].
Большинство аллельных вариантов генов-кандидатов не вносят значительного вклада в формирование метаболических фенотипов ПM и МM у пациентов, получающих ВК. Несмотря на это, риск развития ВК-индуцированных НР (например, гепатотоксичности, нейротоксичности, тератогенности, метаболического синдрома) [15] может быть вариабельным (низким, средним или высоким) у представителей различных популяций в зависимости от генетически детерминированных изменений ферментативной активности и/или экспрессии ключевых изоферментов цитохрома Р450 печени (CYPs), участвующих в Р-окислении ВК [16]. Несомненно, это следует учитывать при разработке панелей ФГТ для различных этнических и расовых групп пациентов, проживающих на территории Российской Федерации, и их применении в реальной клинической практике невролога и психиатра [3][17][18].
В целом, разработка панелей ФГТ в неврологии и психиатрии актуальна прежде всего для наиболее часто назначаемых психоактивных ЛС с доказанной эффективностью, но с неблагоприятным профилем безопасности, включая развитие серьезных НР [1][19]. К таким ЛС относится ВК и ее соединения [3], что нашло свое отражение в нормативных документах, утвержденных Минздравом России4 и регламентирующих работу практикующих врачей. Чувствительность и специфичность разрабатываемых панелей ФГТ для пациентов, получающих вальпроаты, может варьировать в широком диапазоне, что в последние годы объясняется вариабельностью частот аллелей риска нарушения метаболизма ВК и ее соединений в различных расовых и этнических группах населения мира. Это подтверждают результаты ассоциативных и полногеномных генетических исследований, которые убедительно демонстрируют роль аллелей риска генов, кодирующих ключевые изоферменты цитохрома Р450 печени, в безопасности применения ВК у пациентов различных этнических/расовых групп [20]. Однако крупномасштабные международные исследования, посвященные экономической эффективности внедрения различных типов панелей ФГТ в реальную клиническую практику в неврологии и психиатрии, пока отсутствуют.
Рекомендации по дозированию препаратов ВК разрабатываются на основе результатов ФГТ во многих странах мира [21][22], включая Россию [23]. Тем не менее, в реальной клинической практике вальпроаты продолжают назначаться пациентам с психическими расстройствами и неврологическими заболеваниями эмпирически, то есть без использования предиктивного (прореактивного) ФГТ. При этом предпочтение отдается реактивному ФГТ, которое назначается только в случае развития серьезных ВК-индуцированных НР. Использование терапевтического лекарственного мониторинга (ТЛМ) уровня ВК в плазме крови пока более популярно в реальной клинической практике [24], но на результаты этого диагностического метода влияют факторы межиндивидуальной (в том числе генетически детерминированной) вариабельности метаболизма ВК, а также других психотропных ЛС (межлекарственное взаимодействие) при политерапии. Кроме того, ФГТ можно проводить до назначения ВК, тогда как ТЛМ — только после того, как уровень ВК и ее реактивных метаболитов достигнет стабильного уровня в крови, и у пациента уже могут возникнуть ВК-индуцированные НР [25]. После того как уровень ВК достигнет стабильных показателей в крови, могут быть применены ТЛМ [26] и исследование активных метаболитов ВК [3] для персонализированной оценки безопасности и риска терапии вальпроатами, профилактики и коррекции ВК-индуцированных НР в каждом конкретном клиническом случае [27].
Разработчики панелей ФГТ и все больше исследователей поддерживают прогностическое (упреждающее) или прореактивное ФГТ, то есть перед назначением вальпроатов или на старте терапии (на стадии титрации дозы) [20][27], то есть до развития НР. Однако следует признать, что доказательная база как прореактивного, так и реактивного ФГТ для прогнозирования и диагностики ВК-индуцированных НР пока остается ограниченной [20][22].
Таким образом, с позиции персонализированной медицины5 неврологу или психиатру важно учитывать все имеющиеся генетические, эпигенетические, экологические и этнические предикторы для оптимального выбора дозы в начале терапии ВК у каждого конкретного пациента.
Цель работы — выявить направления для реализации персонализированного подхода к разработке панелей ФГТ для оценки безопасности и риска фармакотерапии вальпроатами в различных этнических и расовых группах популяции Российской Федерации.
Проведен анализ результатов популяционных исследований частот нефункциональных и низкофункциональных аллелей (известных как аллели риска) генов, кодирующих ключевые изоферменты Р-окисления ВК в печени, поступивших в базы данных eLIBRARY.RU, PubMed, Scopus, Google Scholar в период 2012–2022 гг. Критерии включения статей в исследование: наличие полнотекстовой версии на русском или английском языке, тип публикации — оригинальная статья, систематический обзор, метаанализ, Кокрейновский обзор, клинический случай.
Из анализа были исключены дублирующие публикации, постеры, материалы конференций (тезисы), статьи, в которых: данные были статистически незначимыми; ОНВ не соответствовали международным номенклатурам баз данных; не указаны ассоциации с конкретными аллелями/генами; выборки составляли менее 100 человек; изучены нечеловеческие генетические биомаркеры (например, микробиомные ОНВ); изучены генетические биомаркеры, которые использовались для диагностики моногенных заболеваний (например, мутации и генетические варианты гена POLG [27][28]), но могли влиять на метаболизм ВК в печени.
ОСНОВНАЯ ЧАСТЬ
Р-окисление вальпроевой кислоты в печени
Генетические и негенетические факторы риска (рис. 1) могут оказывать влияние на фармакокинетику ВК, развитие и тяжесть ВК-индуцированных НР [29]. При этом все больший интерес исследователей и клиницистов уделяется роли Р-окисления как важному этапу I фазы метаболизма ВК в гепатоцитах [17], которое осуществляется с участием изоферментов цитохрома Р450 (CYPs). Известно, что CYPs представлены суперсемейством гемопротеинов, выполняющих важнейшие функции в метаболизме как эндогенных, так и ксенобиотических соединений [16]. Для ключевых изоферментов цитохрома Р450, участвующих в Р-окислении ВК (в частности, CYP2A6, CYP2C9, CYP2B6, CYP3A4, CYP2D6), известны как частые, так и редкие аллельные варианты генов семейства CYPs, которые приводят к изменению экспрессии или функциональным изменениям этих изоферментов, вызывая снижение или потерю функции [3]. Носительство таких низкофункциональных и нефункциональных аллелей (аллелей риска) приводит к межиндивидуальным различиям в концентрациях ВК и ее активных метаболитов (терапевтических и токсических) в биологических жидкостях и тканях организма человека, существенно влияя на риск и безопасность фармакотерапии.
При Р-окислении ВК в гепатоцитах образуются ее активные метаболиты 4-гидрокси(OH)-ВК и 5-гидрокси(OH)-ВК, преимущественно с участием изоферментов CYP2C9, CYP2B6 и CYP2A6, хотя в Р-окислении ВК принимают участие и другие CYPs (CYP2C19, CYP2D6). Изоферменты CYP2A6 и CYP2B6 вместе обеспечивают образование около 20–25% активных метаболитов ВК (4-ене-ВК, 4-OH-ВК и 5-OH-ВК). Изофермент CYP2A6 опосредует Р-окисление ВК до 3-OH-ВК, но при политерапии (например, при совместном назначении ВК с мощными ингибиторами CYP2A6) образование 3-OH-ВК в микросомах печени человека ингибируется [3]. Скорость Р-окисления ВК ассоциирована с экспрессией и функциональной активностью вышеуказанных CYPs, но межиндивидуальная вариабельность этих характеристик генетически детерминирована.
Аллельные варианты генов, кодирующих ключевые ферменты Р-окисления ВК
Аллельные варианты — это различные нуклеотиды в пределах одного и того же гена, расположенные в одинаковых участках (локусах) гомологичных хромосом. Замена одного варианта гена может влиять на транскрипцию и трансляцию генов количественно или качественно, а также на структуру и функцию кодируемых ими белков (ферментов). Различные аллельные варианты генов, кодирующих CYPs, могут существенно влиять на межиндивидуальную изменчивость скорости P-окисления ВК в печени и риск развития НР, что объясняет важность персонализированного подхода к выбору и дозированию вальпроатов [30]. В свою очередь, аллельная частота — это частота, которая является характеристикой встречаемости (накопления) конкретного аллельного варианта в популяции. На аллельную частоту влияет дрейф генов, приводящий к колебанию частот аллелей в конечных популяциях. Со временем генетический дрейф может привести к фиксации или потере отдельных аллельных вариантов генов семейства CYPs, тем самым систематически устраняя разнообразие из популяции. Эта тенденция уравновешена мутациями de novo, постоянно производящими новые аллельные варианты [31], которые со временем (в случае их фиксации и накопления) могут влиять на риск и безопасность соединений ВК.
В разных странах мира выявлены значимые различия популяционной частоты некоторых минорных («мутантных» или вариативных) низкофункциональных и нефункциональных аллелей, ассоциированных с замедлением Р-окисления ВК. Это обусловливает различия частоты встречаемости пациентов с неврологическими заболеваниями и психическими расстройствами, которые являются гомозиготами и гетерозиготами по аллелю (аллелям) риска гена (генов) семейства CYPs, ассоциированных с формированием метаболических фенотипов ПМ и ММ и с развитием НР [32–34].
Несмотря на то, что результаты некоторых исследований фармакогенетики ВК противоречивы, в последние годы отношение к применению ФГТ для оценки скорости ее Р-окисления в печени пересматривается как в России [13][20], так и за рубежом [35]. Это связано с тем, что использование результатов ТЛМ вальпроатов в качестве предиктора [25], то есть для прогнозирования ВК-индуцированных НР на старте терапии, может быть неинформативно [27]. Во-первых, ТЛМ используется не до, а во время приема вальпроатов и только по достижении их целевой или максимальной суточной доз. Во-вторых, референсный коридор для ВК достаточно широкий (50–100 мкг/мл), а результаты ТЛМ могут быть ложноотрицательными [36]. Это зависит как от времени забора образца крови для исследования (для оценки риска развития НР важна пиковая, а не остаточная плазменная концентрация ВК), так и от пробоподготовки и хранения образцов (необходимо проведение ТЛМ в течение ближайших 30–60 мин от забора крови или быстрое помещение образца в низкотемпературный холодильник), поскольку ВК как жирорастворимая кислота относится к нестойким ex vivo соединениям. В-третьих, известно, что развитие нейротоксических и метаболических НР в некоторых случаях не коррелирует с результатами ТЛМ, то есть носит так называемый «дозонезависимый характер» (например, ВК-индуцированные экстрапирамидные расстройства, ВК-индуцированная гипераммонемия и аггравация эпилептических приступов, ВК-индуцированный метаболический синдром, ВК-индуцированные остеопения и остеопороз) [37–41]. Этот феномен связан не с общей концентрацией ВК в плазме по данным ТЛМ, а с повышением уровней свободной ВК и реактивных токсических метаболитов ВК, на которые могут оказывать существенное влияние генетически детерминированные изменения метаболизма ВК, в частности индивидуальная скорость ее Р-окисления в печени с участием некоторых изоферментов цитохрома Р450. В клинической практике широкое распространение получил ТЛМ общей концентрации ВК, тогда как за фармакологические и токсические эффекты вальпроатов ответственна не общая, а свободная фракция ВК [42]. При этом общая и свободная концентрации ВК сильно отличаются из-за высокой степени связывания ВК с белками и способности к насыщению. Поэтому в последние годы рекомендуется ТЛМ свободной концентрации ВК, что пока не нашло широкого применения. Тем не менее корреляция между концентрацией свободной ВК и ассоциированными с ней НР пока остается недостаточно изученной [42]. Для исследования этих реактивных токсических метаболитов ВК применяются масс-спектрометрия и газожидкостная хроматография [3], что пока технически и экономически затруднено в большинстве медицинских учреждений. В связи с этим предложена стратегия фармакогенетическиинформированной фармакометаболомики для определения пациентов группы риска, которым показано фармакометаболическое исследование [3][10]. Наконец, результаты ТЛМ могут быть ложноположительными у пациентов с гипопротеинемией (например, уровень свободной фракции ВК в плазме может повышаться у вегетарианцев, у пациентов с нарушением питания или анорексией, а также у беременных женщин с гестозом первого триместра беременности). Это объясняется тем, что клиренс ВК низкий (6–20 мл/ч/кг) из-за ее высокого связывания с белками (87–95%) [43].
Применение ФГТ, в отличие от ТЛМ, проводится однократно в течение жизни и позволяет прогнозировать развитие ВК-индуцированных НР на старте терапии и во время длительного приема вальпроатов [1][4]. ФГТ также позволяет определить, уровень каких реактивных токсических метаболитов ВК может повышаться при приеме среднетерапевтических доз вальпроатов, и оценить необходимость проведения фармакометаболического исследования у конкретного пациента в зависимости от его метаболического фенотипа [4][10][18]. Таким образом, ФГТ наряду с ТЛМ является эффективным инструментом персонализации терапии вальпроатами.
Фармакокинетические и фармакогенетические исследования последних лет свидетельствуют о том, что безопасность терапии ВК может варьировать в различных этнических/расовых группах [44][45]. Например, метаанализ H. Fang и соавт. [46] продемонстрировал, что снижение дозы ВК должно быть рекомендовано детям, носителям нефункционального аллеля С (1075A>C) гена CYP2C9, особенно азиатам. Авторы отметили, что ассоциация гетерозиготного генотипа АС с высокими концентрациями ВК в плазме наблюдалась у азиатов (уровень значимости р<0,00001, показатель гетерогенности I2=0%), но не у европеоидов (р=0,34, I2=87%). Сопоставимые результаты были получены в этнически и расово гетерогенной популяции Российской Федерации в более раннем исследовании Д.В. Дмитренко и соавт. [47].
Изофермент CYP2A6 является членом 6 подсемейства A семейства 2 цитохрома P450. Он экспрессируется преимущественно в гепатоцитах и в специализированных типах внепеченочных клеток [16][48]. CYP2A6 относят к основным ферментам Р-окисления ВК [49], в частности он активно участвует в метаболизме ВК путем 3-гидроксилирования с образованием 3-гидрокси-ВК [3]. Ген, кодирующий изофермент CYP2A6, является высокополиморфным, на сегодняшний день охарактеризовано более 40 генетических вариантов, обобщенных Консорциумом фармакогенных вариаций (PharmVar)6. При этом различные этнические/расовые группы демонстрируют различные паттерны генетической изменчивости CYP2A6 [49]. Например, аллель CYP2A6*7 обнаружен преимущественно в азиатских популяциях [50], а аллели CYP2A6*17, *20, *23-25 и *28 идентифицированы у людей африканского происхождения [51]. Несмотря на расовые различия в аллельных частотах, влияние каждого аллеля на активность изофермента CYP2A6 одинаково в разных этнических/расовых популяциях. Например, аналогичное снижение активности фермента CYP2A6 на 33 и 39% соответственно наблюдается у белых и афроамериканцев с генотипом CYP2A6*1/*9 по сравнению с генотипом CYP2A6*1/*1 (генотип дикого типа) [49].
Частоты наиболее изученных аллелей риска, которые могут приводить к замедлению Р-окисления ВК, представлены на рисунке 2, выполненном с помощью находящегося в открытом доступе интернет-ресурса Geography of Genetic Variants7 [52]. Азиаты и африканцы (афроамериканцы), как правило, имеют более высокую частоту низкофункциональных и нефункциональных генетических вариантов со снижением или потерей функции изофермента CYP2A6 и, следовательно, демонстрируют меньшую активность CYP2A6 по сравнению с европеоидами [49]. В то же время обращает на себя внимание, что аллельная частота ОНВ rs1801272 гена CYP2A6 выше среди европейцев, проживающих в регионах Северной Америки и Западной Европы, а аллельная частота ОНВ rs4986891 выше среди африканцев, проживающих в Западной Африке и Северной Америке. Среди азиатов наибольшую аллельную частоту имеют ОНВ rs28399433 и rs1809810 [53][54].
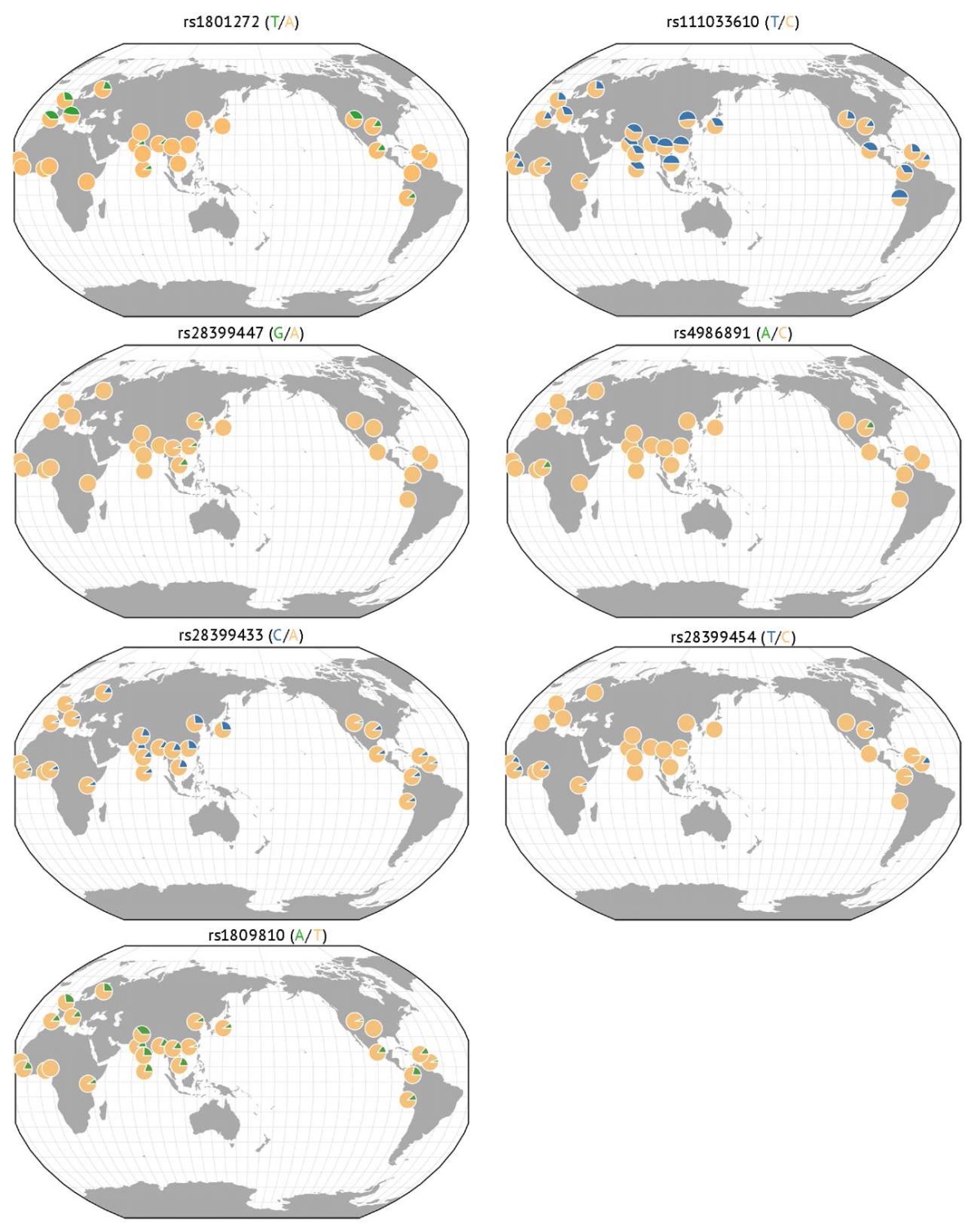
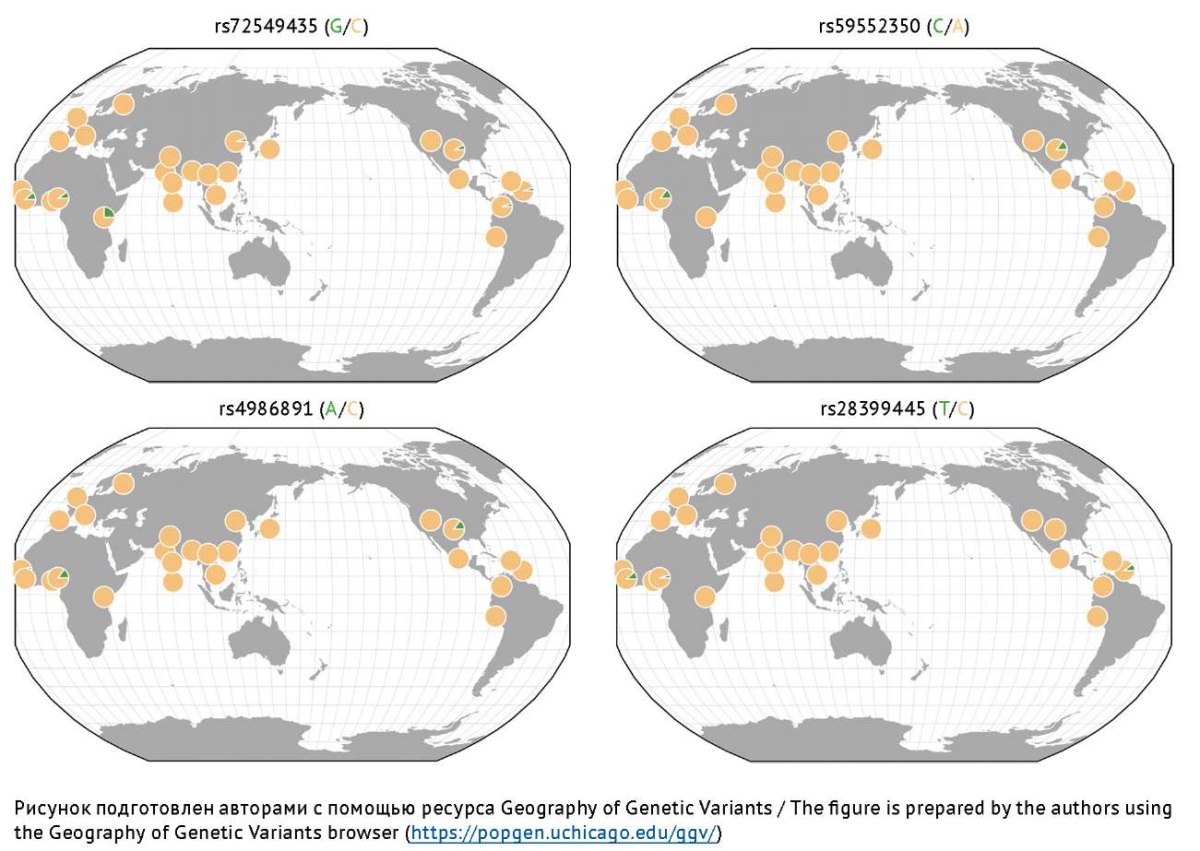
Рис. 2. Распределение частот наиболее изученных аллелей риска гена CYP2A6,
ассоциированных с замедлением Р-окисления вальпроевой кислоты в печени
Fig. 2. Frequency distribution of the most studied risk alleles of the CYP2A6 gene
associated with slowing down the P-oxidation of valproic acid in the liver
Изофермент CYP2C9 является членом 9 подсемейства C семейства 2 цитохрома P450. Это наиболее изученный изофермент подсемейства CYP2C человека. Он экспрессируется преимущественно в печени [16][55]. Участие изофермента CYP2C9 в метаболизме ВК приводит к образованию таких активных метаболитов ВК, как 2-ене-ВК, 4-ене-ВК, 4-гидрокси-ВК и 5-гидрокси-ВК [3]. ОНВ гена CYP2C9, кодирующего этот изофермент, активно изучаются в Российской Федерации [56–58], странах СНГ [59] и за рубежом [60][61] как генетические предикторы кумуляции ВК в крови и развития НР. Частоты наиболее изученных аллелей риска замедления Р-окисления ВК представлены на рисунке 3. Аллельная частота ОНВ rs1799853 гена CYP2C9 выше среди европейцев, проживающих в регионах Северной Америки и Западной Европы, а аллельная частота ОНВ rs7900194, rs28371685 и rs28371686 выше среди африканцев, проживающих в Западной Африке и Северной Америке. В популяции стран Азии (азиаты) наибольшую аллельную частоту имеет ОНВ rs72558187 и rs1057910 [62]. Анализ работ российских авторов показал, что частота ОНВ rs1799853 оказалась ниже в популяции русских и составила 6,7%, в то время как среди таких народностей Кавказа, как черкесы, лакцы, аварцы и даргинцы, данный ОНВ оказался широко распространен. Среди аварцев, даргинцев и лакцев распространенность составила 19,57, 17,00 и 15,50% соответственно [63][64]. Аллельная частота rs1799853 гена CYP2C9 выше у русских и армян как представителей европеоидной расы и редко встречается у представителей монголоидной расы, а именно у якутов, бурятов, тувинцев [63].
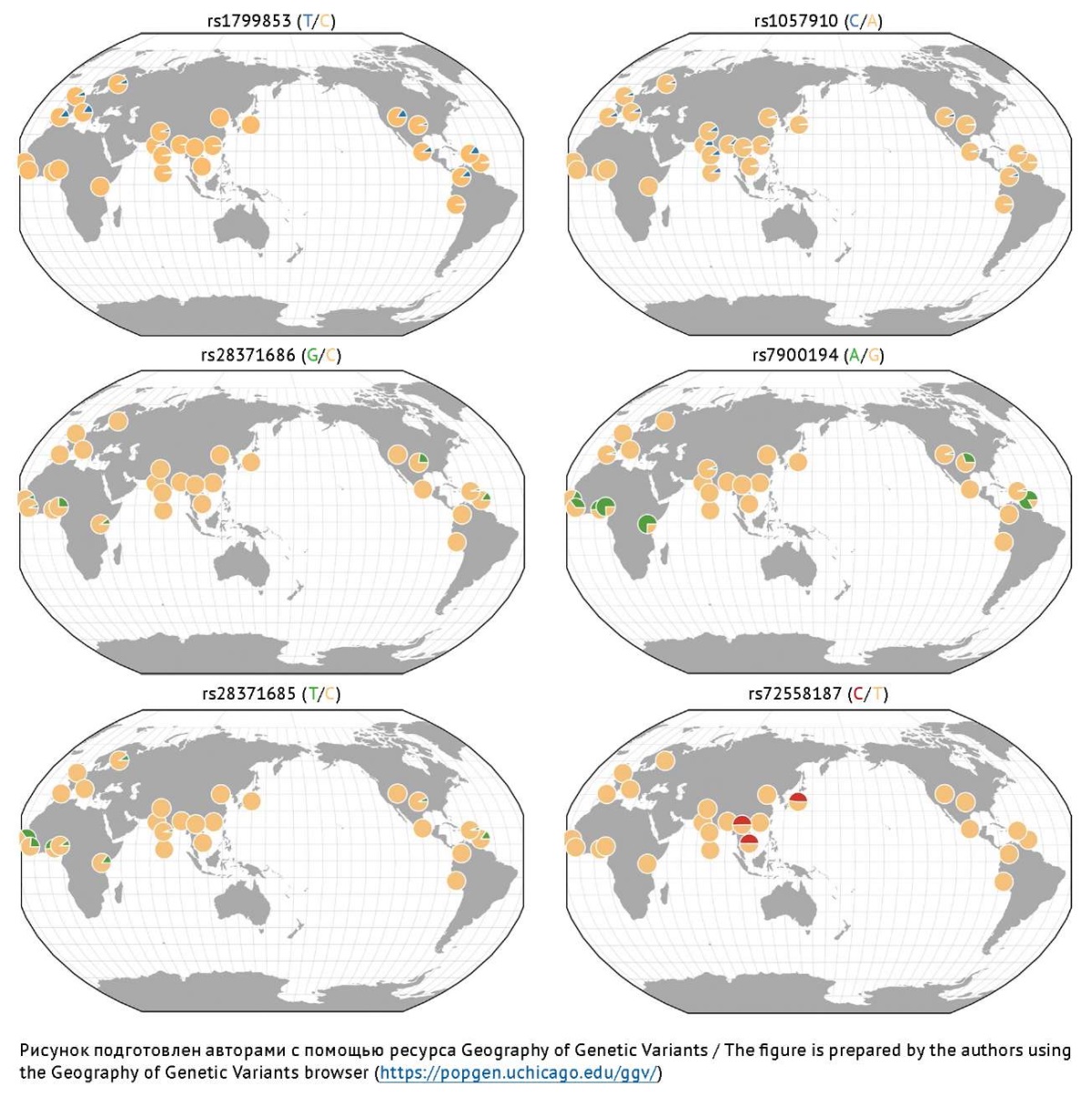
Рис. 3. Распределение частот наиболее изученных аллелей риска гена CYP2C9,
ассоциированных с замедлением Р-окисления вальпроевой кислоты в печени
Fig. 3. Frequency distribution of the most studied risk alleles of the CYP2C9 gene
associated with slowing down the P-oxidation of valproic acid in the liver
Изофермент CYP2B6 является членом 6 подсемейства B семейства 2 цитохрома P450 [16]. Этот изофермент имеет высокий уровень экспрессии в печени и в меньшей степени — во внепеченочных тканях, включая головной мозг, почки, пищеварительный тракт и легкие [65][66]. CYP2B6 является активным катализатором образования 4-ене-ВК, 4-гидрокси-ВК и 5-гидрокси-ВК, которые обладают как терапевтическими, так и (преимущественно) токсическими эффектами [3], поэтому фармакогенетические исследования роли ОНВ гена CYP2B6, кодирующего этот изофермент, активно проводятся за рубежом [67–71]. При этом все больший интерес исследователей вызывает межэтническая вариативность частот низкофункциональных/нефункциональных аллелей [70], что может дать ключ к разработке новых направлений персонализированной медицины при выборе и дозировании препаратов ВК. Например, аллельная частота нефункционального ОНВ rs12721655 гена CYP2B6 выше среди европейцев, проживающих в регионах Северной Америки и Западной Европы, а аллельная частота ОНВ rs28399499 выше среди африканцев, проживающих в Западной Африке, и среди азиатов. Нефункциональный ОНВ rs36079186 преимущественно распространен среди жителей Восточной Африки и жителей Азии [69], но очень редок в других популяциях (рис. 4).
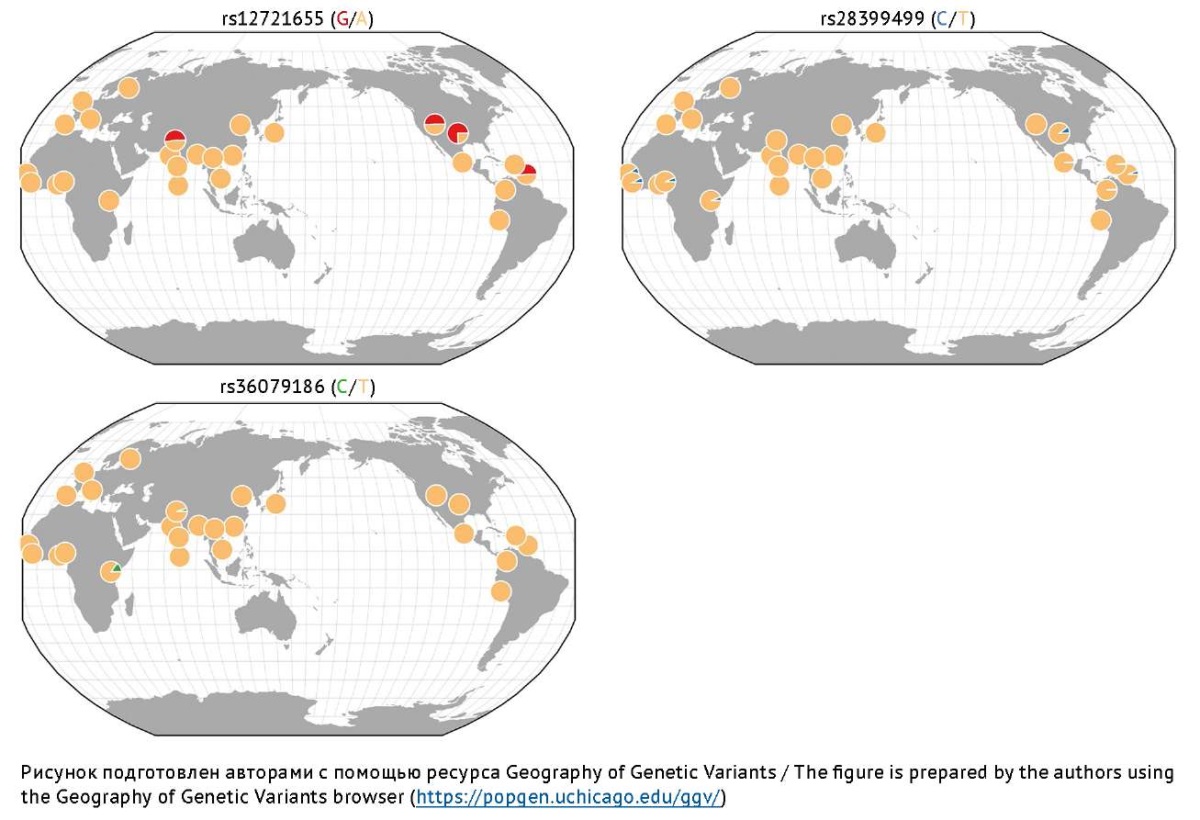
Рис. 4. Распределение частот наиболее изученных аллелей риска гена CYP2B6,
ассоциированных с замедлением Р-окисления вальпроевой кислоты в печени
Fig. 4. Frequency distribution of the most studied risk alleles of the CYP2B6 gene
associated with slowing down the P-oxidation of valproic acid in the liver
Изофермент CYP3A4 является членом 4 подсемейства A семейства 3 цитохрома P450. Он экспрессируется преимущественно в гепатоцитах и в специализированных типах клеток кишечника [16]. Фармакогенетические исследования последних лет демонстрируют ассоциацию полиморфных вариантов гена, кодирующего этот изофермент, с изменением скорости метаболизма ВК [72]. Аллельная частота нефункционального ОНВ rs4986910 гена CYP3A4 выше среди европейцев, проживающих в регионах Северной и Центральной Америки, а также Западной Европы. Нефункциональный ОНВ rs28371759 встречается преимущественно среди жителей Азии [73]. Эти аллели риска не описаны у африканцев (рис. 5). В Российской Федерации частота встречаемости аллельного варианта rs2740574 гена CYP3A4 составила 4,0% среди русских, 0,5% среди татарского населения и 0,9% среди башкирского населения [74].
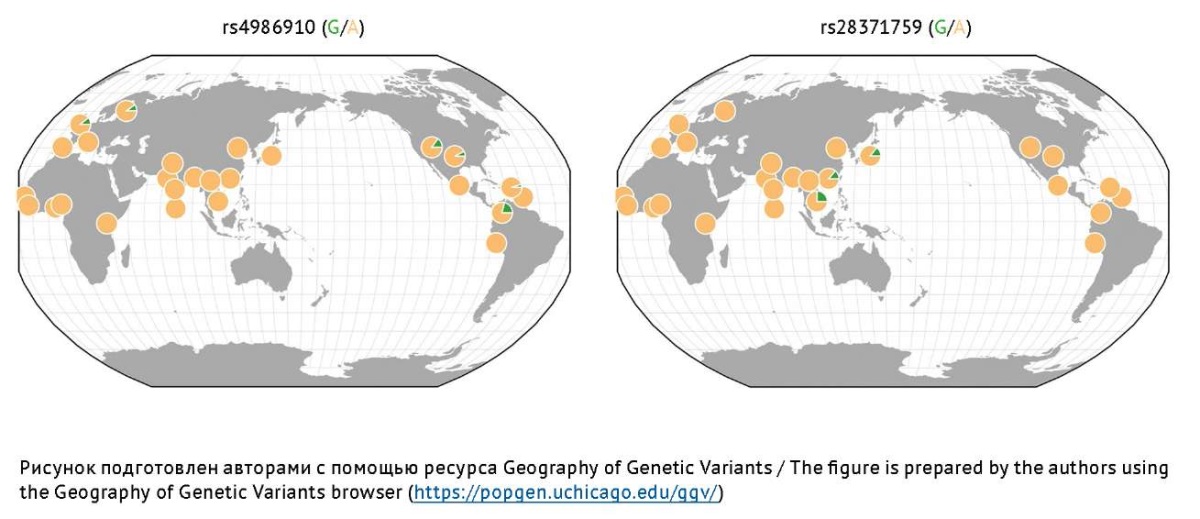
Рис. 5. Распределение частот наиболее изученных аллелей риска гена CYP3A4,
ассоциированных с замедлением Р-окисления вальпроевой кислоты в печени
Fig. 5. Frequency distribution of the most studied risk alleles of the CYP3A4 gene
associated with slowing down the P-oxidation of valproic acid in the liver
Изофермент CYP2C19 — член 19 подсемейства C семейства 2 цитохрома P450. Он является клинически значимым изоферментом семейства CYP и составляет около 16% от общего содержания изоферментов CYP в печени [16]. Прогностическая роль ОНВ гена CYP2C19, кодирующего этот изофермент, продемонстрирована российскими [58][75] и зарубежными [35][76][77] исследователями. Показано, что аллельная частота ОНВ rs4244285 гена CYP2C19 выше среди европейцев, проживающих в регионах Северной и Южной Америки, Западной Европы, а также превалирует среди азиатов. В то же время аллельная частота ОНВ rs41291556 выше среди жителей Азии и Северной Америки (США), а rs28399504 — среди жителей Западной Европы, Центральной Америки и Юго-Восточной Азии [78][79] (рис. 6). Анализ работ российских исследователей выявил широкую распространенность в популяции аллельных вариантов rs4244285 и rs12248560, в то время как rs4986893 встречается реже и преимущественно у представителей монголоидной расы [63]. Распространенность аллеля А полиморфного локуса 681G/A гена CYP2C19 в популяции Забайкальского края составила 14,2% и оказалась сопоставимой с европеоидами, но встречалась реже, чем у китайцев и японцев. Распространенность гомозиготного генотипа 681A/A гена CYP2C19 составила 1,5%, что соответствовало мировым данным среди европеоидных популяций и встречалась реже, чем у азиатов [80]. При сравнении частот аллелей среди популяции русских и этнической группы Республики Дагестан было выявлено, что частота носительства rs12248560 в русской популяции составила 27,3%, а в популяции аварцев — 20% [64].
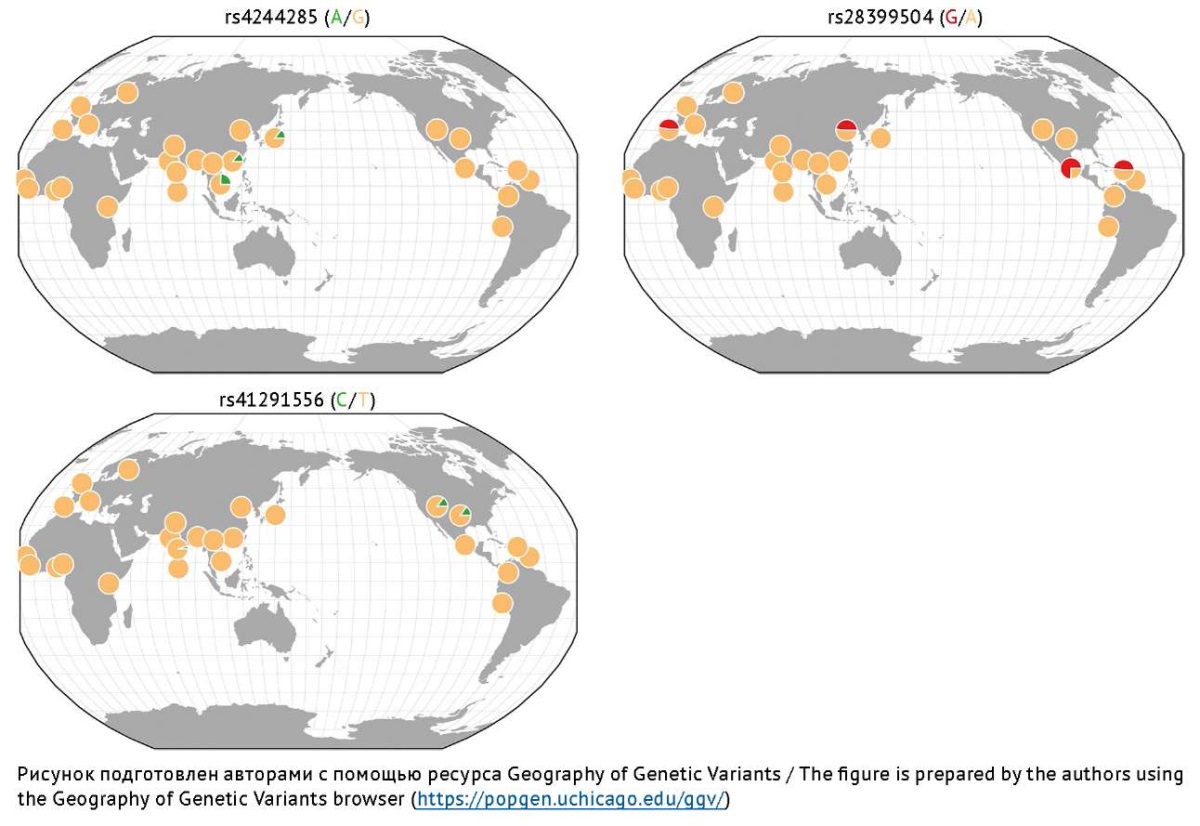
Рис. 6. Распределение частот наиболее изученных аллелей риска гена CYP2C19,
ассоциированных с замедлением Р-окисления вальпроевой кислоты в печени
Fig. 6. Frequency distribution of the most studied risk alleles of the CYP2C19 gene
associated with slowing down the P-oxidation of valproic acid in the liver
Изофермент CYP2D6 — член 6 подсемейства D семейства 2 цитохрома P450 экспрессируется в печени и желудочно-кишечном тракте человека [16]. Участие изофермента CYP2D6 в метаболизме ВК показано у 1–8% пациентов [3][13][17][48][81]. Аллельная частота нефункциональных ОНВ rs3892097 и rs1065852 гена CYP2D6 выше среди европейцев, проживающих в регионах Северной и Южной Америки, Западной Европы, а частота аллеля риска rs1065852 наиболее высока среди азиатов, особенно в Центральной и Юго-Восточной Азии. Аллельная частота нефункционального ОНВ rs5030865 высока среди жителей Центральной Азии, а частота аллеля риска rs28371706 наиболее высока в популяциях стран Африки и Центральной Америки [82][83] (рис. 7). Российскими исследователями показано, что носительство ОНВ rs3892097 широко распространено в общей популяции. В то же время частота встречаемости дикого гомозиготного генотипа ОНВ rs1065852, который ассоциирован с метаболическим фенотипом БМ, была самой высокой в Сибирском федеральном округе, в то время как в Северо-Западном федеральном округе она была ниже (82,6 и 64,2% соответственно). Частота гетерозиготного генотипа rs1065852 (метаболический фенотип ПМ) в Северо-Западном регионе была значительно выше и составила 35,8%, в то время как у пациентов из Сибирского федерального округа выявлена самая низкая его встречаемость — 17,4% [81]. Частота носительства минорного аллеля rs3892097 сопоставима с таковой в европейской популяции и составляет около 30% [84], при этом она в 3,6 раза выше у представителей русской этнической группы по сравнению с этническими казахами [85].
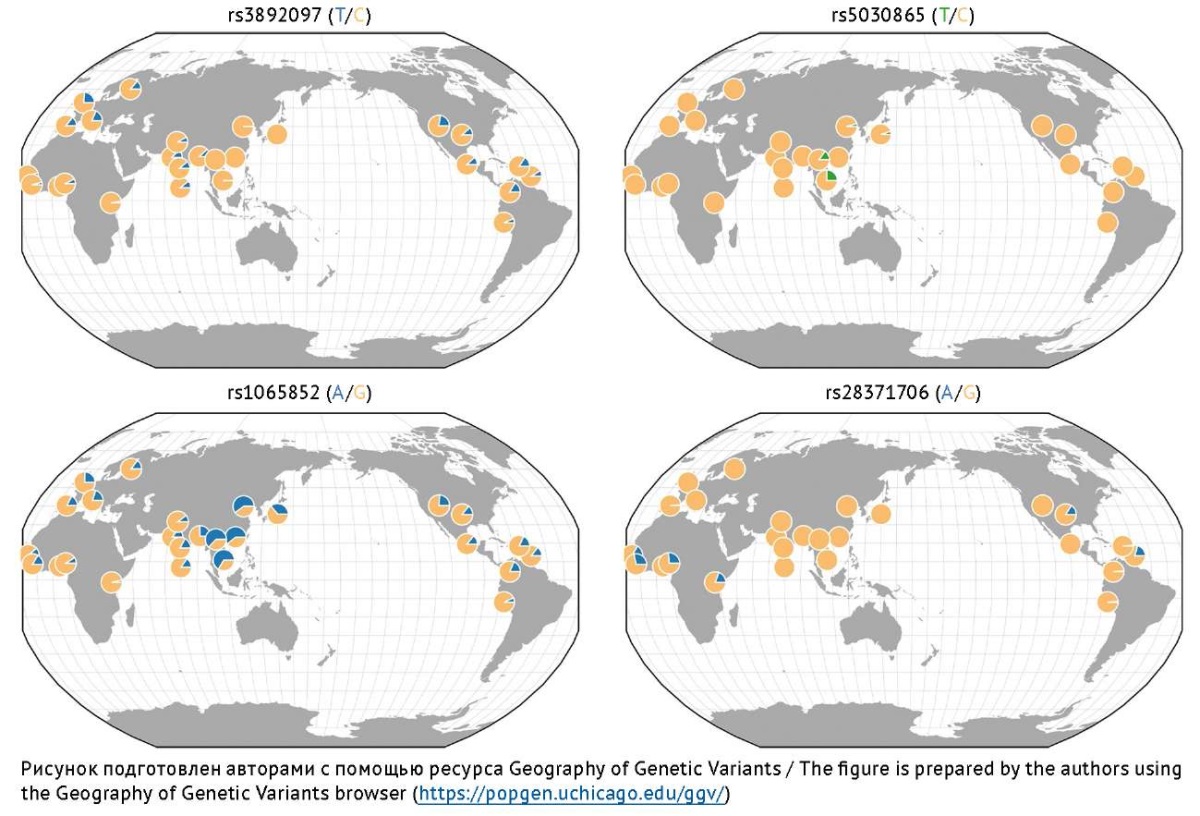
Рис. 7. Распределение частот наиболее изученных аллелей риска гена CYP2D6,
ассоциированных с замедлением Р-окисления вальпроевой кислоты в печени
Fig. 7. Frequency distribution of the most studied risk alleles of the CYP2D6 gene
associated with slowing down the P-oxidation of valproic acid in the liver
Персонализированный подход к разработке панелей ФГТ для оценки безопасности и риска фармакотерапии вальпроатами
Несмотря на то, что безопасность применения вальпроатов, ассоциированная с индивидуальной скоростью их метаболизма в печени (в частности, Р-окисления) у конкретного пациента, является результатом слаженной работы нескольких изоферментов цитохрома Р450, а значит, и нормальным функционированием нескольких генов, носительство нефункциональных аллельных вариантов (также известных как аллели риска) может быть связано с развитием серьезных ВК-индуцированных НР. Наличие этих аллелей часто приводит к серьезным ошибкам метаболизма ЛС и отбраковывается в процессе эволюции — пациенты с такими аллелями риска не выживают и/или имеют нарушения фертильности [1]. Однако некоторые клинически значимые нефункциональные аллельные варианты генов суперсемейства CYP сохраняются в популяции различных регионов (стран) мира и накапливаются в геноме в виде гетерозигот. При этом некоторые нефункциональные/низкофункциональные аллельные варианты CYPs могут проявляться клинически далеко не сразу после старта назначения препаратов ВК. Например, генетическая предрасположенность к нарушению Р-окисления вальпроатов в печени и развитию ВК-индуцированных НР выявляется чаще всего при применении этого ЛС длительно (3 и более месяцев) и/или в высоких дозах [27][81]. Это объясняет, почему такие аллельные варианты генов семейства CYP могут никак не отбраковываться в естественных условиях, и поэтому их аллельная частота может быть высокой в некоторых популяциях. Естественным образом гомозиготные носители минорных (редких или, по новой номенклатуре, вариативных) нефункциональных аллелей (аллелей риска) генов CYPs встречаются в популяции достаточно редко, а гетерозиготное носительство некоторых клинически значимых аллелей риска может долго оставаться не диагностированным.8
Практикующие неврологи и психиатры, эмпирически назначающие вальпроаты без использования ФГТ, на старте терапии могут не подозревать о существующих у пациента проблемах с Р-окислением ВК в печени, пока не возникнет необходимость повышения дозы ВК или назначения длительной терапии вальпроатами в случае хронических неврологических заболеваний и психических расстройств, а также в случаях, требующих назначения нескольких психотропных ЛС и/или ЛС других фармакологических групп, но со схожим путем метаболизма, или ЛС — ингибиторов ключевых изоферментов Р-окисления ВК. Отказ от использования предиктивного ФГТ не позволяет прогнозировать межиндивидуальную вариабельность безопасности вальпроатов и снизить риск развития ВК-индуцированных НР.
Таким образом, для реализации персонализированного подхода к оценке безопасности и риска фармакотерапии вальпроатами (как в монотерапии, так и в политерапии) клинически и экономически обоснованным является прореактивное (предиктивное или прогностическое) ФГТ с детекцией валидных (индивидуальных и специальных) для конкретной популяции аллелей риска. Скрининговые панели ФГТ, позволяющие оценить генетические детерминанты замедления Р-окисления ВК, имеют определенную ценность в связи с относительно небольшой ценой и достаточной чувствительностью. Однако клинический и экономический эффекты [86] можно повысить за счет включения в эти скрининговые панели ФГТ для оценки риска и безопасности ВК только тех аллельных вариантов генов CYPs, для которых подтверждена клиническая значимость именно в рамках этнической и расовой неоднородности популяции Российской Федерации [47][81][87]. Такой персонализированный подход с включением в панель ФГТ этнически-ориентированных клинически значимых аллелей риска генов CYPs позволит неврологу/психиатру или клиническому фармакологу уже на стартовом этапе терапии объяснить пациенту наличие рисков применения ВК, связанных с его индивидуальными генетическими особенностями, и необходимость их своевременной идентификации с помощью расширенной панели ФГТ [26][27][34][47][56][58][75].
Однако важно помнить о том, что проблема риска и безопасности применения вальпроатов может быть ассоциирована также с вариативными аллелями риска генов, кодирующих ферменты глюкуронидации и ацетилирования ВК [3][40], а также быть следствием коморбидных заболеваний печени и нездорового образа жизни (злоупотребление алкоголем, курение, употребление психоактивных веществ, несбалансированное питание и др.) (рис. 8).

Рис. 8. Основные факторы риска нарушения Р-окисления вальпроевой кислоты (ВК)
в гепатоцитах человека
Fig. 8. Key risk factors for impaired P-oxidation of valproic acid (VPA)
in human hepatocytes
Этнически ориентированная фармакогенетическиинформированная фармакометаболомика [10] может позволить улучшить прогнозирование риска и безопасности ВК до начала приема вальпроатов или в течение первых недель от старта терапии у представителей конкретной популяции. Так, риск развития НР при назначении ВК может быть более высоким у представителей азиатских этнических групп, проживающих на территории Российской Федерации [47][81].
Перспективным направлением для реализации персонализированного подхода к оценке безопасности и риска фармакотерапии вальпроатами также является разработка системы поддержки принятия решений для врачей при назначении препаратов ВК, основанной на оценке аддитивного эффекта метаболического фенотипа пациента по результатам ФГТ [88][89] и других основных факторов риска нарушения Р-окисления ВК в печени. Это актуальная междисциплинарная проблема, поскольку многие из наиболее значимых факторов риска развития ВК-индуцированных НР могут иметь не только клинический, но и психосоциальный характер.
Рекомендации по дозированию ВК
С учетом результатов ФГТ, полученных ранее [26][27][34][47][56][58][75][89], не рекомендуется назначение ВК пациентам с метаболическим фенотипом ММ, хотя возможно назначение вальпроатов коротким курсом в дозе на 50% ниже средней терапевтической. Назначение ВК возможно пациентам с фенотипом ПМ, но дозировка вальпроатов должна быть снижена в среднем на 25% от средней терапевтической. При этом не рекомендуется дополнительное назначение других ЛС со схожим путем Р-окисления в печени и/или препаратов — ингибиторов низкофункциональных CYPs у конкретного пациента.
Пациентам с фенотипом ЭМ возможно назначать ВК в средней терапевтической дозировке, в том числе длительно. Наконец, пациентам с фенотипами БМ и УБМ рекомендуется повышение дозы на 25–50% от средней терапевтической в зависимости от гетерозиготного или гомозиготного носительства высокофункциональных аллельных вариантов гена (генов), кодирующих CYPs, ассоциированных с ускорением метаболизма этого ЛС и низкой концентрации ВК в крови.
Пациентам с фенотипом ММ и ПМ, а также пациентам с профилем ЭМ (в случае длительного приема высоких доз ВК или одновременного длительного приема ингибиторов ключевых изоферментов Р-окисления ВК по поводу сопутствующих заболеваний) рекомендуется проведение ТЛМ [90] пиковой общей (при наличии технической возможности, свободной) концентрации ВК в крови или слюне в динамике не реже 1 раза в 3 месяца и исследование токсических метаболитов ВК в крови [91], моче и/ или других биологических жидкостях (ликвор, слюна, пот, выдыхаемый воздух) [3][40], если это технически доступно в медицинском учреждении или регионе проживания пациентов с генетически-детерминированными высоким риском развития ВК-индуцированных НР (рис. 2–7).
ЗАКЛЮЧЕНИЕ
Проведенный обзор литературы позволил выявить новые направления для реализации персонализированного подхода к разработке панелей ФГТ для оценки безопасности и риска фармакотерапии вальпроатами с учетом скорости Р-окисления ВК в печени у представителей различных этнических и расовых групп, что может представлять несомненную практическую значимость. Однако перспективы прямой трансляции результатов ранее проведенных исследований в реальную клиническую практику в Российской Федерации путем разработки панелей ФГТ пока недостаточно ясны ввиду этнической и расовой неоднородности популяции и большой территориальной протяженности нашей страны.
Для повышения чувствительности и специфичности разрабатываемых российских панелей ФГТ требуется проведение «мостовых» исследований, чтобы реплицировать полученные на других этнических группах ассоциации наиболее распространенных аллелей риска нарушения Р-окисления ВК для конкретной популяции регионов России. Частоты аллелей риска замедления I фазы метаболизма (Р-окисления) ВК в печени широко варьируют в расовых и этнических группах различных регионов мира, что может существенно влиять на чувствительность и специфичность панелей ФГТ. Таким образом, оценка риска и безопасности ВК и ее соединений с позиции персонализированной медицины должна проводиться с использованием этнически-ориентированного подхода. Это, в свою очередь, может способствовать повышению безопасности терапии психических расстройств и неврологических заболеваний с использованием препаратов ВК в режиме моно- и политерапии и снижению риска развития ВК-индуцированных НР в этнически/расово гетерогенной популяции Российской Федерации.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.А. Шнайдер — концепция и дизайн исследования, написание текста рукописи; В.В. Гречкина — сбор и анализ данных литературы; В.В. Архипов — анализ нормативных документов, доработка текста рукописи; Р.Ф. Насырова — общее руководство, редактирование текста рукописи, утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Natalia A. Shnayder conceptualised and designed the study, and drafted the manuscript. Violetta V. Grechkina collected and analysed literature data. Vladimir V. Arkhipov analysed regulatory documents and finalised the manuscript. Regina F. Nasyrova administered the project, edited the manuscript, and approved the final version for publication.
1. https://cpicpgx.org
2. https://www.pharmgkb.org
3. http://www.pgrn.org
4. Письмо Министерства здравоохранения Российской Федерации от 19.05.2023 № 25-6/4732 «О рекомендации внесения изменений в инструкции по применению зарегистрированных в Российской Федерации лекарственных препаратов для медицинского применения, содержащих в качестве действующего вещества вальпроевую кислоту».
5. Приказ Министерства здравоохранения Российской Федерации от 24.04.2018 № 186 «Об утверждении Концепции предиктивной, превентивной и персонализированной медицины».
6. www.PharmVar.org
7. Geography of Genetic Variants Browser. https://popgen.uchicago.edu/ggv/
8. Яковлев В.В. Популяционная генетика человека. Томск; 2005.
Список литературы
1. Насырова РФ, Незнанов НГ, ред. Клиническая психофармакогенетика. СПб: ДЕАН; 2019. EDN: QCOSIL
2. Idda ML, Zoledziewska M, Urru SAM, McInnes G, Bilotta A, Nuvoli V, et al. Genetic variation among pharmacogenes in the Sardinian population. Int J Mol Sci. 2022;23(17):10058. https://doi.org/10.3390/ijms231710058
3. Shnayder NA, Grechkina VV, Khasanova AK, Bochanova EN, Dontceva EA, Petrova MM, et al. Therapeutic and toxic effects of valproic acid metabolites. Metabolites. 2023;13(1):134. https://doi.org/10.3390/metabo13010134
4. Сычев Д.А. Рекомендации по применению фармакогенетического тестирования в клинической практике. Качественная клиническая практика. 2011;(1):3–10. EDN: RWVOVT
5. Ricardo-Silgado ML, Singh S, Cifuentes L, Decker PA, Gonzalez-Izundegui D, Moyer AM, et al. Association between CYP metaboliser phenotypes and selective serotonin reuptake inhibitors induced weight gain: a retrospective cohort study. BMC Medicine. 2022;20(1):261. https://doi.org/10.1186/s12916-022-02433-x
6. Шнайдер НА, Хасанова АК, Насырова РФ. Первая фаза метаболизма антипсихотиков в печени: роль окисления. Фармакогенетика и фармакогеномика. 2022;(1):15-30. https://doi.org/10.37489/2588-0527-2022-1-15-30
7. Kane M. CYP2D6 overview: allele and phenotype frequencies. 2021 Oct 15. In: Pratt VM, Scott SA, Pirmohamed M, et al., eds. Medical Genetics Summaries [Internet]. Bethesda (MD): National Center for Biotechnology Information (US); 2012–2021.
8. Brouwer JMJL, Nijenhuis M, Soree B, Guchelaar HJ, Swen JJ, van Schaik RHN, et al. Dutch Pharmacogenetics Working Group (DPWG) guideline for the gene-drug interaction between CYP2C19 and CYP2D6 and SSRIs. EJHG. 2022;30(10):1114–20. https://doi.org/10.1038/s41431-021-01004-7
9. Caudle KE, Dunnenberger HM, Freimuth RR, Peterson JF, Burlison JD, Whirl-Carrillo M, et al. Standardizing terms for clinical pharmacogenetic test results: consensus terms from the Clinical Pharmacogenetics Implementation Consortium (CPIC). Genetics in Medicine: Official Journal of the American College of Medical Genetics. 2017;19(2):215–23. https://doi.org/10.1038/gim.2016.87
10. Шнайдер НА, Гречкина ВВ, Архипов ВВ, Насырова РФ. Фармакогенетически-информированная фармакометаболомика как инновационный подход к оценке безопасности и риска фармакотерапии препаратами вальпроевой кислоты. Безопасность и риск фармакотерапии. 2023;11(4):450–62. https://doi.org/10.30895/2312-7821-2023-386
11. Шнайдер НА, Хасанова АК, Насырова РФ. Первая фаза метаболизма антипсихотиков в печени: роль окисления. Фармакогенетика и фармакогеномика. 2022;(1):15–30. https://doi.org/10.37489/2588-0527-2022-1-15-30
12. Насырова РФ, Добродеева ВС, Скопин СД, Шнайдер НА, Незнанов НГ. Проблемы и перспективы внедрения фармакогенетического тестирования в реальной клинической практике в Российской Федерации. Вестник неврологии, психиатрии и нейрохирургии. 2020;(3):6–8. https://doi.org/10.33920/med-01-2003-01
13. Дроков АП, Липатова ЛВ, Шнайдер НА, Насырова РФ. Фармакогенетические маркеры метаболических нарушений при лечении вальпроевой кислотой. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(10–2):82–9. https://doi.org/10.17116/jnevro201811810282
14. Москалева ПВ, Шнайдер НА, Насырова РФ. Сроки проведения фармакогенетического тестирования: до или после развития нежелательных лекарственных реакций? Фармакогенетика и фармакогеномика. 2018;(2):56–7. https://doi.org/10.24411/2588-0527-2018-10030
15. Бочанова ЕН, Шнайдер НА, Зырянов СК, Дмитренко ДВ, Веселова ОФ, Курц ЕМ, Гордеева НВ. Оценка знаний врачей о системе фармаконадзора. Уральский медицинский журнал. 2016;4:142–4. EDN: WELQLP
16. Shnayder NA, Abdyrakhmanova AK, Nasyrova RF. Phase I of antipsychotics metabolism and its pharmacogenetic testing. Personalized Psychiatry and Neurology. 2022;2(1):4–21. https://doi.org/10.52667/2712-9179-2022-2-1-4-21
17. Насырова РФ, Сивакова НА, Липатова ЛВ, Иващенко ДВ, Сосина КА, Дроков АП, Шнайдер НА. Биологические маркеры эффективности и безопасности противоэпилептических препаратов: фармакогенетика и фармакокинетика. Сибирское медицинское обозрение. 2017;103(1):17–25. https://doi.org/10.20333/2500136-2017-1-17-25
18. Sychev DA. “Multiomic” studies as a promising clinical pharmacological tool for personalization of socially significant diseases pharmacotherapy in Russia. Personalized Psychiatry and Neurology. 2022;2(2):1–2. https://doi.org/10.52667/2712-9179-2022-2-2-1-2
19. Бочанова Е, Шнайдер Н, Дмитренко Д, Шаповалова Е, Веселова О, Шилкина О, Потупчик Т. Опыт регистрации нежелательных побочных реакций на противоэпилептические препараты в клинике Красноярского медицинского университета. Врач. 2016;(4):6–8. EDN: VVNJRN
20. Власов ПН, Орехова НВ, Антонюк МВ, Филатова НВ, Шнайдер НА, Дмитренко ДВ и др. Эффективность и безопасность препаратов вальпроевой кислоты с замедленным высвобождением активного вещества у взрослых в реальной клинической практике с позиции фармакокинетического и фармакогенетического подхода. Неврология, нейропсихиатрия, психосоматика. 2017;9(1S):11–20. https://doi.org/10.14412/2074-2711-2017-1S-11-20
21. Zhu MM, Li HL, Shi LH, Chen XP, Luo J, Zhang ZL. The pharmacogenomics of valproic acid. J Hum Genet. 2017;62(12):1009–14. https://doi.org/10.1038/jhg.2017.91
22. Iannaccone T, Sellitto C, Manzo V, Colucci F, Giudice V, Stefanelli B, et al. Pharmacogenetics of carbamazepine and valproate: focus on polymorphisms of drug metabolizing enzymes and transporters. Pharmaceuticals (Basel). 2021;14(3):204. https://doi.org/10.3390/ph14030204
23. Бочанова ЕН. Фармакогенетика противоэпилептических препаратов (обзор литературы). Качественная клиническая практика. 2017;(1):51–5. https://doi.org/10.24411/2588-0519-2017-00008
24. Абаимов ДА, Сариев АК, Носкова ТЮ, Шведков ВВ, Ширяева МВ, Стырова ЕЮ и др. Современные технологии в терапевтическом лекарственном мониторинге. Эпилепсия и пароксизмальные состояния. 2013;5(2):31–41.
25. Дмитренко Д, Шнайдер Н, Бочанова Е, Артюхов И, Зырянов С, Веселова О и др. Терапевтический лекарственный мониторинг в лечении эпилепсии. Врач. 2017;(1):81–3. EDN: XVSRQT
26. Шнайдер НА, Дмитренко ДВ, Говорина ЮБ, Муравьева АВ, Котловский ЮВ, Бочанова ЕН и др. Влияние полиморфизмов гена CYP2C9 на уровень вальпроевой кислоты в крови у женщин репродуктивного возраста с эпилепсией. Фармакогенетика и фармакогеномика. 2015;(2):24–8.
27. Бочанова ЕН, Шнайдер НА, Шилкина ОС, Дмитренко ДВ. Каскад нежелательных лекарственных реакций у девочки с юношеской миоклонической эпилепсией (клинический случай). Фармакогенетика и фармакогеномика. 2018;(1):21–4.
28. Шилкина ОС, Шнайдер НА, Артюхов ИП, Москалева ПВ, Панина ЮС. Проблемы дифференциальной диагностики миоклонус-эпилепсии, ассоциированной с мутацией гена POLG1, и юношеской миоклонической эпилепсии: клинический случай. Русский журнал детской неврологии. 2018;13(1):57–63. https://doi.org/10.17650/2073-8803-2018-13-1-57-63
29. Aka I, Bernal CJ, Carroll R, Maxwell-Horn A, Oshikoya KA, Van Driest SL. Clinical pharmacogenetics of cytochrome P450-associated drugs in children. J Pers Med. 2017;7(4):14. https://doi.org/10.3390/jpm7040014
30. Шнайдер НА, Дмитренко ДВ. Хроническая интоксикация вальпроевой кислотой в эпилептологии: диагностика и лечение. Неврология, нейропсихиатрия, психосоматика. 2016;8(2):94–9. https://doi.org/10.14412/2074-2711-2016-2-94-99
31. Messer PW. Neutral models of genetic drift and mutation. In: Kliman RM, ed. Encyclopedia of Evolutionary Biology. Academic Press. 2016;119–23. https://doi.org/10.1016/B978-0-12-800049-6.00031-7
32. Zhou HH, Liu ZQ. Ethnic differences in drug metabolism. Clin Chem Lab Med. 2000;38(9):899–03. https://doi.org/10.1515/CCLM.2000.131
33. Monti B, Polazzi E, Contestabile A. Biochemical, molecular and epigenetic mechanisms of valproic acid neuroprotection. Curr Mol Pharmacol. 2009;2(1):95–109. https://doi.org/10.2174/1874467210902010095
34. Бочанова ЕН, Гусев СД, Дмитренко ДВ, Шнайдер НА, Насырова РФ. Алгоритм персонализированного назначения препаратов вальпроевой кислоты для лечения эпилепсии. Доктор.Ру. 2019;161(6):6–11. https://doi.org/10.31550/1727-2378-2019-161-6-6-11
35. Wang S, Li J, Song M, Yan P, Ju X, Liu J, Wang C, Shi J. Effect of CYP2C19 polymorphisms on serum valproic level acid in Chinese Han patients with schizophrenia. Scientific Reports. 2021;11(1):23150. https://doi.org/10.1038/s41598-021-02628-x
36. Patsalos PN, Spencer EP, Berry DJ. Therapeutic drug monitoring of antiepileptic drugs in epilepsy. Therapeutic Drug Monitoring. 2018;40(5):526–48. https://doi.org/10.1097/FTD.0000000000000546
37. Muralidharan A, Rahman J, Banerjee D, Hakim Mohammed AR, Malik BH. Parkinsonism: a rare adverse effect of valproic acid. Cureus. 2020;12(6):e8782. https://doi.org/10.7759/cureus.8782
38. Sekiguchi K, Mashiko T, Koide R, Kawai K, Fujimoto S, Tanaka R. A case of long-term exposure to valproic acid mimicking tremor-dominant Parkinson’s disease. Tremor Other Hyperkinet Mov (NY). 2023;13:17. https://doi.org/10.5334/tohm.755
39. Vázquez M, Fagiolino P, Maldonado C, Olmos I, Ibarra M, Alvariza S, Guevara N, Magallanes L, Olano I. Hyperammonemia associated with valproic acid concentrations. Biomed Res Int. 2014;2014:217269. https://doi.org/10.1155/2014/217269
40. Shnayder NA, Grechkina VV, Trefilova VV, Efremov IS, Dontceva EA, Narodova EA, et al. Valproate-induced metabolic syndrome. Biomedicines. 2023;(11):1499. https://doi.org/110.3390/biomedicines11051499
41. Донцева ЕА, Пилипенко ПИ, Шнайдер НА, Петрова ММ, Насырова РФ. Частота встречаемости антиконвульсант-индуцированного дефицита витамина D. Эпилепсия и пароксизмальные состояния. 2022;14(3):304–15. https://doi.org/10.17749/2077-8333/epi.par.con.2022.117
42. Tseng YJ, Huang SY, Kuo CH, Wang CY, Wang KC, Wu CC. Safety range of free valproic acid serum concentration in adult patients. PLoS One. 2020;15(9):e0238201. https://doi.org/10.1371/journal.pone.0238201
43. Safdar A, Ismail F. A comprehensive review on pharmacological applications and drug-induced toxicity of valproic acid. Saudi Pharm J. 2023;31(2):265–78. https://doi.org/10.1016/j.jsps.2022.12.001
44. Sun Y, Yu J, Yuan Q, Wu X, Wu X, Hu J. Early post-traumatic seizures are associated with valproic acid plasma concentrations and UGT1A6/CYP2C9 genetic polymorphisms in patients with severe traumatic brain injury. Scandinavian Journal of Trauma, Resuscitation and Emergency Medicine. 2017;25(1):85. https://doi.org/10.1186/s13049-017-0382-0
45. Usman M, Shaukat QU, Khokhar MI, Bilal R, Khan RR, Saeed HA, Ali M, Khan HM. Comparative pharmaco-kinetics of valproic acid among Pakistani and South Korean patients: a population pharmacokinetic study. PLoS One. 2022;17(8):e0272622. https://doi.org/10.1371/journal.pone.0272622
46. Fang H, Wang X, Hou K, Zhang Y, Shao S, Zhang G, Feng Y, Huang L. The association of adjusted plasma valproic acid concentration with CYP2C9 gene polymorphism in patients with epilepsy: a systematic review and meta-analysis. Annals of Translational Medicine. 2021;9(10):846. https://doi.org/10.21037/atm-21-1459
47. Дмитренко ДВ, Шнайдер НА, Говорина ЮБ, Николаева ТЯ, Попова ТЕ, Шаравии Л.К. и др. Этнические аспекты носительства полиморфизмов гена CYP2C9 у детей и подростков с эпилепсией в Восточной и Северо-Восточной Сибири. Современные проблемы науки и образования. 2015;(6):84. EDN: VJPQSZ
48. Alsanosi SMM, Skiffington C, Padmanabhan S. Chapter 17 — Pharmacokinetic pharmacogenomics. In: Handbook of Pharmacogenomics and Stratified Medicine. Academic Press; 2014. P. 341–64. https://doi.org/10.1016/B978-0-12-386882-4.00017-7
49. Tanner JA, Tyndale RF. Variation in CYP2A6 activity and personalized medicine. J Pers Med. 2017;7(4):18. https://doi.org/10.3390/jpm7040018
50. Mwenifumbo JC, Myers MG, Wall TL, Lin SK, Sellers EM, Tyndale RF. Ethnic variation in CYP2A6*7, CYP2A6*8 and CYP2A6*10 as assessed with a novel haplotyping method. Pharmacogenet. Genom. 2005;15:189–192. https: //doi.org/10.1097/01213011-200503000-00008
51. Ho MK, Mwenifumbo JC, Al Koudsi N, Okuyemi KS, Ahluwalia JS, Benowitz NL, Tyndale RF. Association of nicotine metabolite ratio and CYP2A6 genotype with smoking cessation treatment in African-American light smokers. Clin. Pharmacol. Ther. 2009;85:635–43. https://doi.org/10.1038/clpt.2009.19
52. Marcus JH, Novembre J. Visualizing the geography of genetic variants. Bioinformatics. 2017;3(4):594–95. https://doi.org/10.1093/bioinformatics/btw643
53. Francis LYW. Chapter 1 — Principles of pharmacogenomics: pharmacokinetic, pharmacodynamic, and clinical implications. In: Pharmacogenomics. Academic Press. 2019;1–53. https://doi.org/10.1016/B978-0-12-812626-4.00001-2
54. Пономаренко ТМ, Сычёв ДА, Чикало АО, Бердникова НГ, Кукес ВГ. Система цитохрома Р450 в лёгких: роль в патогенезе заболеваний и фармакокинетике лекарственных средств. Фармакокинетика и Фармакодинамика. 2012;(1):25–8.
55. Sangkuhl K, Claudio-Campos K, Cavallari LH, Agundez JAG, Whirl-Carrillo M, Duconge J, et al. Pharm-Var GeneFocus: CYP2C9. Clin Pharmacol Ther. 2021;110(3):662–76. https://doi.org/10.1002/cpt.2333
56. Шнайдер НА, Пилюгина МС, Дмитренко ДВ. Стратификация больных эпилепсией по группам риска развития нежелательных лекарственных явлений на фоне приема препаратов вальпроевой кислоты. Заместитель главного врача. 2011;(7):50–63. EDN: QBJXBJ
57. Сокова ЕА, Архипов ВВ, Чилова РА, Демидова ОА, Проклова ГФ, Пикуза ТВ. Эффективность и безопасность противоэпилептических лекарственных средств у беременных: фармакогенетические аспекты. Ведомости Научного центра экспертизы средств медицинского применения. 2018;8(2):72– 6 (In Russ.). https://doi.org/10.30895/1991-2919-2018-8-2-72-76
58. Данилова ММ, Глотов АС, Сергеева ТВ, Баранов ВС. Влияние полиморфизма генов CYP2C9, CYP2C19 и MDR1 на риск развития побочных эффектов при лечении вальпроатами больных эпилепсией. Клинико-лабораторный консилиум. 2013;4(47):4–11. EDN: TCUOSV
59. Докукина ТВ, Гилеп АА, Голубева ТС, Махров МВ, Гайдукевич ИВ. Совершенствование фармакогенетического тестирования с целью персонализации терапии — доктрина мирового развития здравоохранения. Медицинские новости. 2017;(5):45–9. EDN: YPHSYV
60. Monostory K, Nagy A, Tóth K, Bűdi T, Kiss Á, Déri M, Csukly G. Relevance of CYP2C9 function in valproate therapy. Curr Neuropharmacol. 2019;17(1):99–106. https: //doi.org/10.2174/1570159X15666171109143654
61. Song C, Li X, Mao P, Song W, Liu L, Zhang Y. Impact of CYP2C19 and CYP2C9 gene polymorphisms on sodium valproate plasma concentration in patients with epilepsy. European Journal of Hospital Pharmacy: Science and Practice. 2022;29(4):198–201. https://doi.org/10.1136/ejhpharm-2020-002367
62. Van Booven D, Marsh S, McLeod H, Carrillo MW, Sangkuhl K, Klein TE, Altman RB. Cytochrome P450 2C9-CYP2C9. Pharmacogenet Genomics. 2010;20(4):277–81. https://doi.org/10.1097/FPC.0b013e3283349e84
63. Мирзаев КБ, Федоринов ДС, Иващенко ДВ, Сычев ДА. Мультиэтнический анализ кардиологических фармакогенетических маркеров генов цитохрома Р450 и мембранных транспортеров в российской популяции. Рациональная фармакотерапия в кардиологии. 2019;15(3):393–406. https://doi.org/10.20996/1819-6446-2019-15-3-393-406
64. Рыжикова КА. Распространенность полиморфизмов генов системы цитохрома Р-450 и генов белков-транспортеров среди популяции русских и трех этнических групп Республики Дагестан. Кремлевская медицина. Клинический вестник. 2018;(1):32–8. EDN: YKKUNR
65. Zhou Y, Nevosadová L, Eliasson E, Lauschke VM. Global distribution of functionally important CYP2C9 alleles and their inferred metabolic consequences. Hum Genomics. 2023;17(1):15. https://doi.org/10.1186/s40246-023-00461-z
66. Schaffenburg WC, Lockshin BN, DeKlotz CMC. 3 — Polymorphisms: why individual drug responses vary. In: Wolverton SE, ed. Comprehensive Dermatologic Drug Therapy. Elsevier; 2021;2:21–33. https://doi.org/10.1016/B978-0-323-61211-1.00003-6
67. Kiang TK, Ho PC, Anari MR, Tong V, Abbott FS, Chang TK. Contribution of CYP2C9, CYP2A6, and CYP2B6 to valproic acid metabolism in hepatic microsomes from individuals with the CYP2C9*1/*1 genotype. Toxicological Sciences. 2006;94(2):261–71. https://doi.org/10.1093/toxsci/kfl096
68. Hedrich WD, Hassan HE, Wang H. Insights into CYP2B6-mediated drug–drug interactions. Acta Pharm Sin B. 2016;6(5):413–25. https://doi.org/10.1016/j.apsb.2016.07.016
69. Langmia IM, Just KS, Yamoune S, Brockmöller J, Masimirembwa C, Stingl JC. CYP2B6 functional variability in drug metabolism and exposure across populations—implication for drug safety, dosing, and individualized therapy. Front Genet. 2021;12:692234. https://doi.org/10.3389/fgene.2021.692234
70. Ahmed S, Khan H, Khan A, Bangash MH, Hussain A, Qayum M, Hamdard MH. Inter-ethnic genetic variations and novel variant identification in the partial sequences of CYP2B6 gene in Pakistani population. Peer J. 2021;9:11149. https://doi.org/10.7717/peerj.11149
71. Filiptsova O, Kobets M, Kobets J, Naboka O, Koiro O, Ochkur A, Galiy L. Distribution of CYP2B6 516G/T pharmacogenetically important polymorphism in the Ukrainian population. Saudi Pharm J. 2018;26(5): 651–55. https://doi.org/10.1016/j.jsps.2018.02.027
72. Feng W, Mei S, Zhu L, Yu Y, Yang W, Gao B, et al. Effects of UGT2B7, SCN1A and CYP3A4 on the therapeutic response of sodium valproate treatment in children with generalized seizures. Seizure. 2018;58:96–100. https://doi.org/10.1016/j.seizure.2018.04.006
73. Dasgupta A. Chapter 4 — Genetic factors associated with opioid therapy and opioid addiction. Elsevier. 2020;61–88. https://doi.org/10.1016/B978-0-12-820075-9.00004-1
74. Mustafina OE, Tuktarova IA, Karimov DD. CYP2D6, CYP3A5, and CYP3A4 gene polymorphisms in Russian, Tatar, and Bashkir populations. Russ J Genet. 2015;51:98–107. https://doi.org/10.1134/S1022795415010081
75. Кантемирова БИ, Стародубцев АК, Сычев ДА, Белопасов ВВ, Цоцонава ЖМ, Григанов ВИ. Пути совершенствования фармакотерапии эпилепсии у детей: фокус на индивидуальные особенности биотрансформации лекарственных средств. Эпилепсия и пароксизмальные состояния. 2012;4(3):14–8. EDN: PEJLZZ
76. Mani B, Nair PP, Sekhar A, Kamalanathan S, Narayan SK, Kesavan R. CYP2C19 & UGT1A6 genetic polymorphisms and the impact on valproic acid-induced weight gain in people with epilepsy: prospective genetic association study. Epilepsy Research. 2021;177:106786. https://doi.org/10.1016/j.eplepsyres.2021.106786
77. Islamiyah WR, Nasronudin, Machin A, Ernawati I, Sugianto P. Relationship between CYP2C19 polymorphisms and weight gain in epilepsy patients treated with divalproex sodium: does gender matter? Bali Medical Journal. 2022;11(3):1800–4. https://doi.org/10.15562/bmj.v11i3.3748
78. Klein K, Zanger UM. Pharmacogenomics of cytochrome P450 3A4: recent progress toward the “missing heritability” problem. Front Genet. 2013;4:12. https://doi.org/10.3389/fgene.2013.00012
79. Dehbozorgi M, Kamalidehghan B, Hosseini I, Dehghanfard Z, Sangtarash MH, Firoozi M. Prevalence of the CYP2C19*2 (681 G>A), *3 (636 G>A) and *17 (-806 C>T) alleles among an Iranian population of different ethnicities. Mol Med Rep. 2018;17(3):4195–202. https://doi.org/10.3892/mmr.2018.8377
80. Жилина АА, Ларева НВ, Лузина ЕВ, Цвингер СМ, Морозова ЕИ. Клиническая значимость полиморфизма гена цитохрома Р4502С19(681G/A) у жителей Забайкальского края при лечении кислото-зависимых заболеваний. Архивъ внутренней медицины. 2022;12(2):123–8. https://doi.org/10.20514/2226-6704-2021-12-2-123-128
81. Сивакова НА, Шнайдер НА, Дмитренко ДВ, Липатова ЛВ, Толмачев МЮ, Насырова РФ. Распространенность аллельных вариантов гена CYP2D6*10 (100C>T, rs1065852) у больных эпилепсией Cеверо-Западного региона и Cибири. Обозрение психиатрии и медицинской психологии имени В.М. Бехтерева. 2019;4(1):91–2. https://doi.org/10.31363/2313-7053-2019-4-1-91-92
82. Payan M, Tajik N, Rouini MR, Ghahremani MH. Genotype and allele frequency of CYP2C19*17 in a healthy Iranian population. Med J Islam Repub Iran. 2015;29:269. PMID: 26793660
83. Зобова СН, Дмитренко ДВ, Шнайдер НА, Яковлева КД, Первунина АВ, Правдин ДЕ, Прусова ТИ. Роль носительства однонуклеотидных вариантов генов CYP2D6 и ABCB1 в эффективности терапии препаратами вальпроевой кислоты у пациентов с эпилепсией. Фармакогенетика и фармакогеномика. 2019;(2):12–3. https://doi.org/10.24411/2588-0527-2019-10046
84. Любченко ЛН, Филиппова МГ, Шендрикова ТА, Жукова ЛГ, Мехтиева НИ, Крохина ОВ, Портной СМ. Фармакогенетическое тестирование аллельных вариантов гена CYP2D6 при гормоноположительном раке молочной железы. Успехи молекулярной онкологии. 2017;4(3):57–66. https://doi.org/10.17650/2313-805X-2017-4-3-57-66
85. Кантемирова БИ. Состояние фармакогенетических исследований в Российской Федерации и за рубежом. Астраханский медицинский журнал. 2012;7(4):134–8. EDN: PWTCXN
86. Abdyrakhmanova AK, Nasyrova RF. Pharmacogenetic testing of cytochrome P450 metabolizing enzymes in 28-year-old man with treatment-resistant schizophrenia. Personalized Psychiatry and Neurology. 2022;2(1):81–8. https://doi.org/10.52667/2712-9179-2022-2-1-81-88
87. Бочанова ЕН. Фармакоэкономические исследования: ликбез для провизоров и фармацевтов. Новая аптека. 2018;(11):96–102. EDN: VRJAFM
88. Розочкин ИН, Застрожин МС, Скрябин ВЮ, Петросян ТР, Нестеренко ЕВ, Иванченко ВА и др. Фармакогенетические системы поддержки принятия решений (обзор литературы). Наркология. 2021;20(11):36–50.
89. Bochanova EN, Shnayder NA, Dmitrenko DV, Artyukhov IP, Gusev SD, Yurjeva EA, Shilkina OS. Process of personalized prescription of valproic acid as the main element of the management of epilepsy. International Journal of Biomedicine. 2018;8(1):26–32. https://doi.org/10.21103/Article8(1)_OA3
90. Бэрри Д, Кукес ВГ, Соколов АВ, Городецкий ВВ, Городецкая ГИ, Жестовская АС. Терапевтический лекарственный мониторинг: его задачи, принципы проведения и клинические результаты. Лекарственные средства и рациональная фармакотерапия. 2013;(1):5–21. EDN: RUISEH
91. Малыгин АС, Попов НС, Демидова МА, Кудряшова МН. Определение вальпроевой кислоты и ее метаболитов в плазме крови методом ВЭЖХ-масс-спектрометрии (ВЭЖХ-МС/МС). Эпилепсия и пароксизмальные состояния. 2018:10(2):35–42. https://doi.org/10.17749/2077-8333.2018.10.2.035-042
Об авторах
Н. А. ШнайдерРоссия
Шнайдер Наталья Алексеевна, д-р мед. наук, профессор
ул. Бехтерева, д. 3, Санкт-Петербург, 192019;
ул. Партизана Железняка, д. 1, г. Красноярск, 660022
В. В. Гречкина
Россия
Гречкина Виолетта Владимировна
ул. Бехтерева, д. 3, Санкт-Петербург, 192019
В. В. Архипов
Россия
Архипов Владимир Владимирович, д-р мед. наук, доцент
ул. Победы, д. 85, г. Белгород, 308015
Р. Ф. Насырова
Россия
Насырова Регина Фаритовна, д-р мед. наук
ул. Бехтерева, д. 3, Санкт-Петербург, 192019
Дополнительные файлы
Рецензия
Для цитирования:
Шнайдер Н.А., Гречкина В.В., Архипов В.В., Насырова Р.Ф. Роль фармакогенетического тестирования в оценке риска и безопасности применения вальпроатов: этнический аспект (обзор). Безопасность и риск фармакотерапии. 2024;12(2):132-154. https://doi.org/10.30895/2312-7821-2024-12-2-132-154
For citation:
Shnayder N.A., Grechkina V.V., Arkhipov V.V., Nasyrova R.F. Role of Pharmacogenetic Testing in the Risk and Safety Assessment of Valproates: The Ethnic Aspect (Review). Safety and Risk of Pharmacotherapy. 2024;12(2):132-154. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-2-132-154





































