Перейти к:
Пострегистрационный фармаконадзор: обзор открытых источников получения данных по безопасности лекарственных препаратов
https://doi.org/10.30895/2312-7821-2024-12-3-309-330
Резюме
ВВЕДЕНИЕ. Пострегистрационный фармаконадзор — основной механизм мониторинга и оценки безопасности лекарственных препаратов в процессе широкого клинического применения, который позволяет получить актуальную информацию о нежелательных реакциях и принять необходимые меры для профилактики и минимизации рисков фармакотерапии. Держатели регистрационных удостоверений должны регулярно проводить поиск и анализ информации по безопасности лекарственных препаратов во всех доступных источниках данных. Отсутствие практических рекомендаций по выбору релевантных источников информации не позволяет разработать оптимальную стратегию сбора данных по безопасности лекарственных препаратов, необходимую для своевременного выявления изменений в профиле безопасности лекарственного препарата, влияющих на соотношение «польза–риск».
ЦЕЛЬ. Выбор оптимальных подходов к сбору информации по безопасности лекарственных препаратов из открытых источников данных, используемых при проведении мониторинга профиля безопасности и оценки соотношения «польза–риск» зарегистрированных лекарственных препаратов.
ОБСУЖДЕНИЕ. Основными источниками новых сведений по безопасности лекарственных препаратов являются: базы данных по фармаконадзору, интернет-сайты регуляторных органов, публикации в научной медицинской литературе, данные реальной клинической практики. Результаты проведенного анализа показали, что наиболее широко используются базы данных Всемирной организации здравоохранения (VigiBase), Европейского союза (EudraVigilance) и США (FAERS). В статье подробно описаны возможности приложений для работы с данными, условия доступа, представлены интерфейсы этих инструментов. Среди интернет-сайтов зарубежных регуляторных органов наиболее информативными являются сайты Европейского агентства по лекарственным средствам (EMA) и Управления по контролю за качеством продуктов питания и лекарственных средств США (FDA). Представлены подробные инструкции по поиску информации по безопасности на интернет-сайтах этих организаций. Кроме того, обобщены сведения об авторитетных медицинских журналах, в которых с наибольшей вероятностью могут быть опубликованы статьи о нежелательных реакциях при применении лекарственных препаратов, и о библиографических базах данных и поисковых системах, упрощающих поиск научных публикаций. Систематический мониторинг информации в указанных источниках позволит держателям регистрационных удостоверений эффективно оценивать профиль безопасности и соотношение «польза–риск» для зарегистрированных лекарственных препаратов.
ВЫВОДЫ. Использование рекомендованных источников данных позволит оптимизировать процесс мониторинга сведений по безопасности лекарственных препаратов, значительно повысить уровень выявления потенциальных рисков, связанных с их применением, и своевременно разработать меры для их предупреждения. В целом это будет способствовать повышению безопасности пациента и улучшению качества оказываемой медицинской помощи.
Ключевые слова
Для цитирования:
Шубникова Е.В. Пострегистрационный фармаконадзор: обзор открытых источников получения данных по безопасности лекарственных препаратов. Безопасность и риск фармакотерапии. 2024;12(3):309-330. https://doi.org/10.30895/2312-7821-2024-12-3-309-330
For citation:
Shubnikova E.V. Postmarketing Surveillance: Review of Open Sources of Drug Safety Data. Safety and Risk of Pharmacotherapy. 2024;12(3):309-330. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-3-309-330
ВВЕДЕНИЕ
Использование в клинической практике лекарственных препаратов (ЛП) нередко приводит к развитию нежелательных реакций (НР), в том числе с летальными исходами. По данным Всемирной организации здравоохранения (ВОЗ), неблагоприятные события при оказании медицинской помощи, в том числе развитие НР на фоне медикаментозного лечения, входят в число десяти ведущих причин смертности и инвалидности пациентов во многих странах, а затраты на лечение их последствий зачастую превышают стоимость терапии1. Около 60% всех НР и связанных с ними госпитализаций являются предотвратимыми2 [1].
Ежегодно разрешение к медицинскому применению получают десятки новых ЛП, для которых в доклинических и клинических исследованиях подтверждены эффективность, безопасность, определен оптимальный режим дозирования. Однако ограничения длительности клинических испытаний, численности и репрезентативности различных групп участников (в исследования редко включают пациентов с сопутствующими патологиями, детей, беременных женщин, пожилых людей) не позволяют выявить весь спектр возможных НР и частоту их развития. Информация о редких, но тяжелых НР и хронической токсичности, которые могут изменить соотношение «польза–риск» ЛП, часто неполная или отсутствует3 [2–8].
Выявление всего спектра НР возможно только в процессе широкого клинического применения ЛП, поэтому очевидна необходимость проведения мониторинга безопасности ЛП в пострегистрационном периоде [9][10]. При этом от момента внедрения нового ЛП в медицинскую практику до обнаружения отсроченных или редких НР при его применении может пройти много времени, иногда несколько десятков лет. Например, ацетилсалициловую кислоту используют в медицинской практике с 1899 г., и только через 65 лет, в 1964 г., была установлена причинно-следственная связь между применением этого ЛП и развитием желудочно-кишечных кровотечений. Примерно столько же времени потребовалось для установления нефротоксичности анальгетика фенацетина [11][12].
Важным принципом фармаконадзора является изучение безопасности ЛП на всех этапах его жизненного цикла: от лабораторного тестирования, доклинических исследований на животных, предрегистрационных клинических исследований до широкого использования в медицинской практике4. Установление факта преобладания рисков использования ЛП над его пользой может привести к его отзыву с фармацевтического рынка.
Например, ЛП цизаприд — агонист серотонининовых рецепторов 5-НТ4, способствующий высвобождению ацетилхолина в кишечной нервной системе (особенно в миентеральном сплетении). Применялся с 1988 г. для лечения функциональных расстройств кишечника5, однако в 2000 г. был отозван с фармацевтического рынка США, Канады и Великобритании в связи с поступлением 386 сообщений о тяжелых нарушениях сердечного ритма (желудочковая тахикардия типа «пируэт», удлинение интервала QT). Только в США за весь период обращения ЛП было зарегистрировано 80 случаев аритмий с летальными исходами, всего в мире — 125 случаев [13][14]. Факторами риска развития аритмий являлись сопутствующие заболевания и межлекарственные взаимодействия [13][14]. Во время проведения предрегистрационных клинических исследований цизаприда было зарегистрировано 8 случаев летального исхода у детей, однако предостережения, касающиеся его применения в педиатрии, не были внесены в инструкцию по медицинскому применению (ИМП) этого ЛП. К моменту отзыва цизаприда в Управление по контролю за качеством продуктов питания и лекарственных средств США (US Food and Drug Administration, FDA) поступило 24 сообщения о смертях детей в возрасте до 6 лет на фоне его применения6 [13][14].
Еще одним подтверждением целесообразности проведения пострегистрационного фармаконадзора является внедрение в клиническую практику в США в августе 1998 г. вакцины RotaShield [RRV-TV] против ротавирусного гастроэнтерита. После начала вакцинации RotaShield в базе данных по мониторингу за безопасностью вакцин (Vaccine Adverse Event Reporting System, VAERS) было зарегистрировано 16 случаев развития инвагинации кишечника у детей. Результаты пострегистрационных исследований показали, что применение вакцины вызывало инвагинацию кишечника у здоровых младенцев в возрасте до 12 мес., риск развития этого заболевания у которых обычно низкий. По данным Центра по контролю и профилактике заболеваний в США (Centers for Disease Control and Prevention, CDC) это непредвиденное нежелательное явление, обусловленное вакцинацией, наблюдалось в основном после введения первой из трех необходимых доз вакцины в большинстве случаев среди грудных детей старше 3 мес. Несмотря на сложности в определении истинной частоты этого явления, международная группа экспертов пришла к заключению, что связанный с вакцинацией риск составляет 1 случай на 10 000 привитых детей грудного возраста. Патогенетические механизмы развития инвагинации кишечника после вакцинации против ротавирусной инфекции остаются не полностью выясненными, но в октябре 1999 г. производитель добровольно отозвал вакцину RotaShield с фармацевтического рынка7 [15].
В соответствии с действующим законодательством Российской Федерации и Евразийского экономического союза держатели регистрационных удостоверений (ДРУ) обязаны регулярно проводить мониторинг профиля безопасности ЛП на территории стран, где разрешено его обращение, и оценивать соотношение «польза–риск»8 [8][16][17].
На сегодняшний день отсутствуют четкие рекомендации по выбору релевантных источников данных и формированию стратегии поиска актуальной информации по безопасности ЛП. Источниками новых данных о НР при применении ЛП могут быть международные и национальные базы данных по безопасности ЛП, информация, полученная от регуляторных органов по фармаконадзору, публикации в научной медицинской литературе, а также данные реальной клинической практики (real-world data, RWD)9 [9][10].
Совершенствование процесса поиска актуальной информации по безопасности ЛП из различных источников данных позволит ДРУ эффективно проводить оценку профиля безопасности и соотношения «польза–риск» разрешенных к применению ЛП.
Цель работы — выбор оптимальных подходов к сбору информации по безопасности лекарственных препаратов из открытых источников данных, используемых при проведении мониторинга профиля безопасности и оценки соотношения «польза–риск» зарегистрированных лекарственных препаратов.
Поиск информации осуществляли на интернет-сайтах российских и зарубежных регуляторных органов по фармаконадзору и в открытых источниках научной медицинской литературы: индексируемых в базах данных eLIBRARY. RU, PubMed, Cochrane Library, Google Scholar без ограничения по дате и типу публикации. Для поиска использовали следующие термины и их комбинации на русском и английском языках: «postmarketing surveillance», «open sources of drug safety», «drug safety information», «drug safety data sources», «vaccine safety information».
ОСНОВНАЯ ЧАСТЬ
Пострегистрационный фармаконадзор в Российской Федерации
Основой рациональной фармакотерапии как составляющей доказательной медицины является эффективное и безопасное применение ЛП, обеспеченное максимально возможным преобладанием пользы над рисками, которое контролируется уполномоченными органами. Пострегистрационный фармаконадзор — это основной механизм мониторинга и оценки безопасности ЛП после их регистрации в процессе широкого клинического применения, который позволяет получить актуальную информацию о НР и принять необходимые меры для профилактики и минимизации рисков фармакотерапии. С 2010 г. все ЛП, находящиеся в обращении на территории Российской Федерации, подлежат мониторингу безопасности (фармаконадзору) в целях выявления возможных негативных последствий их применения, предупреждения пациентов и их защиты от применения таких препаратов10 [8][18].
Ответственными за организацию и проведение мониторинга безопасности ЛП в Российской Федерации является Управление организации государственного контроля качества медицинской продукции (отдел организации фармаконадзора) Федеральной службы по надзору в сфере здравоохранения и социального развития (Росздравнадзор) и экспертная организация Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора (центр по фармаконадзору)11.
Основными задачами отдела организации фармаконадзора являются осуществление деятельности по мониторингу безопасности ЛП, информирование субъектов обращения ЛП о регуляторных решениях, касающихся безопасности применения ЛП, координация деятельности территориальных органов Росздравнадзора, а также своевременный обмен информацией по безопасности ЛП с международными организациями, в частности с Центром сотрудничества ВОЗ по международному мониторингу безопасности лекарственных препаратов в Уппсале, Швеция (Uppsala Monitoring Centre, UMC). Субъекты обращения ЛП обязаны сообщать в Росздравнадзор в установленном уполномоченным органом порядке о НР, нежелательных явлениях, непредвиденных НР, серьезных НР, в том числе не указанных в ИМП, об индивидуальной непереносимости, об отсутствии эффективности, об особенностях взаимодействия ЛП между собой, а также об иных фактах и обстоятельствах, представляющих угрозу жизни пациентов12.
Специалисты центра по фармаконадзору проводят: анализ спонтанных сообщений, полученных от субъектов обращения ЛП, и оценку причинно-следственной связи «ЛП–НР»; анализ сообщений, полученных в ходе проведения клинических исследований; анализ и согласование периодических обновляемых отчетов по безопасности ЛП (ПООБ), направляемых ДРУ в Росздравнадзор; анализ и согласование периодических отчетов по безопасности разрабатываемого ЛП (РООБ), направляемых в Росздравнадзор юридическими лицами, на имя которых выданы разрешения на проведение клинических исследований в Российской Федерации, либо другими уполномоченными юридическими лицами; информации, полученной в ходе осуществления государственного контроля в сфере обращения ЛП; планов управления рисками (ПУР); специальных уведомлений, в том числе уведомлений об экстренных проблемах, связанных с безопасностью ЛП; анализ научной медицинской литературы, интернет-сайтов ведущих регуляторных агентств и специализированных научных и информационных ресурсов по фармаконадзору13.
При выявлении специалистами Росздравнадзора сведений, отсутствующих в общей характеристике ЛП (ОХЛП), ИМП, листке-вкладыше (ЛВ) или документации клинического исследования, влияющих на отношение ожидаемой пользы к возможному риску применения ЛП, либо информации об иной проблеме, связанной с безопасностью, направляется уведомление в Минздрав России.
К основным источникам актуальной информации по безопасности ЛП, которые должны использовать ДРУ в процессе пострегистрационного мониторинга, относятся14 [9][10]:
1) международные и национальные базы данных по фармаконадзору, в которые поступают спонтанные сообщения от врачей, пациентов, производителей, ДРУ, дистрибьюторов и сотрудников аптечных организаций;
2) регуляторные органы по фармаконадзору;
3) публикации в научной медицинской литературе: результаты клинических исследований, систематические обзоры и метаанализы, публикации отдельных клинических случаев;
4) RWD (регистры и реестры пациентов, электронные медицинские карты), сообщения в социальных сетях, сообществах и форумах пациентов.
Анализ информации по безопасности ЛП, проводимый ДРУ, должен быть направлен на выявление сигналов, новых рисков или важных новых аспектов известных рисков применения ЛП. Актуальные сведения по безопасности ЛП ДРУ представляют в Росздравнадзор в следующем виде: индивидуальные сообщения о НР, которые регистрируются и собираются в национальной базе данных «Фармаконадзор 2.0» автоматизированной информационной системы (АИС) Росздравнадзора; документы периодической отчетности (ПООБ, ПУР); сообщения об экстренных проблемах, связанных с безопасностью ЛП; дополнительная информация по запросу уполномоченных органов, необходимая для оценки соотношения «польза–риск» ЛП15 [19].
На основании полученной информации специалисты Росздравнадзора проводят оценку соотношения «польза–риск» для каждого ЛП. При выявлении новых рисков для пациентов уполномоченными органами могут быть приняты следующие меры по их минимизации: 1) актуализация информации в ОХЛП, ИМП, ЛВ; 2) ограничение применения ЛП (например, перевод ЛП из категории безрецептурного препарата в рецептурный); 3) проведение дополнительных доклинических и/или клинических исследований выявленного риска; 4) проведение дополнительных исследований качества, эффективности и безопасности ЛП; 5) распространение актуальной информации по безопасности ЛП среди врачей и пациентов с использованием ресурсов ДРУ или уполномоченных органов; 6) разработка или актуализация ПУР для ЛП; 7) приостановление обращения либо отмена регистрации ЛП.
Сведения о регуляторных решениях Минздрава России, принимаемых на основе рекомендаций Росздравнадзора, публикуются на официальном сайте Росздравнадзора в сети Интернет либо могут быть отправлены непосредственно ДРУ [9][10]. Эффективность пострегистрационного надзора напрямую зависит от активного участия и правильно выстроенного взаимодействия в сборе и представлении информации о ЛП между представителями регуляторных органов, фармацевтических компаний, производителями, специалистами в сфере здравоохранения и пациентами16 [20].
Таким образом, пострегистрационный мониторинг профиля безопасности и оценка соотношения «польза–риск» ЛП — непрерывный постоянно развивающийся процесс, который включает в себя следующие этапы работы с информацией: 1) поиск и получение (сбор); 2) хранение; 3) обработка и регистрация; 4) анализ; 5) медицинская оценка и стандартизация; 6) коммуникация (передача актуальной информации между субъектами обращения ЛП).
Международные и национальные базы данных спонтанных сообщений
На сегодняшний день в мировой практике основным источником сбора данных по безопасности ЛП и вакцин в пострегистрационном периоде являются системы спонтанной отчетности (Spontaneous Reporting Systems, SRSs). Работа SRSs основана на применении метода спонтанных сообщений, который предполагает добровольное или законодательно регламентированное представление в уполномоченные органы субъектами обращения ЛП информации о предполагаемых НР, возникших у конкретного пациента в определенный момент времени17 [19][21][22].
Для передачи сообщений о НР при применении ЛП используют бумажные или цифровые носители (например, система желтой карты (Yellow Card Scheme, YCS Великобритании)18 или система MedEffect в Канаде19), которые передаются по почте, электронной почте, телефону, факсу или дистанционно с использованием сети Интернет (например, онлайн-отчетность или мобильные приложения в системе MedWatch в США)20 [23].
С помощью SRSs информация по безопасности ЛП собирается и хранится в виде записей, содержащих описания индивидуальных сообщений о НР (Individual Safety Case Reports, ICSR). Полученные ICSR верифицируются, анализируются, систематизируются, определяется причинно-следственная связь между НР и ЛП и затем формируется база данных21. Информация из базы данных подвергается статистическому анализу, и сведения из ICSR используются для выявления и оценки потенциальных сигналов по безопасности ЛП22 [21–24].
Перечень национальных и международных баз данных по фармаконадзору с открытым доступом к информации о НР представлен в таблице 1. Медицинская информация о пациентах, представленная в этих базах данных, анонимизирована в соответствии с международными и национальными принципами конфиденциальности персональных данных [25][26].
Таблица 1. Международные и национальные базы данных по безопасности лекарственных препаратов с открытым доступом к информации через ресурсы сети Интернет
Table 1. Overview of national and international drug safety databases with open access via online resources
|
Страна Country |
База данных безопасности лекарственных препаратов Drug Safety Databases |
Веб-сайт Website |
|
Всемирная организация здравоохранения World Health Organization |
VigiAccess |
https://www.vigiaccess.org/ |
|
Европейский союз European Union |
European Union Drug Regulating Authorities Pharmacovigilance, EudraVigilance |
https://www.adrreports.eu/ |
|
США USA |
FDA Adverse Event Reporting System (FAERS) Vaccine Adverse Event Reporting System (VAERS) |
https://www.fda.gov/drugs https://vaers.hhs.gov/index.html |
|
Соединенное Королевство Великобритании United Kingdom |
MHRA: interactive Drug Analysis Profiles (iDAPs) |
https://yellowcard.mhra.gov.uk/ |
|
Австралия Australia |
Database of Adverse Event Notifications (DAEN) |
https://www.tga.gov.au/safety |
|
Новая Зеландия New Zealand |
Suspected Medicine Adverse Reaction Search (SMARS) |
www.medsafe.govt.nz |
|
Канада Canada |
Canada Vigilance Adverse Reaction Online Database |
www.canada.ca/en/ |
|
Япония Japan |
Japanese Adverse Drug Event Report database (JADER) |
www.pmda.go.jp/safety |
|
Франция France |
DATA.ANSM |
https://data.ansm.sante.fr/ |
|
Нидерланды Netherlands |
Netherlands Pharmacovigilance Centre Lareb database |
https://www.lareb.nl/en |
Таблица составлена автором / The table is prepared by the author
Примечание. FDA — Управление по контролю за качеством продуктов питания и лекарственных средств США (US Food and Drug Administration); MHRA — Регуляторное агентство по контролю за лекарственными средствами и изделиями медицинского назначения Великобритании (Medicines and Healthcare Products Regulatory Agency UK); ANSM — Национальное агентство Франции по безопасности лекарственных средств и изделий медицинского назначения (Agence nationale de sécurité du médicament et des produits de santé).
Note. FDA, Food and Drug Administration (USA); MHRA, Medicines and Healthcare Products Regulatory Agency (United Kingdom); ANSM, National Agency for Medicines and Health Products Safety (France).
По уровню доступа пользователя к информации о НР, представленной в международных и национальных базах данных, можно выделить следующие категории: 1) базы данных с высоким уровнем доступа к информации (США, Канада); 2) базы данных со средним уровнем доступа к информации (Австралия, Европа, Франция, Новая Зеландия); 3) базы данных с низким уровнем доступа к информации (Япония, Нидерланды, Великобритания, ВОЗ) [25][26].
При проведении пострегистрационного мониторинга профиля безопасности ЛП наиболее широко используются базы данных НР ВОЗ, Европы и США [19][27].
Международная единая база данных ВОЗ (WHO Global Individual Case Safety Report (ICSR) Database, VigiBase) создана в 1968 г. и с 1978 г. поддерживается UMC23. На сегодняшний день VigiBase является крупнейшим в мире хранилищем данных по безопасности ЛП. Ежегодно в ней регистрируются миллионы ICSR, поступающих из национальных центров по фармаконадзору 170 стран — участниц Международной программы мониторинга безопасности лекарственных средств (WHO Programme for International Drug Monitoring, PIDM)24 [28]. С апреля 2015 г. ВОЗ организовала доступ к информации по безопасности ЛП через веб-приложение VigiAccess — модуль для работы с открытыми данными, с помощью которого пользователь может проводить поиск ICSR по торговому или международному непатентованному наименованию (МНН) ЛП.
Уровень доступа к информации через веб-приложение VigiAccess ограничен25 [30]: представлены только обзорные статистические данные, касающиеся распределения сведений из ICSR по клиническим проявлениям НР, территории, откуда поступили ICSR, году поступления ICSR, возрастным группам и полу пациентов (рис. 1). Для Национальных центров по фармаконадзору доступен модуль VigiFlow, предназначенный для ввода данных ICSR в VigiBase, а также модуль VigiLyse, использующийся для проведения углубленного анализа данных и поиска сигналов по безопасности ЛП26.
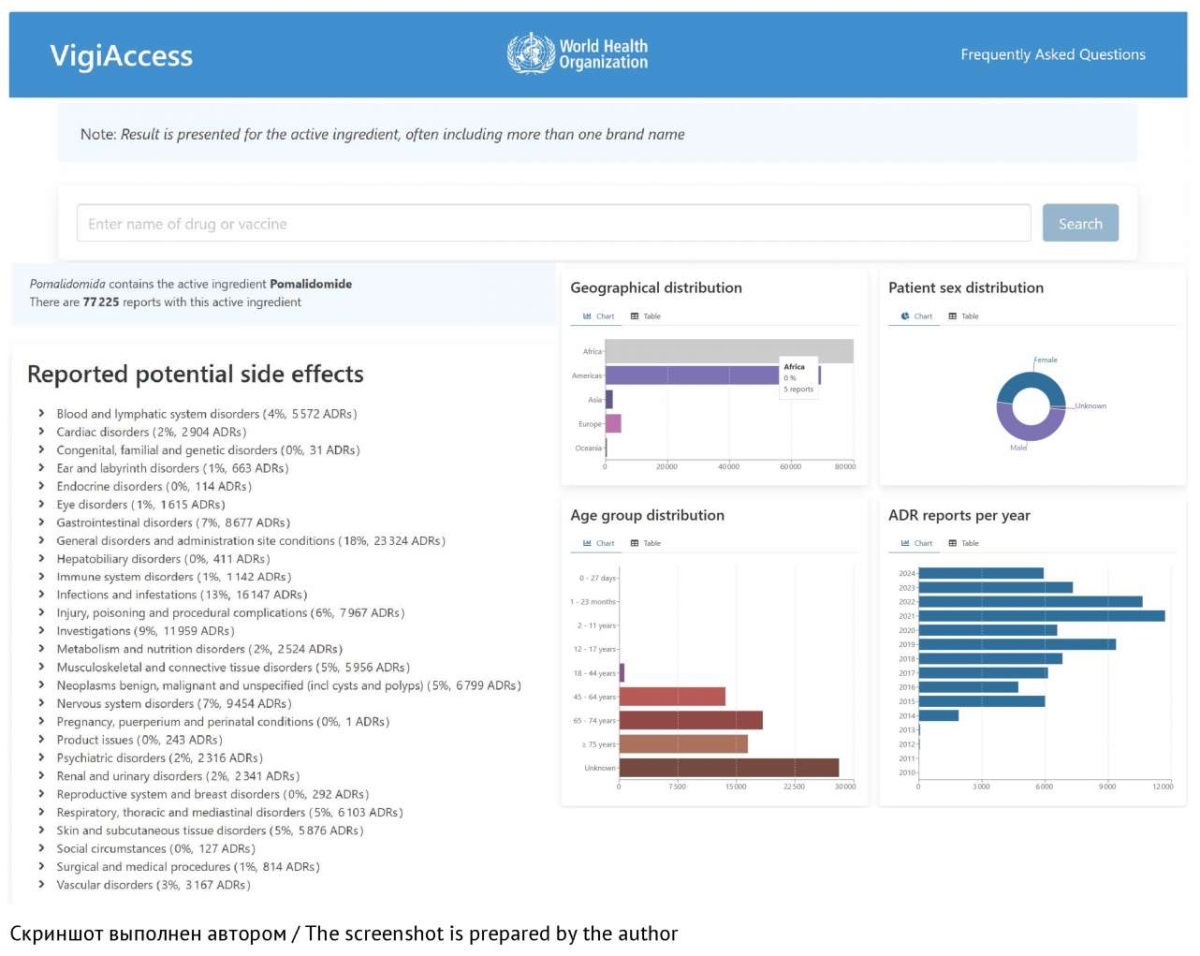
Рис. 1. Интерфейс веб-приложения VigiAccess на примере поиска нежелательных реакций для лекарственного препарата с МНН помалидомид
Fig. 1. Interface of the VigiAccess web application as exemplified by a search for adverse reactions to drugs products with the International Non-proprietary Name pomalidomide
Регуляторные органы по фармаконадзору стран — участниц PIDM обязаны направлять в базу данных VigiBase сведения о рисках применения ЛП, полученные в пострегистрационный период. Сбор информации на национальном уровне и ее передача в глобальную базу данных облегчает обнаружение сигналов о возможных рисках применения ЛП, а дальнейший анализ этой информации способствует увеличению вероятности обнаружения редких и отсроченных НР. Данные, аккумулированные в VigiBase, позволяют сравнить спектры зарегистрированных НР при применении ЛП в разных странах, а также выявить и провести анализ различий в рисках фармакотерапии между странами или регионами27 [29].
В рамках программы PIDM специалисты UMC проводят выявление и анализ международных данных по безопасности ЛП с целью раннего обнаружения сигналов и быстрой передачи информации национальным центрам по фармаконадзору. Для эффективного функционирования международной системы фармаконадзора разработаны общие формы отчетов, согласованы руководства по вводу информации о НР, подготовлены терминологические справочники и классификаторы, системы для передачи, хранения, распространения и обработки информации о НР28 [7][28]. Обратная связь с Национальными центрами по фармаконадзору осуществляется двумя способами: по запросу или публикацией сообщений о выявленных в ходе анализа базы данных сигналах, информация о которых может использоваться национальными центрами для инициации внутренних административных решений или дополнительных исследований [30].
Европейская база данных по фармаконадзору. В Европейском союзе фармакологический надзор за ЛП регулируется Европейской комиссией (European Commission, EC) и Европейским агентством по лекарственным средствам (European Medicines Agency, EMA), а также национальными компетентными органами в государствах — членах Европейской экономической зоны (European Economic Area, EEA)29 [31]. Мониторингом безопасности вакцин и информированием о нежелательных явлениях после вакцинации занимается Европейский центр профилактики и контроля заболеваний (European Centre for Disease Prevention and Control, ECDC)30.
С 2001 г. в Европейском союзе под руководством EMA функционирует Европейская база данных по фармаконадзору (European Union Drug Regulating Authorities Pharmacovigilance, EudraVigilance) — единая автоматизированная общедоступная система сбора, управления и анализа информации о НР ЛП, зарегистрированных в EEA или изучаемых в клинических исследованиях на его территории31 [32]. В базу данных EudraVigilance поступают спонтанные сообщения от ДРУ, спонсоров клинических исследований, специалистов системы здравоохранения, пациентов; данные неинтервенционных пострегистрационных исследований и научных медицинских публикаций. Передача информации о НР ЛП в систему EudraVigilance является обязательной для ДРУ и спонсоров клинических исследований [7][32].
В 2018 г. EMA с целью автоматизации и ускорения процесса обнаружения и анализа сигналов внедрило в работу EudraVigilance систему анализа данных (EudraVigilance Data Analysis System, EVDAS) — мощный инструмент, предназначенный для быстрой обработки большого объема данных. С помощью EVDAS пользователю становится доступным функционал анализа данных из ICSR, собранных в базе EudraVigilance, результаты которого можно использовать при оценке профиля безопасности ЛП32 [33].
Доступ к данным EudraVigilance предоставляется на странице Access to EudraVigilance data33 интернет-сайта ЕМА. Панель базы данных EudraVigilance позволяет пользователю проводить поиск ICSR по действующему веществу или торговому наименованию ЛП или вакцины (рис. 2).
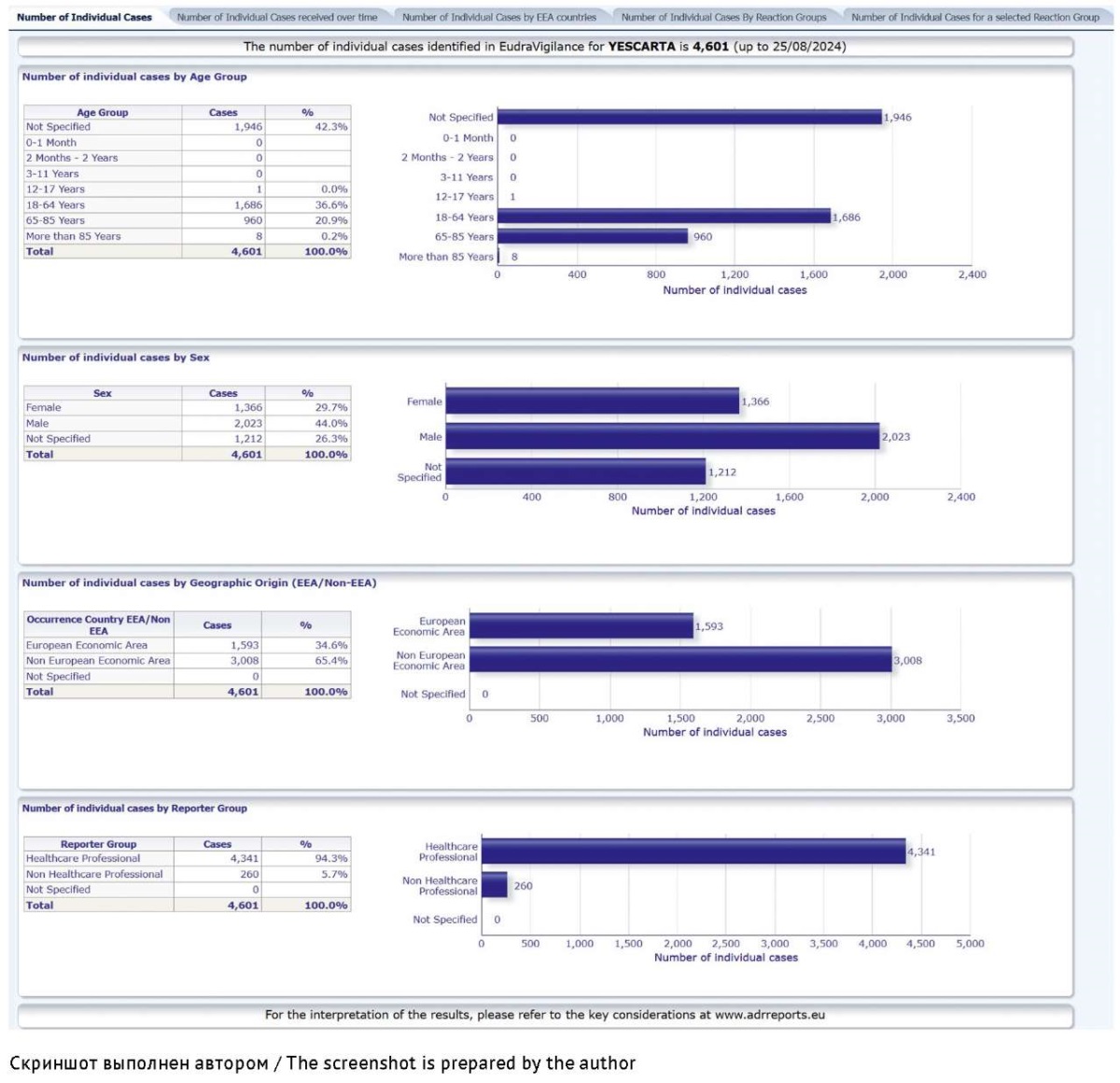
Рис. 2. Интерфейс общедоступной панели базы данных EudraVigilancе на примере лекарственного препарата YESCARTA
Fig. 2. Interface of the public dashboard of the EudraVigilance database as exemplified by the page of YESCARTA
В открытом доступе находятся агрегированные данные EudraVigilance, стратифицированные по следующим параметрам: общее число ICSR, полученных на конкретный ЛП; количество ICSR, полученных за определенный период времени; общее количество ICSR, распределенное по странам ЕЕА; общее количество ICSR, полученных по всем группам НР; количество ICSR, распределенных по определенной группе НР; количество ICSR по искомой НР. В пределах каждого параметра предусмотрены различные варианты сортировки данных: по возрасту, полу пациентов, серьезности НР, репортеру и географическому происхождению данных34 [33]. Все данные доступны для скачивания и сохранения в форматах .xls и .pdf.
Система спонтанной отчетности о нежелательных явлениях США. В США регуляторным органом по фармаконадзору является Управление по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA)35, которое в 1969 г. совместно с Центром по оценке и исследованиям лекарственных средств (Center for Drug Evaluation and Research, CDER) департамента здравоохранения и социального обеспечения США (US Department of Health and Human Services, HHS36) в рамках реализации программы пострегистрационного наблюдения за безопасностью одобренных ЛП разработало систему спонтанной отчетности о нежелательных явлениях (FDA Adverse Event Reporting System, FAERS) [7][34].
В 1993 г. FDA для оптимизации процесса идентификации и уведомления о нежелательных явлениях, связанных с применением продуктов, регулируемых FDA (ЛП, медицинские изделия, продукты питания), была разработана система сбора информации о безопасности медицинской продукции MedWatch37 [35–37]. В рамках программы MedWatch специалисты системы здравоохранения, пациенты, производители могут сообщать о НР, в том числе серьезных, и других рисках, связанных с применением ЛП, с помощью стандартных форм отчетов, которые направляются по почте или в электронном виде. Форматы отчетов соответствуют нормам, разработанным Международным советом по гармонизации технических требований к регистрации ЛП для медицинского применения (International Council on Harmonisation, ICH). При составлении отчетов используется стандартизированная международная терминология Медицинского словаря для регуляторной деятельности (Medical Dictionary for Regulatory Activities, MedDRA) [35][36]. Вся информация из системы MedWatch поступает в базу данных FAERS. Кроме того, у ДРУ есть возможность отправлять данные напрямую в FAERS c помощью стандартной электронной формы E2B(R3)38 [7][36][38].
В 2017 г. FDA создало общедоступную сводную информационную панель FAERS Public Dashboard — это интерактивный веб-инструмент, облегчающий доступ и работу пользователя с данными FAERS. Вход на главную страницу FAERS Public Dashboard располагается на сайте FDA в разделе FDA Adverse Event Reporting System (FAERS). На главной странице FAERS Public Dashboard размещены основные показатели репортирования о НР за весь период работы базы данных, отражающие динамику количества ICSR в режиме реального времени39 (рис. 3).
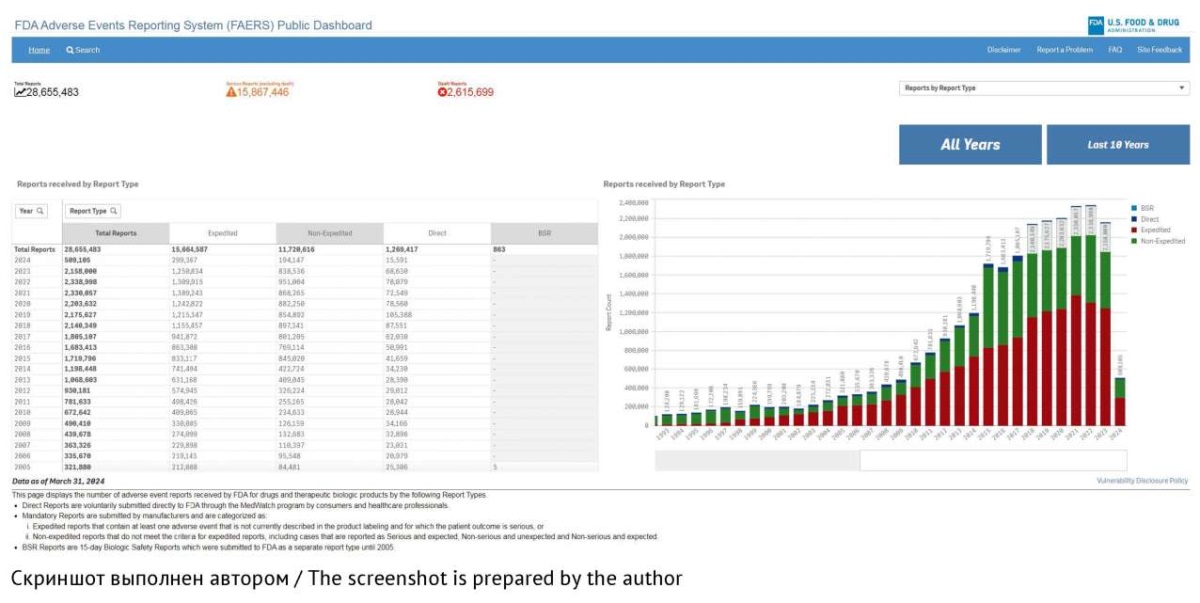
Рис. 3. Главная страница общедоступной информационной панели FAERS Public Dashboard
Fig. 3. Home page of the FAERS Public Dashboard
С помощью FAERS Public Dashboard пользователь может проводить поиск и анализ информации по безопасности ЛП40 [39]. Информация о НР находится в открытом доступе с возможностью поиска, сортировки и визуализации данных по следующим ключевым параметрам: подозреваемый ЛП; НР; критерии серьезности и летальные исходы; возраст, пол пациента; территория регистрации НР41 [39][40]. По запросу пользователь может получить полный доступ к необработанным данным FAERS (полному описанию ICSRs) в виде файлов ASCII/XLM с возможностью их дальнейшего анализа (сортировка, статистическая обработка, оценка информации из отдельных ICSR) [40].
Для пострегистрационного надзора за безопасностью вакцин в 1990 г. FDA совместно с CDC разработало отдельную систему сбора информации о нежелательных явлениях после иммунизации (Vaccine Adverse Event Reporting System, VAERS)42 [7].
Специалисты ВОЗ и национальных регуляторных органов по фармаконадзору, таким образом, систематически проводят анализ данных по безопасности ЛП из SRSs с целью выявления и оценки сигналов, новых рисков или новых аспектов известных рисков, связанных с применением ЛП. Результаты научной оценки полученных данных публикуются регуляторными органами на интернет-сайтах в виде информационных писем. Регуляторный орган может также размещать в сети Интернет списки ЛП, в отношении которых были выявлены сигналы по безопасности, требующие дальнейшего изучения и оценки. Новая информация по безопасности может стать основанием для принятия регуляторных мер: внесение изменений в ОХЛП, ИМП (ЛВ), разработка или актуализация ПУР, ограничение или запрет на применение ЛП.
Интернет-сайты регуляторных органов по фармаконадзору
Важным источником информации для получения полных и объективных данных по безопасности ЛП являются рекомендации, размещенные на интернет-сайтах регуляторных органов по фармаконадзору43. Регуляторные органы обязаны информировать субъекты обращения ЛП о рисках фармакотерапии с помощью распространения актуальных сведений по безопасности ЛП. Способы и методы распространения информации по безопасности ЛП внутри отдельной страны и между странами могут различаться [41]. В большинстве стран регуляторные органы публикуют актуальные сведения по безопасности ЛП в открытом доступе (табл. 2).
Таблица 2. Интернет-сайты зарубежных регуляторных органов по фармаконадзору
Table 2. Websites of international regulatory authorities in pharmacovigilance
|
Страна Country |
Регуляторный орган Regulatory authority |
Веб-сайт Website |
|
Швеция Sweden |
Международный центр по мониторингу безопасности лекарственных средств в Уппсале WHO Collaborating Centre — The Uppsala Monitoring Centre |
https://who-umc.org/ |
|
Европейский союз European Union |
Европейское агентство по лекарственным средствам European Medicines Agency, EMA |
https://www.ema.europa.eu/ |
|
США USA |
Управление по контролю за качеством продуктов питания и лекарственных средств US Food and Drug Administration, FDA |
https://www.fda.gov/ |
|
Великобритания United Kingdom |
Регуляторное агентство по контролю за лекарственными средствами и изделиями медицинского назначения Великобритании Medicines and Healthcare Products Regulatory Agency, MHRA |
https://www.gov.uk/ |
|
Япония Japan |
Агентство по фармацевтическим препаратам и медицинским изделиям Японии Pharmaceuticals and Medical Devices Agency, PMDA |
https://www.pmda.go.jp/ |
|
Франция France |
Национальное агентство по безопасности лекарственных средств и изделий медицинского назначения Франции Agence nationale de sécurité du médicament et des produits de santé, ANSM |
https://ansm.sante.fr/ |
|
Канада Canada |
Министерство здравоохранения Канады Health Canada |
https://www.canada.ca/en.html |
|
Австралия Australia |
Австралийское управление по контролю за средствами медицинского применения Therapeutic Goods Administration, TGA |
https://www.tga.gov.au/medicines |
|
Новая Зеландия New Zealand |
Агентство по контролю за безопасностью лекарственных средств и медицинских изделий Новой Зеландии Medicines and Medical Devices Safety Authority, Medsafe |
https://www.medsafe.govt.nz/ |
|
Нидерланды Netherlands |
Центр по фармаконадзору Lareb, Нидерланды Netherlands Pharmacovigilance Centre Lareb |
https://www.lareb.nl/en |
|
Швейцария Switzerland |
Швейцарское агентство по лекарственным средствам Swiss Agency for Therapeutic Products, SWISSMEDIC |
https://www.swissmedic.ch/swissmedic/de/home.html |
Таблица составлена автором / The table is prepared by the author
В зависимости от конечного пользователя, срочности представления и способа распространения регуляторный орган размещает на сайте информацию по безопасности ЛП следующего содержания.
1. Оповещения по безопасности ЛП (drug safety alerts) — срочные предупреждения для информирования субъектов обращения (специалистов в сфере здравоохранения, пациентов, производителей) о рисках, связанных с применением ЛП, и/или действиях, которые необходимо предпринять в отношении ЛП c целью предупреждения рисков. Необходимость в срочном оповещении появляется в случае возникновения экстренной проблемы по безопасности ЛП, это может быть как известный риск, так и новый риск или случайное событие (примеры: Австралия44, Великобритания45, США46).
2. Обновление информации по безопасности ЛП (drug safety update) — новые сведения, предназначенные для информирования субъектов обращения ЛП, об актуальных изменениях в профиле безопасности ЛП. К ним относятся рекомендации регуляторного органа о необходимости внесения изменений в информацию о ЛП, представленную в соответствующих разделах ОХЛП, ИМП (ЛВ), или о введении в отношении ЛП дополнительных мер по минимизации рисков или мероприятий по фармаконадзору (примеры: Австралия47, Великобритания48, Европейский союз49).
3. Прямое информирование специалистов системы здравоохранения (Direct Healthcare Professional Communication, DHPC) — средство коммуникации, при помощи которого важная информация по безопасности ЛП представляется напрямую специалистам системы здравоохранения (рассылка по почте, электронной почте). ДРУ либо уполномоченный орган по фармаконадзору отправляют информационное сообщение с целью оповещения о необходимости принятия определенных мер или изменения рутинной практики в связи с полученными новыми важными данными о ЛП. Разработка информационных материалов ДРУ для DHPC осуществляется после одобрения их уполномоченным органом. DHPC распространяются при необходимости принятия срочных мер или изменений в существующей практике в отношении ЛП в следующих случаях: приостановление или аннулирование регистрационного удостоверения, обусловленные изменениями профиля безопасности ЛП; внесение изменений в рекомендации по применению ЛП (ограничение показаний к применению, появление нового противопоказания, изменения в рекомендуемых дозах, обусловленные изменением профиля безопасности ЛП); ограничения доступности лекарственного препарата на фармацевтическом рынке или прекращение производства ЛП, что может неблагоприятно сказаться на системе оказания медицинской помощи (примеры: Европейский союз50, Швейцария51).
4. Информация об отозванных ЛП (drug recalls). Отзыв — это добровольное действие, предпринимаемое фармацевтической компанией для удаления с рынка некачественного ЛП или предупреждения пациентов и потребителей о потенциальном риске, связанном с применением ЛП.
Причинами отзыва ЛП могут быть: 1) выявление проблемы, связанной с безопасностью (обнаружение токсичности или серьезных НР); 2) недостатки, связанные с качеством (ошибки при производстве, загрязнение, неправильная маркировка или упаковка); 3) отсутствие эффективности; 4) несоответствие регуляторным стандартам (изменения в регуляторных требованиях могут привести к необходимости изменения состава, упаковки или ОХЛП, ИМП (ЛВ) ЛП)52.
Как правило, регуляторный орган публикует списки отозванных ЛП или создает общедоступную базу данных с возможностью проведения поиска, например Medsafe Online Recalls Database в Новой Зеландии53, Drug Recalls в США54, Recalls and Safety Alerts Database в Канаде55. Отзыв ЛП является эффективным способом защиты потребителя от некачественного или потенциально вредного продукта.
На сегодняшний день наиболее информативными ресурсами являются интернет-сайты зарубежных регуляторных органов государств — членов Европейского союза (EMA) и США (FDA). Системы фармаконадзора, разработанные и внедренные в регуляторную практику в этих странах, характеризуются ранним выявлением сигналов по безопасности и высоким уровнем информирования субъектов обращения ЛП56 [9][10][42].
Важным источником информации по безопасности ЛП на сайте ЕМА являются решения Комитета по оценке рисков в сфере фармаконадзора (Pharmacovigilance Risk Assessment Committee, PRAC, EMA). PRAC занимается научной оценкой сигналов по безопасности ЛП в Европейском союзе. Эксперты PRAC проводят анализ данных по фармаконадзору на пред- и пострегистрационном этапе, анализ ПООБ, анализ и согласование ПУР, вносят предложения о необходимости разработки мер по минимизации рисков фармакотерапии и мероприятиям по фармаконадзору в случаях, когда возникают подозрения в небезопасности ЛП. Кроме того, эксперты анализируют протоколы пострегистрационных исследований безопасности с их последующим одобрением или отклонением, определяют частоту представления ПООБ ДРУ в регуляторный орган, разрабатывают и публикуют списки ЛП, требующих дополнительного мониторинга. PRAC согласует свои рекомендации по безопасности с Комитетом по лекарственным средствам для применения у человека (Committee for Medicinal Products for Human Use, CHMP) и Координационной группой по взаимному признанию и децентрализованным процедурам (Coordination Group for Mutual Recognition and Decentralised Procedures — Human, CMDh), после чего принимаются регуляторные решения. Результаты экспертной оценки безопасности PRAC публикует на сайте ЕМА в составе рекомендаций по сигналам безопасности57 (PRAC recommendations on safety signals, раздел Pharmacovigilance: post-authorisation, подраздел Signal management). В рекомендациях PRAC обязывает ДРУ вносить актуальную информацию по безопасности (как правило, в течение двух месяцев с даты публикации информации) в соответствующие разделы ОХЛП, ИМП (ЛВ) ЛП. Рекомендации PRAC публикуются ежемесячно и доступны для скачивания в формате .pdf.
На интернет-сайте FDA актуальные сведения по безопасности ЛП можно найти в базе данных изменений маркировки ЛП, связанных с безопасностью (Drug Safety-related Labeling Changes database)58 (рис. 4).
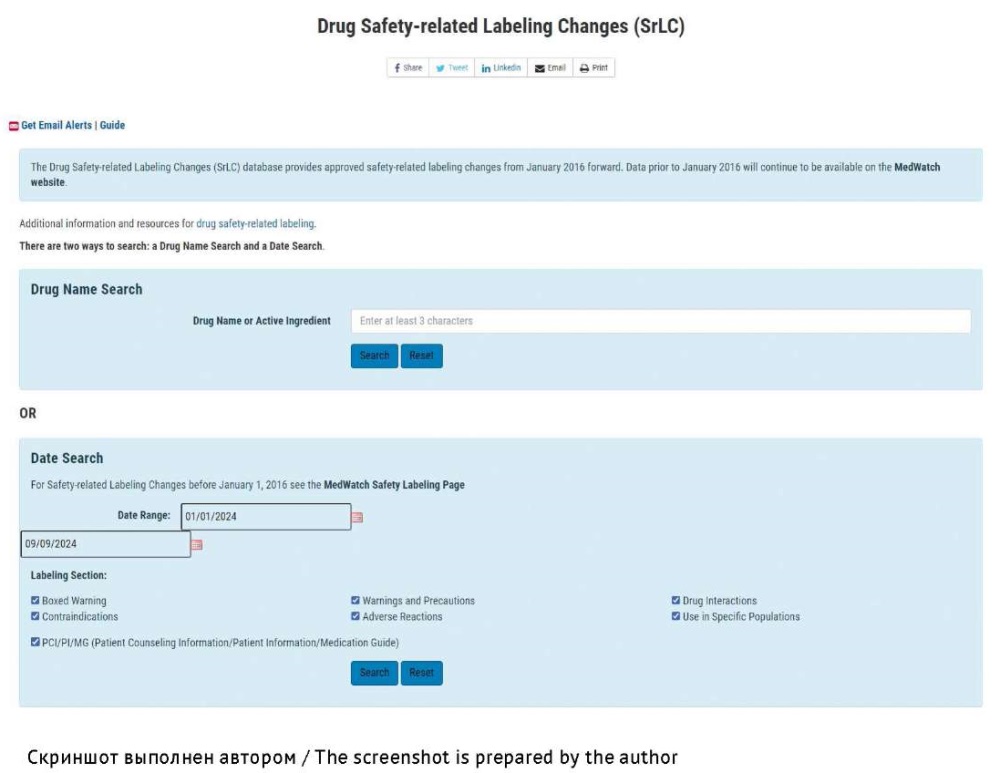
Рис. 4. Интерфейс базы данных Drug Safety-related Labeling Changes database
Fig. 4. Interface of the Drug Safety-related Labeling Changes database
База данных содержит утвержденные FDA изменения в информации по безопасности ЛП (отпускаемых по рецепту), размещенной на составляющих системы упаковки (укупорки) и/или в ИМП (ЛВ). В базе Drug Safety-related Labeling Changes пользователю доступен поиск данных по торговому наименованию ЛП или действующему веществу. Кроме того, предусмотрены возможность сортировки информации по дате ее поступления и просмотр данных за определенный промежуток времени. Меню Drug Safety-related Labeling Changes также позволяет провести поиск изменений в информации, указанной в соответствующих разделах ИМП (ЛВ) или на упаковке ЛП: Boxed Warning — особые предупреждения в рамке; Contraindications — противопоказания; Warnings and Precautions — предупреждение и меры предосторожности; Adverse Reactions — НР; Patient Counseling Information/Patient Information/Medication Guide (PCI/PI/MG) — информация для пациента / информация о пациенте / руководство по приему ЛП; Drug Interactions — взаимодействие с другими ЛП; Use in Specific Populations — применение в конкретных группах59. Результаты проведенного поиска можно сохранить в форматах .xls и .pdf.
Как правило, регуляторные органы ежемесячно размещают в открытом доступе на интернет-сайтах информационные бюллетени Drug Safety Newsletters, в которых публикуют обобщенные актуальные сведения по безопасности ЛП. Drug Safety Newsletters доступны для скачивания в формате .pdf и подлежат распространению среди субъектов обращения ЛП60 (рис. 5).

Рис. 5. Информационные бюллетени по безопасности лекарственных препаратов: А — WHO Pharmaceuticals Newsletter (Всемирная организация здравоохранения); В — Drug Safety Update (Регуляторное агентство по контролю за лекарственными средствами и изделиями медицинского назначения Великобритании); С — Health Product InfoWatch (Министерство здравоохранения Канады)
Fig. 5. Drug safety fact sheets: A, WHO Pharmaceuticals Newsletter (World Health Organization); B, Drug Safety Update (Medicines and Healthcare Products Regulatory Agency); C, Health Product InfoWatch (Health Canada)
Так, ВОЗ с 1982 г. выпускает раз в квартал информационный бюллетень WHO Pharmaceuticals Newsletter, который содержит актуальную информацию по безопасности ЛП, полученную из национальных центров по фармаконадзору стран — участниц PIDM. В разделе «Signal» WHO Pharmaceuticals Newsletter ВОЗ публикует результаты актуальных исследований по сигналам безопасности ЛП, основанных на анализе сведений, полученных с помощью международной базы данных VigiBase61.
На интернет-сайтах регуляторных органов Российской Федерации, государств — членов ЕАЭС и Союза Независимых Государств (СНГ) также размещается информация по безопасности ЛП (табл. 3).
Таблица 3. Интернет-сайты регуляторных органов государств — членов Евразийского экономического союза и Союза Независимых Государств
Table 3. Websites of the national regulatory authorities of the Member States of the Eurasian Economic Union and the Commonwealth of Independent States
|
Страна Country |
Регуляторный орган Regulatory authority |
Веб-сайт Website |
|
Российская Федерация Russian Federation |
Министерство здравоохранения Российской Федерации Ministry of Health of the Russian Federation Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор) Federal Service for Surveillance in Healthcare |
https://grls.rosminzdrav.ru/ https://roszdravnadzor.gov.ru/ |
|
Республика Беларусь Republic of Belarus |
Центр экспертиз и испытаний в здравоохранении Министерства здравоохранения Республики Беларусь Center for Examinations and Tests in Health Service (Republican Unitary Enterprise) |
https://www.rceth.by/ru/ |
|
Республика Казахстан Republic of Kazakhstan |
Национальный центр экспертизы лекарственных средств и медицинских изделий Комитета медико-фармацевтического контроля Министерства здравоохранения Республики Казахстан National Center for Expertise of the Committee of Sanitary and Epidemiological Control of the Ministry of Health of the Republic of Kazakhstan |
https://www.ndda.kz/ |
|
Республика Армения Republic of Armenia |
Научный центр экспертизы лекарств и медицинских технологий имени академика Э. Габриеляна Scientific Centre of Drug and Medical Technology Expertise after Academician Emil Gabrielyan |
https://www.pharm.am/index.php/ru/ |
|
Кыргызская Республика Republic of Kyrgyzstan |
Департамент лекарственных средств и медицинских изделий при Министерстве здравоохранения Кыргызской Республики Department of Medicines and Medical Devices of the Ministry of Health of the Kyrgyz Republic |
https://www.pharm.kg/ |
|
Республика Азербайджан Republic of Azerbaijan |
Центр аналитической экспертизы Министерства здравоохранения Республики Азербайджан Analytical Expertise Center of the Ministry of Health of the Republic of Azerbaijan |
https://pharma.az/ |
|
Республика Узбекистан Republic of Uzbekistan |
Государственное Учреждение Центр безопасности фармацевтической продукции при Министерстве здравоохранения Республики Узбекистан The Center for Pharmaceutical Products Safety (State Institution) of the Ministry of Health of the Republic of Uzbekistan |
https://uzpharm-control.uz/ |
|
Республика Молдова Republic of Moldova |
Агентство по лекарственным средствам и медицинским изделиям Республики Молдова Medicines and Medical Devices Agency of the Republic of Moldova |
https://amdm.gov.md/ |
|
Грузия Georgia |
Государственное Агентство по регулированию медицинской и фармацевтической деятельности State Regulation Agency for Medical Activities |
https://rama.moh.gov.ge/ |
|
Республика Таджикистан Republic of Tajikistan |
Служба государственного надзора за фармацевтической деятельностью State Supervision Service for Pharmaceutical Activities |
https://pharmnadzor.tj |
|
Туркменистан Turkmenistan |
Центр регистрации лекарственных средств и государственного контроля их качества при Министерстве здравоохранения и медицины промышленности Туркменистана Center for Registration and State Quality Control of Medicinal Products of the Ministry of Health and Medical Industry of Turkmenistan |
http://centreg.gov.tm/ |
Таблица составлена автором / The table is prepared by the author
На интернет-сайте Росздравнадзора в разделе «Мониторинг эффективности и безопасности лекарственных препаратов» публикуются информационные письма от ДРУ и регуляторного органа, содержащие актуальные сведения по безопасности ЛП, и письма, информирующие общественность о внедрении разработанных и согласованных материалов по дополнительным мерам минимизации рисков и/ или мероприятиям по фармаконадзору. Кроме того, в данном разделе осуществляется доступ для субъектов обращения ЛП в российскую национальную базу данных НР «Фармаконадзор 2.0» АИС Росздравнадзора, данные в которой хранятся в формате, рекомендованном Советом по гармонизации ICH E2B(R3)62. АИС Росздравнадзора поддерживает возможность автоматического формата передачи сообщений из локальных баз данных по фармаконадзору ДРУ, а также обмен информацией в рамках PIDM c базой данных ВОЗ VigiBase. В работе АИС Росздравнадзора используются современные методы анализа данных по безопасности ЛП, включая статистический поиск, а в формат сообщений интегрирован перевод на русский язык терминов MedDRA63.
На интернет-сайте Государственного реестра лекарственных средств64 в разделе «Безопасность лекарственных препаратов» доступны для просмотра сведения об отмене государственной регистрации ЛП и информационные письма Минздрава России, содержащие рекомендации по актуализации сведений по безопасности ЛП. ДРУ регулярно инициируют добровольную отмену государственной регистрации зарегистрированных ранее ЛП. Причинами этого могут являться закрытие производственной площадки, получение результатов новых клинических исследований, истечение срока действия первичной регистрации.
Для своевременного информирования пациентов и специалистов системы здравоохранения о новых рисках фармакотерапии и поддержания информации в ОХЛП, ИМП (ЛВ) в актуальном состоянии ДРУ обязаны проводить регулярный мониторинг различных источников информации, в том числе сайтов регуляторных органов, на наличие изменений в профиле безопасности и соотношении «польза–риск» зарегистрированных ЛП. ДРУ должны обеспечить соответствие информации о ЛП современному уровню научных знаний, включая результаты оценки новой информации о безопасности, выполненной уполномоченными органами государств-членов. ДРУ несет ответственность за объективность и точность представляемой населению информации65.
Сотрудники Управления экспертизы безопасности лекарственных средств, экспертной организации ФГБУ «НЦЭСМП» Минздрава России, систематически проводят поиск, анализ и обобщение актуальных сведений по безопасности ЛП из научной медицинской литературы и решений регуляторных органов. Новые сведения передают сотрудникам этического комитета Минздрава России и Росздравнадзора. Специалисты Росздравнадзора направляют результаты общего анализа актуальной информации по безопасности ЛП в Департамент регулирования обращения лекарственных средств и медицинских изделий Минздрава России для принятия решений о внесении изменений в ОХЛП, ИМП (ЛВ) ЛП. Вопросы о необходимости актуализации сведений в ОХЛП, ИМП (ЛВ) ЛП, находящихся в гражданском обороте в Российской Федерации, рассматриваются сотрудниками Центра экспертизы и контроля готовых лекарственных средств ФГБУ «НЦЭСМП» Минздрава России. На финальном этапе на сайте Государственного реестра лекарственных средств в разделе «Безопасность лекарственных препаратов» публикуются информационные письма, которые содержат рекомендации Минздрава России, предназначенные для ДРУ ЛП, в отношении которых была выявлена необходимость в актуализации сведений, в том числе по безопасности, в ОХЛП, ИМП (ЛВ)66.
В течение жизненного цикла ЛП по мере поступления новых научных данных, включая данные по безопасности, информация о ЛП подлежит пересмотру и обновлению. Отсутствие в ОХЛП, ИМП (ЛВ) актуальной информации может привести к неблагоприятным для пациента последствиям, нежелательному или неэффективному лечению [43].
Публикации в научной медицинской литературе: типы статей, рекомендуемые журналы и базы данных
Важным источником актуальной информации по безопасности ЛП являются научные публикации в отечественных и зарубежных рецензируемых медицинских журналах, такие как результаты клинических исследований, систематические обзоры и метаанализы, публикации отдельных клинических случаев [22][44–48].
Перечень рецензируемых научных российских журналов, рекомендуемых автором для поиска информации по безопасности лекарственных препаратов: «Российский медицинский журнал», «Терапевтический архив», «Педиатрическая фармакология», «Клиническая фармакология и терапия», «Педиатрия», «Безопасность и риск фармакотерапии», «Клиническая медицина», «Акушерство и гинекология», «Экспериментальная и клиническая фармакология», «Вестник Росздравнадзора», «Ремедиум», «Качественная клиническая практика», «Разработка и регистрация лекарственных средств», «Фармация и фармакология», «Регуляторные исследования и экспертиза лекарственных средств».
Перечень рецензируемых научных зарубежных журналов, рекомендуемых автором для поиска информации по безопасности лекарственных препаратов: Drug Safety, Pharmacoepidemiology and Drug Safety, Journal of the American Medical Association, The New England Journal, The BMJ, The Lancet, Journal Watch, Annals of Internal Medicine, Indian Journal of Pharmacology, Journal of Pharmacology and Pharmacotherapeutics, International Journal of Risk & Safety in Medicine, Expert Opinion on Drug Safety, Therapeutic Innovation & Regulatory Science, Drug Safety Case Reports. Архивы большинства журналов находятся в свободном доступе на собственных интернет-сайтах.
Ресурсами, упрощающими поиск научных публикаций при проведении систематического обзора научной литературы, являются электронные библиографические базы данных и поисковые системы:
- MEDLINE на PubMed, EBSCO, Ovid, Web of Science;
- EMBASE67;
- Web of Science68;
- Scopus;
- HighWire Press;
- Cochrane Library;
- International Pharmaceutical Abstracts на Cambridge Scientific Abstracts, DataStar, Dialog, DIMDI, EBSCO, Ovid, ProQuest, STN International;
- Google Scholar;
- OpenAlex;
- Scilit;
- RU;
- КиберЛенинка.
Самой авторитетной базой данных в мире является MEDLINE (MEDlars onLINE), созданная в 1966 г. Национальной медицинской библиотекой США. Универсальная поисковая система PubMed предназначена для поиска ссылок и резюме статей в библиографической базе данных MEDLINE69.
База данных систематических обзоров Кокрейновской библиотеки (Cochrane Library), в которых обобщены результаты рандомизированных контролируемых клинических исследований с использованием статистических методов метаанализа, позволяет более точно и надежно оценить степень эффективности фармакотерапии70.
Полные тексты электронных версий российских медицинских журналов доступны зарегистрированным пользователям на портале Научной электронной библиотеки eLIBRARY. RU71. Аннотированный перечень научной периодики по медицине и здравоохранению, который содержит полную информацию о российских научных журналах в электронном виде, включающий их описания и все вышедшие выпуски (по годам) с открытым доступом к их полным текстам, размещен на сайте Научной электронной библиотеки «Киберленинка»72.
Публикации в научной медицинской литературе служат важным источником актуальных сведений по безопасности ЛП, необходимых для обнаружения или подтверждения сигналов и оценки соотношения «польза–риск». Анализ публикаций позволяет выявить редкие и отсроченные НР, неизвестные межлекарственные взаимодействия, неэффективность фармакотерапии, фальсифицированные ЛП. Такие данные могут стать триггером к проведению более глубоких исследований безопасности ЛП. Качественные публикации о клинических случаях в научных медицинских журналах повышают осведомленность специалистов в сфере здравоохранения о наличии возможной взаимосвязи между НР и ЛП и побуждают к дальнейшим публикациям сообщений о подобных клинических случаях [45–48]. Так, ранние сообщения о случаях возникновения тяжелых врожденных пороков развития после приема талидомида женщинами во время беременности (1959 г.) и сообщения о дефектах нервной трубки, вызванные применением вальпроатов (1982 г.) были впервые представлены в научной медицинской литературе в публикациях, описывающих отдельные клинические случаи и серии случаев [45].
В соответствии с надлежащей практикой по фармаконадзору ДРУ обязаны проводить регулярный поиск актуальной информации по безопасности ЛП в научной медицинской литературе не реже одного раза в неделю. При проведении обзора научной медицинской литературы ДРУ необходимо использовать библиографические базы данных, содержащие максимальное количество ссылок на публикации, имеющие отношение к наблюдаемому ЛП73. Помимо глобального мониторинга информации в научных медицинских журналах, индексируемых в крупных библиографических базах данных, специалистам по фармаконадзору следует проводить поиск сведений в региональных журналах тех стран, где обращаются ЛП. Поиск должен охватывать также данные по безопасности ЛП, которые могут быть представлены в отчетах о клинических случаях, описаниях результатов клинических исследований, в стендовых докладах, письмах в редакцию и сборниках научных конференций.
Важными дополнительными источниками актуальных сведений по безопасности ЛП являются данные реальной клинической практики RWD (регистры, реестры пациентов, электронные медицинские карты, реестры и метарегистры клинических исследований) и спонтанные сообщения, полученные из социальных сетей и сообществ пациентов [7][22][49–51].
Своевременный сбор ДРУ актуальной информации о ЛП повышает эффективность мониторинга безопасности ЛП, способствует быстрому выявлению изменений в соотношении «польза–риск» и проведению качественной оценки профиля безопасности ЛП.
ЗАКЛЮЧЕНИЕ
Организация ДРУ эффективной системы сбора, анализа и передачи информации по безопасности ЛП в регуляторные органы, необходимой для проведения непрерывного мониторинга профиля безопасности и оценки соотношения «польза–риск», является обязательным условием для получения разрешений на медицинское применение ЛП и продолжение обращения на фармацевтическом рынке.
ДРУ следует осуществлять сбор данных по безопасности ЛП во всех источниках, указанных в действующих регуляторных документах. Результаты проведенного исследования показали, что приоритетными источниками, содержащими наибольший объем релевантной информации для фармаконадзора, являются: международные и национальные базы данных спонтанных сообщений (VigiBase, EudraVigilance, FAERS и др.), интернет-сайты российских и зарубежных регуляторных органов по фармаконадзору, публикации в научной медицинской литературе, библиографические базы данных. Информация, полученная из баз данных по фармаконадзору, — важный источник актуальных сведений как для ДРУ, так и для специалистов регуляторных органов, специалистов в сфере здравоохранения, исследователей. Проведение регулярного мониторинга информации из этих источников способствует выявлению ранее не известных редких и отсроченных НР, обнаружению сигналов. Сведения по безопасности ЛП могут быть использованы при разработке ЛП (новые молекулы, биоаналоги), оценке межлекарственных взаимодействий, проведении ретроспективных наблюдательных исследований.
Анализ публикаций в научной медицинской литературе является необходимым, поскольку способствует обнаружению или подтверждению сигналов, выявлению редких и отсроченных НР, неизвестных межлекарственных взаимодействий, неэффективности фармакотерапии, фальсифицированных ЛП и может стать триггером к проведению более глубоких исследований безопасности ЛП.
Полнота сбора сведений напрямую зависит от спектра используемых источников информации, поэтому для качественной оценки профиля безопасности ЛП ДРУ необходимо сочетать анализ спонтанных сообщений c систематическим мониторингом и анализом научной медицинской литературы, административных решений, размещенных на сайтах регуляторных органов по фармаконадзору, данных реальной клинической практики (регистры, реестры пациентов), а также информации, полученной из социальных сетей и интернет-сообществ пациентов.
Использование рекомендованных источников данных позволит ДРУ оптимизировать процесс мониторинга информации по безопасности ЛП, значительно повысить степень выявления сигналов, новых рисков или важных аспектов известных рисков фармакотерапии и своевременно проинформировать о них регуляторные органы по фармаконадзору, специалистов в сфере здравоохранения и пациентов, а также при необходимости разработать эффективные меры по управлению рисками и их минимизации для повышения безопасности пациента и улучшения качества оказываемой медицинской помощи.
Вклад автора. Автор подтверждает соответствие своего авторства критериям ICMJE.
Authors’ contributions. The author confirms that she meets the ICMJE criteria for authorship.
1. Безопасность пациентов. Глобальные действия по обеспечению безопасности пациентов. Доклад Генерального директора ВОЗ 25 марта 2019 г. WHA72/26. ВОЗ; 2019.
2. Zsifkovits J, Zuba M, Geißler W, Lepuschütz L, Pertl D, Kernstock E, Ostermann H. Costs of unsafe care and costeffectiveness of patient safety programmes. Final Report. European Union; 2016. https://health.ec.europa.eu/system/files/2017-02/2016_costs_psp_en_0.pdf
3. Council for International Organizations of Medical Sciences (CIOMS). Reporting Adverse Drug Reactions. Definitions of Terms and Criteria for their Use. CIOMS; 1999.
4. Там же.
5. https://go.drugbank.com/drugs/DB00604
6. Medsafe Editorial Team. Cisapride and Arrhythmias. https://medsafe.govt.nz/profs/puarticles/cisapride.htm
Willman D. How a new policy led to seven deadly drugs. Los Angeles Times. Dec. 20, 2000. https://www.latimes.com/nation/la-122001fda-story.html
7 https://archive.cdc.gov/#/details?url=https://www.cdc.gov/vaccines/vpd-vac/rotavirus/vac-rotashield-historical.htm
https://www.cdc.gov/mmwr/preview/mmwrhtml/mm5334a3.htm
8. Федеральный закон Российской Федерации от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (ст. 64).
Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
Приказ Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора».
9. Шубникова ЕВ. Пострегистрационный фармаконадзор: открытые источники получения данных по безопасности лекарственных средств. Доклад на Российском конгрессе «Безопасность фармакотерапии 360°: Noli nocere!». 16–19 мая 2023 г., Москва.
10. Федеральный закон Российской Федерации от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (ст. 64).
Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
Всемирная организация здравоохранения. Фармаконадзор: обеспечение безопасного использования лекарственных средств. https://iris.who.int/bitstream/handle/10665/68782/WHO_EDM_2004.8.pdf?sequence=1&isAllowed=y
11. Приказ Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора».
https://www.fgu.ru/
12. Федеральный закон Российской Федерации от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (ст. 64).
Приказ Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора».
13. Приказ Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора».
Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
14. Шубникова ЕВ. Пострегистрационный фармаконадзор: открытые источники получения данных по безопасности лекарственных средств. Доклад на Российском конгрессе «Безопасность фармакотерапии 360°: Noli nocere!». 16–19 мая 2023 г., Москва.
15. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
Шубникова ЕВ. Пострегистрационный фармаконадзор: открытые источники получения данных по безопасности лекарственных средств. Доклад на Российском конгрессе «Безопасность фармакотерапии 360°: Noli nocere!». 16–19 мая 2023 г., Москва.
16. Шубникова ЕВ. Организация эффективной системы фармаконадзора: актуальность своевременного информирования пациентов и специалистов системы здравоохранения о рисках фармакотерапии. Доклад на конференции «РЕГЛЕК 2023», 13–15 ноября 2023 г., Москва.
17. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
https://www.who.int/publications/i/item/9241593911
18. https://yellowcard.mhra.gov.uk/
19. https://www.canada.ca/en/health-canada/services/drugs-health-products/medeffect-canada.html
20. https://www.fda.gov/safety/medwatch-fda-safety-information-and-adverse-event-reporting-program
https://www.who.int/publications/i/item/9241593911
21. https://cioms.ch/wp-content/uploads/2018/03/WG8-Signal-Detection.pdf
22. Там же.
23. www.who-umc.org
24. www.who-umc.org
https://who-umc.org/about-the-who-programme-for-international-drug-monitoring/about-the-who-pidm/
https://www.who.int/teams/regulation-prequalification/regulation-and-safety/pharmacovigilance/networks/pidm
25. https://who-umc.org/about-the-who-programme-for-international-drug-monitoring/about-the-who-pidm/
https://www.who.int/teams/regulation-prequalification/regulation-and-safety/pharmacovigilance/networks/pidm
26. https://who-umc.org/pv-products/vigiflow/
27. https://who-umc.org/about-the-who-programme-for-international-drug-monitoring/about-the-who-pidm/
28. https://www.ich.org/
29. https://www.ema.europa.eu/en/about-us/how-we-work/european-medicines-regulatory-network
30. https://www.ecdc.europa.eu/en
31. https://www.ema.europa.eu/en/human-regulatory-overview/research-development/pharmacovigilance-research-development/eudravigilance/eudravigilance-system-overview
32. https://www.ema.europa.eu/en/human-regulatory-overview/research-development/pharmacovigilance-research-development/eudravigilance/access-eudravigilance-data
33. Там же.
34. Там же.
35. https://www.fda.gov/
36. https://www.fda.gov/drugs/questions-and-answers-fdas-adverse-event-reporting-system-faers/fda-adverse-event-reporting-system-faers-electronic-submissions
37. https://www.fda.gov/safety/medwatch-fda-safety-information-and-adverse-event-reporting-program
38. https://www.fda.gov/drugs/surveillance/questions-and-answers-fdas-adverse-event-reporting-system-faers
39. https://www.fda.gov/drugs/questions-and-answers-fdas-adverse-event-reporting-system-faers/fda-adverse-event-reporting-system-faers-public-dashboard
40. Там же.
41. https://www.fda.gov/drugs/questions-and-answers-fdas-adverse-event-reporting-system-faers/fda-adverse-event-reporting-system-faers-public-dashboard
42. https://www.fda.gov/vaccines-blood-biologics/vaccine-adverse-events/vaers-overview
43. Шубникова ЕВ. Пострегистрационный фармаконадзор: открытые источники получения данных по безопасности лекарственных средств. Доклад на Российском конгрессе «Безопасность фармакотерапии 360°: Noli nocere!». 16–19 мая 2023 г., Москва.
44. https://www.tga.gov.au/news/safety-alerts
45. https://www.gov.uk/drug-device-alerts
46. https://www.fda.gov/drugs/drug-safety-and-availability/drug-safety-communications
47. https://www.tga.gov.au/news/safety-updates
48. https://www.gov.uk/drug-safety-update
49. https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/pharmacovigilance-post-authorisation/periodic-safety-update-reports-psurs
50. https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/pharmacovigilance-post-authorisation/direct-healthcare-professional-communications
51. https://www.swissmedic.ch/swissmedic/en/home/humanarzneimittel/market-surveillance/health-professional-communication--hpc-.html
52. Федеральный закон Российской Федерации от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств».
53. https://www.medsafe.govt.nz/hot/Recalls/RecallSearch.asp
54. https://www.fda.gov/drugs/drug-safety-and-availability/drug-recalls
55. https://www.canada.ca/en/health-canada/services/drugs-health-products/advisories-warnings-recalls.html
56. Шубникова ЕВ. Пострегистрационный фармаконадзор: открытые источники получения данных по безопасности лекарственных средств. Доклад на Российском конгрессе «Безопасность фармакотерапии 360°: Noli nocere!». 16–19 мая 2023 г., Москва.
57. https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/pharmacovigilance-post-authorisation/signal-management/prac-recommendations-safety-signals
58. https://www.accessdata.fda.gov/scripts/cder/safetylabelingchanges/
59. https://www.fda.gov/drugs/drug-safety-and-availability/drug-safety-related-labeling-changes-srlc-database-overview-updates-safety-information-fda-approved
60. https://www.gov.uk/government/publications/drug-safety-update-monthly-newsletter
https://www.ema.europa.eu/en/news-and-events/publications/newsletters
https://www.canada.ca/en/health-canada/services/drugs-health-products/medeffect-canada/health-product-infowatch/april-2024.html
61. https://www.who.int/publications/i
62. EMA/CHMP/ICH/287/1995. ICH guideline E2B (R3) on electronic transmission of individual case safety reports (ICSRs) — data elements and message specification — implementation guide. EMA; 2013.
https://roszdravnadzor.gov.ru/drugs/monitpringlp
63. https://www.meddra.org/how-to-use/support-documentation/english
64. https://grls.rosminzdrav.ru/Default.aspx
65. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
66. Шубникова ЕВ. Организация эффективной системы фармаконадзора: актуальность своевременного информирования пациентов и специалистов системы здравоохранения о рисках фармакотерапии. Доклад на конференции «РЕГЛЕК 2023», 13–15 ноября 2023 г., Москва.
67. Платный доступ.
68. Платный доступ.
69. https://www.ncbi.nlm.nih.gov/
70. https://www.cochrane.org/ru/evidence
71. https://www.elibrary.ru/
72. https://cyberleninka.ru/
73. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
Список литературы
1. Giardina C, Cutroneo PM, Mocciaro E, Russo GT, Mandraffino G, Basile G, et al. Adverse drug reactions in hospitalized patients: results of the FORWARD (Facilitation of Reporting in Hospital Ward) study. Front Pharmacol. 2018;9:350. https://doi.org/10.3389/fphar.2018.00350
2. Englev E, Petersen KP. ICH-GCP Guideline: kvalitetssikring af kliniske laegemiddelforsøg. Status og perspektiver [ICH-GCP Guideline: quality assurance of clinical trials. Status and perspectives]. Ugeskr Laeger. 2003;165(16):1659–62 [In Danish]. PMID: 12756823.
3. Dixon JR Jr. The International Conference on Harmonization Good Clinical Practice guideline. Qual Assur. 1998;6(2):65–74. https://doi.org/10.1080/105294199277860
4. Spelsberg A, Prugger C, Doshi P, Ostrowski K, Witte T, Hüsgen D, et al. Contribution of industry funded post-marketing studies to drug safety: survey of notifications submitted to regulatory agencies. BMJ. 2017;356:j337. https://doi.org/10.1136/bmj.j337
5. Daluwatte C, Schotland P, Strauss DG, Burkhart KK, Racz R. Predicting potential adverse events using safety data from marketed drugs. BMC Bioinformatics. 2020;21(1):163. https://doi.org/10.1186/s12859-020-3509-7
6. Samara C, Garcia A, Henry C, Vallotton L, Cariolato L, Desmeules J, Pinçon A. Safety surveillance during drug development: comparative evaluation of existing regulations. Adv Ther. 2023;40(5):2147–85. https://doi.org/10.1007/s12325-023-02492-3
7. Izem R, Sanchez-Kam M, Ma H, Zink R, Zhao Y. Sources of safety data and statistical strategies for design and analysis: postmarket surveillance. Ther Innov Regul Sci. 2018;52(2):159–69. https://doi.org/10.1177/2168479017741112
8. Raj N, Fernandes S, Charyulu NR, Dubey A, Ravi GS, Hebbar S. Postmarket surveillance: a review on key aspects and measures on the effective functioning in the context of the United Kingdom and Canada. Ther Adv Drug Saf. 2019;10:2042098619865413. https://doi.org/10.1177/2042098619865413
9. Шубникова ЕВ, Букатина ТМ, Каперко ДА, Вельц НЮ, Дармостукова МА, Казаков АС и др. Постмаркетинговые исследования безопасности лекарственных средств: анализ рекомендаций зарубежных регуляторных органов. Безопасность и риск фармакотерапии. 2018;6(3):130–7.
10. Шубникова ЕВ, Дармостукова МА, Букатина ТМ, Каперко ДА, Вельц НЮ, Казаков АС и др. О зарегистрированных в постмаркетинговый период нежелательных реакциях лекарственных средств. Безопасность и риск фармакотерапии. 2019;7(1):15–22.
11. Babb RR, Wilbur RS. Aspirin and gastrointestinal bleeding. An opinion. Calif Med. 1969;110(5):440–1. PMID: 5305637
12. Prescott LF. The nephrotoxicity of analgesics. J Pharm Pharmacol. 1966;18(6):331–53. https://doi.org/10.1111/j.2042-7158.1966.tb07886.x
13. Ferriman A. UK licence for cisapride suspended. BMJ. 2000;321(7256):259. PMID: 10915117
14. Wysowski DK, Bacsanyi J. Cisapride and fatal arrhythmia. N Engl J Med. 1996;335(4):290–1. https://doi.org/10.1056/NEJM199607253350416
15. Yen C, Healy K, Tate JE, Parashar UD, Bines J, Neuzil K, et al. Rotavirus vaccination and intussusception – science, surveillance, and safety: a review of evidence and recommendations for future research priorities in low and middle income countries. Hum Vaccin Immunother. 2016;12(10):2580–9. https://doi.org/10.1080/21645515.2016.1197452
16. Hamid AAA, Rahim R, Teo SP. Pharmacovigilance and its importance for primary health care professionals. Korean J Fam Med. 2022;43(5):290–5. https://doi.org/10.4082/kjfm.21.0193
17. Tsintis P, La Mache E. CIOMS and ICH initiatives in pharmacovigilance and risk management: overview and implications. Drug Saf. 2004;27(8):509–17. https://doi.org/10.2165/00002018-200427080-00004
18. Хосева ЕН, Морозова ТЕ. Проблемные аспекты развития системы фармаконадзора в Российской Федерации на современном этапе (обзор). Качественная клиническая практика. 2013;(3):40–5.
19. Jyndiang A, Shabaraya AR, Chandur VK. A comprehensive review on pharmacovigilance: enhancing drug safety and surveillance. Int J Pharm Sci. 2023;1(12):158–65. https://doi.org/10.5281/zenodo.10302560
20. Мурашко МА, Пархоменко ДВ, Асецкая ИЛ, Косенко ВВ, Поливанов ВА, Глаголев СВ. Актуальные вопросы мониторинга безопасности лекарственных средств в Российской Федерации. Акушерство и гинекология. 2015;(2):72–80.
21. Alomar M, Tawfiq AM, Hassan N, Palaian S. Post marketing surveillance of suspected adverse drug reactions through spontaneous reporting: current status, challenges and the future. Ther Adv Drug Saf. 2020;11:2042098620938595. https://doi.org/10.1177/2042098620938595
22. Ibrahim H, Abdo A, El Kerdawy AM, Sharaf Eldin A. Signal detection in pharmacovigilance: a review of informatics-driven approaches for the discovery of drug–drug interaction signals in different data sources. Artificial Intelligence in the Life Sciences. 2021;1:100005. https://doi.org/10.1016/j.ailsci.2021.100005
23. Malikova MA. Practical applications of regulatory requirements for signal detection and communications in pharmacovigilance. Ther Adv Drug Saf. 2020;11:2042098620909614. https://doi.org/10.1177%2F2042098620909614
24. Bate A, Evans SJ. Quantitative signal detection using spontaneous ADR reporting. Pharmacoepidemiol Drug Saf. 2009;18(6):427–36. https://doi.org/10.1002/pds.1742
25. Fouretier A, Malriq A, Bertram D. Open access pharmacovigilance databases: analysis of 11 databases. Pharm Med. 2016;30:221–31. https://doi.org/10.1007/s40290-016-0146-6
26. Giunchi V, Fusaroli M, Hauben M, Raschi E, Poluzzi E. Challenges and opportunities in accessing and analysing FAERS data: a call towards a collaborative approach. Drug Saf. 2023;46(10):921–6. https://doi.org/10.1007/s40264-023-01345-w
27. Worakunphanich W, Youngkong S, Suwankesawong W, Anderson C, Thavorncharoensap M. Comparison of patient adverse drug reaction reporting systems in nine selected countries. Int J Environ Res Public Health. 2022;19(8):4447. https://doi.org/10.3390/ijerph19084447
28. Lindquist M. VigiBase, the WHO global ICSR database system: basic facts. Ther Innov Regul Sci. 2008;42:409–9. https://doi.org/10.1177/009286150804200501
29. Казаков АС, Шубникова ЕВ, Дармостукова МА, Снегирева ИИ, Кутехова ГВ, Затолочина КЭ и др. Международный мониторинг безопасности лекарственных средств. Безопасность и риск фармакотерапии. 2019;7(3):120–6.
30. Загородникова КА. Организация мониторинга безопасности лекарственных средств в мире – методологические подходы. Тихоокеанский медицинский журнал. 2015;(1):11–5.
31. Santoro A, Genov G, Spooner A, Raine J, Arlett P. Promoting and protecting public health: how the European Union pharmacovigilance system works. Drug Saf. 2017;40(10):855–69. https://doi.org/10.1007/s40264-017-0572-8
32. Postigo R, Brosch S, Slattery J, van Haren A, Dogné JM, Kurz X, et al. EudraVigilance medicines safety database: publicly accessible data for research and public health protection. Drug Saf. 2018;41(7):665–75. https://doi.org/10.1007/s40264-018-0647-1
33. Sardella M, Lungu C. Evaluation of quantitative signal detection in EudraVigilance for orphan drugs: possible risk of false negatives. Ther Adv Drug Saf. 2019;10:2042098619882819. https://doi.org/10.1177/2042098619882819
34. Lavertu A, Vora B, Giacomini KM, Altman R, Rensi S. A new era in pharmacovigilance: toward real-world data and digital monitoring. Clin Pharmacol Ther. 2021;109(5):1197–202. https://doi.org/10.1002/cpt.2172
35. Kessler DA. Introducing MEDWatch. A new approach to reporting medication and device adverse effects and product problems. JAMA. 1993;269(21):2765–8. https://doi.org/10.1001/jama.269.21.2765
36. Craigle V. MedWatch: the FDA safety information and adverse event reporting program. J Med Libr Assoc. 2007;95(2):224–5. https://doi.org/10.3163/1536-5050.95.2.224
37. Alomar M, Palaian S, Al-Tabakha MM. Pharmacovigilance in perspective: drug withdrawals, data mining and policy implications. F1000Res. 2019;8:2109. https://doi.org/10.12688/f1000research.21402.1
38. Sakaeda T, Tamon A, Kadoyama K, Okuno Y. Data mining of the public version of the FDA adverse event reporting system. Int J Med Sci. 2013;10(7):796–803. https://doi.org/10.7150/ijms.6048
39. Kumar A. The newly available FAERS public dashboard: implications for health care professionals. Hosp Pharm. 2019;54(2):75–7. https://doi.org/10.1177/0018578718795271
40. Giunchi V, Fusaroli M, Hauben M, Raschi E, Poluzzi E. Challenges and opportunities in accessing and analysing FAERS data: a call towards a collaborative approach. Drug Saf. 2023;46(10):921–6. https://doi.org/10.1007/s40264-023-01345-w
41. Weatherburn CJ, Guthrie B, Dreischulte T, Morales DR. Impact of medicines regulatory risk communications in the UK on prescribing and clinical outcomes: systematic review, time series analysis and meta-analysis. Br J Clin Pharmacol. 2020;86(4):698–710. https://doi.org/10.1111/bcp.14104
42. Пастернак ЕЮ, Букатина ТМ, Аляутдин РН, Романов БК. Практические рекомендации по поиску информации о безопасности лекарственных средств. Безопасность и риск фармакотерапии. 2016;(3):36–9.
43. Lucas S, Ailani J, Smith TR, Abdrabboh A, Xue F, Navetta MS. Pharmacovigilance: reporting requirements throughout a product's lifecycle. Ther Adv Drug Saf. 2022;13:20420986221125006. https://doi.org/10.1177/20420986221125006
44. Anandabaskar N. Drug Information. In: Raj G, Raveendran R, eds. Introduction to basics of pharmacology and toxicology. Springer; 2019. https://doi.org/10.1007/978-981-32-9779-1_14
45. Shah RR. Importance of publishing adverse drug reaction case reports: promoting public health and advancing pharmacology and therapeutics. Drug Saf Case Rep. 2017;4(1):11. https://doi.org/10.1007/s40800-017-0053-0
46. Kolupoti A, Chakraborty A, Shahistha K. ADR in journals: are they translated into regulatory frameworks? Curr Drug Saf. 2022;17(1):34–9. https://doi.org/10.2174/1574886316666210609115148
47. Kelly W, Arellano F, Barnes J, Bergman U, Edwards R, Fernandez A, et al. Guidelines for submitting adverse event reports for publication. Therapie. 2009;64(4):289–94. https://doi.org/10.2515/therapie/2009041
48. Shah RR. Importance of publishing adverse drug reaction case reports: promoting public health and advancing pharmacology and therapeutics. Drug Saf Case Rep. 2017;4(1):11. https://doi.org/10.1007/s40800-017-0053-0
49. Marchenko O, Russek-Cohen E, Levenson M, Zink RC, Krukas-Hampel MR, Jiang Q, et al. Sources of safety data and statistical strategies for design and analysis: real world insights. Ther Innov Regul Sci. 2018;52(2):170–86. https://doi.org/10.1177/2168479017739270
50. Wessel D, Pogrebnyakov N. Using social media as a source of real-world data for pharmaceutical drug development and regulatory decision making. Drug Saf. 2024;47(5):495–511. https://doi.org/10.1007/s40264-024-01409-5
51. van Stekelenborg J, Ellenius J, Maskell S, Bergvall T, Caster O, Dasgupta N, et al. Recommendations for the use of social media in pharmacovigilance: lessons from IMI WEB-RADR. Drug Saf. 2019;42(12):1393–407. https://doi.org/10.1007/s40264-019-00858-7
Об авторе
Е. В. ШубниковаРоссия
Шубникова Елена Владимировна, канд. мед. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Рецензия
Для цитирования:
Шубникова Е.В. Пострегистрационный фармаконадзор: обзор открытых источников получения данных по безопасности лекарственных препаратов. Безопасность и риск фармакотерапии. 2024;12(3):309-330. https://doi.org/10.30895/2312-7821-2024-12-3-309-330
For citation:
Shubnikova E.V. Postmarketing Surveillance: Review of Open Sources of Drug Safety Data. Safety and Risk of Pharmacotherapy. 2024;12(3):309-330. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-3-309-330




































