Перейти к:
Диагностика и прогностическая оценка лекарственно-индуцированного поражения печени: каковы возможности в амбулаторных условиях? (Обзор)
https://doi.org/10.30895/2312-7821-2025-447
Резюме
ВВЕДЕНИЕ. Лекарственно-индуцированное поражение печени (ЛИПП) является распространенным осложнением при применении лекарственных препаратов и биологически активных добавок к пище, которое может приводить к жизнеугрожающим последствиям. Выявление признаков поражения печени на раннем этапе может быть затруднено при наличии полипрагмазии, коморбидности, фоновых заболеваний печени у пациента, а также в связи с неправильной трактовкой неспецифической клинической картины нарушений. Обобщение информации о возможностях диагностики и прогностической оценки ЛИПП для врачей амбулаторного звена является актуальным.
ЦЕЛЬ. Обобщение и систематизация информации о факторах риска развития, методах ранней диагностики и прогностической оценки для подготовки рекомендаций по выявлению ЛИПП в амбулаторных условиях.
ОБСУЖДЕНИЕ. Основными факторами риска, способствующими возникновению ЛИПП, являются применение потенциально гепатотоксичных лекарственных препаратов, высокая доза препарата, полипрагмазия, заболевания печени в анамнезе, генетическая предрасположенность. ЛИПП потенциально способно вызвать применение любого лекарственного препарата, но особое значение имеет осведомленность врачей амбулаторного звена о препаратах, наиболее часто индуцирующих данное состояние. При первичном скрининге повреждения печени и определения степени его тяжести необходимы тщательный сбор лекарственного анамнеза и проведение стандартных лабораторных тестов (активность аланиновой трансаминазы, аспарагиновой трансаминазы, щелочной фосфатазы, уровень общего билирубина). В амбулаторных условиях актуальным является использование шкал для выявления причинно-следственной связи между применением лекарственного препарата и развитием нарушений (CIOMS/RUCAM, M&V, DDW—J, Наранжо), а также инструментов для прогностической оценки и оценки степени тяжести ЛИПП (закон Хая). Следует учитывать, что шкала CIOMS/RUCAM подходит при подозрении на гепатоцеллюлярное или холестатическое ЛИПП, шкала M&V адаптирована также для смешанного варианта ЛИПП и позволяет учитывать внепеченочные проявления.
ВЫВОДЫ. Рекомендованный подход, включающий, помимо сбора анамнеза, осмотра, лабораторной и инструментальной диагностики, рутинное использование шкал для выявления причинно-следственной связи между приемом препарата и развитием ЛИПП и прогностической оценки состояния пациента, будет способствовать выявлению поражения печени врачами амбулаторного звена на раннем этапе и быстрому принятию решений о дальнейшем лечении.
Ключевые слова
Для цитирования:
Ганцгорн Е.В., Божко А.В., Ярченко С.В. Диагностика и прогностическая оценка лекарственно-индуцированного поражения печени: каковы возможности в амбулаторных условиях? (Обзор). Безопасность и риск фармакотерапии. 2025;13(1):58-69. https://doi.org/10.30895/2312-7821-2025-447
For citation:
Gantsgorn E.V., Bozhko A.V., Yarchenko S.V. Diagnosis and Prognostic Assessment of Drug-Induced Liver Injury: What Are the Outpatient Options? (Review). Safety and Risk of Pharmacotherapy. 2025;13(1):58-69. (In Russ.) https://doi.org/10.30895/2312-7821-2025-447
ВВЕДЕНИЕ
Во всем мире лекарственно-индуцированное поражение печени (ЛИПП) является одной из ведущих причин развития острого поражения печени и острого гепатита [1][2]. Известная ежегодная частота выявления ЛИПП в популяционных исследованиях в Европе колеблется от 2,3 до 19,1 случая на 100 тыс. населения [3][4]. По оценкам проспективного популяционного исследования, проведенного в Исландии, общая заболеваемость ЛИПП составляет 19 на 100 тыс., а частота острых серьезных повреждений печени, требующих госпитализации, оценивается в 0,7–1 на 100 тыс. населения в год [5]. В России ЛИПП выявляют у 2–5% госпитализированных пациентов на фоне применения противотуберкулезных, антибактериальных, гормональных, гипотензивных, антиаритмических, нестероидных противовоспалительных препаратов, цитостатиков и др. [4].
Ранняя диагностика ЛИПП на амбулаторном уровне затруднительна по многим причинам, основными являются полипрагмазия, коморбидность, фоновые заболевания печени, маскирующие аномальные биохимические показатели крови. Значение имеют и такие факторы, как невозможность полноценно собрать лекарственный анамнез из-за нежелания пациента сообщать врачу обо всех принимаемых ЛС (особенно в случае применения антидепрессантов, ЛС, повышающих потенцию, нейролептиков и др.)1, а также неправильная трактовка неспецифической клиники ЛИПП. Выявление ЛИПП затрудняют особенности амбулаторного приема, характеризующегося большим потоком пациентов и ограниченным временем для коммуникации между пациентом и специалистом. В таких условиях врач привыкает к наиболее частым причинам обращения за медицинской помощью, что снижает уровень настороженности в отношении других, менее распространенных, но не менее опасных состояний, в том числе ЛИПП. Однако даже в случае подозрения на ЛИПП установить лекарственный генез поражения печени крайне трудно, учитывая схожесть проявлений при острых и при хронических нарушениях и отсутствие соответствующих однозначных тестов [4]. В связи с этим необходимо обобщение имеющейся актуальной информации о возможностях диагностики и прогностической оценки ЛИПП на амбулаторном приеме.
Цель работы — обобщение и систематизация информации о факторах риска развития, методах ранней диагностики и прогностической оценки для подготовки рекомендаций по выявлению ЛИПП в амбулаторных условиях.
Поиск информации выполняли в открытых источниках научной медицинской литературы в базах данных eLIBRARY.RU, PubMed, Cochrane Library, поисковой системе Google Scholar. Для поиска использовали следующие комбинации ключевых слов и логический оператор SQL: «лекарственно-индуцированное поражение печени» ИЛИ «гепатотоксичность»; «нежелательная лекарственная реакция» ИЛИ «безопасность фармакотерапии», «причинно-следственная связь» ИЛИ «лекарственный мониторинг», «adverse drug reaction» OR «safety of pharmacotherapy»), («drug-induced liver injury» OR «hepatotoxicity») AND («cause-and-effect relationship» OR «drug monitoring»). Глубина поиска: 2015–2024 гг. В качестве релевантных источников рассматривали клинические рекомендации, полнотекстовые статьи по результатам клинических исследований, систематические обзоры и метаанализы на русском и английском языках.
ОСНОВНАЯ ЧАСТЬ
Краткие сведения о патогенезе и факторах риска, способствующих развитию ЛИПП
Патогенез ЛИПП подробно описан, он включает несколько звеньев: нарушение гепатоцеллюлярных белков-транспортеров, нарушение эвакуации желчи, нарушение регуляторной функции Toll-подобных рецепторов гепатоцитов, иммуновоспалительные реакции [6–8].
На сегодняшний день выделяют три возможных механизма ЛИПП: прямое, опосредованное (идиосинкразическое, ИЛИПП), а также непрямое ЛИПП [6][7]. Последняя категория была обозначена позже двух первых, и считается, что такой вариант развития ЛИПП связан с усугублением ранее существовавшего хронического заболевания печени (стеатогепатит, стеатоз) за счет вынужденного или неверного назначения ЛС с известным гепатотоксическим действием либо с реактивацией вирусов гепатита В и С ввиду применения иммунотропных ЛС [6]. В отношении пациентов с сопутствующим заболеванием печени, относящихся к группе риска, единственной стратегией раннего выявления ЛИПП является периодический мониторинг биохимических показателей состояния гепатоцитов. Такой контроль безопасности фармакотерапии особенно важен при терапии заведомо гепатотоксичными ЛС [9][10].
Патогенез прямого ЛИПП связан со строго дозозависимым непосредственным токсическим действием ЛС или его метаболита на гепатоцит, подвергающийся в результате некрозу или апоптозу в течение первых часов или суток с момента приема гепатотоксичного ЛС. Состояние прямого ЛИПП в 80% случаев полностью обратимо при отмене причинного ЛС [2][11].
ИЛИПП долгое время считались дозонезависимой НР, однако в ряде исследований было установлено, что для развития аллергического ЛИПП пороговая доза любого ЛС составляет более 10 мг, а для идиосинкразии — более 50 мг/ сут [3][12][13]. Такие ЛС, как тетрациклин, такрин, оксипенициллин, могут вызывать ЛИПП, частично зависимые от дозы [14].
Важным механизмом развития данного типа повреждения является гаптеновая гипотеза с активацией клеточного и гуморального иммунитета на фоне генетической предрасположенности, роль которой освещена во многих работах и продолжает активно изучаться [15–17]. Такое ЛИПП может сохраняться в течение полугода и прогрессировать вплоть до смерти пациента, несмотря на отмену ЛС.
Описанные вероятные сценарии поражения печени указывают на важную роль таких факторов риска развития ЛИПП, как доза лекарственного препарата, заболевания печени в анамнезе и генетическая предрасположенность. Генетический фактор сложно учесть без проведения специальных генетических исследований. Но врача должны насторожить такие факторы, как продолжительность приема ЛС, применение препарата в высокодозовом режиме, негативные изменения состояния после приема нового для пациента препарата, ожирение, а также фоновые заболевания печени, ВИЧ и аутоиммунные заболевания в анамнезе. Роль возраста в развитии ЛИПП до конца не выяснена. В данном вопросе более важное значение имеет другой, характерный в первую очередь для пожилых пациентов фактор риска — полипрагмазия [18]. При развившемся ЛИПП требуется назначение гепатопротекторов, что само по себе усиливает феномен полипрагмазии по типу цепной реакции. С другой стороны, в ряде случаев необходимо назначение заведомо токсичных ЛС в структуре агрессивной схемы лечения (например, в составе полихимиотерапии, при фармакотерапии туберкулеза, системных заболеваниях соединительной ткани). В таких ситуациях обоснованная политерапия обусловлена жизненной необходимостью, и необходима тщательная оценка соотношения «польза–риск» назначенных ЛС клиницистом, в том числе врачом — клиническим фармакологом [17–20].
Лекарственные средства, наиболее часто вызывающие ЛИПП
ЛИПП потенциально способно вызвать любое ЛС, но наибольшее практическое значение имеет осведомленность врачей амбулаторного звена о ЛС, наиболее часто индуцирующих данное состояние. В таблице 1 представлен перечень таких ЛС в зависимости от патогенетического варианта токсического воздействия на гепатоциты.
Таблица 1. Патогенетическая классификация лекарственных средств, наиболее часто индуцирующих развитие лекарственно-индуцированного поражения печени (цит. по [4][21] с изм.)
Table 1. Pathogenetic classification of medicines that most often cause drug-induced liver injury (adapted from [4][21])
|
Вариант лекарственно-индуцированного повреждения печени Type of drug-induced liver injury |
Лекарственное средство или группа лекарственных средств Medicine or group of medicines |
|
|
Прямое Direct |
Парацетамол, амиодарон, вальпроевая кислота, статины, никотиновая кислота, ацетилсалициловая кислота, препараты для химиотерапии, фиалуридин, метотрексат, растения, содержащие пирролизидиновые алкалоиды, метилдопа Paracetamol (acetaminophen), amiodarone, valproic acid, statins, nicotinic acid, acetylsalicylic acid, chemotherapies, fialuridine, methotrexate, plants containing pyrrolizidine alkaloids, methyldopa |
|
|
Идиосинкразическое Idiosyncratic |
Без указания типа No type specified |
Изониазид, рифампицин, макролиды, фторхинолоны, статины, нестероидные противовоспалительные средства Isoniazid, rifampicin, macrolides, fluoroquinolones, statins, non-steroidal anti-inflammatory drugs |
|
Холестатическое Cholestatic |
Амоксициллин+клавулановая кислота, триметоприм, азатиоприн, эналаприл, метилдопа, комбинированные оральные контрацептивы, глибенкламид Amoxicillin+clavulanic acid, trimethoprim, azathioprine, enalapril, methyldopa, combined oral contraceptives, glibenclamide |
|
|
Гепатоцеллюлярное Hepatocellular |
Изониазид, нитрофурантоин, ламотриджин, интерферон-8, ингибиторы фактора некроза опухоли, ингибиторы протонной помпы, эналаприл, флуконазол, метронидазол Isoniazid, nitrofurantoin, lamotrigine, interferon 8, tumour necrosis factor inhibitors, proton-pump inhibitors, enalapril, fluconazole, metronidazole |
|
|
Смешанное Mixed |
Кларитромицин, фенитоин, карбамазепин, сульфасалазин Clarithromycin, phenytoin, carbamazepine, sulfasalazine |
|
|
Непрямое Indirect |
Азатиоприн, анаболические стероиды, тамоксифен, амиодарон Azathioprine, anabolic steroids, tamoxifen, amiodarone |
|
Таблица составлена авторами / The table is prepared by the authors
Большое значение имеет повышение информированности как специалиста, так и пациента о ЛС, наиболее часто вызывающих ЛИПП. При назначении в амбулаторном режиме ЛС (табл. 1) следует регулярно контролировать активность печеночных ферментов. Если подозреваемым является ЛС, которому не свойственна выраженная гепатотоксичность, решающее значение имеют настороженность врача и его алгоритмически выстроенные действия, направленные на установление ЛИПП как диагноза исключения.
Возможности выявления и прогностической оценки ЛИПП в амбулаторных условиях
Обсуждать вероятность наличия у пациента ЛИПП (в том числе при приеме биологически активных добавок к пище) следует, если наблюдается2:
- повышение активности аланиновой трансаминазы (АЛТ) >2 верхних границ нормы (ВГН);
- или повышение уровня связанного билирубина >2 ВГН;
- или сочетание повышения активности аспарагиновой трансаминазы (АСТ), щелочной фосфатазы (ЩФ) и уровня общего билирубина (один из показателей >2 ВГН).
Варианты паренхиматозного повреждения печени дифференцируют в зависимости от изменений биохимических показателей3: гепатоцеллюлярный тип характеризуется повышением активности АЛТ >2 ВГН или соотношение АЛТ/ЩФ ≥5; холестатический тип — ЩФ >2 ВГН или соотношение АЛТ/ЩФ ≤2; смешанный тип — АЛТ >2 ВГН и ЩФ >2 ВГН, а соотношение АЛТ/ ЩФ от 2 до 5.
Для диагностики и прогностической оценки ЛИПП разработаны различные инструменты.
Оценка причинно-следственной связи
Шкала CIOMS/RUCAM (Council for the International Organisation of Medical Sciences / Roussel Uclaf Causality Assessment Method) используется для оценки причинно-следственной связи при ЛИПП4 [22], позволяет оценить вероятность поражения печени гепатоцеллюлярного и холестатического типов на основании оценки по 7 критериям. Каждому критерию соответствует определенное количество баллов, которые суммируются, и сумма баллов позволяет интерпретировать каждый рассматриваемый случай. Шкала проста для использования и информативна (чувствительность шкалы — 86%, специфичность — 89%) [10][18]. Наиболее актуальная версия шкалы RUCAM валидирована в электронном варианте и существует в виде онлайн-калькулятора5, позволяющего быстро провести расчеты по результатам опроса пациента и проведенного обследования, использование которого значительно экономит время специалиста.
Наличие причинно-следственной связи между применением препарата и развитием поражения печени по шкале RUCAM оценивают по 7 критериям.
- Время появления от начала приема лекарственного препарата или биологически активной добавки к пище.
- Динамика активности АЛТ после прекращения приема лекарственного/растительного препарата (при подозрении на гепатоцеллюлярное ЛИПП), динамика активности ЩФ после прекращения приема лекарственного/растительного препарата (при подозрении на холестатическое ЛИПП) — процентная разница между пиком и верхней границей нормы.
- Факторы риска (употребление алкоголя, возраст ≥55 лет).
- Сопутствующая терапия лекарственными препаратами или биологически активными добавками к пище.
- Поиск других причин поражения печени.
- Есть ли предшествующая информация о гепатотоксичности лекарственного препарата или биологически активной добавки к пище.
- Появилась ли реакция на преднамеренное повторное воздействие.
Интерпретация результатов: 0 баллов — отсутствие связи между применением лекарственного препарата и поражением печени; 1–2 балла — маловероятная связь; 3–5 баллов — возможная связь; 6–8 баллов — вероятная связь; >9 баллов — определенная или высоковероятная связь.
Основные ограничения и требования по использованию шкалы RUCAM: шкала исключает случаи, когда поражение печени возникло до начала применения ЛС; применима только при остром повреждении печени, а не при существовавшем ранее хроническом заболевании печени; объективная оценка по шкале не выполнима, если ЩФ повышена по причинам, не связанным с печенью; итоговый балл рассчитывается отдельно для каждого совместно применяемого ЛС; конечную причинно-следственную связь следует относить к ЛС с наивысшим баллом, полученным по шкале [23][24].
С целью улучшения эффективности шкалы RUCAM была разработана шкала M&V (Maria & Victorino System of Causality Assessment in Drug-Induced Liver Injury)6, которая позволяет учесть внепеченочные проявления ЛИПП (табл. 2). При прямом сравнении «высоковероятные» в системе RUCAM обычно интерпретируются как эквивалентные «определенным» в системе M&V. Информативность шкалы M&V подтверждена мнением экспертов: при сопоставлении результатов оценки, проведенной с использованием шкалы M&V, с оценками внешних экспертов уровень совпадений составил около 84%. ЛС, присутствующим на рынке более 5 лет и не имеющим документально подтвержденного потенциала гепатотоксичности, присваиваются более низкие баллы [3][7].
Таблица 2. Шкала M&V (Maria & Victorino) для оценки причинно-следственной связи между применением препарата и развитием поражения печени (цит. по данным8 с изм.)
Table 2. Maria and Victorino (M&V) System of Causality Assessment in Drug-Induced Liver Injury (adapted from8)
|
Показатель Parameter |
Балл Score |
|
1. Временнáя связь между приемом лекарственного препарата и развитием клинической картины 1. Temporal relationship between the administration of a medicinal product and the onset of clinical manifestations |
|
|
А. Время от приема препарата до появления первых клинических или лабораторных проявлений А. Time from the medicinal product administration to the first clinical or laboratory manifestation |
|
|
от 4 сут до 8 недель (или менее 4 сут в случае повторного приема) 4 days to 8 weeks (or less than 4 days for re-exposure) |
3 |
|
менее 4 сут или более 8 недель less than 4 days or more than 8 weeks |
1 |
|
Б. Время от отмены препарата до появления проявлений B. Time from the medicinal product discontinuation to the onset of manifestations |
|
|
0–7 сут 0 to 7 days |
3 |
|
от 8 до 15 сут 8 to 15 days |
0 |
|
более 15 сут (за исключением препаратов, длительно присутствующих в организме, например амиодарон) more than 15 days (except for medicinal products that have prolonged persistence in the body after discontinuation (e.g., amiodarone) |
–3 |
|
В. Время от отмены препарата до нормализации лабораторных показателей C. Time from the medicinal product discontinuation to the normalisation of laboratory values |
|
|
менее 6 мес. (холестатическая или смешанная формы) или 2 мес. (гепатоцеллюлярная форма) less than 6 months (cholestatic or mixed forms) or 2 months (hepatocellular form) |
3 |
|
более 6 мес. (холестатическая или смешанная форма) или 2 мес. (гепатоцеллюлярная форма) more than 6 months (cholestatic or mixed forms) or 2 months (hepatocellular form) |
0 |
|
2. Исключение альтернативных причин 2. Exclusion of alternative causes |
|
|
Вирусный гепатит (HAV, HBV, HCV, CMV, EBV), алкогольная болезнь печени, обструкция желчных протоков, предшествующее заболевание печени, другое (беременность, острая гипотония): использовать подходящие в конкретном случае критерии исключения Viral hepatitis (HAV, HBV, HCV, CMV, and EBV), alcoholic liver disease, biliary obstruction, pre-existing liver disease, other (pregnancy, acute hypotension): use the exclusion criteria considered appropriate in each case |
|
|
полное исключение complete exclusion |
3 |
|
частичное исключение partial exclusion |
0 |
|
обнаружена возможная альтернативная причина possible alternative cause detected |
–1 |
|
обнаружена вероятная альтернативная причина probable alternative cause detected |
–3 |
|
3. Внепеченочные проявления 3. Extrahepatic manifestations |
|
|
Сыпь, лихорадка, артралгии, эозинофилия (>6%), цитопения Rash, fever, arthralgias, eosinophilia (>6%), cytopenia |
|
|
4 или более проявлений 4 or more |
3 |
|
2 или 3 проявления 2 or 3 manifestations |
2 |
|
1 проявление 1 manifestation |
1 |
|
ни одного проявления none |
0 |
|
4. Преднамеренное или случайное повторное воздействие препарата 4. Intentional or accidental re-exposure to the medicinal product |
|
|
Положительный повторный тест Positive rechallenge test |
3 |
|
Отрицательный или отсутствующий повторный тест Negative or absent rechallenge test |
0 |
|
5. Предыдущие сообщения в литературе о случаях поражения печени, связанных с приемом лекарственного препарата 5. Previously published reports of drug-induced liver injury associated with the medicinal product |
|
|
Имеются Yes |
2 |
|
Отсутствуют (препараты находятся в обращении в течение 5 лет) No (medicinal products marketed for up to 5 years) |
0 |
|
Отсутствуют (препараты находятся в обращении более 5 лет) No (medicinal products marketed for more than 5 years) |
–3 |
|
Интерпретация результатов / Score interpretation До 6 баллов — связь между применением лекарственного препарата и поражением печени исключена / <6: causality between the medicinal product and drug-induced liver injury is excluded 6–9 баллов — маловероятная связь / 6 to 9: causality is unlikely 10–13 баллов — возможная связь / 10 to 13: causality is possible 14–17 баллов — вероятная связь / 14 to 17: causality is probable Более 17 баллов — определенная связь / >17: causality is definite |
|
Таблица адаптирована авторами / The table is adapted by the authors
В то же время при проведении дополнительного анализа было обнаружено, что полное соответствие результатов при оценке причинно-следственной связи по шкалам M&V и RUCAM было достигнуто только в 18% случаев. Перечень показателей шкалы M&V и их относительный вес были сформулированы на основе экспертного мнения, а не по результатам всесторонней оценки многих критериев7.
Шкала DDW—J (Digestive Disease Week–Japan), предложенная в Японии, представляет собой некоторую модификацию шкалы CIOMS/RUCAM. Данная шкала позволяет учитывать возможные модификации хронологических критериев, вызванные применением сопутствующих ЛС, а также внепеченочные проявления. При оценке вероятности развития ЛИПП используется тест лекарственной стимуляции лимфоцитов in vitro. По результатам оценки вероятность причинно-следственной связи между применением ЛС и развитием ЛИПП характеризуется как определенная, вероятная и маловероятная. Шкала DDW—J имеет высокие показатели специфичности и чувствительности (более 90%), однако доступ к ее рутинному использованию ограничен ввиду технической сложности и трудоемкости проведения тестов [17].
Однозначно полезным и нетрудоемким процессом является опрос пациента по стандартной шкале Наранжо, позволяющей выявить наличие причинно-следственной связи между развившейся нежелательной реакцией и применением лекарственного препарата.
Связь может быть оценена как сомнительная (0 баллов из 9), возможная (1–4 балла), вероятная (5–8 баллов) и определенная (9 баллов). Опрос пациента по шкале Наранжо является быстрым и нетрудоемким шагом на пути диагностики лекарственно-индуцированного повреждения и выявления ЛС, вызвавшего нарушение, но не имеет специфичности в отношении ЛИПП [24].
Прогностическая оценка
Закона Хая — доступный метод прогностической оценки, представляет собой эмпирическую закономерность, согласно которой у пациента имеется высокий риск летального ЛИПП, если ЛС вызывает гепатоцеллюлярное, а не холестатическое повреждение. В соответствии с законом Хая маркерами тяжелой формы ЛИПП являются:
1) гепатоцеллюлярное нарушение, которое обычно проявляется превышением ВГН АЛТ или АСТ в 3 или более раза (иногда и в 5–10 раз);
2) превышение ВНГ общего билирубина сыворотки крови в 2 и более раза без застоя желчи (определяется как менее чем 2-кратное превышение ВГН ЩФ) при отсутствии обструкции билиарных путей или синдрома Жильбера;
3) отсутствуют иные причины (вирусный гепатит, алкоголизм, ранее выявленное заболевание печени) развития имеющейся лабораторной картины.
Подобная ситуация является маркером тяжелой формы ЛИПП, характеризующегося неблагоприятным прогнозом и уровнем летальности около 10% [25].
Для большей прогностической ценности закон Хая был модернизирован с повышением специфичности выявления острой печеночной недостаточности на 20%. Это было достигнуто за счет лабораторного контроля не АЛТ в отдельности, а отношения кратности превышения ВГН АЛТ (или АСТ, в зависимости от того, активность какого фермента изначально повышена в большей степени) к кратности превышения ВГН ЩФ. При значении этого отношения равном 5 и более имеется высокий риск развития острой печеночной недостаточности. Данный подход в большей степени применим для случаев гепатоцеллюлярного ЛИПП, поскольку предполагается, что при холестатических случаях риск развития острой печеночной недостаточности гораздо ниже [26].
Подходы к выявлению ЛИПП в амбулаторных условиях
В связи с неспецифической клинической картиной ЛИПП, которая может напоминать практически любую патологию печени, в том числе псевдохирургическую [18][27], целесообразным является использование следующего диагностического подхода к выявлению ЛИПП и дальнейшей маршрутизации пациентов:
- Сбор жалоб и анамнеза, в том числе информации о принимаемых ЛС, с последующей оценкой их гепатотоксичного потенциала по базе LiverTox9.
- Врачебный осмотр (цвет кожных покровов, склер, размеры печени, наличие кожной сыпи, проведение проб на симптом раздражения брюшины).
- Лабораторная и инструментальная диагностика с целью исключения поражения печени нелекарственного генеза (рис. 1).
- Установление причинно-следственной связи между приемом препарата и развитием ЛИПП с использованием шкалы CIOMS/RUCAM является обязательным в соответствии с клиническими рекомендациями10, а также M&V, DDW—J, Наранжо.
- Оценка функционального статуса печени по классификации Чайлда–Пью11для случаев с известным фоновым циррозом печени.
- Прогностическая оценка с помощью закона Хая.
- Вывод об исключении ЛИПП или установка диагноза ЛИПП (с включением в него наименования ЛС, применение которого вызвало поражение печени), клинического варианта ЛИПП, формы (острое или хроническое), показателя по шкале RUCAM и степени тяжести ЛИПП (табл.3) [16][28].
- Незамедлительная отмена ЛС с назначением соответствующего лечения согласно клиническим рекомендациям12. Лечение в амбулаторных условиях проводят при ЛИПП легкой и умеренной степени тяжести.
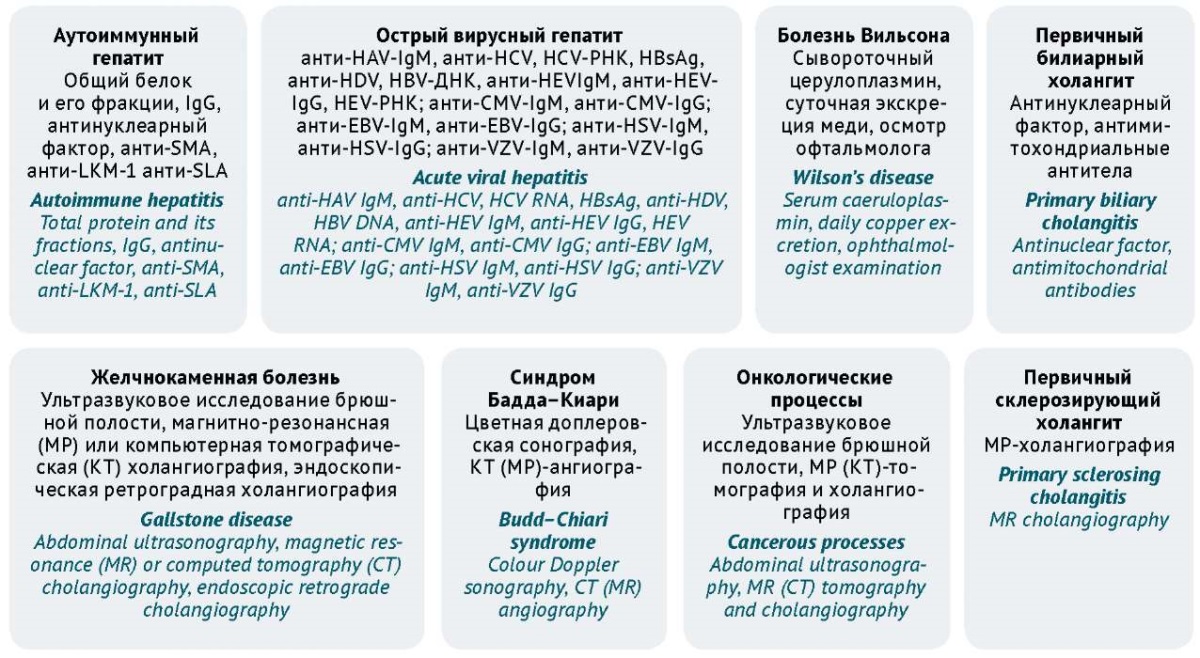
Рисунок подготовлен авторами по данным клинических рекомендаций13 / The figure is prepared by the authors using clinical recommendations13
Рис. 1. Основные исследования для дифференциальной диагностики лекарственного поражения печени. CMV — цитомегаловирус; EBV — вируса Эпштейна–Барр; HSV — вирус простого герпеса; HEV — вирус гепатита E; HAV — вирус гепатита А; HBV — вирус гепатита B; HСV — вирус гепатита С; HDV — вирус гепатита D; HBsAg — поверхностный антиген вируса гепатита В; VZV — вирус Varicella-zoster (ветряной оспы и опоясывающего лишая); анти-SMA — антитела к гладким мышцам; анти-LKM-1 — антитела к почечно-печеночным микросомам, тип 1; анти-SLA — антитела к растворимому печеночному антигену
Fig. 1. Basic tests used in the differential diagnosis of drug-induced liver injury. CMV, cytomegalovirus; EBV, Epstein–Barr virus; HSV, herpes simplex virus; HEV, hepatitis E virus; HAV, hepatitis A virus; HBV, hepatitis B virus; HCV, hepatitis C virus; HDV, hepatitis D virus; HbsAg, hepatitis B virus surface antigen; VZV, Varicella-zoster virus (varicella and herpes zoster); anti-SMA, anti-smooth muscle antibodies; anti-LKM-1, antibodies to liver and kidney microsomes, type 1; anti-SLA, antibodies to soluble liver antigen
Таблица 3. Классификация лекарственно-индуцированного поражения печени по степени тяжести (по Drug-Induced Liver Injury Network, DILIN [16][29])
Table 3. Drug-induced liver injury classification by severity (based on Drug-Induced Liver Injury Network, DILIN [16][29])
|
Категория Category |
Степень тяжести Severity |
Критерии диагностики Diagnostic criteria |
|
1 |
Легкая Mild |
Повышение активности АЛТ и/или ЩФ, при этом уровень ОБ <42 мкмоль/л и МНО <1,5 Elevated ALT/ALP, total bilirubin <42 µmol/L, and INR <1.5 |
|
2 |
Умеренная Moderate |
Повышение активности АЛТ и/или ЩФ, при этом уровень ОБ >42 мкмоль/л и МНО >1,5 Elevated ALT/ALP, total bilirubin >42 µmol/L, and INR >1.5 |
|
3 |
Тяжелая Severe |
Повышение активности АЛТ, ЩФ, уровня ОБ или МНО, госпитализация в связи с развитием ЛИПП (продление существовавшей госпитализации из-за ЛИПП). Повышение активности АЛТ и/или ЩФ, уровня ОБ >42 мкмоль/л и есть одно из следующего: · печеночная недостаточность (МНО >1,5, асцит или энцефалопатия), · отказ другого органа (почек или легких) вследствие ЛИПП Elevated ALT, ALP, total bilirubin, or INR, hospitalisation (hospitalisation extension) due to DILI. Elevated ALT/ALP, total bilirubin >42 µmol/L, and one of the following: · liver failure (INR >1.5, ascites, or encephalopathy), · other organ (kidney or lung) failure due to DILI |
|
4 |
Фатальная или требующая трансплантации Fatal or requiring transplantation |
Летальный исход или трансплантация печени Death or liver transplantation |
Таблица составлена авторами / The table is prepared by the authors
Примечание. АЛТ — аланиновая трансаминаза; ЩФ — щелочная фосфатаза; ОБ — общий билирубин; МНО — международное нормализованное отношение; ЛИПП — лекарственно-индуцированное поражение печени.
Note. ALT, alanine transaminase; ALP, alkaline phosphatase; INR, international normalised ratio; DILI, drug-induced liver injury.
Критериями, усиливающими подозрение на лекарственный генез поражения печени, являются: аллергическая реакция на ЛС в анамнезе, улучшение или ухудшение состояния пациента после отмены или непредвиденного повторного приема ЛС соответственно, высокий балл по шкале RUCAM. Врач не должен пренебрегать контролем безопасности применения заведомо гепатотоксичных ЛС, а в случае отклонения от нормы биохимических показателей для оценки функции печени важны своевременные последовательные действия по выявлению этиологии [30][31].
Использование диагностических шкал и прогностических инструментов, описанных выше, в практике специалиста амбулаторного звена может быть затруднено ввиду ограниченного времени приема пациента, а также возможностей конкретного медицинского учреждения (как лабораторного, так и инструментального оснащения). В то же время при проведении оценки по той или иной шкале необходим однозначный ответ на вопрос о наличии сопутствующих заболеваний печени, поэтому неполное обследование пациента может повлиять на количество баллов и стать причиной получения некорректного результата. Врачам следует учитывать, что при наличии внепеченочных проявлений наиболее информативной среди рассмотренных шкал будет шкала M&V, а в сомнительных ситуациях следует прибегать к помощи врачей — клинических фармакологов.
Необходимо подчеркнуть, что оценка тяжести ЛИПП и прогноз его течения определяют дальнейшее ведение пациента. При тяжелом течении ЛИПП с развитием печеночно-клеточной недостаточности, выраженной клинической симптоматикой (рвота, обезвоживание, кровотечения, признаки печеночной энцефалопатии), с неблагоприятным прогнозом показана госпитализация пациента [18][21].
ЗАКЛЮЧЕНИЕ
ЛИПП — диагноз исключения, возможность постановки которого в амбулаторных условиях в значительной степени определяется способностью специалиста к доверительной коммуникации с пациентом для получения необходимых анамнестических данных. Прогноз течения и исхода ЛИПП зависит от его ранней диагностики, что возможно лишь при высокой клинической настороженности. Для быстрого принятия решения врачу необходимо знать факторы риска развития ЛИПП, а также ЛС, наиболее часто его вызывающие. При неоднозначных ситуациях дифференциальная диагностика становится единственным способом подтвердить наличие ЛИПП.
Действующие клинические рекомендации и практические руководства подчеркивают, что в большинстве случаев наблюдение и лечение пациентов с ЛИПП проводится в амбулаторных условиях, а госпитализация показана при неясных случаях ЛИПП, требующих дополнительных диагностических исследований, и при ЛИПП тяжелой формы. Учитывая, что ЛИПП — диагноз исключения, словосочетание «неясный случай» невозможно интерпретировать однозначно, и решающее значение в правильном ведении пациента все же имеет исключение других этиологий, повреждающих печень.
В амбулаторных условиях может отсутствовать возможность проведения в краткие сроки лабораторно-инструментального исследования пациента в полном объеме. Поэтому актуальным является рутинное использование шкал для оценки причинно-следственной связи между применением ЛС и развитием повреждения печени, а также шкал прогностической оценки и оценки степени тяжести ЛИПП. Следует учитывать специфику этих диагностических инструментов: шкала RUCAM подходит при подозрении на гепатоцеллюлярное холестатическое/смешанное ЛИПП, тогда как при наличии внепеченочных проявлений информативней окажется шкала M&V. Прогностические шкалы позволяют оценить тяжесть состояния пациента и определить дальнейшую маршрутизацию пациента.
Ограниченное взаимодействие «врач — амбулаторный пациент» является фактором, затрудняющим раннее выявление ЛИПП вне стационара. Ключом к решению данной проблемы являются повышение информированности как специалиста, так и пациента о ЛС, наиболее часто вызывающих ЛИПП, а также настороженности по поводу возможности идиосинкразической альтерации печени при применении любого ЛС. Осуществление этих мер, по нашему мнению, будет способствовать раннему выявлению ЛИПП, что имеет важнейшее прогностическое значение для пациента.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.В. Ганцгорн — концепция исследования, сбор и анализ данных литературы, написание и редактирование текста рукописи; А.В. Божко — концепция исследования, сбор и анализ данных литературы, критический пересмотр содержания рукописи; С.В. Ярченко — сбор и анализ данных литературы, редактирование текста рукописи.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Elena V. Gantsgorn conceptualised the study, collected and analysed literature, drafted and edited the manuscript. Andrey V. Bozhko conceptualised the study, collected and analysed literature, and critically revised the manuscript. Svetlana V. Yarchenko collected and analysed literature, edited the manuscript.
1. Лекарственные поражения печени (ЛПП) у взрослых. Клинические рекомендации. Минздрав России; 2022.
2. Лекарственные поражения печени (ЛПП) у взрослых. Клинические рекомендации. Минздрав России; 2022.
3. Там же.
4. Там же.
5. https://clincasequest.org/rucam-scale/
6. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury. Maria and Victorino (M&V) System of Causality Assessment in Drug Induced Liver Injury. 2012. https://www.ncbi.nlm.nih.gov/books/NBK547853/
7. Там же.
8. LiverTox: Clinical and research information on drug-induced liver injury. Maria and Victorino (M&V) System of Causality Assessment in Drug Induced Liver Injury. 2012. https://www.ncbi.nlm.nih.gov/books/NBK547853/
9. https://www.ncbi.nlm.nih.gov/books/NBK547852/
10. Лекарственные поражения печени (ЛПП) у взрослых. Клинические рекомендации. Минздрав России; 2022.
11. Там же.
12. Там же.
13. Лекарственные поражения печени (ЛПП) у взрослых. Клинические рекомендации. Минздрав России; 2022.
Список литературы
1. Коренская ЕГ, Парамонова ОВ. Лекарственные поражения печени — одна из важных проблем у коморбидного пациента. Consilium Medicum. 2019;21(8):78–83. https://doi.org/10.26442/20751753.2019.8.190355
2. European Association for the Study of the Liver. EASL clinical practice guidelines: Drug-induced liver injury. J Hepatol. 2019;70(6):1222–61. https://doi.org/10.1016/j.jhep.2019.02.014
3. Devarbhavi H, Asrani SK, Arab JP, Nartey YA, Pose E, Kamath PS. Global burden of liver disease: 2023 update. J Hepatol. 2023;79(2):516–37. https://doi.org/10.1016/j.jhep.2023.03.017
4. Маев ИВ, Полунина ТЕ. Лекарственные повреждения печени: диагноз исключения. Терапевтический архив. 2023;95(8):611–20. https://doi.org/10.26442/00403660.2023.08.202329
5. Aithal GP, Kulkarni AV. Drug-induced liver injury. Medicine. 2023;51(5):342–6. https://doi.org/10.1016/j.mpmed.2023.02.006
6. Hoofnagle JH, Björnsson ES. Drug-induced liver injury — types and phenotypes. N Engl J Med. 2019;381(3):264–73. https://doi.org/.1056/NEJMra1816149
7. Nedashkivskyi SM. Drug-induced liver damage: Principles of diagnosis, pathological changes and approaches to treatment. Emergency Medicine. 2019;97(2):63–70. https://doi.org/10.22141/2224-0586.2.97.2019.161644
8. Jee A, Sernoskie SC, Uetrecht J. Idiosyncratic drug-induced liver injury: Mechanistic and clinical challenges. Int J Mol Sci. 2021;22(6):2954. https://doi.org/10.3390/ijms22062954
9. Kwon J, Kim S, Yoo H, Lee E. Nimesulide-induced hepatotoxicity: A systematic review and meta-analysis. PLoS One. 2019;14(1):e0209264. https://doi.org/10.1371/journal.pone.0209264
10. Ниёзова ШХ. Гепатотоксический синдром на фоне полихимиотерапии солидных опухолей и современные возможности его коррекции (обзор литературы). Вестник науки и образования. 2019;(17):73–6. https://doi.org/10.24411/2312-8089-2019-11704
11. Мехтиев СН, Зиновьева СН, Мехтиева ОА. Лекарственные поражения печени при многокомпонентной терапии коморбидных состояний. Экспериментальная и клиническая гастроэнтерология. 2015;6(118):71–7. EDN: UHYNMN
12. Björnsson ES, Bergmann OM, Björnsson HK, Kvaran RB, Olafsson S. Incidence, presentation and outcomes in patients with drug-induced liver injury in the general population of Iceland. Gastroenterology. 2013;144(7):1419–25. https://doi.org/10.1053/j.gastro.2013.02.006
13. Lancaster EM, Hiatt JR, Zarrinpar A. Acetaminophen hepatotoxicity: An updated review. Arch Toxicol. 2015;89(2):193–9. https://doi.org/10.1007/s00204-014-1432-2
14. Байкова ИЕ, Никитин ИГ. Лекарственное поражение печени. РМЖ. 2009;1:4–10.
15. Безвуляк ЕИ, Башарин ВА, Епифанцев АВ, Куценко ВП, Селиверстов ПВ. Возможности профилактики токсического лекарственно-индуцированного поражения печени при химиотерапии онкологических заболеваний. Медицинский совет. 2020;(5):42–9. https://doi.org/10.21518/2079-701X-2020-5-42-49
16. Aithal GP, Nicoletti P, Björnsson E. HLAA*33:01 is strongly associated with drug-induced liver injury (DILI) due to terbinafine and several other unrelated compounds. Hepatology. 2015;65( 1):325–26. https://doi.org/10.1002/hep.28203
17. Sandhu N, Navarro V. Drug-induced liver injury in GI practice. Hepatol Commun. 2020;4(5):631–45. https://doi.org/10.1002/hep4.1503
18. Лазебник ЛБ, Голованова ЕВ, Хлынова ОВ, Алексеенко СА, Арямкина ОЛ, Бакулин ИГ и др. Лекарственные поражения печени (ЛИПП) у взрослых. Экспериментальная и клиническая гастроэнтерология. 2020;174(2):29–54. https://doi.org/10.31146/1682-8658-ecg-174-2-29-54
19. Yu YC, Mao YM, Chen CW, Chen JJ, Chen J, Cong WM, et al. CSH guidelines for the diagnosis and treatment of drug-induced liver injury. Hepatol Int. 2017;11(3):221–41. https://doi.org/10.1007/s12072-017-9793-2
20. Yang WN, Pang LL, Zhou JY, Qiu YW, Miao L, Wang SY, et al. Single-nucleotide polymorphisms of HLA and Polygonum multiflorum-induced liver injury in the Han Chinese population. World J Gastroenterol. 2020;26(12):1329–39. https://doi.org/10.3748/wjg.v26.i12.1329
21. Яковенко ЭП, Агафонова НА, Яковенко АВ, Иванов АН, Ковтун АВ. Патогенетический подход к выбору гепатопротекторов в терапии лекарственно-индуцированных поражений печени. Лечебное дело. 2017;(2):34–40. EDN: YZKMZN
22. Danan G, Teschke R. RUCAM in drug and herb induced liver injury: The update. Int J Mol Sci. 2015;17(1):14. https://doi.org/10.3390/ijms17010014
23. Буеверов АО. Лекарственные поражения печени: проблема, не теряющая актуальности. Доктор.Ру. 2016;2(119):57–64.
24. Ortega-Alonso A, Stephens C, Lucena MI, Andrade RJ. Case characterization, clinical features and risk factors in drug-induced liver injury. Int Mol Sci. 2016;17(5):714. https://doi.org/10.3390/ijms17050714
25. Суханов ДС, Тимофеев ЕВ, Алексеева ЮС, Азовцев ДЮ. Лекарственные поражения печени при туберкулезе. Механизмы развития и методы диагностики. Juvenis Scientia. 2023;1(9):24–42. https://doi.org/10.32415/jscientia_2023_9_1_24-42
26. Robles-Diaz M, Lucena MI, Kaplowitz N, Stephens C, Medina-Cáliz I, González-Jimenez A et al. Use of Hy’s law and a new composite algorithm to predict acute liver failure in patients with drug-induced liver injury. Gastroenterology. 2014;147(1):109–118.e5. https://doi.org/10.1053/j.gastro.2014.03.050
27. Губергриц НБ, Беляева НВ, Клочков АЮ. Лекарственное поражение печени: от патогенеза к лечению. Вестник клуба панкреатологов. 2020;46(1):72–80. EDN: HUVKED
28. Pessayre D, Larrey D. Drug-induced liver injury. In: Rodés J, Benhamou J–P, Blei A, Reichen J, Rizzetto M, eds. Textbook of hepatology: From basic science to clinical practice. Blackwell Publishing; 2007. P. 1211–77. https://doi.org/10.1002/9780470691861.ch14a
29. Aithal GP, Watkins PB, Andrade RJ, Larrey D, Molokhia M, Takikawa H, et al. Case definition and phenotype standardization in drug-induced liver injury. Clin Pharmacol Ther. 2011;89(6):806–15. https://doi.org/10.1038/clpt.2011.58
30. Ганцгорн ЕВ, Арчакова МА, Манвелян РМ, Маллеев ИМ, Антонян БГ, Дзангиев ИИ и др. Клинический случай карбамазепин-индуцированного гепатита. Экспериментальная и клиническая фармакология. 2024;87(1):21–4. https://doi.org/10.30906/0869-2092-2024-87-01-21-24
31. Мазеркина ИА. Идиосинкратическая лекарственная гепатотоксичность — от патогенеза к снижению риска. Безопасность и риск фармакотерапии. 2023;11(2):204–14. https://doi.org/10.30895/2312-7821-2023-11-2-204-214
Об авторах
Е. В. ГанцгорнРоссия
Ганцгорн Елена Владимировна, канд. мед. наук, доцент
Нахичеванский пер., д. 29, Ростов-на-Дону, 344022;
ул. Ларина, д. 6, г. Ростов-на-Дону, 344068
А. В. Божко
Россия
Божко Андрей Викторович, канд. мед. наук
Нахичеванский пер., д. 29, Ростов-на-Дону, 344022;
ул. Ларина, д. 6, г. Ростов-на-Дону, 344068
С. В. Ярченко
Россия
Ярченко Светлана Вячеславовна
ул. Ларина, д. 6, г. Ростов-на-Дону, 344068
Дополнительные файлы
Рецензия
Для цитирования:
Ганцгорн Е.В., Божко А.В., Ярченко С.В. Диагностика и прогностическая оценка лекарственно-индуцированного поражения печени: каковы возможности в амбулаторных условиях? (Обзор). Безопасность и риск фармакотерапии. 2025;13(1):58-69. https://doi.org/10.30895/2312-7821-2025-447
For citation:
Gantsgorn E.V., Bozhko A.V., Yarchenko S.V. Diagnosis and Prognostic Assessment of Drug-Induced Liver Injury: What Are the Outpatient Options? (Review). Safety and Risk of Pharmacotherapy. 2025;13(1):58-69. (In Russ.) https://doi.org/10.30895/2312-7821-2025-447




































