Перейти к:
Выбор релевантных видов животных для проведения доклинических исследований безопасности лекарственных средств: обзор
https://doi.org/10.30895/2312-7821-2025-460
Резюме
ВВЕДЕНИЕ. Использование релевантных видов экспериментальных животных для проведения доклинических исследований безопасности при разработке нового лекарственного средства позволяет получить значимую информацию для оценки пользы и риска применения препарата у человека. Выбор подходящих видов включает рассмотрение научных, этических и практических аспектов и требует тщательного обоснования. В нормативных документах Евразийского экономического союза (ЕАЭС) содержатся указания на необходимость проведения доклинических исследований безопасности лекарственных средств с использованием релевантных животных, однако имеющиеся рекомендации являются недостаточными. Актуально определение значимых критериев выбора видов экспериментальных животных на основании анализа международных нормативных документов по доклиническим исследованиям и рекомендаций научного сообщества.
ЦЕЛЬ. Анализ нормативной правовой и научно-методической базы, определение ключевых факторов и критериев для обоснования выбора релевантных видов экспериментальных животных при проведении доклинических исследований безопасности лекарственных средств.
ОБСУЖДЕНИЕ. Проанализированы руководства ЕАЭС, Международного совета по гармонизации технических требований к фармацевтическим препаратам для использования человеком (ICH), Европейского агентства по лекарственным средствам (EMA), регламентирующие доклинические исследования, и научные публикации по выбору экспериментальных животных. Установлено, что рекомендации по выбору релевантных животных наиболее полно отражены в Правилах проведения исследований биологических лекарственных препаратов ЕАЭС и ICH S6(R1), руководствах ICH S5(R3) по изучению репродуктивной токсичности, ICH S11 по разработке педиатрических препаратов и EMA по стратегиям идентификации и минимизации риска при первом применении препарата у человека. Вопросы выбора подходящих животных являются предметом оживленной научной дискуссии. Спонсоры исследований отмечают, что большинство запросов регуляторного органа, связанных с релевантностью, касаются предоставления дополнительной информации о фармакологической значимости животных, обоснования использования только одного вида, а также рекомендаций по проведению дополнительных исследований на других видах животных. Многие исследовательские коллективы руководствуются в своей работе внутренними документами, в которых описаны этапы и критерии выбора релевантных животных. Научным сообществом предложено более сорока различных показателей, оценка которых в опытах in vitro, in vivo и in silico позволяет обосновать релевантность экспериментальных животных для доклинических исследований безопасности лекарственных средств.
ВЫВОДЫ. Выбор релевантных тест-систем и моделей в доклинических исследованиях безопасности лекарственных средств является самостоятельной научной задачей. Для обоснования релевантности экспериментальных животных, обеспечения трансляционности полученных результатов и соблюдения этических принципов наибольшую ценность представляют критерии, разработанные на основе системного подхода, который базируется на анализе комплекса фармакодинамических, фармакокинетических и токсикологических параметров in vitro и in vivo.
Ключевые слова
Для цитирования:
Енгалычева Г.Н., Сюбаев Р.Д. Выбор релевантных видов животных для проведения доклинических исследований безопасности лекарственных средств: обзор. Безопасность и риск фармакотерапии. 2025;13(1):31-43. https://doi.org/10.30895/2312-7821-2025-460
For citation:
Engalycheva G.N., Syubaev R.D. Relevant Species Selection for Preclinical Safety Studies of Medicines: A Review. Safety and Risk of Pharmacotherapy. 2025;13(1):31-43. (In Russ.) https://doi.org/10.30895/2312-7821-2025-460
ВВЕДЕНИЕ
Понятие релевантности (от англ. relevant — актуальный, существенный, важный, подходящий и пр.) используется в регуляторных документах. От правильности толкования и применения этого термина зависит адекватность выбора подходящих для доклинических исследований лекарственных средств тест-систем. Для оценки степени релевантности экспериментальных животных или тест-систем in vitro применяют критерии, по которым определяют их соответствие патологии, популяции пациентов и механизму действия лекарственного средства. Правильная оценка релевантности тест-системы гарантирует получение полезной информации о потенциальных фармакологических и/или токсических свойствах лекарственного средства, которую можно экстраполировать на человека. При экспертизе лекарственных средств для получения разрешения на проведение клинического исследования1 оригинального препарата эксперт прежде всего оценивает научную обоснованность программы доклинических исследований и выбор экспериментальной модели исследования и/или тест-систем2.
В нормативных документах Евразийского экономического союза (ЕАЭС) содержатся указания на необходимость проведения доклинических исследований безопасности лекарственных средств с использованием релевантных животных, однако научно-методические рекомендации по обоснованию выбора экспериментальных животных являются недостаточными, что создает проблемы как для разработчиков лекарственных препаратов, так и для экспертного учреждения. В связи с этим актуально выделение критериев, которые могут быть использованы при выборе экспериментальных животных, на основании анализа информации из международных нормативных документов по доклиническим исследованиям и рекомендаций научного сообщества.
Цель работы — анализ нормативной правовой и научно-методической базы, определение ключевых факторов и критериев для обоснования выбора релевантных видов экспериментальных животных при проведении доклинических исследований безопасности лекарственных средств.
Проведен обзор норм, требований и рекомендаций ЕАЭС, Российской Федерации и ведущих зарубежных регуляторных органов по выбору релевантных видов животных при проведении доклинических исследований. Рассмотрены научные публикации в базах данных PubMed, eLIBRARY.RU, находящиеся в открытом доступе по состоянию на 10.09.2024. Ключевые слова для поиска: доклинические исследования, релевантные виды животных, релевантные тест-системы.
Статья посвящена выбору экспериментальных животных для проведения доклинических исследований препаратов, представляющих собой низкомолекулярные химические соединения и биологические препараты, которые классифицируются в соответствии с Решением Евразийской экономической комиссии (ЕЭК) от 03.11.2016 № 89 (ред. от 04.07.2023)3. Обращение прочих препаратов (например, таких как олигонуклеотиды, вакцины, лекарственные средства для генной и клеточной терапии) регулируется отдельными нормативными документами и в данной статье подробно не обсуждается. Вместе с тем многие аспекты выбора релевантных видов животных могут быть применены и к этим препаратам.
ОСНОВНАЯ ЧАСТЬ
Нормативная правовая база
Евразийский экономический союз
Согласно Решению Совета ЕЭК от 03.11.2016 № 81 токсикологические исследования должны проводиться в соответствии с Правилами надлежащей лабораторной практики4. При доклиническом изучении биотехнологических лекарственных препаратов отдельные исследования, требующие использования специфических тест-систем, могут частично не соответствовать Правилам надлежащей лабораторной практики. В этих случаях необходимо указать области несоответствия и оценить степень их значимости для общей оценки безопасности5.
Тест-системой является используемая в исследовании биологическая, химическая, физическая система, аналитическое оборудование или их комбинация6. Обоснование выбора тест-системы должно быть включено в план исследования.
Рекомендации по выбору экспериментальных животных для проведения доклинических исследований содержатся в следующих документах.
Руководство по изучению фармакологической безопасности (Рекомендация Коллегии ЕЭК от 27.10.2020 № 18)7. Согласно этому документу выбор подходящей модели на животных или другой тест-системы обосновывается и осуществляется с учетом следующих факторов:
- способность модели на животных реагировать на фармакодинамические эффекты;
- фармакокинетический профиль, вид, порода, пол и возраст модели на животных;
- восприимчивость, чувствительность и воспроизводимость тест-системы;
- доступность ранее полученных данных об исследуемом веществе.
При выборе тест-системы следует учитывать также доступные данные, полученные в исследованиях у человека (например, о метаболизме in vitro). Сроки осуществления измерений должны определяться фармакодинамическими и фармакокинетическими свойствами исследуемого вещества. В целях получения достоверных научных данных необходимо обосновать выбор конкретной модели на животных или тест-системы.
В приложении к данному руководству указано, что при изучении способности препарата вызывать замедление сердечной проводимости in vivo (увеличение интервала QT) наиболее информативными являются модели, обладающие наиболее полным соответствием молекулярных, биохимических и физиологических систем.
Правила проведения исследований биологических лекарственных средств (Решение Совета ЕЭК от 03.11.2016 № 89)8. Согласно этому документу при проведении доклинической оценки безопасности биологического лекарственного препарата необходимо обеспечить выбор соответствующих (релевантных) видов животных, наиболее чувствительных в отношении фармакологического и токсического действия исследуемого вещества. Релевантным является такой вид животных, при проведении исследования на котором изучаемый препарат проявляет фармакологическую активность за счет взаимодействия с рецептором (или эпитопом, если речь идет о моноклональных антителах). Для поиска релевантных видов животных могут быть использованы различные методы (например, иммунохимические или функциональные тесты). При оценке релевантности вида животных, выбранных для проведения исследований, рекомендуется следующее:
1) на первом этапе следует провести сравнение последовательностей молекул-мишеней с целью выявления гомологии между видами животных;
2) на следующем этапе нужно провести в тестах in vitro качественную и количественную межвидовую сравнительную оценку аффинности связывания действующего белкового вещества препарата с мишенью, распределения (занятости) рецепторов (лигандов) и кинетических характеристик такого связывания;
3) выполнить оценку функциональной активности. Функциональная активность может быть продемонстрирована в исследованиях с использованием видоспецифичных клеточных систем и/или в рамках фармакологических и токсикологических исследований in vivo. Доказательством функциональной активности, которое можно использовать для обоснования выбора данного вида животных, может служить модуляция биологической реакции или показателей фармакодинамического маркера.
Если релевантные виды найти не удается, следует рассмотреть использование соответствующих трансгенных животных, экспрессирующих рецептор человека, или использование гомологичных белков. Должно быть представлено научное обоснование использования этих моделей заболеваний на животных для обеспечения безопасности биологического препарата.
Как правило, требуются данные, полученные на двух видах экспериментальных животных, как минимум один из которых не относится к грызунам, что позволяет оценить видовые различия в ответ на введение препарата. Однако в некоторых случаях может быть достаточно одного релевантного вида, если он является единственным (что должно быть обосновано).
При исследовании моноклональных антител релевантными видами животных являются те, у которых экспрессируется необходимый эпитоп и для тканей которых можно продемонстрировать профиль перекрестной реактивности, аналогичный тканям человека.
Необходимо подчеркнуть, что с 01.09.2024 вступили в силу изменения Федерального закона «Об обращении лекарственных средств»9, согласно которым для получения разрешения на проведение клинического исследования биологического лекарственного препарата в регуляторный орган подаются документы и сведения, предусмотренные правилами проведения исследований биологических лекарственных средств ЕАЭС, утвержденными ЕЭК. Таким образом, несмотря на то что процедура получения разрешения на проведение клинического исследования подчиняется российскому законодательству, обоснование релевантности экспериментальных животных должно соответствовать требованиям ЕАЭС.
Руководство по работе с лабораторными (экспериментальными) животными (Рекомендация Коллегии ЕЭК от 14.11.2023 № 33)10. В документе подчеркнуто, что от выбора методов исследования и вида биологических моделей зависит необходимое количество и благополучие экспериментальных животных. Поэтому при выборе метода следует руководствоваться следующим принципом: наряду с получением надежных результатов животному будет причинен минимум боли, страдания и дистресса.
Согласно приложению № 13 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения11 при экспертизе результатов доклинических исследований от эксперта требуется рассмотреть и оценить:
- научную обоснованность программы доклинических исследований лекарственного препарата;
- данные, характеризующие фармакологическую активность лекарственного средства в эксперименте на животных: вид животных, использованные модели, дозы и пути введения;
- используемые виды животных, их релевантность;
- длительность эксперимента;
- уровень изученных доз / системная экспозиция;
- токсические/нетоксические дозы, стартовая доза (первое применение у человека);
- органы-мишени / токсические эффекты;
- необходимость проведения дополнительных (расширенных) исследований;
- интерпретацию результатов доклинических исследований, которую представил разработчик.
ICH, EMA
Отбор видов животных и оценка их релевантности для общих токсикологических исследований регулируются следующими документами Международного совета по гармонизации технических требований к лекарственным средствам для медицинского применения (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH) и Европейского агентства по лекарственным средствам (European Medicines Agency, EMA) [1].
ICH M3(R2)12. Содержит указание, что для проведения исследования необходимо использовать «два вида млекопитающих (один из которых относится к негрызунам)». Другие указания по выбору видов животных отсутствуют. Необходимо отметить, что данное руководство легло в основу Решения Коллегии ЕЭК № 20213.
ICH S1B14. Содержит очень краткую рекомендацию в разделе «Выбор вида для долгосрочного исследования канцерогенности»: при отсутствии четких доказательств в пользу одного вида рекомендуется выбрать крыс.
ICH S2(R1)15. В разделе «Тесты для выявления хромосомных повреждений in vivo» отмечено: как крысы, так и мыши считаются подходящими для использования в тесте на микроядра в костном мозге.
ICH S5(R3)16. Информация о выборе видов животных представлена в нескольких разделах руководства.
- Рекомендации по изучению фертильности и раннего эмбрионального развития (fertility and early embryonic development, FEED) при применении биофармацевтических препаратов. В данном разделе указано, что этот вид исследований обычно проводят на грызунах. Если биопрепарат фармакологически активен у грызунов или кроликов, рекомендуется провести исследование FEED на одном из этих видов. Оценка спаривания, как правило, невозможна у негрызунов (таких как собаки и нечеловекообразные приматы — НЧП).
- Стратегия исследования эмбриофетального развития (embryo-fetal development, EFD). Для большинства малых молекул влияние на EFD обычно оценивают на двух видах животных: грызунах и негрызунах (обычно кроликах). По крайней мере на одном из тестируемых видов должен быть показан желаемый фармакодинамический эффект. Однако грызуны часто бывают фармакологически нерелевантными, в этом случае оценка EFD может быть проведена только у одного релевантного вида негрызунов. В тех случаях, когда НЧП являются единственным релевантным видом, вместо исследования EFD может быть проведено расширенное исследование пре- и постнатального развития (enhanced pre- and postnatal developmental toxicity, ePPND).
- Выбор видов животных для исследований репродуктивной токсичности и влияния на развитие потомства (developmental and reproductive toxicity, DART). Крысы, как правило, подходят для тестирования DART и являются наиболее часто используемым видом грызунов по соображениям практичности, общих знаний о фармакологии, обширных токсикологических данных, обычно доступных для интерпретации доклинических наблюдений, и большого количества исторических справочных данных. По тем же соображениям также часто для изучения DART используют мышей. Второй вид млекопитающих, не относящийся к грызунам, как правило, используют только для оценки EFD. Доказано, что использование кроликов позволяет выявлять тератогены для человека, которые не обнаруживаются в исследовании на грызунах, поэтому кролики являются доступным видом животных, не относящимся к грызунам, который пригоден для тестирования DART.
- Выбор видов животных для изучения профилактических и лечебных вакцин. Виды животных, отобранные для изучения вакцин (с адъювантами или без них), должны демонстрировать иммунный ответ на вакцину. Тип проводимого исследования DART вакцин и выбор модели на животных должны быть обоснованы с учетом наблюдаемого иммунного ответа и возможности введения соответствующей дозы. Как правило, в исследованиях токсического действия вакцин на развитие потомства используются кролики, крысы или мыши. НЧП следует применять только в том случае, если нет другого релевантного вида животных, демонстрирующего иммунный ответ.
- В приложении 1 (табл. 1) к документу ICH S5(R3) описаны основные преимущества и недостатки различных видов животных в исследованиях токсичности для развития потомства и репродукции (DART), в том числе видов, используемых обычно (крысы, кролики, мыши) или более редко (НЧП, карликовые свиньи, хомяки, собаки).
ICH S6(R1)17. Документ посвящен доклиническим исследованиям биотехнологических препаратов. Аналогичные подходы к выбору релевантных животных для проведения доклинических исследований содержит Решение Совета ЕЭК № 8918.
ICH S7A19. Документ посвящен общим вопросам изучения фармакологической безопасности лекарственных средств. Он не содержит конкретных рекомендаций по выбору вида животных, кроме указания о необходимости предоставления обоснования выбора конкретной модели на животных или тест-системы.
ICH S7B20. Документ посвящен оценке влияния лекарственных препаратов на реполяризацию желудочков сердца. Аналогичные подходы к выбору релевантных животных для доклинической оценки проаритмогенного риска изложены в Рекомендации Коллегии ЕЭК №1821.
ICH S922. Документ посвящен доклинической оценке противораковых препаратов. В разделе «Общая токсикология» указано, что для малых молекул токсикологические исследования обычно проводят на грызунах и негрызунах. При определенных обстоятельствах, определяемых в каждом конкретном случае, могут быть уместны альтернативные подходы. Например, для генотоксичных препаратов, действие которых направлено на быстро делящиеся клетки, исследование токсичности повторных доз на одном виде грызунов может быть сочтено достаточным при условии, что этот вид является релевантным.
ICH S9 Q&A23. Документ содержит ответы ICH на вопросы, касающиеся доклинического изучения противораковых препаратов. Некоторые вопросы и ответы касаются выбора экспериментальных животных при изучении противораковых препаратов. В разделе «Прочие рекомендации» (применимо к конъюгатам антитело — лекарственное средство (antibody drug conjugates, ADC) приведен ответ на следующий вопрос: «Как правило, для токсикологического тестирования используются два вида животных. Существуют ли ситуации, когда при образовании ADC допустимо использовать один вид?» Ответ: «Когда антителообразующая часть ADC связывается только с антигенами человека и НЧП, целесообразно провести оценку токсичности ADC только для НЧП (единственного релевантного вида), как описано в ICH S6(R1)».
ICH S1124. Документ посвящен доклиническим исследованиям при разработке лекарственных препаратов для педиатрии. В разделе «Выбор животных в качестве тест-систем» отмечено, что при необходимости проведения исследований безопасности на неполовозрелых животных в большинстве случаев считается достаточным использовать один вид. В качестве вида для исследований на неполовозрелых животных в первую очередь следует рассматривать тот же вид, который использовался в исследованиях с введением повторных доз взрослым особям, предпочтительно грызунам. Во всех случаях выбор вида животных должен быть обоснован.
При выборе релевантного вида следует учитывать следующие факторы:
1) понимание онтогенеза фармакологической или токсикологической мишени (например, рецептора) у животных в сравнении с таковым в предполагаемой популяции детей;
2) предпочтительный выбор вида, для которого имеются данные о токсичности при повторном введении взрослым животным, что облегчает сравнение профилей токсичности и системного воздействия у неполовозрелых и взрослых животных;
3) токсикологические органы-мишени;
4) сходство с характеристиками фармакокинетики человека (absorption, distribution, metabolism, excretion, ADME);
5) техническую/практическую осуществимость проведения исследования на выбранных видах животных.
Преимущества и недостатки использования грызунов (крысы, мыши) или других видов (кролики, собаки, карликовые свиньи, НЧП) приведены в приложении A документа, таблица A6.
Руководство EMEA/CHMP/SWP/28367/07 Rev.125. Документ посвящен стратегиям выявления и снижения рисков при проведении первого клинического исследования с участием человека. В разделе «Выбор релевантных животных» указано, что релевантность животных должна быть обоснована в заявке на проведение клинических исследований. Демонстрация релевантности животных может включать сравнение с человеком по следующим параметрам:
- экспрессия целевой мишени, распределение и первичная структура (в документе отмечено, что высокая степень гомологии не обязательно подразумевает сопоставимые эффекты);
- фармакодинамические показатели;
- метаболизм и другие фармакокинетические параметры;
- целевое и нецелевое связывание с рецепторами/лигандами, степень оккупации и др.
В рассматриваемом руководстве отмечено, что для низкомолекулярных соединений в соответствии с рекомендациями ICH M3(R2) по крайней мере один вид, используемый для токсикологических исследований (грызуны или негрызуны), должен быть «фармакологически» релевантным, при этом следует учитывать как наличие мишени, так и относительную эффективность молекулы в отношении мишени у выбранных видов животных и предполагаемой популяции пациентов. Вид животных также следует выбирать на основе сходства с человеком метаболического профиля, установленного в условиях in vitro.
Что касается продуктов, полученных с помощью биотехнологии, то в соответствии с ICH S6(R1) исследования на нерелевантных видах животных могут привести к неправильному толкованию и не приветствуются. Если релевантных видов не существует, следует рассмотреть возможность использования гомологичных белков или соответствующих трансгенных или гуманизированных животных, экспрессирующих мишень человека.
Согласно данному руководству определение факторов риска при первом применении препарата у человека относится к сфере ответственности спонсора и исследователя. Опасения о небезопасности разрабатываемого препарата могут быть вызваны конкретной информацией о механизме действия, природе мишени, релевантности модели или животного.
Ранняя клиническая разработка новых лекарственных средств для человека сопряжена с некоторой неопределенностью в отношении как возможных преимуществ, так и рисков применения нового препарата-кандидата. Неопределенность может возникать из-за недостаточности или отсутствия информации о механизме действия препарата, наличия или отсутствия биомаркеров, данных о природе мишени, а также адекватности доступных моделей на животных и/или результатов доклинических исследований безопасности. Спонсор должен определить степень риска, разработать стратегию снижения риска и предоставить ее на рассмотрение регулятора. Одна из составляющих стратегии снижения риска состоит в проведении дополнительных доклинических исследований, которые могут включать данные, подтверждающие релевантность животных, адекватность экспериментальных моделей, проведение исследований с использованием материала, полученного от человека.
Рекомендации научного сообщества по выбору релевантных видов животных
Понятие «модель на животных» (animal model) определяется как вид, не являющийся Homo sapiens, используемый в биомедицинских исследованиях, поскольку может имитировать аспекты биологических процессов или заболеваний, обнаруживаемых у человека26. Выбор видов животных в биологических исследованиях долгое время определялся лишь «удобством» их использования, что подразумевало доступность, круглогодичную фертильность, низкую стоимость, а также анатомические или физиологические особенности, облегчающие экспериментальные манипуляции и процедуры [2]. Тем не менее идентификация и выбор подходящих моделей является одним из наиболее важных элементов исследований на животных [3].
Научным сообществом предложены различные критерии, которые могут быть использованы для выбора релевантных животных. Например, модели, основанные на аналогии (сходные структуры подразумевают сходные функции), и модели, основанные на гомологии (структуры, происходящие от одного и того же эволюционного предшественника, имеют одинаковые или сходные функции) [4]. Понимание филогенетического положения и эволюционной истории видов может помочь определить наиболее выгодные и репрезентативные особенности животного для конкретного исследования с точки зрения трансляционности результатов с соблюдением принципа относительной замены на основе филогенетической шкалы [2].
Однако по мнению некоторых авторов филогенетические критерии не всегда позволяют выбрать подходящий вид животных для проведения биомедицинских исследований, поэтому для отбора релевантных видов предлагают и другие критерии. Они включают восприимчивость, видоспецифичность и сходство с человеком целевого патологического процесса, поведение и размер животного, подходящие для использования экспериментальных методов и оценки возрастных различий, наличие большого объема данных, относящихся к исследованию, цель исследования, соответствие общим регуляторным требованиям [5]. В научной дискуссии важным признается максимально возможное соответствие генома экспериментальных животных и человека. При этом отмечают, что не каждая модель на животных может быть использована для всех видов исследований, и ни одна из них не имитирует все болезни человека, поэтому требуется комплексный подход и объединение различных доклинических исследований27.
В последние годы ведется активная разработка биофармацевтических препаратов на основе принципиально новых подходов и технологий. Доклинические исследования биологических препаратов имеют уникальные особенности. Выбор соответствующих видов животных, понимание иммуногенности, оценка фармакодинамики и токсикологических свойств требуют многоуровневого, детализированного подхода [6]. Иными словами, обоснование релевантности экспериментальных животных и выбор оптимальных видов, работа с которыми позволит получить достаточную информацию о потенциальных фармакологических и/или токсических свойствах лекарственного средства, которую можно экстраполировать на человека, представляет собой самостоятельное научное исследование для подтверждения межвидовой трансляционности результатов доклинического исследования.
В этой связи представляет интерес анализ результатов опроса, касающегося критериев выбора экспериментальных животных для проведения исследований новых химических соединений и биологических препаратов, проведенного среди сотрудников нескольких биофармацевтических компаний и контрактных исследовательских организаций, базирующихся в Европейском союзе, США, Канаде и Японии [1]. Авторы разработали анкету, учитывающую критерии выбора экспериментальных животных на основании фармакологических и токсикологических данных in vitro и in vivo (рис. 1).
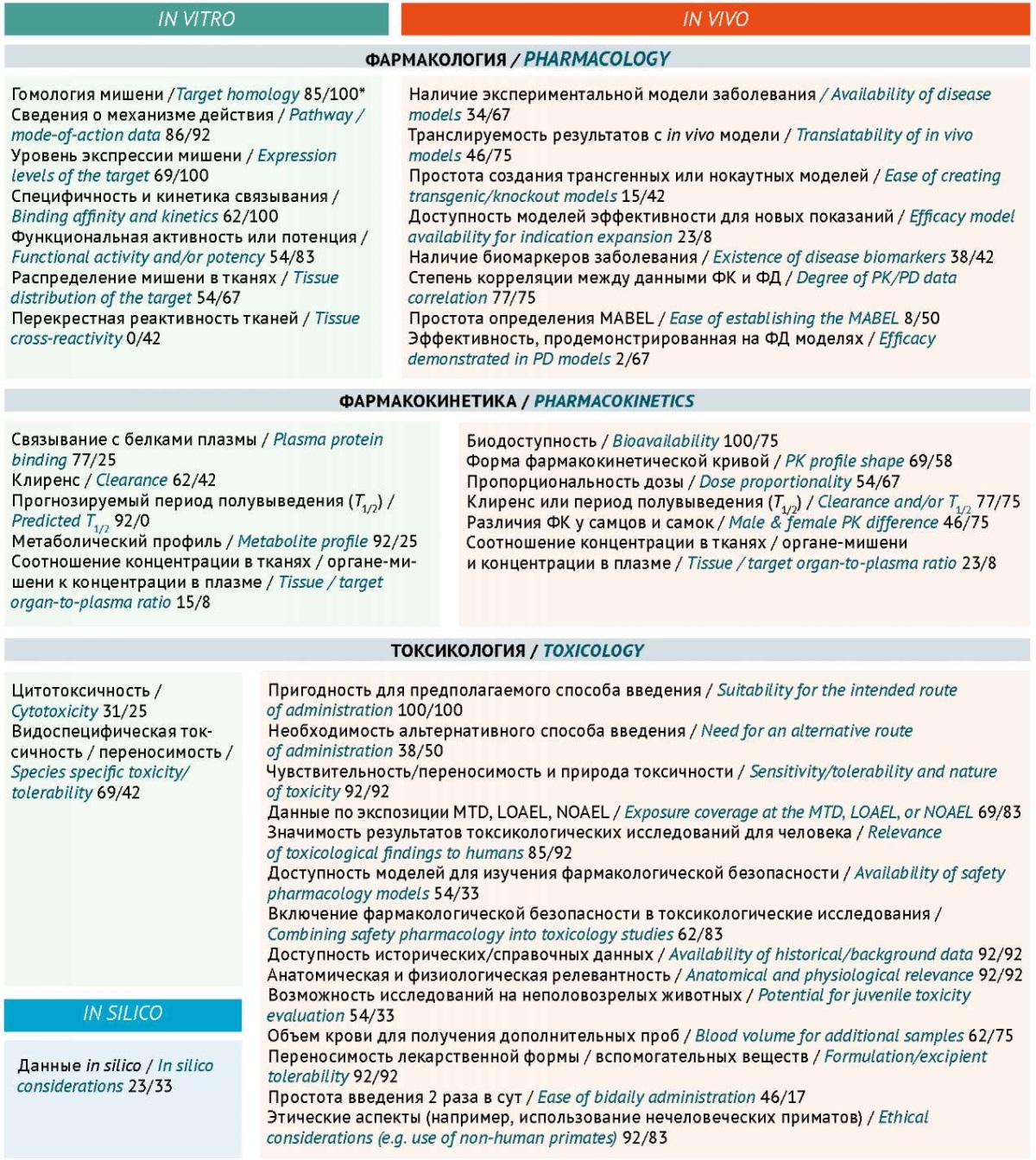
Рисунок подготовлен авторами по данным источника [1] / The figure is adapted by the authors from [1]
Рис. 1. Критерии выбора релевантных видов животных для токсикологических исследований. ФК – фармакокинетика; ФД – фармакодинамика; LOAEL – наименьшая токсическая доза; NOAEL – нетоксическая доза; MABEL – минимальная биологически активная доза
* — доля специалистов, рекомендующих использовать критерий для выбора релевантных видов животных при разработке химических/биологических препаратов, %
Fig. 1. Criteria for selecting relevant animal species for toxicological studies. PK, pharmacokinetics; PD, pharmacodynamics; LOAEL, low observed adverse effect level; NOAEL, no observed adverse effect level; MABEL, minimum anticipated biological effect level
* Percentage of experts who recommend using the criterion for selecting relevant animal species when developing new chemical entities/biologicals
Результаты опроса [1] показали, что все респонденты выбирают животных, при работе с которыми препарат можно вводить тем же способом, что и человеку. Имеется определенное сходство в подходах к выбору видов экспериментальных животных при разработке лекарственных средств на основе новых химических соединений (new chemical entity, NCE) и биологических препаратов. Это видно на примере приоритетности фармакологических критериев in vitro при выборе релевантных животных, а также некоторых фармакокинетических параметров in vitro, например эффективности при изучении фармакодинамики и корреляции с фармакодинамическими данными и in vivo: клиренс, период полувыведения, биодоступность. Однако существуют также различия, при этом ключевыми факторами для NCE являются сходство с человеком метаболического профиля, биодоступность при пероральном приеме и видовая чувствительность/переносимость, в то время как ключевыми факторами для биологических препаратов были фармакологические факторы in vitro.
Все респонденты в исследовании подтвердили, что они включают в регистрационные документы информацию, обосновывающую выбор видов животных при проведении токсикологических исследований. Также было отмечено, что большинство запросов регуляторного органа, связанных с релевантностью вида животных, касалось предоставления дополнительной информации о фармакологической значимости и/ или обоснования использования только одного вида животных при проведении хронических токсикологических исследований биологических препаратов. Иногда это приводило к просьбам о проведении дополнительных исследований на других видах животных. Большинство компаний указали, что у них есть официальные или полуофициальные процедуры, которые описывают этапы или данные, облегчающие выбор видов животных для токсикологических исследований [1].
Авторы анкеты на основе системного подхода подготовили очень подробный перечень критериев, которые они рекомендуют учитывать при выборе вида экспериментальных животных для токсикологических исследований. Представляется целесообразным использовать предложенные критерии для разработки стандартизованного подхода по выбору релевантного вида животных.
Низкая трансляционность результатов доклинических исследований лекарственных препаратов является признанной проблемой [7]. Для ее преодоления необходимо обеспечить гарантии того, что: 1) эксперименты проводятся в соответствии с лучшими научными практиками; 2) выбор моделей на животных осуществляется с четким обоснованием их применения. Соблюдение этих принципов позволит в полной мере оценить значимость использования модели на животных при разработке лекарственных препаратов [8].
Выбор релевантных тест-систем для доклинических исследований обеспечивает не только повышение трансляционности результатов, но и соблюдение этических принципов [3][9]. В последнее время обсуждается возможность использования результатов моделирования вместо проведения исследований на животных [10]. Однако на сегодняшний день полностью отказаться от исследований на животных не представляется возможным. Научное сообщество признает использование экспериментальных животных исключительно в рамках этических норм [11]. Соблюсти этические принципы при изучении биологических препаратов при отсутствии релевантных видов позволяет использование трансгенных животных [12]. При невозможности создания трансгенной модели на животных регуляторные органы могут проявлять гибкий подход к оценке доклинических данных. Например, при доклинической разработке инфликсимаба релевантным видом (на основании сходства его связывания с TNFα у человека) оказались только человекообразные обезьяны шимпанзе. В этой связи экспертами EMA было сочтено приемлемым отсутствие подробных данных об изучении токсичности инфликсимаба на животных28.
Отдельные экспериментальные лаборатории могут иметь разные взгляды и предпочтения в отношении различных аспектов исследования в зависимости от характеристик исследуемого вещества и предыдущего опыта работы с конкретными мишенями или классами соединений [13]. Перед началом очередного эксперимента на животных необходимо тщательно проанализировать уже имеющиеся экспериментальные данные как с научной, так и с этической точки зрения, чтобы избежать проведения дублирующих, малоинформативных или избыточных исследований. Наиболее подходящим методом для проведения тщательного анализа научной литературы является систематический обзор [14].
Необходимо отметить, что указаний о точном количестве и типе доклинических исследований, которые необходимы для оценки безопасности, не существует, поскольку при изучении каждого нового препарата применяются как традиционные методы доклинических исследований безопасности, изложенные в руководящих документах ICH и Управления по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA), так и новые подходы, учитывающие особенности механизма действия лекарственного средства [15].
Создание оригинальных высокоэффективных лекарственных препаратов, обладающих принципиально новым механизмом действия или новой терапевтической эффективностью, невозможно без глубокого научного обоснования цели и задач доклинических исследований. Научной базой, обеспечивающей надежность результатов доклинических исследований, являются, в том числе, актуальные научные сведения о разработке тест-систем на основе изучения патогенеза заболеваний и выявления общих биомаркеров и мишеней фармакологического и токсического действия у человека и экспериментальных животных [16–23].
ЗАКЛЮЧЕНИЕ
Использование релевантных тест-систем и видов экспериментальных животных является непременным условием получения достоверной, научно обоснованной информации о безопасности лекарственного средства и трансляционности результатов доклинических исследований безопасности. Отбор релевантных тест-систем и видов животных для доклинической оценки безопасности является сложной самостоятельной научной задачей и играет решающую роль в разработке новых лекарственных средств, поскольку полученная информация используется для оценки риска для человека и обоснования последующей клинической разработки и регистрации лекарственного препарата. Выбор подходящего вида животных для токсикологических исследований включает рассмотрение научных, этических и практических факторов. При этом методы изучения и/или подтверждения заявленных физико-химических, биологических и клинических характеристик лекарственных препаратов определяются не только актуальными руководствами и/или рекомендациями, но и существующим уровнем научных знаний.
Проведенный анализ международной нормативной базы показал недостаточную регламентацию выбора экспериментальных животных: в большинстве документов, действующих на территории государств — членов ЕАЭС и регионов ICH, постулируется необходимость использования релевантных видов без конкретизации методологии и критериев отбора. В этой связи при оценке релевантности тест-систем необходимо руководствоваться национальными и международными нормативными и методическими документами, а также специальными рекомендациями, предлагаемыми научным сообществом, и актуальной информацией из научной литературы. Обоснование релевантности видов экспериментальных животных необходимо включать в брошюру исследователя и в регистрационное досье лекарственного препарата.
Представляется целесообразным использовать системный подход при выборе релевантного вида животных на основании критериев, учитывающих достаточное количество фармакодинамических, фармакокинетических и токсикологических параметров in vitro и in vivo.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Г.Н. Енгалычева — концепция работы, анализ и систематизация данных литературы, написание текста рукописи; Р.Д. Сюбаев — критический пересмотр содержания, редактирование текста и утверждение окончательного варианта рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Galina N. Engalycheva conceptualised the study, analysed and systematised literature data, and drafted the manuscript. Rashid D. Syubaev critically revised the content, edited the manuscript, and approved the final version for publication.
1. Приказ Минздрава России от 24.08.2017 № 558н «Об утверждении Правил проведения экспертизы лекарственных средств для медицинского применения и особенности экспертизы отдельных видов лекарственных препаратов для медицинского применения (референтных лекарственных препаратов, воспроизведенных лекарственных препаратов, биологических лекарственных препаратов, биоаналоговых (биоподобных) лекарственных препаратов (биоаналогов), гомеопатических лекарственных препаратов, лекарственных растительных препаратов, комбинаций лекарственных препаратов), форм заключений комиссии экспертов».
2. Приложение № 5 к приказу Минздрава России от 24.08.2017 № 558н.
3. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
4. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 81 «Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств».
5. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
6. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 81 «Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств».
7. Рекомендация Коллегии Евразийской экономической комиссии от 27.10.2020 № 18 «О Руководстве по исследованию фармакологической безопасности лекарственных препаратов для медицинского применения».
8. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
9. Федеральный закон от 30.01.2024 № 1-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и статьи 1 и 4 Федерального закона «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и Федеральный закон «О внесении изменений в Федеральный закон «Об обращении лекарственных средств».
10. Рекомендация Коллегии Евразийской экономической комиссии от 14.11.2023 № 33 «О Руководстве по работе с лабораторными (экспериментальными) животными при проведении доклинических (неклинических) исследований».
11. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
12. ICH M3(R2). Non-clinical safety studies for the conduct of human clinical trials and marketing authorisation for pharmaceuticals. CPMP/ICH/286/95. EMA; 2008.
13. Решение Коллегии Евразийской экономической комиссии от 26.11.2019 № 202 «Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов».
14. ICH S1B. Testing for carcinogenicity of pharmaceuticals. ICH; 2022.
15. ICH S2 (R1). Guidance on genotoxicity testing and data interpretation for pharmaceuticals intended for human use. EMA/ CHMP/ICH/126642/2008. EMA; 2012.
16. ICH S5 (R3). Detection of reproductive and developmental toxicity for human pharmaceuticals. EMA/CHMP/ICH/544278/1998. EMA; 2020.
17. ICH S6 (R1). Preclinical safety evaluation of biotechnology-derived pharmaceuticals. EMA/CHMP/ICH/731268/1998. EMA; 2011.
18. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
19. ICH S7A. Safety pharmacology studies for human pharmaceuticals. CPMP/ICH/539/00. EMA; 2001.
20. ICH S7B. The non-clinical evaluation of the potential for delayed ventricular repolarization (QT interval prolongation) by human pharmaceuticals. EMA; 2005.
21. Рекомендация Коллегии Евразийской экономической комиссии от 27.10.2020 № 18 «О руководстве по исследованию фармакологической безопасности лекарственных препаратов для медицинского применения».
22. ICH S9. Nonclinical evaluation for anticancer pharmaceuticals. EMA/CHMP/ICH/646107/2008. EMA; 2009.
23. ICH S9 guideline on nonclinical evaluation for anticancer pharmaceuticals – questions and answers. EMA/CHMP/ICH/453684/2016. EMA; 2018.
24. ICH S11. Nonclinical safety testing in support of development of paediatric pharmaceuticals. EMA/CHMP/ICH/616110/2018. EMA; 2020.
25. Guideline on strategies to identify and mitigate risks for first-in-human and early clinical trials with investigational medicinal products. EMEA/CHMP/SWP/28367/07 Rev. 1. EMA; 2017.
26. Talking glossary of genomic and genetic terms. https://www.genome.gov/genetics-glossary
27. https://blog.biobide.com/how-to-choose-an-animal-model-in-research
28. https://www.ema.europa.eu/en/documents/scientific-discussion/remicade-epar-scientific-discussion_en.pdf
Список литературы
1. Namdari R, Jones K, Chuang SS, Van Cruchten S, Dincer Z, Downes N, et al. Species selection for nonclinical safety assessment of drug candidates: Examples of current industry practice. Regul Toxicol Pharmacol. 2021;126:105029. https://doi.org/10.1016/j.yrtph.2021.105029
2. Макарова МН, Матичин АА, Матичина АА, Макаров ВГ. Принципы выбора животных для научных исследований. Сообщение 1. Выбор модельных организмов на основании филогенетических связей. Лабораторные животные для научных исследований. 2022;(2):58–70. https://doi.org/10.29296/2618723X-2022-02-07
3. Chitipothu MD, Chowdary SD, Chandrashekar P, Nartey NO. Animal models of relevance to dentistry. Open Access Library Journal. 2022;9:e8673. https://doi.org/10.4236/oalib.1108673
4. Davidson MK, Lindsey JR, Davis JK. Requirements and selection of an animal model. Isr J Med Sci. 1987;23(6):551–5. PMID: 3312096
5. Mann MD. Choosing the right species in research. Lab Anim (NY). 2015;44(7):274–8. https://doi.org/10.1038/laban.742
6. Куркин ДВ, Морковин ЕИ, Бакулин ДА, Заборовский АВ, Макаренко ИЕ, Драй РВ и др. Методологические и регуляторные аспекты фармацевтической разработки биопрепаратов. Фармация и фармакология. 2023;11(5):384–98. https://doi.org/10.19163/2307-9266-2023-11-5-384-398
7. Макаров ВГ. Трансляционность доклинических исследований. Тезисы Девятой конференции специалистов по лабораторным животным Rus-LASA. 2021. https://labanimalsjournal.ru/ru/2618723x-ruslasa2021-35
8. Bizzaro D. Association of animal models in the field of translational medicine: Prediction and validation. In: Pathak S, Banerjee A, Bisgin A, eds. Handbook of Animal Models and its Uses in Cancer Research. Springer, Singapore; 2023. https://doi.org/10.1007/978-981-19-3824-5_45
9. Shim J, Kim J. Considerations for experimental animal ethics in the research planning and evaluation process. Kosin Medical Journal. 2022;37(4):271–7. https://doi.org/10.7180/kmj.22.139
10. Robinson NB, Krieger K, Khan FM, Huffman W, Chang M, Naik A, et al. The current state of animal models in research: A review. Int J Surg. 2019;72:9–13. https://doi.org/10.1016/j.ijsu.2019.10.015
11. Festing S, Wilkinson R. The ethics of animal research. Talking point on the use of animals in scientific research. EMBO Rep. 2007;8(6):526–30. https://doi.org/10.1038/sj.embor.7400993
12. Mukherjee P, Roy S, Ghosh D, Nandi SK. Role of animal models in biomedical research: A review. Lab Anim Res. 2022;38(1):18. https://doi.org/10.1186/s42826-022-00128-1
13. Prior H, Haworth R, Labram B, Roberts R, Wolfreys A, Sewell F. Justification for species selection for pharmaceutical toxicity studies. Toxicol Res (Camb). 2020;9(6):758–70. https://doi.org/10.1093/toxres/tfaa081
14. Leenaars M, Hooijmans CR, van Veggel N, ter Riet G, Leeflang M, Hooft L, et al. A step-by-step guide to systematically identify all relevant animal studies. Lab Anim. 2012;46(1):24–31. https://doi.org/10.1258/la.2011.011087
15. Avila AM, Bebenek I, Bonzo JA, Bourcier T, Davis Bruno KL, Carlson DB, et al. An FDA/CDER perspective on nonclinical testing strategies: Classical toxicology approaches and new approach methodologies (NAMs). Regul Toxicol Pharmacol. 2020;114:104662. https://doi.org/10.1016/j.yrtph.2020.104662
16. Hilmer SN, Johnell K, Mach J. Pre-clinical models for geriatric pharmacotherapy. Drugs Aging. 2024;41(8):633–40. https://doi.org/10.1007/s40266-024-01129-6
17. Moura JA, Meldrum K, Doak SH, Clift MJD. Alternative lung cell model systems for toxicology testing strategies: Current knowledge and future outlook. Semin Cell Dev Biol. 2023;147:70–82. https://doi.org/10.1016/j.semcdb.2022.12.006
18. Rayatdoost F, Grottke O. The use of large animal models in trauma and bleeding studies. Hamostaseologie. 2023;43(5):360–73. https://doi.org/10.1055/a-2118-1431
19. Sadie-Van Gijsen H, Kotzé-Hörstmann L. Rat models of diet-induced obesity and metabolic dysregulation: Current trends, shortcomings and considerations for future research. Obes Res Clin Pract. 2023;17(6):449–57. https://doi.org/10.1016/j.orcp.2023.09.010
20. Heinis FI, Merani S, Markin NW, Duncan KF, Moulton MJ, Fristoe L, et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Animal Model Exp Med. 2024;7(3):283–96. https://doi.org/10.1002/ame2.12411
21. Aoki S. Elucidating the mechanisms underlying interindividual differences in the onset of adverse drug reactions. Biol Pharm Bull. 2024;47(6):1079–86. https://doi.org/10.1248/bpb.b24-00072
22. Mascolini MV, Toniolo I, Carniel EL, Fontanella CG. Ex vivo, in vivo and in silico studies of corneal biomechanics: A systematic review. Phys Eng Sci Med. 2024;47(2):403–41. https://doi.org/10.1007/s13246-024-01403-2
23. Wagner H, Egelhaaf M, Carr C. Model organisms and systems in neuroethology: One hundred years of history and a look into the future. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 2024;210(2):227–42. https://doi.org/10.1007/s00359-023-01685-z
Об авторах
Г. Н. ЕнгалычеваРоссия
Енгалычева Галина Нинелевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. Д. Сюбаев
Россия
Сюбаев Рашид Даутович, д-р мед. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Енгалычева Г.Н., Сюбаев Р.Д. Выбор релевантных видов животных для проведения доклинических исследований безопасности лекарственных средств: обзор. Безопасность и риск фармакотерапии. 2025;13(1):31-43. https://doi.org/10.30895/2312-7821-2025-460
For citation:
Engalycheva G.N., Syubaev R.D. Relevant Species Selection for Preclinical Safety Studies of Medicines: A Review. Safety and Risk of Pharmacotherapy. 2025;13(1):31-43. (In Russ.) https://doi.org/10.30895/2312-7821-2025-460
JATS XML





































