Перейти к:
Алгоритмы оценки риска в фармаконадзоре: обзор
https://doi.org/10.30895/2312-7821-2025-13-2-138-148
Резюме
ВВЕДЕНИЕ. В Российской Федерации риск-ориентированные подходы/методы к оценке безопасности лекарственных препаратов (ЛП) применяются с 2016 г., но существующие модели на их основе немногочисленны и применимы в основном для медицинских организаций. Поэтому актуальной является систематизация процедуры оценки рисков ЛП специалистами фармаконадзора с применением риск-ориентированного подхода в системе управления рисками.
ЦЕЛЬ. Анализ основных инструментов риск-ориентированного подхода и оптимизация его применения в системе управления рисками ЛП.
РЕЗУЛЬТАТЫ. Представлены четыре основных этапа управления рисками ЛП с применением риск-ориентированного подхода к их оценке: выявление рисков, связанных с применением ЛП, установление факторов
риска для каждого выявленного риска, характерных для конкретного ЛП, сопоставление и оценка соответствующих данных для каждого выявленного фактора риска с каждым из выявленных рисков и заключение о соотношении «польза–риск» применения ЛП. Основными инструментами риск-ориентированного подхода в системе управлении рисками ЛП являются: 1) организация работы с информацией о нежелательных реакциях (НР); 2) проведение активного мониторинга безопасности ЛП; 3) разработка и введение мер минимизации рисков, оценка эффективности данных мер; 4) информирование о проблемах по безопасности целевой аудитории (специалисты системы здравоохранения, пациенты и лица, осуществляющие уход за ними). В качестве источников информации для выявления рисков развития НР на пострегистрационном этапе обращения ЛП используются спонтанные сообщения, сообщения о НР, полученные по запросу от держателя регистрационного удостоверения, данные фармакоэпидемиологических исследований, сведения,
опубликованные в научной медицинской литературе, а также ресурсы сети Интернет. Факторами риска развития НР при применении ЛП являются физиологические изменения в организме пациента, пол, возраст, наличие сопутствующих заболеваний, генетическая предрасположенность, различия в фармакокинетике и фармакодинамике ЛП в зависимости от возраста пациента, применение ЛП off-label. Предложен алгоритм оценки рисков ЛП, включающий пять этапов: параметры и цели оценки риска(ов), источники данных, потенциальные риски, серьезность и вероятность риска(ов) и соотношение «польза–риск». Обобщены сведения о дополнительных мерах минимизации рисков.
ВЫВОДЫ. Предложенный вариант риск-ориентированного подхода с использованием доступных инструментов может быть использован специалистами фармаконадзора при управлении рисками ЛП.
Ключевые слова
Для цитирования:
Букатина Т.М. Алгоритмы оценки риска в фармаконадзоре: обзор. Безопасность и риск фармакотерапии. 2025;13(2):138-148. https://doi.org/10.30895/2312-7821-2025-13-2-138-148
For citation:
Bukatina T.M. Risk Assessment Algorithms in Pharmacovigilance: A Review. Safety and Risk of Pharmacotherapy. 2025;13(2):138-148. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-2-138-148
ВВЕДЕНИЕ
В рамках федерального государственного контроля в сфере обращения лекарственных средств1 реализуются мероприятия по управлению рисками при обращении лекарственных препаратов (ЛП). В законодательстве Евразийского экономического союза определены принципы системы фармаконадзора2, согласно которым как регуляторные органы [1], так и держатели регистрационных удостоверений (ДРУ) имеют ряд правовых обязательств и решают задачи мониторинга безопасности ЛП и выявления любых изменений в соотношении пользы и риска при применении зарегистрированных ЛП [2] для обеспечения их безопасного и эффективного использования [1][3].
Риск-ориентированные подходы и риск-ориентированные методы выявления рисков ЛП и их минимизации с целью обеспечения и контроля безопасности ЛП в фармаконадзоре — это стратегия применения предупреждающих мер [4][ 5]. План управления рисками (ПУР)3 является формой для представления описания системы управления рисками ЛП и документальным подтверждением принятых мер по предотвращению или минимизации рисков, связанных с применением ЛП [6].
В Российской Федерации переход к риск-ориентированному подходу оценки безопасности ЛП связан с утверждением и вступлением в силу в 2016 г. Правил надлежащей практики фармаконадзора Евразийского экономического союза4 [4][7]. Многие авторы указывают на необходимость разработки и внедрения специалистами в области фармаконадзора риск-ориентированных подходов/методов для повышения и обеспечения безопасности ЛП. Однако управление рисками и риск-ориентированные подходы/методы в системе фармаконадзора на данный момент развиты недостаточно, предлагаемые модели немногочисленны и в основном используются для обеспечения безопасности применения ЛП в медицинских организациях [5][7–9]. Поэтому актуальна систематизация процедуры оценки рисков ЛП специалистами фармаконадзора с применением риск-ориентированного подхода в системе управления рисками.
Цель работы — анализ основных инструментов риск-ориентированного подхода и оптимизация его применения в системе управления рисками лекарственных препаратов.
ОСНОВНАЯ ЧАСТЬ
Общая характеристика риск-ориентированного подхода в фармаконадзоре
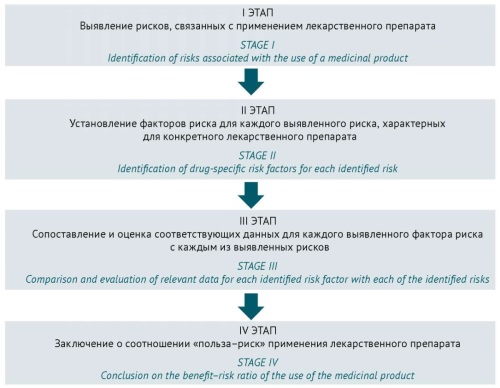
Риск-ориентированный подход в фармаконадзоре основан на выявлении и минимизации рисков с целью обеспечения безопасного применения ЛП. Профилирование риска является методологическим подходом к систематизации всей доступной информации о рисках и факторах риска для получения профиля каждого отдельного риска, связанного с конкретным ЛП. На рисунке 1 представлена схема одной из методологий данного подхода в фармаконадзоре, включающая четыре последовательных этапа5, которая может использоваться также в системе управления рисками ЛП.
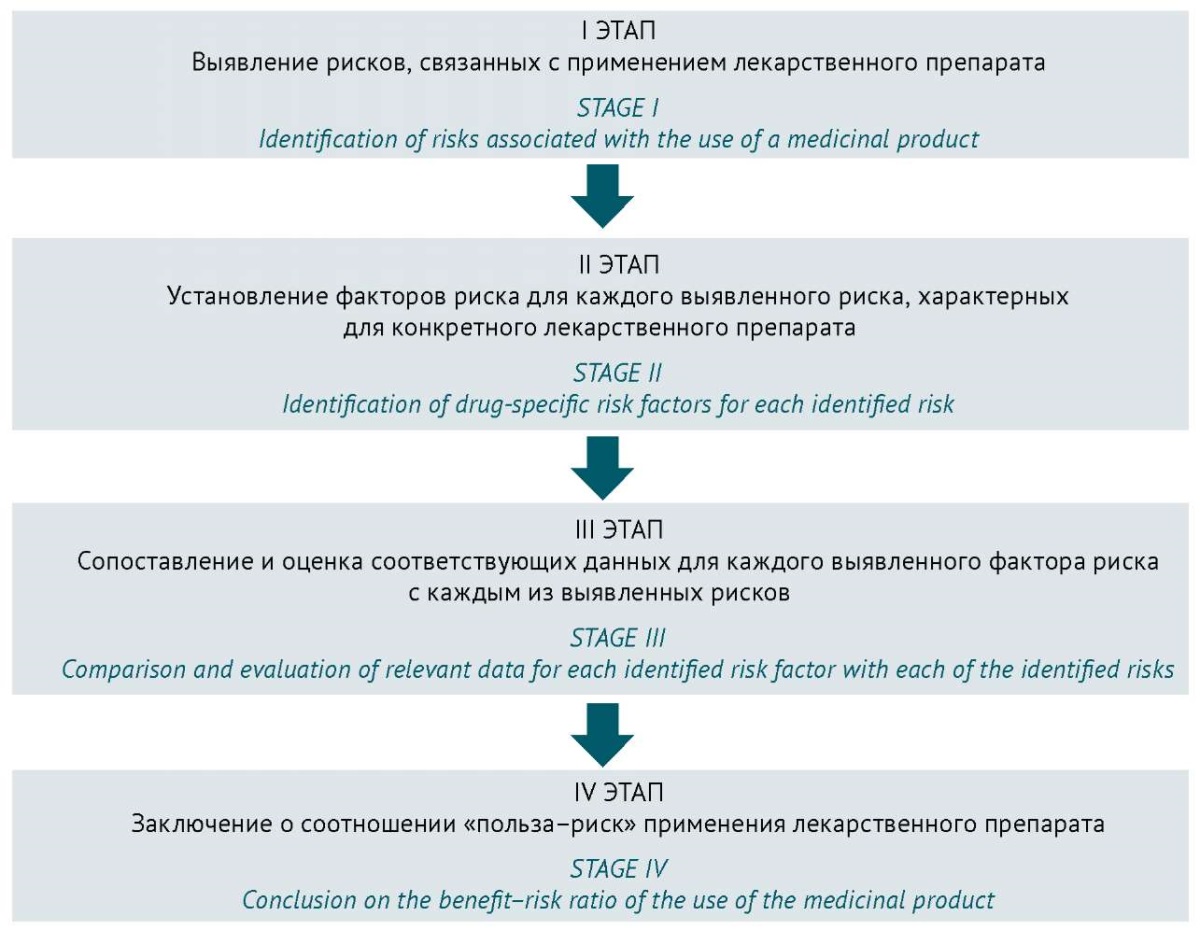
Рисунок подготовлен автором на основе нормативного документа EMA/CAT/CPWP/686637/2011 / The figure is prepared by the author using the regulatory document EMA/CAT/CPWP/686637/2011
Рис. 1. Основные этапы риск-ориентированного подхода оценки безопасности применения лекарственных препаратов
Fig. 1. Key stages in a risk-based approach to assessing the safety of medicinal product use
В качестве основных инструментов риск-ориентированного подхода в управлении рисками ЛП, таким образом, применимы: 1) организация работы с информацией о нежелательных реакциях (НР); 2) проведение активного мониторинга безопасности ЛП; 3) разработка и введение мер минимизации рисков, оценка эффективности данных мер; 4) информирование о проблемах по безопасности целевой аудитории (специалисты системы здравоохранения, пациенты и лица, осуществляющие уход, которые используют ЛП)6.
Выявление рисков
Основные источники сбора информации для выявления рисков развития НР на пострегистрационном этапе обращение ЛП — спонтанные сообщения, сообщения о НР, а также сведения, опубликованные в научной медицинской литературе, полученные из сети Интернет и других средств информации, сообщения, полученные по запросу ДРУ7, данные фармакоэпидемиологических исследований [11].
В процессе пострегистрационного мониторинга безопасности ЛП специалисты фармаконадзора в значительной мере опираются на спонтанное репортирование (спонтанные сообщения) врачами, пациентами, производителями, дистрибьюторами, сотрудниками аптечных организаций о НР ЛП. Эти сообщения агрегируются в специализированных базах данных и являются наиболее эффективным инструментом для сбора информации о неидентифицированных в клинических исследованиях НР ЛП, поскольку охватывают широкую аудиторию и не требуют больших финансовых затрат. Анализ полученной информации позволяет выявлять потенциальные риски, связанные с применением ЛП, в том числе отсроченные, и разрабатывать меры по их минимизации [3][12].
Также важными источниками информации для мониторинга профиля безопасности и соотношения «польза–риск» являются научные публикации в отечественных и зарубежных рецензируемых медицинских журналах (результаты клинических исследований, систематические обзоры и метаанализы, публикации отдельных клинических случаев) и рекомендации, размещенные на интернет-сайтах регуляторных органов по фармаконадзору. Регуляторные органы обязаны информировать субъекты обращения ЛП о рисках фармакотерапии с помощью распространения актуальных сведений по безопасности ЛП [3].
Сообщения о подозреваемых НР, полученные по запросу, поступают из систем организованного сбора данных, которые включают в себя клинические исследования, неинтервенционные исследования, регистры, персонализированные программы использования незарегистрированных ЛП, другие программы применения незарегистрированных ЛП, назначенных в связи с исключительными обстоятельствами из соображений сострадания (применение ЛП при неизлечимых или не поддающихся лечению заболеваниях и др.), и мониторинга заболеваний, опросы пациентов и медицинских работников, сбор данных об эффективности ЛП или приверженности пациентов8.
Результаты фармакоэпидемиологических исследований также могут быть использованы для сбора и анализа информации о безопасности ЛП, выявления новых или редких НР. Анализ данных фармакоэпидемиологических исследований позволяет сравнивать эффекты ЛП в популяционных группах, которые ранее не оценивались (дети, пожилые люди, беременные женщины и др.); выявлять закономерности использования ЛП при определенных заболеваниях или группах населения; изучать, как эффекты ЛП изменяются под воздействием других ЛП (взаимодействие ЛП) или заболеваний (сопутствующие заболевания); количественно определять долю серьезных НР, обнаруживать редкие и очень редкие НР, непредвиденные НР, эффекты передозировки, отсроченные НР (тератогенные, мутагенные, канцерогенные эффекты); сравнивать затраты и результаты применения ЛП, используемых для терапии одного и того же заболевания [11]. Выбор типа исследования (описательный или аналитический), а также его дизайна (перекрестное исследование, когортное исследование, исследование «случай–контроль» и др.) зависят от поставленной задачи исследования и имеющихся данных. Это позволяет минимизировать риск искажения результатов [11][13].
Факторы риска
Для различных популяций населения характерны как общие, так и специфичные факторы риска развития НР при применении ЛП. Факторы на уровне пациента увеличивают риск развития НР в значительной степени за счет влияния на фармакокинетику и/или фармакодинамику ЛП. Изменения физиологических процессов, вызванные снижением функции почек или печени, беременностью или увеличением/уменьшением массы тела, могут оказывать влияние на абсорбцию, распределение, метаболизм и выведение ЛП, в то время как генетические полиморфизмы или гормональный контроль над генетической экспрессией могут влиять как на метаболические ферменты, участвующие в процессах всасывания, распределения, метаболизма и экскреции, так и на рецепторы/мишени. Факторы риска возникновения НР с иммунологическим патогенезом, таких как НР, связанные с человеческим лейкоцитарным антигеном (human leukocyte antigens, HLA), также могут быть генетически детерминированы. Выявление и характеристика факторов риска возникновения НР ЛП позволяет принять меры по минимизации вреда от применения ЛП [14].
Факторами риска развития НР могут быть возраст, пол, наличие сопутствующих заболеваний и др. Так, например, в результате исследования [14], в котором была проведена оценка 354 приоритетных статистических сигналов базы данных НР Всемирной организации здравоохранения (VigiBase), для уже известных НР ЛП были установлены новые потенциальные популяционные группы риска, связанные с возрастом (пожилые), полом (мужчины и женщины), индексом массы тела (недостаточный вес и ожирение) и географическим регионом (Азия), а также описаны предполагаемые факторы риска возникновения НР в каждой группе (табл. 1, опубликована на сайте журнала9).
Результаты исследований показали, что у людей пожилого и старческого возраста риск развития НР выше по сравнению с более молодыми, и увеличение возраста может представлять собой один из факторов риска их возникновения [15]. У пожилых пациентов НР при приеме одного ЛП возникают приблизительно в 10% случаев, а при приеме свыше 10 ЛП, то есть в условиях полипрагмазии, — практически в 100% случаев. При этом наблюдается увеличение летальности до 10%. У пожилых людей происходят изменения структуры и функции органов и систем, вызванные естественными процессами старения организма, которые могут потенциально влиять на фармакокинетику и фармакодинамику ЛП, повышая риск развития НР, в том числе лекарственно-индуцированных заболеваний [16]. Также факторами риска увеличения развития НР на ЛП у пациентов пожилого возраста являются: физиологические возрастные изменения, мультиморбидность, функциональные нарушения (например, нарушение зрения или слуха, трудности при ходьбе), гериатрические синдромы (делирий, падения, ортостатическая гипотензия), когнитивные и сенсорные нарушения и др. [15]. Если планируется применение ЛП у пациентов данной популяционной группы, то эти факторы риска следует учитывать.
В детской популяции эффективность и безопасность ЛП могут отличаться от таковых не только во взрослой, но и в разных возрастных группах (например, новорожденные и подростки). Риск возникновения НР ЛП у детей могут повысить такие специфичные для этой популяции факторы, как ограниченные данные по фармакокинетике и фармакодинамике, полученные в доклинических и клинических исследованиях, их изменения в процессе роста и развития ребенка, возрастные гормональные изменения. Так, у новорожденных и детей раннего возраста в течение первых месяцев жизни происходит активное изменение фармакокинетических и/или фармакодинамических процессов. Это обусловлено развитием органов, изменениями в распределении жира в жировой ткани и в активности ферментов, участвующих в метаболизме ЛП. Например, младенцы и дети младшего возраста могут быть более подвержены риску повреждения печени при приеме вальпроатов из-за возрастных различий путей метаболизма вальпроевой кислоты [17]. В подростковом возрасте активные гормональные изменения могут также оказывать влияние на процессы метаболизма некоторых ЛП, например антигипергликемических препаратов при сахарном диабете II типа, тем самым повышая риск развития НР [18][19].
Изменения дозы и частоты приема ЛП у детей повышают вероятность ошибок, увеличивающих риск развития НР. Риск некорректного дозирования ЛП в этой популяции выше, чем у взрослых, также в связи с недостаточным количеством удобных для детей лекарственных форм, недостаточной подготовкой медицинских и фармацевтических работников [20].
Применение ЛП off-label (не в соответствии с общей характеристикой лекарственного препарата (ОХЛП) или инструкцией по медицинскому применению (ИМП)) является еще одним фактором, увеличивающим риск развития НР [21]. К случаям off-label применения ЛП относят: назначение противопоказанного при данной патологии ЛП; назначение по незарегистрированным показаниям; назначение не указанным в инструкции популяциям (беременные) или возрастным группам (дети, пожилые); одновременное назначение ЛП в неблагоприятных комбинациях; использование ЛП с нарушением способов применения (кратности, дозирования, пути введения, продолжительности лечения) [21–23]. Основными группами пациентов, среди которых применение ЛП off-label наиболее распространено, являются дети, беременные женщины, лица пожилого и старческого возраста, пациенты с онкологическими и орфанными заболеваниями, лица, получающие паллиативную медицинскую помощь, пациенты с психическими заболеваниями и расстройствами [21]. Законодательные требования к критериям включения пациентов данных популяционных групп в клинические исследования более жесткие, поэтому частота проведений исследований гораздо реже. Применение ЛП off-label у таких пациентов наиболее распространено, поскольку не всегда возможно найти ЛП, зарегистрированный для использования в данной популяции в конкретной клинической ситуации [21].
Оценка рисков
Оценка рисков в фармаконадзоре представляет собой систематический подход к выявлению, оценке и управлению потенциальными рисками ЛП. Основные этапы оценки рисков применения ЛП представлены на рисунке 2.

Рисунок подготовлен автором по данным источника10 / The figure is adapted from10
Рис. 2. Основные этапы оценки рисков при применении лекарственных препаратов
Fig. 2. Main stages of risk assessment in the use of medicinal products
Таким образом, оценка рисков играет важную роль в обеспечении безопасности ЛП и соблюдении нормативных требований. Систематический сбор достоверных и актуальных данных из разных источников, в том числе мониторинг научной литературы, имеет решающее значение для проведения комплексной оценки риска. Объективный подход к оценке рисков способствует принятию обоснованных решений специалистами по фармаконадзору, минимизации потенциальных рисков, связанных с применением ЛП, и повышает их безопасность для целевой популяции.
Управление рисками
Проактивное управление рисками ЛП является отличительной чертой современного фармаконадзора. Управление рисками заключается в проведении оценки соотношения «польза–риск» применения ЛП на протяжении всего пострегистрационного этапа его применения, практическом внедрении, выполнении и оценке влияния разработанных мер по минимизации риска(ов), а также, при необходимости, внесении в них изменений, разработанных для обеспечения максимальной эффективности и безопасности ЛП [24]. Для снижения риска возникновения установленной проблемы по безопасности ЛП разрабатывается ПУР, в который включают информацию о рутинных и дополнительных мерах минимизации рисков ЛП [25].
Введение рутинных мер минимизации рисков является обязательным для всех ЛП. К рутинным мерам минимизации рисков относятся: ОХЛП/ИМП, листок-вкладыш (ЛВ), маркировка ЛП, размер упаковки, категория отпуска ЛП [26]. В ОХЛП/ИМП, ЛВ рутинное информирование о риске основано на информации разделов «Особые группы пациентов», «Режим дозирования и способ применения», «Особые указания и меры предосторожности при применении», «Показания к применению», «Противопоказания», «Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия», «Влияние на способность управлять транспортными средствами и работать с механизмами», «Передозировка»11. Рутинными также являются такие меры минимизации рисков, выходящие за рамки стандартной медицинской помощи, как: проведение лабораторных исследований перед назначением ЛП, мониторинг лабораторных показателей в период лечения, корректировка дозы или прекращение лечения при обнаружении НР (в том числе при изменении лабораторных показателей), предоставление рекомендаций по контрацепции, запрет на применение других ЛП во время приема назначенного ЛП, лечение или профилактика заболеваний, которые могут быть факторами риска и привести к НР ЛП, рекомендация долгосрочного клинического наблюдения для выявления отсроченных НР на ранних стадиях [25].
Если риски недостаточно контролируются с помощью рутинных мер, могут быть введены дополнительные меры их минимизации для обеспечения благоприятного соотношения «польза–риск» [27]. Такие меры могут потребоваться на момент выдачи регистрационного удостоверения ЛП, а также могут быть введены или прекращены в течение жизненного цикла ЛП по мере появления новой информации о безопасности [28]. Они включают в себя образовательные материалы для медицинских работников, пациентов, лиц, осуществляющих уход за больным, в дополнение к ОХЛП/ИМП/ЛВ; программы контролируемого доступа; программы контролируемого распределения ЛП, при которых отслеживаются все этапы его распространения; программы по предотвращению беременности; непосредственное обращение к специалистам системы здравоохранения [28–30] (табл. 2).
Таблица 2. Дополнительные меры минимизации рисков при применении лекарственных препаратов (по данным [28])
Table 2. Additional risk minimisation measures in the use of medicinal products (according to [28])
Вид Type | Описание Description | Комментарий Comment |
Образовательные материалы Educational programmes | Содержат дополнительную информацию о нежелательной реакции (факторы риска, симптомы нежелательной реакции и др.) к информации, представленной в общей характеристике лекарственного препарата, инструкции по медицинскому применению и листке-вкладыше, о действиях пациента при появлении симптомов данной нежелательной реакции, рекомендации по предотвращению и минимизации рисков ее возникновения Contain additional information about the adverse reaction (risk factors, symptoms of adverse reaction, etc.) to that provided in the general description of the medicinal product, summaries of medicinal product characteristics and patient information leaflets, about the patient's actions in case of symptoms of this adverse reaction, recommendations for prevention and minimisation of risks of its occurrence | Могут быть предназначены для медицинских работников и/или пациентов и лиц, осуществляющих уход за ними May be intended for healthcare professionals and/or patients and caregivers |
Программы контролируемого доступа Controlled access programmes | Меры, направленные на контроль доступа к лекарственному препарату за пределами его правового статуса. Назначение или отпуск лекарственного препарата обусловлены выполнением определенных критериев Consist of measures aimed at controlling access to medicinal products outside their legal status. The prescription or dispensing of a medicinal product is conditioned upon the fulfillment of certain criteria | Критериями доступа могут быть, например, прохождение программы обучения, выполнение определенных диагностических тестов Access criteria may include, for example, completing a training programme or passing certain diagnostic tests |
Программы контролируемого распределения лекарственного препарата Controlled distribution systems | Включают комплекс мер, позволяющих обеспечить отслеживание лекарственного препарата на всех этапах цепочки его распространения (вплоть до рецепта и/или аптеки, осуществляющей отпуск) Include a set of measures to ensure that a medicinal product can be traced along the distribution chain (down to the prescription and/or dispensing pharmacy) | Нет No |
Программы по предотвращению беременности Pregnancy prevention programmes | Включают комплекс мероприятий, направленных на минимизацию риска беременности во время терапии лекарственным препаратом с известным или потенциальным тератогенным действием Include a set of measures aimed at minimising the risk of pregnancy during therapy with a medicinal product with known or potential teratogenic effects | Нет No |
Непосредственное обращение к специалистам системы здравоохранения Direct healthcare professional communications | Информирование непосредственно отдельных медицинских работников держателем регистрационного удостоверения или компетентным органом о необходимости предпринять определенные действия или адаптировать свою практику в отношении лекарственного препарата Informing of individual healthcare professionals about the need to take certain actions or adapt their practice in relation to a medicinal product (conducted directly by the marketing authorisation holder or the competent authority) | Информирование может быть направлено, например, на адаптацию поведения при назначении лекарственного препарата для минимизации определенных рисков и/или снижения риска развития нежелательных реакций For example, this may be aimed at adapting behaviour when prescribing a medicinal product to minimise certain risks and/or reduce the risk of adverse reactions |
Таблица адаптирована автором из научной публикации / The table is adapted by the author from the scientific publication
ПУР, основанные на хорошо проверенных моделях изменения поведения (например, Теория обоснованных действий, модель, основанная на комплексном подходе к оценке потребностей в области здоровья, разработке, реализации и оценке программ общественного здоровья (модель PRECEDE-PROCEED) и теория распространения инноваций), более эффективны в достижении желаемых поведенческих изменений в целевой популяции(-ях) и в поддержании их воздействия с течением времени. Модель изменения поведения представляет собой теоретически обоснованную структуру, которую можно использовать для понимания и прогнозирования воздействия конкретного вмешательства (например, сообщения о рисках) на отношение, поведение и степень принятия вмешательства целевыми получателями [24].
Для того чтобы меры минимизации рисков развития НР и соответствующая информация достигли целевой аудитории, необходимо заранее определить каналы их распространения (например, врачи, информационные стенды в поликлиниках, социальные сети и др.). Кроме того, необходимо тщательно учитывать время и частоту распространения любого вмешательства, поскольку разового распространения образовательных материалов может быть недостаточно для обеспечения охвата всей целевой популяции, которым назначается ЛП, включая новые популяционные группы, которым потенциально может быть назначен препарат. Чем дольше связь какого-либо риска с ЛП остается не выявленной, тем дольше пациенты подвергаются воздействию, которое может нанести вред, поэтому эффективные процессы управления рисками имеют важное значение.
В исследованиях по оценке минимизации рисков оцениваются различные аспекты эффективности мер минимизации рисков с использованием комбинации показателей процесса: достижение целевой популяции, оценка клинических знаний (проведение аналитических вопросов), клинические действия (анализ листов назначения ЛП, данные медицинских карт пациентов [4]) и достигнутые результаты. Индикаторы процесса могут включать оценку влияния на информированность и изменения в поведении пациентов и медицинских работников. Итоговым показателем успеха мер минимизации рисков являются положительные клинические результаты, такие как снижение частоты развития и/или тяжести НР [24].
ВЫВОДЫ
- Основными инструментами риск-ориентированного подхода в фармаконадзоре являются: организация работы с информацией о НР, включая активный мониторинг безопасности ЛП; разработка и введение мер минимизации рисков и оценка их эффективности; информирование о проблемах по безопасности целевой аудитории (специалисты системы здравоохранения, пациенты и лица, осуществляющие уход).
- Предложен возможный вариант риск-ориентированного подхода с использованием доступных инструментов, который может быть применен специалистами фармаконадзора при управлении рисками ЛП.
- Описаны основные этапы данного подхода и инструменты для их выполнения.
- Систематизирован в формате алгоритма процесс проведения оценки рисков ЛП.
- Описаны основные меры по минимизации рисков ЛП.
Внедрение риск-ориентированного подхода способствует повышению эффективности системы управления рисками в обеспечении лекарственной безопасности.
Дополнительная информация. Таблица 1 размещена на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2025-13-2-138-148-tabl
Additional information. Table 1 is published on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2025-13-2-138-148-tabl
Вклад авторов. Автор подтверждает соответствие своего авторства критериям ICMJE.
Authors’ contributions. The author confirms that she meets the ICMJE criteria for authorship.
1. Постановление Правительства Российской Федерации от 29.06.2021 № 1049 (ред. от 06.11.2024) «О федеральном государственном контроле (надзоре) в сфере обращения лекарственных средств».
2. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
3. Там же.
4. Там же.
5. Guideline on the risk-based approach according to annex I, part IV of Directive 2001/83/EC applied to advanced therapy medicinal products. EMA/CAT/CPWP/686637/2011. EMA; 2013.
6. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
7. Там же.
8. Там же.
9. https://doi.org/10.30895/2312-7821-2025-13-2-138-148-tabl
10. https://drug-card.io/blog/how-to-conduct-a-pharmacovigilance-risk-assessment/
11. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
Список литературы
1. Kuzmina AV, Asetskaya IL, Zyryanov SK, Polivanov VA. Detecting medication errors associated with the use of beta-lactams in the Russian Pharmacovigilance database. BMC Pharmacol Toxicol. 2021;22(1):5. https://doi.org/10.1186/s40360-020-00470-x
2. Sienkiewicz K, Burzyńska M, Rydlewska-Liszkowska I, Sienkiewicz J, Gaszyńska E. The importance of direct patient reporting of adverse drug reactions in the safety monitoring process. Int J Environ Res Public Health. 2021;19(1):413. https://doi.org/10.3390/ijerph19010413
3. Шубникова ЕВ. Пострегистрационный фармаконадзор: обзор открытых источников получения данных по безопасности лекарственных препаратов. Безопасность и риск фармакотерапии. 2024;12(3):309–30. https://doi.org/10.30895/2312-7821-2024-12-3-309-330
4. Комиссарова ВА. Меры минимизации рисков в фармаконадзоре: обзор отечественного и зарубежного опыта. Качественная клиническая практика. 2019;(3):33–43. https://doi.org/10.24411/2588-0519-2019-10081
5. Кузнецова ЕВ, Журавлева МВ, Михайлов ИА, Хабриев РУ. Разработка организационной технологии по управлению лекарственной безопасности в медицинских организациях на основе риск-ориентированного подхода. Бюллетень Национального научно-исследовательского института общественного здоровья имени Н.А. Семашко. 2024;(2):71–80. https://doi.org/10.69541/NRIPH.2024.02.012
6. Ezaki A, Hirakawa A, Hanaoka H, Uyama Y. Factors influencing classifications of safety specifications in a risk management plan for antineoplastic agents approved in Japan: a review and descriptive analysis. Ther Innov Regul Sci. 2021;55(5):1075–81. https://doi.org/10.1007/s43441-021-00309-5
7. Журавлева МВ, Романов БК, Городецкая ГИ, Муслимова ОВ, Крысанова ВС, Демченкова ЕЮ. Актуальные вопросы безопасности лекарственных средств, возможности совершенствования системы фармаконадзора. Безопасность и риск фармакотерапии. 2019;7(3):109–19. https://doi.org/10.30895/2312-7821-2019-7-3-109-119
8. Кузнецова ЕВ, Журавлева МВ, Михайлов ИА, Курносова ТИ. Разработка методических подходов к формированию риск-ориентированной модели для минимизации возникновения нежелательных реакций при применении лекарственных препаратов в медицинских организациях города Москвы. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(2):248–57. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.184
9. Мельникова ОА, Смирнов АВ, Марченко СД, Мельников МЮ. Модель риск-ориентированного подхода при осуществлении фармацевтической деятельности. Фармация. 2022;71(2):41–8. https://doi.org/10/29296/25419218-2022-02-07
10. Маевская ВА, Горелов КВ, Корзина НС, Стромова АС. Фармаконадзор в Ярославской области на примере антибактериальных лекарственных препаратов. Вестник Волгоградского государственного медицинского университета. 2021;(2):169–76. https://doi.org/10.19163/1994-9480-2021-2(78)-169-176
11. Sabaté M, Montané E. Pharmacoepidemiology: An overview. J Clin Med. 2023;12(22):7033. https://doi.org/10.3390/jcm12227033
12. Alomar M, Tawfiq AM, Hassan N, Palaian S. Post marketing surveillance of suspected adverse drug reactions through spontaneous reporting: current status, challenges and the future. Ther Adv Drug Saf. 2020;11:2042098620938595. https://doi.org/10.1177/2042098620938595
13. Etminan M, Gill S, Fitzgerald M, Samii A. Challenges and opportunities for pharmacoepidemiology in drug-therapy decision making. J Clin Pharmacol. 2006;46(1):6–9. https://doi.org/10.1177/0091270005283285
14. Sandberg L, Taavola H, Aoki Y, Chandler R, Norén GN. Risk factor considerations in statistical signal detection: Using subgroup disproportionality to uncover risk groups for adverse drug reactions in VigiBase. Drug Saf. 2020;43(10):999–1009. https://doi.org/10.1007/s40264-020-00957-w
15. Zazzara MB, Palmer K, Vetrano DL, Carfì A, Onder G. Adverse drug reactions in older adults: a narrative review of the literature. Eur Geriatr Med. 2021;12(3):463–73. https://doi.org/10.1007/s41999-021-00481-9
16. Сычев ДА, Остроумова ОД, Переверзев АП, Кочетков АИ, Остроумова ТМ, Клепикова МВ, Эбзеева ЕЮ. Пожилой и старческий возраст пациентов как фактор риска развития лекарственно-индуцированных заболеваний. Безопасность и риск фармакотерапии. 2021;9(1):15–24. https://doi.org/10.30895/2312-7821-2021-9-1-15-24
17. Bűdi T, Tóth K, Nagy A, Szever Z, Kiss Á, Temesvari M, et al. Clinical significance of CYP2C9-status guided valproic acid therapy in children. Epilepsia. 2015;56(6):849–55. https://doi.org/10.1111/epi.13011
18. Aurich B, Apele-Freimane D, Banaschewski T, Chouchana L, Day S, Kaguelidou F, et al. c4c: Paediatric pharmacovigilance: Methodological considerations in research and development of medicines for children — A c4c expert group white paper. Br J Clin Pharmacol. 2022;88(12):4997–5016. https://doi.org/10.1111/bcp.15119
19. Akhlaghi F, Matson KL, Mohammadpour AH, Kelly M, Karimani A. Clinical pharmacokinetics and pharmacodynamics of antihyperglycemic medications in children and adolescents with type 2 diabetes mellitus. Clin Pharmacokinet. 2017;56(6):561–71. https://doi.org/10.1007/s40262-016-0472-6
20. Sutherland A, Ashcroft DM, Phipps DL. Exploring the human factors of prescribing errors in paediatric intensive care units. Arch Dis Child. 2019;104(6):588–95. https://doi.org/10.1136/archdischild-2018-315981
21. Марцевич СЮ, Навасардян АР, Комкова НА. Назначение лекарственных средств не в соответствии с официальной инструкцией по медицинскому применению (off-label). возможные причины, виды и последствия. Правовое регулирование в Российской Федерации. Рациональная фармакотерапия в кардиологии. 2017;13(5):667–74. https://doi.org/10.20996/1819-6446-2017-13-5-667-674
22. Русских СВ, Тарасенко ЕА, Москвичева ЛИ, Орлов СА, Трякин АА, Воробьева АВ и др. Лекарственные препараты «off-label»: правовые проблемы и социально-экономические аспекты практики применения. Фармация и фармакология. 2023;11(2):149–60. https://doi.org/10.19163/2307-9266-2023-11-2-149-160
23. Belayneh A, Tadese E, Molla F. Safety and biopharmaceutical challenges of excipients in off-label pediatric formulations. Int J Gen Med. 2020;13:1051–66. https://doi.org/10.2147/IJGM.S280330
24. Mouchantaf R, Auth D, Moride Y, Raine J, Han SY, Smith MY. Risk management for the 21st century: Current status and future needs. Drug Saf. 2021;44(4):409–19. https://doi.org/10.1007/s40264-020-01033-z
25. Esslinger S, Quinn L, Sampat S, Otero-Lobato M, Noël W, Geldhof A, et al. Risk management plans: Reassessment of safety concerns based on Good Pharmacovigilance Practices Module V (Revision 2)-a company experience. J Pharm Health Care Sci. 2022;8(1):14. https://doi.org/10.1186/s40780-022-00244-z
26. Renske JG, Thomas G, Helga G. Limitations reported in evaluating effectiveness of risk minimization measures in the EU during 2018–2021: A qualitative analysis of industry-sponsored post-authorization safety studies. Clinical Pharmacology & Therapeutics. 2024;116(5):1252–8. https://doi.org/10.1002/cpt.3369
27. Essink SCM, Zomerdijk IM, Goedecke T, Straus SMJM, Gardarsdottir H, De Bruin ML. Duration of time intervals for risk mini¬mization measure effectiveness studies. Clin Pharmacol Ther. 2025;117(4):1106–14. https://doi.org/10.1002/cpt.3569
28. Francisca RDC, Baba E, Hoeve CE, Zomerdijk IM, Sturkenboom MCJM, Straus SMJM. Introduction or discontinuation of additional risk minimisation measures during the life cycle of medicines in Europe. Drug Saf. 2021;44(1):63–72. https://doi.org/10.1007/s40264-020-00993-6
29. Букатина ТМ, Шубникова ЕВ. План управления рисками: экспертная оценка представления в зависимости от типа лекарственного препарата при регистрации в ЕАЭС (обзор). Безопасность и риск фармакотерапии. 2024;12(2):201–13. https://doi.org/10.30895/2312-7821-2024-12-2-201-213
30. Essink SCM, Zomerdijk IM, Straus SMJM, Gardarsdottir H, DeBruin ML. Duration of effectiveness evaluation of additional risk minimisation measures for centrally authorised medi¬cinal products in the EU Between 2012 and 2021. Drug Saf. 2023;46(10):1007–20. https://doi.org/10.1007/s40264-023-01341-
Об авторе
Т. М. БукатинаРоссия
Букатина Татьяна Михайловна, канд. мед. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы

|
1. Таблица 1. Факторы риска развития нежелательных реакций при применении некоторых препаратов в разных популяционных группах (по данным [14]) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(136KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Букатина Т.М. Алгоритмы оценки риска в фармаконадзоре: обзор. Безопасность и риск фармакотерапии. 2025;13(2):138-148. https://doi.org/10.30895/2312-7821-2025-13-2-138-148
For citation:
Bukatina T.M. Risk Assessment Algorithms in Pharmacovigilance: A Review. Safety and Risk of Pharmacotherapy. 2025;13(2):138-148. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-2-138-148