Перейти к:
Фатальный рабдомиолиз после модификации дозы розувастатина в рамках терапии острого коронарного синдрома: клинический случай
https://doi.org/10.30895/2312-7821-2025-13-3-333-343
Резюме
ВВЕДЕНИЕ. Пациенты после острого коронарного синдрома находятся в группе высокого риска повторных сердечно-сосудистых катастроф, для предотвращения которых в рамках клинических рекомендаций они получают интенсивную липидоснижающую и дезагрегантную терапию. Однако интенсификация терапии сопряжена с повышенным риском развития нежелательных реакций (НР). В представленном клиническом случае приведено описание фатального рабдомиолиза, ассоциированного с высокодозной терапией розувастатином. Проанализированы факторы риска этой НР, знание которых может помочь предотвратить аналогичные события у пациентов.
ОПИСАНИЕ СЛУЧАЯ. Пациент 68 лет, мужчина, находился на постоянной терапии розувастатином 10 мг/сут в течение 3-х лет с удовлетворительной переносимостью. После развития острого коронарного синдрома доза розувастатина была увеличена до максимальной (40 мг/сут), назначена двойная дезагрегантная терапия тикагрелором и ацетилсалициловой кислотой, а также бисопролол, амлодипин, омепразол, периндоприл, спиронолактон. В течение месяца у пациента развились мышечные боли, острая почечная недостаточность с клинико-лабораторной картиной, подтверждающей рабдомиолиз. Несмотря на интенсивную терапию, через 8 сут пациент скончался. Был проведен анализ на генетические маркеры индивидуальных особенностей фармакокинетики розувастатина со следующими результатами: CYP2C9 *1*1 (нормальная активность), SLCO1B1 *5*15 (сниженная активность в гомозиготном состоянии), ABCG2 c.421 C/C (нормальная активность). Анализ лекарственных взаимодействий по данным литературы выявил вероятность дополнительного повышения концентрации розувастатина (до 2,6 раза) на фоне угнетения тикагрелором активности транспортера BCRP (белка резистентности рака молочной железы).
ВЫВОДЫ. В описанном случае фатальный статин-ассоциированный рабдомиолиз развился на фоне двух значимых факторов: генетической предрасположенности и значимого межлекарственного взаимодействия розувастатина с тикагрелором, что привело к нарушению работы сразу двух белков-переносчиков: BCRP, определяющего биодоступность препарата, и OATPB1, осуществляющего его транспорт через мембрану гепатоцита. При ведении пациентов, которым показана высокодозная терапия статинами и другими препаратами, обладающими потенциалом значимых лекарственных взаимодействий, следует осуществлять фармакогенетическое тестирование, а также активный мониторинг лабораторных показателей в первые дни после назначения лекарственной терапии для своевременной диагностики возможных осложнений.
Ключевые слова
Для цитирования:
Макарова Т.А., Загородникова К.А., Макаров И.А., Добрынина Н.В., Свентицкая Е.Е., Лобачева Ю.Н. Фатальный рабдомиолиз после модификации дозы розувастатина в рамках терапии острого коронарного синдрома: клинический случай. Безопасность и риск фармакотерапии. 2025;13(3):333-343. https://doi.org/10.30895/2312-7821-2025-13-3-333-343
For citation:
Makarova T.A., Zagorodnikova K.A., Makarov I.A., Dobrynina N.V., Sventitskaya E.E., Lobacheva Yu.N. Fatal Rhabdomyolysis after Rosuvastatin Dose Modification in Acute Coronary Syndrome: A Case Report. Safety and Risk of Pharmacotherapy. 2025;13(3):333-343. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-3-333-343
ВВЕДЕНИЕ
Значение вторичной профилактики у пациентов, перенесших острый коронарный синдром (ОКС), трудно переоценить, поскольку именно она позволяет значительно снизить риск повторных сердечно-сосудистых событий и улучшить качество жизни. Одним из ключевых компонентов эффективной вторичной профилактики острых коронарных событий является назначение препаратов группы ингибиторов ГМК-КоА редуктазы (статинов), способных ингибировать синтез холестерина и, как следствие, снижать уровень липопротеинов низкой плотности (ЛПНП), а также производить дополнительные плейотропные эффекты, включая стабилизацию атеросклеротических бляшек, что, в свою очередь, уменьшает риск тромбообразования [1][2]. Адекватная терапия статинами после перенесенного ОКС значительно снижает вероятность повторных инфарктов, инсультов и других сердечно-сосудистых катастроф [3][4]. Пациентам, переносящим ОКС, рекомендовано раннее назначение статинов в высоких дозах (аторвастатин в дозе 40–80 мг/сут, розувастатин в дозе 20–40 мг/сут) в связи с их способностью модулировать тромботические осложнения, стабилизировать функцию эндотелия, подавлять воспаление, снижать вероятность разрыва атеросклеротической бляшки, оказывать протективное действие на миокард [5][6]. Назначение статинов как лекарственных препаратов с высоким классом доказательности в сочетании с антагонистами рецепторов P2Y12 стало неотъемлемой частью комплексного подхода к лечению пациентов, перенесших ОКС, и обосновывает устойчивое положение в российских1 и зарубежных клинических рекомендациях [7].
Однако в ряде случаев применение статинов ограничивается их непереносимостью и/или развитием нежелательных реакций, что вызывает необходимость снижения дозы препарата (несмотря на рекомендованную агрессивную гиполипидемическую терапию), отмены и модификации терапии [8]. К частым нежелательным реакциям со стороны скелетно-мышечной и соединительной ткани на фоне терапии статинами, согласно данным инструкций по применению лекарственных препаратов этой группы, относятся миалгия, миопатия (включая миозит) и рабдомиолиз; очень редко регистрируется артралгия2.
Среди факторов риска развития рабдомиолиза на фоне приема статинов указывают мужской пол, применение статинов в высоких дозах, наличие генетических полиморфизмов, отвечающих за транспорт статинов в гепатоцит или функции миоцитов, а также одновременное применение препаратов, нарушающих мышечный метаболизм, замедляющих выведение и метаболизм статинов [9][10]. В этой связи крайне важно выявлять у пациентов, получающих статины в высоких дозах, факторы риска потенциально фатальных осложнений терапии. Представлено описание развития фатального рабдомиолиза у пациента, которому после перенесенного ОКС назначен розувастатин в максимальной дозе в составе многокомпонентной фармакотерапии.
ОПИСАНИЕ СЛУЧАЯ
Пациент 68 лет, мужчина, европеоидной расы с известным длительным анамнезом артериальной гипертензии без достижения целевого уровня на фоне гипотензивной терапии самостоятельно инициировал прием розувастатина в дозе 10 мг/сут приблизительно 3 г. назад (показание к назначению не уточнено). Терапию розувастатином пациент переносил удовлетворительно.
С начала февраля 2025 г.: клинические проявления впервые возникшей стенокардии, по поводу чего 11.02.2025 экстренно госпитализирован в стационар, где был диагностирован острый инфаркт миокарда с патологическим зубцом Q передней стенки левого желудочка от 01.02.2025 (рубцовые изменения, по данным электрокардиографии от 11.02.2025), ранняя постинфарктная стенокардия от 11.02.2025. Пациенту 11.02.2025 выполнена чрескожная коронарная ангиопластика со стентированием правой межжелудочковой ветви двумя стентами с лекарственным покрытием. В период госпитализации была диагностирована неуточненная острая респираторная вирусная инфекция с фебрильной лихорадкой и катаральными явлениями.
Через неделю пребывания в стационаре пациент был выписан на амбулаторный этап с рекомендациями терапии в объеме: тикагрелор 180 мг/сут, бисопролол 5 мг/сут, омепразол 40 мг/сут (в последующем пациент самостоятельно произвел замену лекарственного препарата из группы ингибиторов протонной помпы на пантопразол 40 мг/сут), ацетилсалициловая кислота 100 мг/сут, периндоприл 10 мг/сут, амлодипин 10 мг/сут, розувастатин 40 мг/сут, спиронолактон 25 мг/сут. Показатели функции почек и печени в период госпитализации (17.02.2025) были несколько повышены, с тенденцией к нормализации при выписке из стационара: креатинин 90 мкмоль/л, скорость клубочковой фильтрации по формуле Кокрофта–Голта 76 мл/мин, аспарагиновая трансаминаза (АСТ) 82,2 Ед/л, аланиновая трансаминаза (АЛТ) 40 Ед/л, билирубин общий 23,3 мкмоль/л. На амбулаторном этапе в динамике эти показатели не контролировались. У пациента до марта 2025 г. сохранялись субфебрильные значения температуры тела.
Ухудшение самочувствия произошло в начале марта 2025 г., когда пациент не смог самостоятельно встать с кровати, ощутил нарастающую слабость в нижних конечностях, а также слабость в плечевых мышцах, боли в тазобедренных суставах, субфебрильную температуру, учащение мочеиспускания, изменение цвета мочи до бурого. Через сутки был экстренно госпитализирован в стационар с представлением об остром нарушении мозгового кровообращения.
При поступлении в стационар обращали на себя внимание высокие значения следующих лабораторных показателей: общая креатинфосфокиназа (КФК) 57 703,9 Ед/л, миоглобин более 1200 нг/мл, креатинфосфокиназа-МВ (КФК-MB) 106,0 ЕД/л (доля от общей — 0,2%), креатинин 400 мкмоль/л, АСТ 2611,2 Ед/л, АЛТ до 578,0 Ед/л, без повышения уровня общего билирубина (13,9 мкмоль/л), повышение активности лактатдегидрогеназы до 5799,0 Ед/л.
Наблюдалось повышение значений маркеров воспаления: лейкоцитоз в клиническом анализе крови до 13,7×10⁹/л, С-реактивный белок до 79,58 мг/л; прокальцитонин не повышен (0,385 нг/мл), тропонин I до 0,2 нг/мл (в дальнейшем без нарастания, за исключением предтерминального периода). По данным ультразвукового исследования органов брюшной полости изменений в структуре печени не выявлено, отмечалось диффузное повышение эхогенности почек. Экстренно выполнена мультиспиральная компьютерная томография головного мозга, по данным которой признаков острого нарушения мозгового кровообращения не обнаружено, визуализировалась КТ-картина полисинусита. Была выполнена ЭХОкардиография, результаты которой показали, что фракция выброса сохранена, без зон гипокинезии и акинезии.
Клинически у пациента наблюдались: неврологический дефицит (периферическая полинейропатия, периферический проксимальный тетрапарез до 4 баллов в верхних конечностях, до 0–1 балла в нижних конечностях), интоксикационный синдром. В дальнейшем выполнялся диагностический поиск, в ходе которого были исключены аутоиммунная воспалительная полирадикулоневропатия Гийена–Барре, острая перемежающаяся порфирия, дерматомиозит. Выполнена люмбальная пункция, по данным которой ликвор бесцветный, прозрачный, под повышенным давлением, без воспалительных изменений, белок не повышен. Пациенту была выполнена магнитно-резонансная томография поясничного отдела позвоночника, по данным которой обнаружен выраженный отек мышц спины, в большей степени на уровне L3–L5 сегментов. Лабораторно в динамике регистрировалось дальнейшее увеличение уровня миоглобина до 887 430 нг/мл, активности КФК до 184 740 Ед/л, миоглобиновой фракции КФК до 2216 Ед/л, лактатдегидрогеназы до 48 537 Ед/л, АСТ до 8350 Ед/л, АЛТ до 1124,2 Ед/л, уровня креатинина до 716,0 мкмоль/л (указаны максимальные зафиксированные значения по каждому из маркеров за период наблюдения). Щелочная фосфатаза, билирубин и его фракции в динамике без клинически значимого нарастания. Преобладание АСТ при отсутствии повышения уровня билирубина, нарушений коагуляции (протромбиновое время 14 с, протромбин по Квику 84%), других признаков повреждения печени свидетельствовали о том, что повышение активности трансаминаз входит в структуру текущего тяжелого рабдомиолиза [11]. Динамика ключевых лабораторных показателей в период госпитализации отражена на рисунке 1.
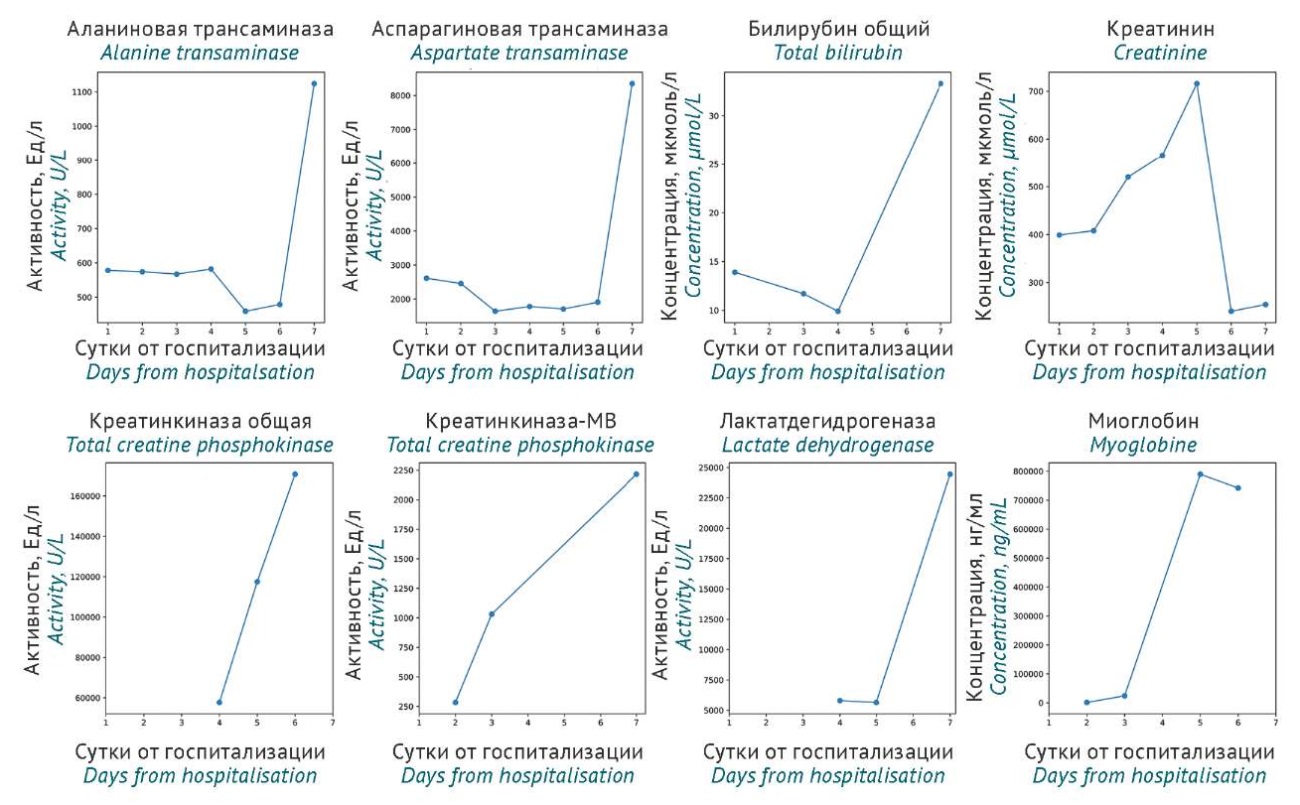
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Динамика ключевых лабораторных показателей пациента, госпитализированного по поводу рабдомиолиза, развившегося после модификации дозы розувастатина при лечении острого коронарного синдрома
Fig. 1. Dynamics of key laboratory parameters for the patient admitted due to rhabdomyolysis after rosuvastatin dose modification for treatment of acute coronary syndrome
По результатам очередной мультиспиральной компьютерной томографии 10.03.2025 выявлена картина субдуральной гематомы справа большого объема с выраженной дислокацией срединных структур, ввиду чего по жизненным показаниям неотложно выполнена резекционная трепанация черепа в правых лобной, теменной, височной областях, а также удаление гематомы. По жизненным показаниям была отменена терапия антиагрегантами на сутки. В динамике при лабораторном контроле нарастала гиперкалиемия в сочетании с изменениями на электрокардиограмме (расширение комплекса QRS), вероятно, на фоне продолжающегося рабдомиолиза. С учетом тяжелой жизнеугрожающей гиперкалиемии и регресса геморрагического синдрома начат сеанс заместительной почечной терапии в виде низкопоточного вено-венозного гемодиализа с использованием в качестве антикоагулянта цитрата натрия. Уровень миоглобина после проведенного сеанса заместительной почечной терапии снизился незначительно, в дальнейшем вернулся к исходным значениям. Состояние пациента в течение всего периода нахождения в условиях отделения реанимации и интенсивной терапии оставалось крайне тяжелым. Через 8 сут после поступления в стационар пациент скончался.
Лекарственная терапия, назначенная пациенту в период текущей госпитализации, представлена на рисунке 2.
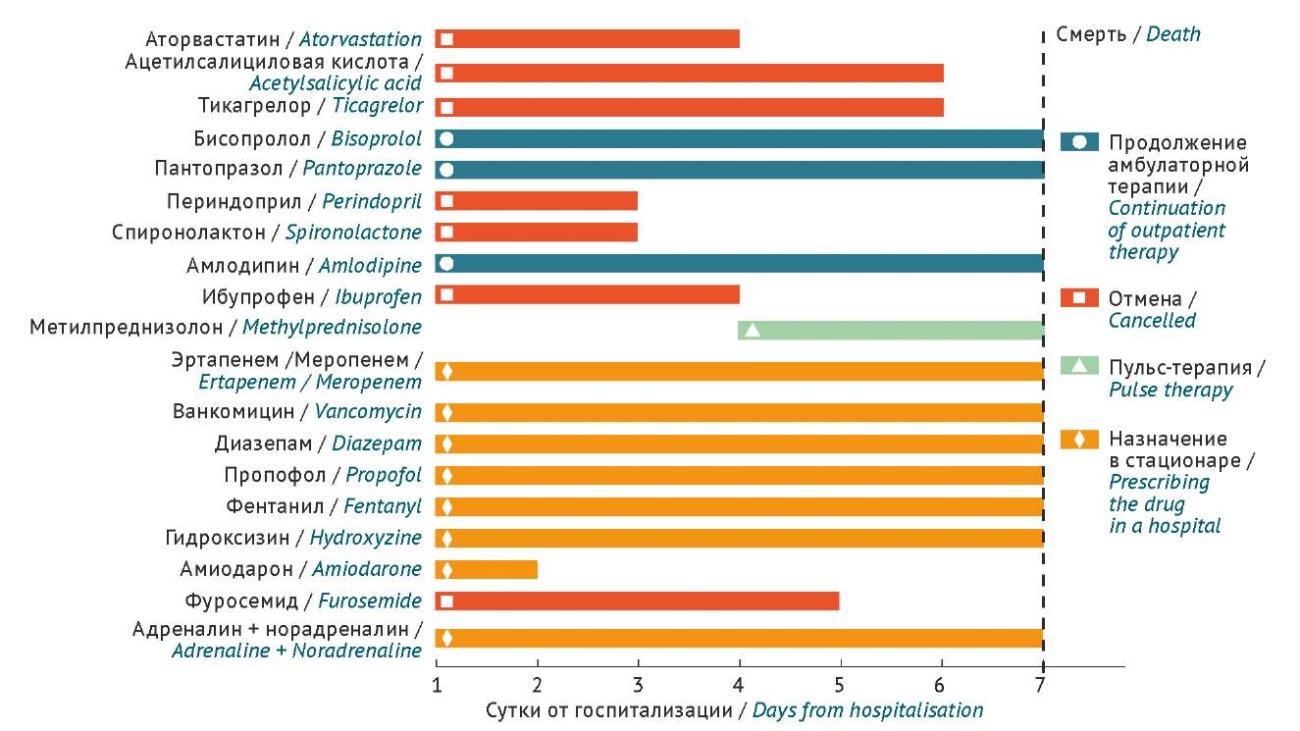
Рисунок составлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Объем стационарной лекарственной терапии пациента, госпитализированного по поводу рабдомиолиза, развившегося после модификации дозы розувастатина при лечении острого коронарного синдрома
Fig. 2. In-hospital medications for the patient admitted due to rhabdomyolysis after rosuvastatin dose modification for treatment of acute coronary syndrome
Аутопсийное исследование подтвердило наличие у пациента острого повреждения почек, вызванного массивным рабдомиолизом, который затронул как скелетную мускулатуру, так и миокард. В скелетных мышцах обнаружены обширные зоны мозаичного рабдомиолиза с минимальной тканевой реакцией, что, вероятно, связано с проведением интенсивной противовоспалительной терапии. В миокарде левого желудочка и межжелудочковой перегородки выявлены участки некроза кардиомиоцитов, макрофагальная инфильтрация и гемосидероз на фоне нежной волокнистой ткани, что указывает на начальную стадию организации рабдомиолиза. При этом зон организации инфаркта миокарда обнаружено не было, что позволяет трактовать перенесенный ОКС в контексте нестабильной стенокардии.
Гистологическое исследование (рис. 3) выявило многочисленные зернистые трубчатые слепки миоглобина и его соединений в дистальных отделах канальцев почек и в собирательных трубочках, что привело к субтотальному сужению просвета мочевого пространства в этих участках. В печени отмечается дольчатая дезорганизация гепатоцитов, зернистая и очаговая жировая дистрофия, портальная венопатия, дилатация синусоидов, а также фокусы смешанноклеточной инфильтрации портальных трактов с небольшим количеством эозинофилов. Наблюдается нежный (перикапиллярный) перисинусоидальный и перицентральный фиброз. Указанные изменения в сочетании с клинической картиной соответствуют репаративной фазе острого гепатита.
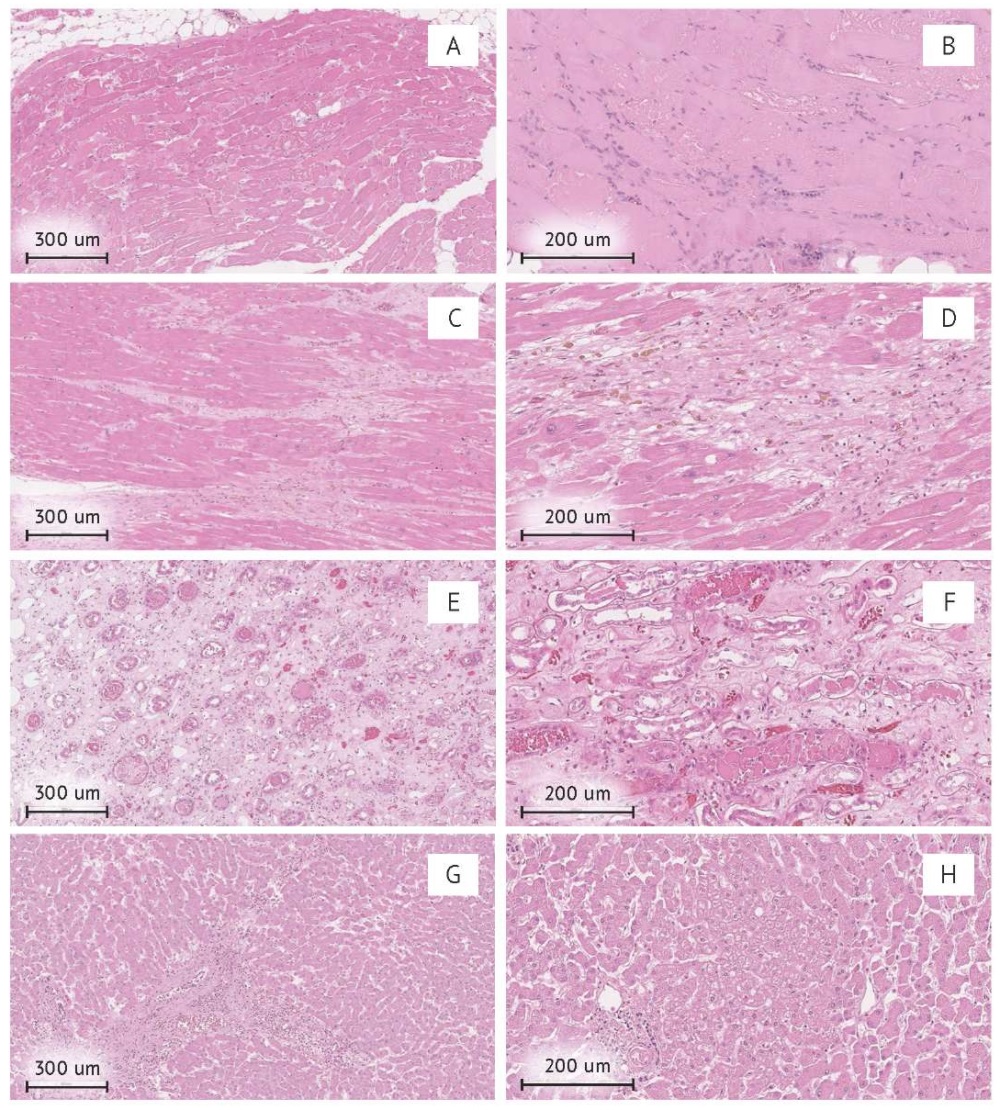
Фотография выполнена авторами / The photo is taken by the authors
Рис. 3. Микрофотографии образцов тканей пациента с фатальным рабдомиолизом. Окраска гематоксилином и эозином, увеличение: A, C, E, G — ×100; B, D, F, H — ×200. А — мозаичные фокусы рабдомиолиза скелетной мускулатуры без тканевой реакции; B — зоны рабдомиолиза с нейтрофильно-макрофагальной инфильтрацией по периферии; C — мозаичные фокусы рабдомиолиза в миокарде левого желудочка; D — гемосидероз, макрофагальная инфильтрация и миоцитолиз в миокарде левого желудочка; E — распространенные зернистые цилиндры в канальцах мозгового слоя почки; F — обтурация просвета дистальных канальцев плотными массами соединений миоглобина; G — порто-портальный фиброз (Metavir 2), выраженные лейкостазы в просвете венул, нежный перисинусоидальный фиброз, смешанно-клеточная инфильтрация портальных трактов с единичными эозинофилами; H — дольчатая дезорганизация гепатоцитов, дилатация синусоидальных пространств, фиброз стенки центральной вены
Fig. 3. Micrographs of tissue samples, patient with fatal rhabdomyolysis. Hematoxylin and eosin staining, magnification: A, C, E, G — ×100; B, D, F, H G — ×200. A — mosaic foci of skeletal muscle rhabdomyolysis without tissue reaction; B — rhabdomyolysis zones with neutrophilic-macrophagal infiltration along the periphery; C — mosaic foci of rhabdomyolysis in the left ventricle myocardium; D — hemosiderosis, macrophage infiltration and myocytolysis of the left ventricle myocardium; E — widespread granular cylinders in the medulla tubules of the kidney; F — lumen obturation of distal tubules with dense masses of myoglobin compounds; G — portoportal fibrosis (Metavir 2), pronounced leukostasis in the lumen of venules, delicate perisinusoidal fibrosis, mixed cell infiltration of portal tracts with single eosinophils; H — lobular disorganisation of hepatocytes, dilation of sinusoidal spaces, fibrosis of the central vein wall
В связи с представлением о статин-ассоциированом рабдомиолизе post mortem был выполнен анализ на генетические маркеры индивидуальных особенностей фармакокинетики розувастатина. Получены следующие результаты: CYP2C9 *1*1 (нормальная активность), SLCO1B1 *5*15 (сниженная активность в гомозиготном состоянии), ABCG2 c.421 C/C (нормальная активность).
ОБСУЖДЕНИЕ
Представленный клинический случай описывает фатальный рабдомиолиз, ассоциированный с приемом розувастатина в высоких дозах (по алгоритмам Наранжо — 3 балла, F.E. Karch, L. Lasagna — 5 баллов, что позволяет оценить степень достоверности причинно-следственной связи как возможную3).
С развитием рабдомиолиза связано применение таких лекарственных препаратов, как пропофол, лефлуномид, дамптомицин, ингибиторы тирозинкиназ, но группой препаратов, чаще других ассоциирующимся с миопатиями, являются статины [12][13]. Частота развития рабдомиолиза на терапии высокодозными статинами в клинических исследованиях оценивается в 4 случая на 10 000 [14]. Статины могут являться причиной статин-ассоциированных мышечных симптомов, клиническая и лабораторная степень выраженности которых варьируют от миопатии до токсического рабдомиолиза. Факторами риска статин-ассоциированных мышечных симптомов являются: применение статинов в высокоинтенсивном режиме, сопутствующая терапия, большая длительность терапии, индивидуальные генетические факторы, влияющие на фармакокинетику, женский пол, пожилой и старческий возраст, азиатская раса, заболевания почек, печени, мышц в анамнезе, тяжелые физические нагрузки [15–17].
Проведенный в 2025 г. R. Morris и соавт. анализ данных базы FAERS (FDA Adverse Event Reporting System) [10] показал, что симвастатин характеризуется самым высоким риском рабдомиолиза среди всех статинов, при применении розувастатина этот риск вдвое меньше. Отметим, что с рабдомиолизом на фоне терапии розувастатином была ассоциирована сопутствующая терапия пантопразолом (вероятность выше в 3,44 раза), нитроглицерином, метопрололом, фуросемидом, бисопрололом, парацетамолом, омепразолом, клопидогрелем и рамиприлом.
В описанном случае пациент получал пантопразол и бисопролол, что могло стать дополнительным фактором риска развития у него рабдомиолиза. Механизм возможного взаимодействия пантопразола и розувастатина предположен на основе способности пантопразола ингибировать белки-переносчики органических анионов, что может приводить к повышению концентрации розувастатина в крови [18]. Механизм возможного взаимодействия с бисопрололом определить сложнее, поскольку соответствующих исследований не проводилось, однако бисопролол является субстратом ферментов CYP3A4/5, которые участвуют, хоть и в небольшой степени, в метаболизме розувастатина [19].
Среди лекарственных препаратов, назначаемых одновременно с розувастатином, большое внимание привлекает тикагрелор. Так, анализ базы данных нежелательных реакций Всемирной организации здравоохранения (VigiBase) показал, что использование тикагрелора одновременно со статинами является фактором, повышающим риск рабдомиолиза. Наиболее выраженным этот риск был для розувастатина (отношение шансов 1,9). Риск возрастает при применении розувастатина в высоких дозах, а также в случае, если возраст пациента >75 лет [20]. В исследовании R. Patel и соавт. (2024) с участием более 900 пациентов, получавших тикагрелор после перенесенного ОКС, в течение года наблюдали 4 случая рабдомиолиза, в том числе 2 с летальным исходом. В трех из них пациенты принимали розувастатин в дозе 40 мг, в одном — аторвастатин в дозе 80 мг [21].
В связи с относительно недолгим периодом обращения тикагрелора на фармацевтическом рынке его лекарственные взаимодействия изучены недостаточно. Изначально предполагалось, что причиной взаимодействия тикагрелора и статинов является взаимодействие в системе изофермента CYP3A4. Однако известно, что ни тикагрелор, ни статины, будучи субстратами, не являются мощными ингибиторами CYP3A4, что делает такой механизм маловероятной причиной рабдомиолиза. При этом в эксперименте тикагрелор вызывал увеличение концентраций симвастатина до 50% и аторвастатина до 30%, не изменяя период полувыведения [22].
Для розувастатина CYP3A4 не является ключевым ферментом метаболизма, поэтому поиск возможных причин был продолжен. M. Lehtisalo и соавт. (2024) обозначили более вероятный механизм [23]. По данным, полученным в исследованиях in vitro, тикагрелор ингибирует активность белков-переносчиков BCRP (белок резистентности рака молочной железы) и OATP (транспортер органических анионов) 1B1, 1B3 и 2B1, субстратом которых является розувастатин. В результате подавления активности BCRP в кишечнике увеличивается биодоступность розувастатина, и его концентрация в плазме крови возрастает более чем в 2 раза. Это предположение подтверждено в исследованиях с участием здоровых добровольцев: тикагрелор при одновременном применении вызывал увеличение площади под фармакокинетической кривой «концентрация–время» розувастатина и его пиковой концентрации в плазме крови в 2,6 раза, а также удлинял период полувыведения более чем в 2 раза [24]. Повышение концентрации розувастатина в крови у пациентов при применении в составе двойной дезагрегантной терапии описано Т. Dermota и соавт. [25]. В исследование включены 93 пациента, перенесшие инфаркт миокарда и получавшие розувастатин в высокой дозе 40 мг/сут и антагонист рецепторов P2Y12 (тикагрелор, прасугрел или клопидогрел). Концентрация розувастатина в плазме была вдвое выше у пациентов, получавших терапию тикагрелором, чем у пациентов, получавших прасугрел или клопидогрел; различия были статистически значимыми. Терапия тикагрелором была независимым фактором, предрасполагающим к повышению концентраций розувастатина в этой когорте пациентов [26].
В условиях реальной клинической практики к этому механизму могут добавляться и другие факторы. Например, в ключевом международном рандомизированном двойном слепом исследовании эффективности тикагрелора PLATO было показано, что с терапией тикагрелором ассоциировано ухудшение функции почек [27]. Для розувастатина почечная элиминация является значимой, и именно почечную дисфункцию на фоне тикагрелора как фактор, предрасполагающий к развитию рабдомиолиза на фоне терапии розувастатином, обозначили авторы в двух описаниях клинических случаев [25][26].
В последнее время появилось несколько публикаций, посвященных описанию клинических случаев рабдомиолиза у пациентов, принимавших розувастатин в сочетании с тикагрелором [28], а также с такими препаратами, как колхицин [29], ситаглиптин [30], циклоспорин, лефлуномид, метилпреднизолон [31], рибоциклиб [32], даптомицин [33]. В связи с тем что пациенты с ОКС получают статины в высоких дозах, а также в большинстве случаев множественную сопутствующую терапию, целесообразно проявлять максимальную настороженность в отношении возможных потенциально фатальных нежелательных реакций.
В представленном клиническом случае фармакогенетическое тестирование выявило у пациента еще один фактор риска развития рабдомиолиза: генотип SLCO1B1 в гомозиготном состоянии, ассоциированный со сниженной активностью кодируемого этим геном белка-транспортера ОАТР1В1. В ряде крупных исследований [34–37] доказано, что сниженная активность этого переносчика способствует риску миопатии и рабдомиолиза на фоне терапии розувастатином вне связи с его концентрациями в плазме крови. Рекомендации Консорциума по практическому использованию фармакогенетических данных (Clinical Pharmacogenetics Implementation Consortium, CPIC) предостерегают от назначения розувастатина в дозах выше 20 мг/сут пациентам с такими особенностями [38]. В данном случае наличие нормального генотипа, отвечающего за активность переносчика BCRP, оказалось неблагоприятным для пациента, поскольку позволило тикагрелору эффективно подавлять функцию переносчика, что, вероятно, привело к значительному увеличению концентрации препарата.
Таким образом, для пациента определяющими исход факторами явились комбинация фармакогенетической предрасположенности к сниженной активности белка-транспортера ОАТР1В1 и межлекарственного взаимодействия розувастатина с тикагрелором на фоне дополнительного влияния таких сопутствующих факторов, как пожилой возраст, одновременное с розувастатином применение пантопразола и бисопролола (что также ассоциировано с рабдомиолизом) [39]. Кроме того, нельзя исключить ухудшение функции почек на фоне приема тикагрелора, однако подтвердить это не представлялось возможным, поскольку контроль соответствующих лабораторных показателей не проводили.
Следует обратить внимание на то, что прогрессированию состояния пациента в стационаре, несмотря на отмену вероятного причинного агента — розувастатина, могло способствовать продолжение применения имеющих доказанные негативные эффекты в отношении мышечной ткани пропофола [40], диазепама [41] и гидроксизина [42], а также продолжение приема статинов в варианте аторвастатина в течение нескольких суток.
ЗАКЛЮЧЕНИЕ
Статины в сочетании с антагонистами рецепторов P2Y12 являются основой первичной и вторичной профилактики острых коронарных событий. Однако повышение доз статинов увеличивает риск осложнений терапии, в том числе серьезных. В настоящем случае фатальный статин-ассоциированный рабдомиолиз развился на фоне двух значимых факторов: генетической предрасположенности (генотип SLCO1B1 в гомозиготном состоянии, ассоциированный со сниженной активностью кодируемого этим геном белка-транспортера ОАТР1В1) и значимого межлекарственного взаимодействия розувастатина с тикагрелором, что привело к нарушению работы сразу двух белков-переносчиков: BCRP, определяющего биодоступность препарата, и OATPB1, осуществляющего его транспорт через мембрану гепатоцита. Учитывая высокую вероятность возникновения таких ситуаций для пациентов после перенесенного ОКС в связи с необходимостью назначения (в соответствии с клиническими рекомендациями) высокодозной терапии статинами и другими препаратами, обладающими потенциалом значимых лекарственных взаимодействий, целесообразно проводить фармакогенетическое тестирование. Помимо этого необходимо оценивать дополнительные факторы риска рабдомиолиза и проводить активный мониторинг лабораторных показателей (КФК, КФК-МВ, АСТ, АЛТ, миоглобин, креатинин, СКФ) в первые дни после назначения комплексной лекарственной терапии для своевременной диагностики возможных осложнений со стороны мышечной и соединительной тканей.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Т.А. Макарова — концепция работы, написание текста рукописи, формулировка выводов, работа с источниками литературы; К.А. Загородникова — написание текста рукописи, формулировка выводов, утверждение окончательной версии рукописи для публикации; И.А. Макаров — описание результатов аутопсии и гистологического исследования; Н.В. Добрынина и Е.Е. Свентицкая — работа с источниками литературы; Ю.Н. Лобачева — выполнение фармакогенетического тестирования, работа с источниками литературы, участие в формулировке выводов.
Информированное согласие на публикацию. В связи с отсутствием в статье информации, позволяющей идентифицировать личность пациента (фотографий, личных данных, уточненной маршрутизации, инструментальных и иных исследований, по которым возможно идентифицировать личность), получение информированного согласия от пациента и его законных представителей не требуется.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria. The most significant contributions were as follows. Taiana A. Makarova conceived the work, wrote the manuscript, formulated conclusions, and worked with literature sources. Ksenia A. Zagorodnikova wrote the manuscript, formulated conclusions, and approved the final manuscript version for publication. Igor A. Makarov described the autopsy and histological pathoanatomic part of the manuscript. Nonna V. Dobrynina worked with literature. Ekaterina E. Sventitskaya worked with literature. Yuliia N. Lobacheva performed pharmacogenetic testing, worked with literature, and participated in formulating conclusions.
Consent for publication. Due to the absence of information that would allow to identify the patient (photographs, personal data, detailed routing, instrumental and other studies that could be used), obtaining informed consent from the patient/relatives is not required.
1. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации. Минздрав России; 2024.
2. https://grls.rosminzdrav.ru/Default.aspx
3. Определение степени достоверности причинно-следственной связи «Неблагоприятная побочная реакция-лекарственное средство». Методические рекомендации. Федеральная служба по надзору в сфере здравоохранения и социального развития; 2008. https://docs.cntd.ru/document/499043554
Список литературы
1. Collins R, Reith C, Emberson J, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet. 2017;389(10069):602. https://doi.org/10.1016/S0140-6736(16)31468-4
2. Rosa GM, Carbone F, Parodi A, et al. Update on the efficacy of statin treatment in acute coronary syndromes. Eur J Clin Invest. 2014;44(5):501–15. https://doi.org/10.1111/eci.12255
3. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2024;45(13):1145. https://doi.org/10.1093/eurheartj/ehad870
4. Aronow HD, Topol EJ, Roe MT, et al. Effect of lipid-lowering therapy on early mortality after acute coronary syndromes: An observational study. Lancet. 2001;357(9262):1063–8. https://doi.org/10.1016/S0140-6736(00)04257-4
5. Sposito AC, Chapman MJ. Statin therapy in acute coronary syndromes: mechanistic insight into clinical benefit. Arterioscler Thromb Vasc Biol. 2002;22(10):1524–34. https://doi.org/10.1161/01.atv.0000032033.39301.6a
6. Yu S, Jin J, Chen Z, Luo X. High-intensity statin therapy yields better outcomes in acute coronary syndrome patients: A meta-analysis involving 26,497 patients. Lipids Health Dis. 2020;19(1):194. https://doi.org/10.1186/s12944-020-01369-6
7. Byrne RA, Rossello X, Coughlan JJ, et al., 2023 ESC Guidelines for the management of acute coronary syndromes: Developed by the task force on the management of acute coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal. 2023;44(38):3720–826. https://doi.org/10.1093/eurheartj/ehad19
8. Gulizia MM, Colivicchi F, Arca M, et al. ANMCO Position Paper: Diagnostic-therapeutic pathway in patients with hypercholesterolaemia and statin intolerance. Eur Heart J Suppl. 2017;19(Suppl D):D55–D63. https://doi.org/10.1093/eurheartj/sux020
9. Schech S, Graham D, Staffa J, et al. Risk factors for statin-associated rhabdomyolysis. Pharmacoepidemiol Drug Saf. 2007;16(3):352–8. https://doi.org/10.1002/pds.1287
10. Morris R, Bu K, Han W, et al. The association between statin drugs and rhabdomyolysis: An analysis of FDA Adverse Event Reporting System (FAERS) data and transcriptomic profiles. Genes. 2025;16(3):248. https://doi.org/10.3390/genes16030248
11. Lim AK. Abnormal liver function tests associated with severe rhabdomyolysis. World J Gastroenterol. 2020;26(10):1020–8. https://doi.org/10.3748/wjg.v26.i10.1020
12. Cabral BMI, Edding SN, Portocarrero JP, Lerma EV. Rhabdomyolysis. Dis Mon. 2020;66(8):101015. https://doi.org/10.1016/j.disamonth.2020.101015
13. Hohenegger M. Drug induced rhabdomyolysis. Curr Opin Pharmacol. 2012;12(3):335–9. https://doi.org/10.1016/j.coph.2012.04.002
14. Cholesterol Treatment Trialists’ (CTT) Collaboration; Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: A meta-analysis of data from 170000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670–81. https://doi.org/10.1016/S0140-6736(10)61350-5
15. Hassan M, Nguyen B, Helmsdoerfer K, et al. High-intensity statin with severe consequences: A case of non-autoimmune rosuvastatin-induced myonecrosis. Cureus. 2022;14(10):e30080. https://doi.org/10.7759/cureus.30080
16. Сычев ДА, Остроумова ТМ, Остроумова ОД и др. Статин-индуцированная миопатия. Безопасность и риск фармакотерапии. 2023;11(3):252–70. https://doi.org/10.30895/2312-7821-2023-11-3-252-270
17. Сумароков АБ, Ежов МВ. Диагностика и лечение статининдуцированной некротизирующей аутоиммунной миопатии. Клиническая фармакология и терапия. 2022;31(2):76–80. https://doi.org/10.32756/0869-5490-2022-2-76-80
18. Liu HC, Goldenberg A, Chen Y, et al. Molecular properties of drugs interacting with SLC22 transporters OAT1, OAT3, OCT1, and OCT2: A machine-learning approach. J Pharmacol Exp Ther. 2016;359(1):215–29. https://doi.org/10.1124/jpet.116.232660
19. Bailey KM, Romaine SP, Jackson BM, et al. Hepatic metabolism and transporter gene variants enhance response to rosuvastatin in patients with acute myocardial infarction: The GEOSTAT-1 study. Circ Cardiovasc Genet. 2010;3(3):276–85. https://doi.org/10.1161/CIRCGENETICS.109.89850
20. Roule V, Alexandre J, Lemaitre A, et al. Rhabdomyolysis with co-administration of statins and antiplatelet therapies-analysis of the WHO pharmacovigilance database. Cardiovasc Drugs Ther. 2024;38(6):1191–9. https://doi.org/10.1007/s10557-023-07459-8
21. Patel R, Sharma JB, Rajput S. Statins ticagrelor and rhabdomyolysis: A coincidence or a drug interaction? J Lipid Atheroscler. 2024;13(1):61–8. https://doi.org/10.12997/jla.2024.13.1.61
22. Rocca B, Bigagli E, Cerbai E. Ticagrelor and statins: Dangerous liaisons? Cardiovasc Drugs Ther. 2024;38(6):1103–9. https://doi.org/10.1007/s10557-024-07624-7
23. Lehtisalo M, Tarkiainen EK, Neuvonen M, et al. Ticagrelor increases exposure to the breast cancer resistance protein substrate rosuvastatin. Clin Pharmacol Ther. 2024;115(1):71–9. https://doi.org/10.1002/cpt.3067
24. Dermota T, Jug B, Trontelj J, et al. Ticagrelor is associated with increased rosuvastatin blood concentrations in patients who have had a myocardial infarction. Clin Pharmacokinet. 2025;64(4):565–71. https://doi.org/10.1007/s40262-025-01489-1
25. Parish LP, Cutshall T, Duhart B. Acute kidney injury and rhabdomyolysis due to ticagrelor and rosuvastatin. Nurse Pract. 2021;46(11):12–6. https://doi.org/10.1097/01.NPR.0000794540.96561.51
26. Park IS, Lee SB, Song SH, et al. Ticagrelor-induced acute kidney injury can increase serum concentration of statin and lead to concurrence of rhabdomyolysis. Anatol J Cardiol. 2018;19(3):225–6. https://doi.org/10.14744/AnatolJCardiol.2017.8200
27. Patel MR, Becker RC, Wojdyla DM, et al. Cardiovascular events in acute coronary syndrome patients with peripheral arterial disease treated with ticagrelor compared with clopidogrel: Data from the PLATO Trial. E J Prev Cardiol. 2015;22(6):734–42. https://doi.org/10.1177/2047487314533215
28. Hasan M, Ahmed M. A case report: Rosuvastatin induced rhabdomyolysis in an 80-year-old female. S D Med. 2024;77(11):501–2. PMID: 39820444
29. Zhang S, Yan MM, Zhao H, et al. Rhabdomyolysis associated with concomitant use of colchicine and statins in the real world: Identifying the likelihood of drug-drug interactions through the FDA adverse event reporting system. Front Pharmacol. 2024;15:1445324. https://doi.org/10.3389/fphar.2024.1445324
30. Atapour A, Momenzadeh M, Panahishokouh M, Badri S. Rosuvastatin-induced rhabdomyolysis as a result of drug interaction with sitagliptin: A case report. Clin Med Insights Case Rep. 2024;17:11795476241274162. https://doi.org/10.1177/11795476241274162
31. Korzec J, Strausbaugh R, Mikolay JJ Jr, Churchwell MD. Rhabdomyolysis and acute kidney injury potentiated by a drug-drug interaction between cyclosporine, leflunomide, and rosuvastatin in a kidney transplant recipient: A missed opportunity for pharmacist involvement. J Am Pharm Assoc (2003). 2024;64(3):102016. https://doi.org/10.1016/j.japh.2024.01.012
32. Teo SW, Hayes T, Gome J. Ribociclib may potentiate rosuvastatin effect in causing late onset rhabdomyolysis. BMJ Case Rep. 2023;16(9):e255632. https://doi.org/10.1136/bcr-2023-255632
33. Wei C, Yin W, He Z, Wu B. Reporting of drug-induced myopathies associated with the combination of statins and daptomycin: A disproportionality analysis using the US Food and Drug Administration Adverse Event Reporting System. J Clin Med. 2023;12(10):3548. https://doi.org/10.3390/jcm12103548
34. Carr DF, O’Meara H, Jorgensen AL, et al. SLCO1B1 genetic variant associated with statin-induced myopathy: A proof-of-concept study using the clinical practice research datalink. Clin Pharmacol Ther. 2013;94(6):695–701. https://doi.org/10.1038/clpt.2013.161
35. Liu JE, Liu XY, Chen S, et al. SLCO1B1 521T>C polymorphism associated with rosuvastatin-induced myotoxicity in Chinese coronary artery disease patients: A nested case-control study. Eur J Clin Pharmacol. 2017;73(11):1409–16. https://doi.org/10.1007/s00228-017-2318-z
36. Bai X, Zhang B, Wang P, et al. Effects of SLCO1B1 and GATM gene variants on rosuvastatin-induced myopathy are unrelated to high plasma exposure of rosuvastatin and its metabolites. Acta Pharmacol Sin. 2019;40(4):492–9. https://doi.org/10.1038/s41401-018-0013-y
37. Lehtisalo M, Taskinen S, Tarkiainen EK, et al. A comprehensive pharmacogenomic study indicates roles for SLCO1B1, ABCG2 and SLCO2B1 in rosuvastatin pharmacokinetics. Br J Clin Pharmacol. 2023;89(1):242–52. https://doi.org/10.1111/bcp.15485
38. Cooper-DeHoff RM, Niemi M, Ramsey LB, et al. The Clinical Pharmacogenetics Implementation Consortium Guideline for SLCO1B1, ABCG2, and CYP2C9 genotypes and statin-associated musculoskeletal symptoms. Clin Pharmacol Ther. 2022;111(5):1007–21. https://doi.org/10.1002/cpt.2557
39. Vrkić Kirhmajer M, Macolić Šarinić V, Šimičević L, et al. Rosuvastatin-induced rhabdomyolysis — possible role of ticagrelor and patients’ pharmacogenetic profile. Basic Clin Pharmacol Toxicol. 2018;123(4):509–18. https://doi.org/10.1111/bcpt.13035
40. Hohenegger M. Drug induced rhabdomyolysis. Curr Opin Pharmacol. 2012;12(3):335–9. https://doi.org/10.1016/j.coph.2012.04.002
41. Noe G, Shah K, Quattlebaum T, Munjal S. Rhabdomyolysis in the context of designer benzodiazepine misuse. Cureus. 2023;15(12):e50741. https://doi.org/10.7759/cureus.50741
42. Ramakrishna KN, Shah A, Martinez-Balzano CD. Massively elevated creatine kinase levels in antihistamine-induced rhabdomyolysis. Proc (Bayl Univ Med Cent). 2019;33(1):44–6. https://doi.org/10.1080/08998280.2019.1688624
Об авторах
Т. А. МакароваРоссия
Макарова Таяна Алексеевна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
К. А. Загородникова
Россия
Загородникова Ксения Александровна, канд. мед. наук
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
И. А. Макаров
Россия
Макаров Игорь Александрович, канд. мед. наук
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
Н. В. Добрынина
Россия
Добрынина Нонна Валерьевна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
Е. Е. Свентицкая
Россия
Свентицкая Екатерина Евгеньевна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
Ю. Н. Лобачева
Россия
Лобачева Юлия Николаевна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
Дополнительные файлы
Рецензия
Для цитирования:
Макарова Т.А., Загородникова К.А., Макаров И.А., Добрынина Н.В., Свентицкая Е.Е., Лобачева Ю.Н. Фатальный рабдомиолиз после модификации дозы розувастатина в рамках терапии острого коронарного синдрома: клинический случай. Безопасность и риск фармакотерапии. 2025;13(3):333-343. https://doi.org/10.30895/2312-7821-2025-13-3-333-343
For citation:
Makarova T.A., Zagorodnikova K.A., Makarov I.A., Dobrynina N.V., Sventitskaya E.E., Lobacheva Yu.N. Fatal Rhabdomyolysis after Rosuvastatin Dose Modification in Acute Coronary Syndrome: A Case Report. Safety and Risk of Pharmacotherapy. 2025;13(3):333-343. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-3-333-343





































