Перейти к:
Терапевтический потенциал мио-инозитола при недостаточности мужской репродуктивной функции: коррекция параметров сперматогенеза и окислительного стресса (обзор)
https://doi.org/10.30895/2312-7821-2025-13-3-290-299
Резюме
ВВЕДЕНИЕ. Мужское бесплодие, в частности недостаточность мужской репродуктивной функции, часто связано с окислительным стрессом. Мио-инозитол, обладающий антиоксидантными свойствами, играет важную роль в различных биохимических и клеточных процессах, происходящих в сперматозоидах, в том числе положительно влияет на функцию митохондрий и подвижность сперматозоидов. Это создает предпосылки для его применения в комплексном лечении недостаточности мужской репродуктивной функции различного генеза, включая олигоастенотератозооспермию, астенозооспермию, а также при вспомогательных репродуктивных технологиях.
ЦЕЛЬ. Оценка возможности и эффективности применения инозитола для восстановления сперматогенеза у мужчин при нарушениях репродуктивной функции, вызванных окислительным стрессом.
ОБСУЖДЕНИЕ. Окислительный стресс вызывает нарушение клеточной мембраны сперматозоидов, дисфункцию митохондрий и повреждение ДНК. Показано, что мио-инозитол оказывает положительное воздействие на сперматогенез за счет антиоксидантных свойств и активизации митохондриального метаболизма. Он способствует увеличению производства АТФ, снижает уровень маркеров окислительного повреждения, уменьшает фрагментацию ДНК и улучшает морфологию сперматозоидов. Мио-инозитол также повышает уровень тестостерона в клетках, увеличивает подвижность сперматозоидов за счет оптимизации взаимодействия актин–глобулин и модулирует содержание внутриклеточного кальция, необходимого для окислительного метаболизма и синтеза АТФ. По данным клинических исследований, мио-инозитол увеличивает общую подвижность сперматозоидов на 20–30%, долю прогрессивно-подвижных сперматозоидов до 40%, повышает частоту оплодотворений на 10–15% и снижает фрагментацию ДНК на 3–5%. Применение мио-инозитола при криоконсервации спермы уменьшает уровень активных форм кислорода, апоптоз, фрагментацию ДНК сперматозоидов, поддерживает митохондриальный мембранный потенциал и повышает эффективность окислительного фосфорилирования.
ВЫВОДЫ. Мио-инозитол является перспективным соединением для терапии недостаточности мужской репродуктивной функции, включая олигоастенотератозооспермию, астенозооспермию, а также для подготовки спермы к использованию при вспомогательных репродуктивных технологиях. Благодаря антиоксидантным свойствам мио-инозитол может быть рекомендован в случае, когда предполагается или лабораторно подтверждается окислительное повреждение спермы. Однако для подтверждения положительного влияния мио-инозитола на репродуктивную функцию у мужчин необходимы дальнейшие масштабные контролируемые исследования.
Ключевые слова
Для цитирования:
Гюлахмедова С.М., Дружинина А.А., Аляутдина О.С., Елисеева Е.М., Чистохина А.А. Терапевтический потенциал мио-инозитола при недостаточности мужской репродуктивной функции: коррекция параметров сперматогенеза и окислительного стресса (обзор). Безопасность и риск фармакотерапии. 2025;13(3):290-299. https://doi.org/10.30895/2312-7821-2025-13-3-290-299
For citation:
Giulakhmedova S.M., Druzhinina A.A., Alyautdina O.S., Eliseeva E.M., Chistokhina A.A. Therapeutic Potential of Myo-Inositol in Male Infertility: Correction of Spermatogenesis Parameters and Oxidative Stress (Review). Safety and Risk of Pharmacotherapy. 2025;13(3):290-299. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-3-290-299
ВВЕДЕНИЕ
По данным отчета Всемирной организации здравоохранения (ВОЗ), распространенность бесплодия среди взрослого населения составляет около 17,5% (примерно каждый шестой человек в мире), что свидетельствует об острой необходимости всестороннего анализа причин его возникновения1. В Российской Федерации за 10 лет (2011–2021 гг.) распространенность женского бесплодия возросла на треть, мужского — почти в два раза2. Недостаточность мужской репродуктивной функции, на долю которой приходится до 50% случаев бесплодия в браке [1], связана в большинстве случаев с нарушением сперматогенной функции [2]. Косвенным свидетельством значимости этой проблемы в популяции может служить пересмотр ВОЗ в 2021 г.3 показателей качества спермы в сторону понижения по сравнению с 2012 г.4
Одной из важнейших причин нарушения сперматогенеза является окислительный стресс, который может развиться под действием таких экзогенных факторов, как курение, злоупотребление алкоголем, стресс, загрязнение окружающей среды, вредные условия труда5 [3–6], а также вследствие применения некоторых лекарственных препаратов (например, антибиотиков, нестероидных противовоспалительных препаратов и др.) [7–9]. Распространенность недостаточности мужской репродуктивной функции, вызванной окислительным стрессом, во всем мире составляет около 37,2 млн случаев [10].
Для повышения мужской фертильности в настоящее время применяют антиоксидантные средства, содержащие несколько компонентов, которые оказывают синергическое действие [11]. Инозитол, в частности его изомер мио-инозитол, играет ключевую роль в ряде биохимических и клеточных процессов сперматозоидов: регуляция ионного обмена, поддержание целостности митохондрий, модуляция активности белков, антиоксидантная защита [12–14]. Это обеспечивает предпосылки для применения мио-инозитола в терапии недостаточности мужской репродуктивной функции различного генеза, включая олигоастенотератозооспермию (снижение концентрации, подвижности, нарушение морфологии сперматозоидов), астенозооспермию (снижение подвижности сперматозоидов) и при криоконсервации спермы.
Цель работы — оценка возможности и эффективности применения инозитола для восстановления сперматогенеза у мужчин при нарушениях репродуктивной функции, вызванных окислительным стрессом.
Поиск литературы на русском и английском языках проводили с помощью поисковой системы Google Scholar, в биомедицинских и академических электронных базах данных PubMed, Embase, Cochrane Library, eLIBRARY.RU, КиберЛенинка, Lens.org по ключевым словам: инозитол/inositol, мио-инозитол/myo-inositol, олигозооспермия/oligozoospermia, астенозооспермия/asthenozoospermia, тератозооспермия/teratozoospermia, олигоастенозооспермия/oligoasthenozoospermia, сперматогенез/spermatogenesis. В обзор включали полнотекстовые статьи, содержащие результаты экспериментальных и клинических исследований применения мио-инозитола при нарушении сперматогенеза в период с 2016 по 2025 гг., а также клинические руководства и рекомендации ВОЗ.
ОСНОВНАЯ ЧАСТЬ
Механизмы влияния окислительного стресса на качество спермы
Высокая чувствительность сперматозоидов к окислительному стрессу определяется тем фактом, что они подвергаются воздействию активных форм кислорода (АФК), участвующих в физиологических функциях в процессе созревания клеток6. Необходимая для сперматозоидов энергия выделяется в результате гликолиза и окислительного фосфорилирования. Мембраны сперматозоидов содержат большое количество полиненасыщенных жирных кислот, которые обеспечивают необходимую для оплодотворения текучесть. В то же время полиненасыщенные жирные кислоты уязвимы к перекисному окислению липидов [15]. Таким образом, риски окислительного повреждения сперматозоидов заложены на этапе их физиологического развития. Окислительное повреждение приводит к нарушению текучести, целостности и проницаемости мембран, вызывает митохондриальную дисфункцию и повреждение (фрагментацию) ДНК сперматозоидов. В свою очередь, эти процессы приводят к снижению жизнеспособности и оплодотворяющей способности сперматозоидов, которая может быть снижена даже при формальной сохранности показателей эякулята [16][17], в том числе при проведении экстракорпорального оплодотворения (ЭКО) и интрацитоплазматической инъекции сперматозоида [17][18]. При фрагментации ДНК сперматозоида повышается вероятность появления ошибок в генетическом материале, которые могут быть переданы в процессе оплодотворения и вызвать генетические отклонения у эмбриона7.
Лекарственно-индуцированное окислительное повреждение сперматозоидов
Лекарственные средства разных фармакологических групп оказывают негативный эффект на сперматогенез через индукцию окислительного стресса [19]. Наибольший отрицательный эффект имеют противоопухолевые и противоэпилептические препараты, гормоны, некоторые антидепрессанты, антибиотики, иммунодепрессанты, а также средства для коррекции обмена липидов (статины) [20–22]. Например, длительное применение статинов в доклинических исследованиях на здоровых грызунах приводило к снижению качества спермы и продукции тестостерона, а также к ухудшению фертильности [21]. Антидепрессанты также могут нарушать показатели спермограммы, но имеющиеся данные противоречивы, а влияние при краткосрочном применении минимально; долгосрочные последствия требуют уточнения [22].
В систематическом обзоре M. Semet и соавт. (2017) [19] обобщены основные фармакологические классы и отдельные лекарственные препараты, оказывающие доказанное или вероятное негативное влияние на сперматогенез и показатели спермы у мужчин. В большинстве случаев отрицательное воздействие на сперматогенез, созревание сперматозоидов, половую функцию были обратимы после отмены лекарственного препарата либо их выраженность была незначительной при коротком курсе лечения, однако для некоторых препаратов (сульфасалазин, азатиоприн, микофенолат мофетил и метотрексат) доказан риск необратимого повреждения в экспериментах на животных или при длительной терапии у человека [19][20].
Данные о негативном влиянии лекарственных препаратов на мужскую фертильность постоянно дополняются. Так, результаты систематического обзора М. Capelo и соавт. (2024), в котором оценивали влияние наиболее широко используемых нестероидных противовоспалительных лекарственных препаратов, показали, что парацетамол и ибупрофен значимо снижают подвижность и количество сперматозоидов, в то время как данные для аспирина и дипирона остаются ограниченными [9]. В исследовании на животных A.F. Ajayi и соавт. (2020) показано, что длительное применение кодеина вызывает значимое увеличение фрагментации ДНК сперматозоидов, снижение их количества, жизнеспособности и подвижности главным образом за счет стимуляции окислительного повреждения. Степень фрагментации ДНК сперматозоидов положительно коррелирует с уровнем 8-гидрокси-2’-дезоксигуанозина, биомаркера окислительного повреждения ДНК, и активностью каспазы 3, биомаркера апоптоза. Основную роль в ухудшении показателей качества сперматозоидов при этом играет окислительный стресс, а влияние на апоптоз является сопутствующим [23]. Полученные in vitro S.Z. Pinto и соавт. (2025) данные свидетельствуют о снижении подвижности сперматозоидов при воздействии антиретровирусных препаратов (долутегравир, тенофовир, эмтрицитабин), изменения становятся значимыми через 90 мин после применения [24].
Влияние инозитола на окислительный стресс
Инозитол представляет собой витаминоподобное вещество, основной биологически активной формой которого является мио-инозитол. Мио-инозитол — важный компонент структурных липидов, входит в состав мембран эукариотических клеток, синтезируется почками (около 4 г/сут) [12].
Мио-инозитол
Результаты исследования in vitro L. Governini и соавт. (2020) демонстрируют, что мио-инозитол увеличивает продукцию АТФ и уровень потребления кислорода сперматозоидами, то есть способствует повышению митохондриального метаболизма [25]. Это соединение также уменьшает концентрацию 8-гидрокси-2’-дезоксигуанозина и других биомаркеров структурных повреждений, связанных с окислительным повреждением. Антиоксидантная активность мио-инозитола проявляется как снижением уровня фрагментации ДНК сперматозоидов, так и улучшением морфологического состояния клеток, предотвращая апоптоз сперматозоидов, и повышением качества эмбрионов при ЭКО или интрацитоплазматической инъекции сперматозоида [13][26].
Мио-инозитол также повышает уровень тестостерона в клетках и увеличивает подвижность сперматозоидов за счет оптимизации взаимодействия актин–глобулин [18]. В сперматозоидах мио-инозитол выступает в роли модулятора уровня внутриклеточного кальция, ответственного за окислительный метаболизм в митохондриях и синтез АТФ [13][27]. Метаболические процессы в митохондриях сперматозоидов, протекающие с участием мио-инозитола, обобщены на рисунке 1.
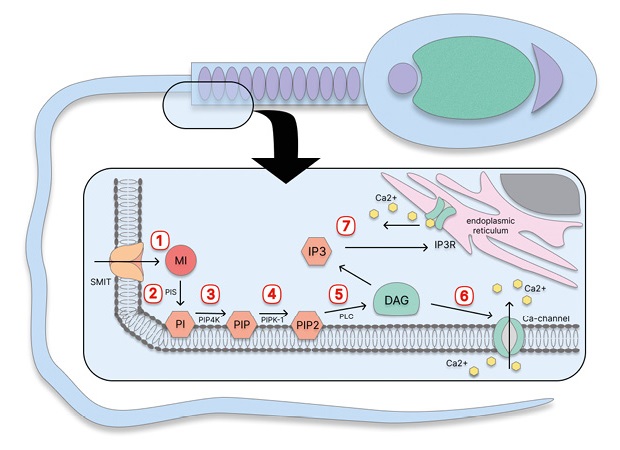
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Метаболизм мио-инозитола (MI) в митохондриях сперматозоидов. 1) MI транспортируется в цитозоль через натрий-мио-инозитоловый транспортер (SMIT); 2) в цитозоле MI метаболизируется в фосфатидилинозитол (PI) с помощью фосфатидилинозитолсинтетазы (PIS); 3) PI фосфорилируется в фосфатидилинозитол-(4)-монофосфат (PIP) с помощью фосфатидилинозитол-4-киназы (PIP4K); 4) PIP фосфорилируется в фосфатидилинозитол-(4,5)-бифосфат (PIP2) с помощью фосфатидилинозитол-4-фосфат-5-киназы 1 (PIPK1); 5) фосфолипаза C (PLC) метаболизирует PIP2 в 1,2-диацилглицерол (DAG); 6) DAG активирует открытие кальциевых каналов на мембране клетки, что приводит к притоку кальция извне; 7) DAG активирует инозитол-(1,4,5)-трифосфат (IP3), который активирует рецептор IP3 (IP3R), вызывая высвобождение кальция из резервуара эндоплазматического ретикулума
Fig. 1. Myo-inositol (MI) metabolism in sperm mitochondria. 1) MI transported into the cytosol via sodium-myo-inositol transporter (SMIT); 2) In the cytosol, MI is metabolised into phosphatidylinositol (PI) by phosphatidylinositol synthetase (PIS); 3) PI is phosphorylated into phosphatidylinositol-(4)-monophosphate (PIP) by phosphatidylinositol-4-kinase (PIP4K); 4) PIP is phosphorylated into phosphatidylinositol(4,5)-biphosphate (PIP2) by phosphatidylinositol 4-phosphate 5-kinase 1 (PIPK1); 5) Phospholipase C (PLC) metabolises PIP2 into 1,2-diacylglycerol (DAG); 6) DAG activates the opening of calcium channels on the cell membrane, leading to calcium influx from the outside; 7) DAG activates inositol-(1,4,5)-triphosphate (IP3), which activates the IP3 receptor (IP3R), causing calcium stored in the endoplasmic reticulum to be released
Влияние мио-инозитола на параметры спермы: результаты метаанализов и рандомизированных контролируемых исследований
M. Vazquez-Levin и соавт. (2020) [28] проведен систематический анализ публикаций о влиянии мио-инозитола на параметры спермы (концентрацию, подвижность, морфологию) и успешность оплодотворения (естественного и с использованием вспомогательных репродуктивных технологий). Показано, что на фоне применения инозитола происходило увеличение общей подвижности сперматозоидов в среднем на 20–30% и доли прогрессивно-подвижных сперматозоидов до 40% в некоторых исследованиях. Частота оплодотворений увеличивалась на 10–15% по сравнению с контрольной группой как в естественных условиях, так и в результате вспомогательных репродуктивных технологий. Фрагментация ДНК при обработке сперматозоидов in vitroснижалась на 3–5%.
Следует обратить внимание на гетерогенность проанализированных исследований: различия в дозировках (2–4 г/сут), продолжительности лечения (1–6 мес.) и составе добавок (мио-инозитол часто комбинировали с фолиевой кислотой, L-карнитином). Во многих проанализированных исследованиях были выборки малого размера (менее 100 участников), а дизайн не предполагал включения группы контроля. По мнению авторов, несмотря на полученные обнадеживающие данные, необходимы более строгие научные исследования для верификации клинической эффективности мио-инозитола и уточнения молекулярных механизмов его действия [28].
Метаанализ М. Ghaemi и соавт. (2024), обобщивший данные 16 клинических исследований различного дизайна, посвященных оценке эффективности терапии мио-инозитолом у мужчин со сниженной фертильностью, выявил, что применение мио-инозитола ассоциируется с достоверным увеличением общей подвижности (стандартизированная разность средних (SMD) 0,90; p=0,001) и доли прогрессивно-подвижных сперматозоидов (SMD 1,48; p=0,008), а также повышением уровня тестостерона у мужчин с олигоастенотератозооспермией (SMD 0,54; p<0,0001) [29]. Снижение фрагментации ДНК сперматозоидов было статистически значимым (SMD –1,37, p=0,01), что важно в контексте предотвращения передачи генетических ошибок потомству. В большинстве исследований, включенных в метаанализ, отмечена тенденция к небольшому увеличению жизнеспособности сперматозоидов и отсутствию выраженных изменений в их морфологии после терапии мио-инозитолом. В 4 исследованиях, помимо параметров спермы, сообщалось о частоте наступления беременности, при применении мио-инозитола она составила 34% (95% ДИ: 21–48%). По мнению авторов, это соединение может использоваться для улучшения мужской фертильности, особенно в случаях сниженной подвижности сперматозоидов и высокого уровня фрагментации ДНК. Однако не во всех исследованиях эффект был одинаково выраженным. Количество исследований, в которых сообщалось об исходах беременности, было ограничено, и требуется проведение дальнейших исследований с большей выборкой для уточнения оптимальных дозировок и групп пациентов [29].
M. Santoro и соавт. (2020) в проспективном лонгитюдном исследовании изучили влияние мио-инозитола на сперматогенез [30]. Участники (51 человек) были разделены на 3 группы: 21 — с нормозооспермией (группа Н) и две группы по 15 мужчин с олигоастенотератозооспермией (группы В и С). В группе В изучали действие мио-инозитола (2 мг/мл) на показатели спермы in vitro, участники в группе С принимали смесь, содержащую 1 г мио-инозитола, по 30 мг L-карнитина, L-аргинина, витамина E, 55 мкг селена и 200 мкг фолиевой кислоты, 1 раз/сут в течение 3 мес. В группах В и С количество сперматозоидов с прогрессивной подвижностью увеличилось на 10% (р<0,01), количество непрогрессивно-подвижных сперматозоидов — также на 10% (р<0,001 и р≤0,05 в группе B и С соответственно). Уровень неподвижных сперматозоидов снизился в группах В и С на 20 и 10% соответственно (р<0,001), причем показатель в группе В был близок к группе с нормальной спермой (группа Н). Показатель жизнеспособности сперматозоидов также был выше в группах В (8%, р≤0,05) и С (5%, р<0,01) по сравнению с исходным средним значением, но ниже, чем в группе Н. В ходе исследования ни один пациент не сообщал о нежелательных реакциях на фоне приема мио-инозитола. Полученные результаты свидетельствуют о том, что компоненты изучаемой смеси действуют как непосредственно на сперматозоиды, так и на сперматогенез, улучшая показатели спермы in vitroи in vivo. Однако исследование проведено на выборке малого размера, и для уточнения данных требуется проведение исследований на выборках большего размера.
В продолжающемся одноцентровом проспективном рандомизированном двойном слепом интервенционном исследовании8 оценивается эффективность воздействия пищевой добавки с мио-инозитолом, N-ацетил-цистеином, цинком и витаминами на фрагментацию ДНК сперматозоидов. В исследование включены 72 пациента в возрасте 20–45 лет с уровнем фрагментации ДНК сперматозоидов ≥30% и с отрицательным результатом посева спермы. Пациенты рандомизированы в соотношении 1:1 на 2 группы: в первой группе принимали пищевую добавку с мио-инозитолом, во второй — плацебо. Уровень фрагментации ДНК сперматозоидов измеряется при первом визите через 16±2 нед. лечения. Ожидаемый результат: снижение скорости фрагментации ДНК сперматозоидов у участников, принимавших пищевую добавку, составит ≥23% по сравнению с группой, получавшей плацебо. В настоящее время результаты не опубликованы, исследование продолжается.
Эффекты мио-инозитола при криоконсервации спермы
В исследовании, проведенном R. Ponchia и соавт. (2021), 25 образцов нормозооспермической спермы были разделены на три группы: 1) криоконсервированные образцы без мио-инозитола; 2) обработанные мио-инозитолом (20 мг/мл) перед криоконсервацией; 3) обработанные мио-инозитолом (20 мг/мл) после криоконсервации [31]. Анализ образцов показал, что обработка мио-инозитолом приводила к значительному улучшению качества спермы после процедуры замораживания–размораживания. Жизнеспособность сперматозоидов увеличилась в обработанной сперме, особенно если обработка была проведена после криоконсервации (p<0,001). Тенденция к увеличению прогрессивной подвижности наблюдалась как в образцах, обработанных до замораживания, так и после. Но статистическая значимость была достигнута только для спермы, обработанной после криоконсервации: прогрессивная подвижность сперматозоидов увеличилась на ~6% (p<0,01). В сперме, обработанной мио-инозитолом после размораживания, зарегистрировано значительное увеличение потребления кислорода (p<0,05), что свидетельствует о повышении эффективности окислительного фосфорилирования и продукции АТФ, а также снижение уровня карбонилированных белков — раннего маркера окислительного стресса (p<0,05). Авторы пришли к выводу, что использование мио-инозитола после размораживания спермы снижает окислительный стресс, улучшает жизнеспособность и подвижность сперматозоидов, а также повышает эффективность энергетического метаболизма [31].
M. Azizi и соавт. (2022) изучили влияние мио-инозитола на параметры спермы, подвергшейся криоконсервации, у 25 мужчин в возрасте от 25 до 40 лет с астенозооспермией [32]. Образцы спермы, собранные через 3–5 сут полового воздержания, были разделены на три равные аликвоты и случайным образом распределены на три группы: 1) свежая сперма; 2) сперма с замораживающей средой (контрольная группа), 3) сперма с замораживающей средой и мио-инозитолом (2 мг/мл). Сперму контрольной группы и сперму с добавлением мио-инозитола подвергли криоконсервации и хранению в течение 7 сут. После этого сперму размораживали в течение 15 мин при комнатной температуре и оценивали ее качество. Показатели жизнеспособности, общей подвижности и морфологии сперматозоидов после криоконсервации с мио-инозитолом были статистически значимо выше (p <0,01, p<0,01 и p<0,05 соответственно), чем в контрольной группе. При добавлении мио-инозитола статистически значимо (по сравнению с контролем) снижался уровень фрагментации ДНК (что свидетельствует о защите генетического материала при криоконсервации), повышался потенциал митохондриальной мембраны (улучшение мембранной функции и активности митохондрий (p<0,05)), снижался уровень маркера окислительного стресса малонового диальдегида, а общий антиоксидантный потенциал повышался (p<0,05) по сравнению с контролем [32].
Положительное влияние мио-инозитола при криоконсервации спермы в данных исследованиях объясняется, таким образом, снижением количества АФК, степени апоптоза, поддержанием митохондриального мембранного потенциала, снижением повреждений ДНК сперматозоидов и увеличением эффективности окислительного фосфорилирования. Это подтверждает эффективность мио-инозитола как антиоксиданта и его потенциал для улучшения репродуктивных результатов при использовании криоконсервированной спермы.
Безопасность мио-инозитола
Безопасность инозитола подтверждена как на моделях in vivo, так и в нескольких клинических исследованиях [33]. Только при использовании в высокой дозировке (12 г/сут и более) у пациентов были отмечены нарушения функции желудочно-кишечного тракта (тошнота, вздутие живота, диарея), которые не были дозозависимыми при дальнейшем увеличении дозировки [34]. Отметим, что максимальная доза мио-инозитола в рассмотренных исследованиях составляла 4 г/сут [28]. В более поздних клинических исследованиях, по данным метаанализа M. Ghaemi и соавт. (2024), на фоне применения мио-инозитола не было выявлено случаев развития нежелательных реакций у мужчин и их партнерш [29], что подтверждает безопасность применения мио-инозитола в используемых дозировках.
Перспективы применения мио-инозитола
Результаты проведенного анализа данных литературы показали, что мио-инозитол в клинической практике может использоваться в комплексной терапии в следующих случаях:
- Нарушение сперматогенеза. Наиболее выраженный эффект отмечен у пациентов с олигоастенотератозооспермией. Применение мио-инозитола показано для повышения общей и прогрессивной подвижности сперматозоидов, что важно при лечении идиопатической недостаточности мужской репродуктивной функции [11][18][30][31].
- Астенозооспермия. Подтверждено статистически значимое улучшение подвижности сперматозоидов при использовании мио-инозитола [11][29–31][35–37].
- Подготовка спермы к использованию при вспомогательных репродуктивных технологиях (ЭКО, интрацитоплазматической инъекции сперматозоида). Прием мио-инозитола внутрь или инкубация спермы с мио-инозитолом позволяют повысить показатели качества сперматозоидов, участвующих в оплодотворении. Особенно актуально для пациентов с повторными неудачами ЭКО и снижением подвижности сперматозоидов [11][30][36–38].
- Повышенный уровень окислительного стресса. Благодаря антиоксидантным свойствам мио-инозитол может быть рекомендован в случаях, когда предполагается или лабораторно подтверждается окислительное повреждение спермы (например, при воздействии токсических факторов, хронических воспалительных заболеваниях) [36][37].
Тщательный сбор анамнеза, результатов обследования, а также учет индивидуальных особенностей пациента являются критически важными при принятии решения о терапии.
ЗАКЛЮЧЕНИЕ
Обладающий антиоксидантным действием мио-инозитол является перспективным соединением для терапии недостаточности мужской репродуктивной функции, ассоциированной с окислительным стрессом. Результаты проведенного анализа литературы показали, что применение мио-инозитола у мужчин перспективно для улучшения сперматогенеза, подвижности, морфологии и функции митохондрий сперматозоидов, снижения уровня повреждений ДНК сперматозоидов при олигоастенотератозооспермии, астенозооспермии, выраженном окислительном стрессе, а также для повышения эффективности вспомогательных репродуктивных технологий. Однако многие проведенные к настоящему времени исследования эффективности мио-инозитола при недостаточности мужской репродуктивной функции имели малую численность выборок, не все были стандартизированы по дизайну, в ряде исследований мио-инозитол использовался в комбинации с другими соединениями, что могло повлиять на достоверность и воспроизводимость результатов.
Для оптимизации стратегий лечения недостаточности мужской репродуктивной функции и разработки клинических рекомендаций применения мио-инозитола необходимо проведение масштабных контролируемых исследований.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: С.М. Гюлахмедова — сбор, анализ, систематизация и интерпретация данных литературы, написание и редактирование текста рукописи, формулировка выводов; А.А. Дружинина — анализ и систематизация данных литературы, пересмотр содержания рукописи; О.С. Аляутдина — концепция исследования, критический пересмотр и редактирование текста рукописи, формулировка выводов; Е.М. Елисеева — сбор, анализ и систематизация данных литературы, написание и редактирование текста рукописи; А.А. Чистохина — подготовка иллюстративных материалов, формулировка выводов, доработка текста рукописи.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria. The most significant contributions were as follows. Safiya M. Giulakhmedova collected, analysed, systematised and interpreted literature data, wrote and edited the manuscript text, and formulated the conclusions. Anna A. Druzhinina analysed and systematised literature data, revised the manuscript content. Olga S. Alyautdina revised the manuscript content, critically revised and edited the manuscript, and formulated the conclusions. Ekaterina M. Eliseeva collected, analysed and systematised literature data, wrote the manuscript text, and edited the manuscript text. Anna A. Chistokhina designed the figure, formulated the conclusions, and edited the manuscript.
1. ВОЗ: бесплодием страдает каждый шестой человек в мире. https://www.who.int/ru/news/item/04-04-2023-1-in-6-people-globally-affected-by-infertility
2. Мкртчян ТМ. Бесплодие в России и в мире. Репробанк; 2021. https://reprobank.ru/novosti/stati/besplodie-v-rossii
3. Лабораторное руководство ВОЗ по исследованию и обработке эякулята человека. 6 изд. ВОЗ; 2021. https://www.who.int/ru/publications/i/item/9789240030787
4. Руководство ВОЗ по исследованию и обработке эякулята человека. 5 изд. ВОЗ; 2012. https://maximus2012.nethouse.ru/static/doc/0000/0000/0349/349989.hkxwiajjzo.pdf
5. Мужское бесплодие. Клинические рекомендации. Минздрав России; 2025.
6. Мужское бесплодие. Клинические рекомендации. Минздрав России; 2025.
7. ClinicalTrials.gov. Efficacy study of a food supplement with Myo-inositol, N-Acetyl-Cystein, Zinc and Vitamins on sperm DNA fragmentation. https://clinicaltrials.gov/study/NCT04959864
8. ClinicalTrials.gov. Efficacy study of a food supplement with Myo-inositol, N-Acetyl-Cystein, Zinc and Vitamins on sperm DNA fragmentation. https://clinicaltrials.gov/study/NCT04959864
Список литературы
1. Андреева МВ, Хаят СШ, Сорокина ТМ и др. Формы патозооспермии у мужчин с бесплодием в браке и/или с нарушениями репродуктивной системы. Андрология и генитальная хирургия. 2017;18(2):33–8. https://doi.org/10.17650/2070-9781-2017-18-2-33-38
2. Imran M, Zia R, Arshad M, et al. Exploration of the genetic and environmental determinants of male infertility: a comprehensive review. Egypt J Med Hum Genet. 2025;26:68. https://doi.org/10.1186/s43042-025-00703-w
3. Zhou Y, Zhang H, Yan H, et al. Deciphering the role of oxidative stress in male infertility: Insights from reactive oxygen species to antioxidant therapeutics. Front Biosci (Landmark Ed). 2025;30(4):27046. https://doi.org/10.31083/FBL27046
4. Pavuluri H, Bakhtiary Z, Panner Selvam MK, Hellstrom WJG. Oxidative stress-associated male infertility: Current diagnostic and therapeutic approaches. Medicina (Kaunas). 2024;60(6):1008. https://doi.org/10.3390/medicina60061008
5. Ilacqua A, Izzo G, Emerenziani GP, et al. Lifestyle and fertility: The influence of stress and quality of life on male fertility. Reprod Biol Endocrinol. 2018;16(1):115. https://doi.org/10.1186/s12958-018-0436-9
6. Епанчинцева ЕА, Селятицкая ВГ. Распространенность социальных факторов риска развития мужского бесплодия: курения, употребления алкоголя и наркотических веществ у мужчин из бесплодных пар, влияние «северного типа» употребления алкоголя на показатели эякулята. Сибирский научный медицинский журнал. 2023;43(3):95–103. https://doi.org/10.18699/SSMJ20230312
7. Гамидов СИ, Шатылко ТВ, Попова АЮ и др. Оксидативный стресс сперматозоидов: клиническое значение и коррекция. Медицинский Совет. 2021;(3):19–27. https://doi.org/10.21518/2079-701X-2021-3-19-27
8. Кадыров ЗА, Акрамов ММ, Алдыраков ЭМ. Воздействие антибактериальных препаратов на сперматогенез (обзор литературы). Андрология и генитальная хирургия. 2020;21(4):40–6. https://doi.org/10.17650/2070-9781-2020-21-4-40-46
9. Capelo MF, Monteiro PB, Anastácio BM. Effects of major analgesics on male fertility: A systematic literature review. JBRA Assist Reprod. 2024;28(2):331–40. https://doi.org/10.5935/1518-0557.20240020
10. Agarwal A, Baskaran S, Parekh N, et al. Male infertility. Lancet. 2021;397(10271):319–33. https://doi.org/10.1016/S0140-6736(20)32667-2
11. Ших ЕВ, Гребенщикова ЛЮ, Жукова ОВ, Багдасарян АА. Терапевтические стратегии применения мио-инозитола в лечении мужского фактора бесплодия. Гинекология. 2022;24(4):319–26. https://doi.org/10.26442/20795696.2022.4.201822
12. Овчинников РИ. Мужское бесплодие, связанное с окислительным стрессом сперматозоидов: патогенез и терапевтический подход. Медицинский совет. 2022;(5):46–53. https://doi.org/10.21518/2079-701X-2022-16-5-46-53
13. De Luca MN, Colone M, Gambioli R, et al. Oxidative stress and male fertility: Role of antioxidants and inositols. Antioxidants. 2021;10(8):1283. https://doi.org/10.3390/antiox10081283
14. Condorelli RA, La Vignera S, Mongioì LM, et al. Myo-inositol as a male fertility molecule: speed them up! Eur Rev Med Pharmacol Sci. 2017;21(2 Suppl):30–5. PMID: 28724176
15. Bisht S, Faiq M, Tolahunase M, Dada R. Oxidative stress and male infertility. Nat Rev Urol. 2017;14(8):470–85. https://doi.org/10.1038/nrurol.2017.69
16. Sharma A, Minhas S, Dhillo WS, Jayasena CN. Male infertility due to testicular disorders. J Clin Endocrinol Metab. 2021;106(2):442–59. https://doi.org/10.1210/clinem/dgaa781
17. Агавердиев БН, Асфандияров ФР, Круглов ВА и др. Антиоксидантная терапия в коррекции ДНК-фрагментации сперматозоидов. Экспериментальная и клиническая урология. 2024;17(2):26–34. https://doi.org/10.29188/2222-543-2024-17-2-26-34
18. Montanino Oliva M, Minutolo E, Lippa A, et al. Effect of myoinositol and antioxidants on sperm quality in men with metabolic syndrome. Int J Endocrinol. 2016;2016:1674950. https://doi.org/10.1155/2016/1674950
19. Semet M, Paci M, Saïas-Magnan J, et al. The impact of drugs on male fertility: a review. Andrology. 2017;5(4):640–63. https://doi.org/10.1111/andr.12366
20. Velez D, Ohlander S. Medical therapies causing iatrogenic male infertility. Fertil Steril. 2021;116(3):618–24. https://doi.org/10.1016/j.fertnstert.2021.07.1202
21. Araújo Leite GA, Lazzari VM, Simão VA, Sanabria M. Effects of statins on male reproductive health: A systematic review of rodent studies and their potential implications to human male reproduction. Crit Rev Toxicol. 2025;55(5):507–25. https://doi.org/10.1080/10408444.2025.2504395
22. Dos Santos LOP, da Silva PRQ, Gonçalves NC, et al. Impact of antidepressants on male fertility and seminal parameters: A systematic review. Reprod Sci. 2025;32(6):1768–74. https://doi.org/10.1007/s43032-025-01858-y
23. Ajayi AF, Akhigbe RE. Codeine-induced sperm DNA damage is mediated predominantly by oxidative stress rather than apoptosis. Redox Rep. 2020;25(1):33–40. https://doi.org/10.1080/13510002.2020.1752003
24. Pinto SZ, Aneck-Hahn N. Effect of in vitro exposure of first-line antiretrovirals on healthy human spermatozoa on kinematics and motility. Int Urol Nephrol. 2025;57(6):1715–35. https://doi.org/10.1007/s11255-024-04340-x
25. Governini L, Ponchia R, Artini PG, et al. Respiratory mitochondrial efficiency and DNA oxidation in human sperm after in vitro myo-inositol treatment. J Clin Med. 2020;9(6):1638. https://doi.org/10.3390/jcm9061638
26. Osman R, Lee S, Almubarak A, et al. Antioxidant effects of myo-inositol improve the function and fertility of cryopreserved boar semen. Antioxidants (Basel). 2023;12(9):1673. https://doi.org/10.3390/antiox12091673
27. Пустотина ОА, Дикке ГБ, Остроменский ВВ. Роль инозитола в репродукции человека. Акушерство и гинекология. 2022;(2):111–8. https://doi.org/10.18565/aig.2022.2.111-118
28. Vazquez-Levin MH, Verón GL. Myo-inositol in health and disease: its impact on semen parameters and male fertility. Andrology. 2020;8(2):277–98. https://doi.org/10.1111/andr.12718
29. Ghaemi M, Seighali N, Shafiee A, et al. The effect of Myo-inositol on improving sperm quality and IVF outcomes: A systematic review and meta-analysis. Food Sci Nutr. 2024;12(11):8515–24. https://doi.org/10.1002/fsn3.4427
30. Santoro M, Aquila S, Russo G. Sperm performance in oligoasthenoteratozoospermic patients is induced by a nutraceuticals mix, containing mainly myo-inositol. Syst Biol Reprod Med. 2020;67(1):50–63. https://doi.org/10.1080/19396368.2020.1826067
31. Ponchia R, Bruno A, Renzi A, et al. Oxidative stress measurement in frozen/thawed human sperm: The protective role of an in vitro treatment with myo-inositol. Antioxidants. 2021;11(1):10. https://doi.org/10.3390/antiox11010010
32. Azizi M, Cheraghi E, Soleimani Mehranjani M. Effect of myo-inositol on sperm quality and biochemical factors in cryopreserved semen of patients with asthenospermia. Andrologia. 2022;54(10):14528. https://doi.org/10.1111/and.14528
33. Formoso G, Baldassarre MPA, Ginestra F, et al. Inositol and antioxidant supplementation: Safety and efficacy in pregnancy. Diabetes Metab Res Rev. 2019;35(5):e3154. https://doi.org/10.1002/dmrr.3154
34. Carlomagno G, Unfer V. Inositol safety: Clinical evidences. Eur Rev Med Pharmacol Sci. 2011;15(8):931–6. PMID: 21845803
35. Dinkova A, Martinov D, Konova E. Efficacy of myo-inositol in the clinical management of patients with asthenozoospermia. Eur Rev Med Pharmacol Sci. 2017;21(2 Suppl):62–5. PMID: 28724182
36. Жукова ОВ, Ших ЕВ. Клинико-фармакологические подходы к применению антиоксидантной терапии при мужском бесплодии. Фармакология & фармакотерапия. 2024;(4):18–26. https://doi.org/10.46393/27132129_2024_4_18-26
37. Роживанов РВ, Чернова МО, Роживанова ЕР, Есауленко ДИ. Коррекция окислительного стресса и репродуктивная реабилитация мужчин. Проблемы репродукции. 2023;29(6):106–15. https://doi.org/10.17116/repro202329061106
38. Korosi T, Barta C, Rokob K, Torok T. Physiological Intra-Cytoplasmic Sperm Injection (PICSI) outcomes after oral pretreatment and semen incubation with myo-inositol in oligoasthenoteratozoospermic men: results from a prospective, randomized controlled trial. Eur Rev Med Pharmacol Sci. 2017;21(2 Suppl):66–72. PMID: 28724183
Об авторах
С. М. ГюлахмедоваРоссия
Гюлахмедова Сафия Мирзабеговна
Петровский б-р, д. 8, стр. 2, Москва, 127051
А. А. Дружинина
Россия
Дружинина Анна Александровна
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. С. Аляутдина
Россия
Аляутдина Ольга Сергеевна, д-р мед. наук, профессор
Трубецкая ул., д. 8, cтр. 2, Москва, 119991
Е. М. Елисеева
Россия
Екатерина Максимовна Елисеева
Петровский б-р, д. 8, стр. 2, Москва, 127051
А. А. Чистохина
Россия
Чистохина Анна Андреевна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Гюлахмедова С.М., Дружинина А.А., Аляутдина О.С., Елисеева Е.М., Чистохина А.А. Терапевтический потенциал мио-инозитола при недостаточности мужской репродуктивной функции: коррекция параметров сперматогенеза и окислительного стресса (обзор). Безопасность и риск фармакотерапии. 2025;13(3):290-299. https://doi.org/10.30895/2312-7821-2025-13-3-290-299
For citation:
Giulakhmedova S.M., Druzhinina A.A., Alyautdina O.S., Eliseeva E.M., Chistokhina A.A. Therapeutic Potential of Myo-Inositol in Male Infertility: Correction of Spermatogenesis Parameters and Oxidative Stress (Review). Safety and Risk of Pharmacotherapy. 2025;13(3):290-299. (In Russ.) https://doi.org/10.30895/2312-7821-2025-13-3-290-299