ОСНОВНАЯ ИНФОРМАЦИЯ О ЖУРНАЛЕ
«Безопасность и риск фармакотерапии» – научно-практический рецензируемый журнал открытого доступа, выпускаемый в печатной и онлайн-версиях, единственный в России, полностью посвященный данной тематике. Основан в 1994 году.
Цель журнала: освещение научных достижений и практического опыта в области обеспечения безопасности лекарственных средств и снижения рисков фармакотерапии.
Целевая аудитория. Предназначен для специалистов практического здравоохранения, клинических фармакологов и врачей других специальностей, провизоров, специалистов экспертных учреждений, уполномоченных по фармаконадзору и специалистов по фармаконадзору фармацевтических компаний и организаций, сотрудников центров доклинических и клинических исследований, регуляторных и контрольно-надзорных органов в сфере обращения лекарственных средств, научно-исследовательских институтов, преподавателей, студентов и соискателей медицинских и фармацевтических вузов. Более подробная информация – в разделе «Цели и тематика».
Учредитель: ФГБУ «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации.
Периодичность: 4 раза в год.
Импакт-фактор: двухлетний импакт-фактор РИНЦ (2024) - 0,826.
Редколлегия. Географическое представительство:
- 3 континента
- 10 стран
- 17 городов
Рецензирование:
- Двойное слепое
- Минимум 2 рецензента на рукопись
Основные метрики журнала:
- 14 дней в среднем от подачи до первого решения
- 151 день в среднем от подачи до публикации в Интернете
- 23% приглашенных авторов
- 63% доля принятия рукописей
- 37 тыс. загрузок PDF в 2023 г.
Плата за публикацию: бесплатно.
Индексация. Входит в Scopus (Accepted Titles May 2025), Перечень ВАК (категория К1), Russian Science Citation Index, РИНЦ, DOAJ seal. Информация об индексации в других российских и международных базах доступна в разделе Индексирование.
Регистрация. Свидетельство о регистрации средства массовой информации ПИ № ФС77-82932 от 14 марта 2022 г.
Подписка. Подписной индекс в каталоге Пресса России – 57940, Урал-Пресс – 57940.
Текущий выпуск
ГЛАВНАЯ ТЕМА: ТОНКОЕ ИСКУССТВО ВРАЧЕВАНИЯ ДУШИ: КАМО ГРЯДЕШИ?
Современные исследования в психофармакологии дополняют традиционные моноаминовые теории, интегрируя новые данные о роли нейровоспаления, микробиома и нарушений нейропластичности в развитии психических расстройств. Для получения экспертной оценки реальных рисков и перспектив, а также понимания комплексных этических, медицинских и социальных вызовов, сопровождающих развитие новых психотропных препаратов, крайне полезен взгляд изнутри — интервью со специалистом-практиком. Главный редактор журнала «Безопасность и риск фармакотерапии», начальник Управления экспертизы безопасности лекарственных средств ФГБУ «НЦЭСМП» Минздрава России, доктор медицинских наук, профессор Ренад Николаевич Аляутдин и заведующая кафедрой психиатрии и наркологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, член-корреспондент РАН, доктор медицинских наук, профессор Марина Аркадьевна Кинкулькина в беседе об особенностях лечения психических расстройств в эпоху эволюции психофармакотерапии обсудили поиск новых мишеней для терапевтического воздействия, проблемы разработки и внедрения инновационных препаратов и возможности минимизации рисков лечения через призму персонализированной медицины.
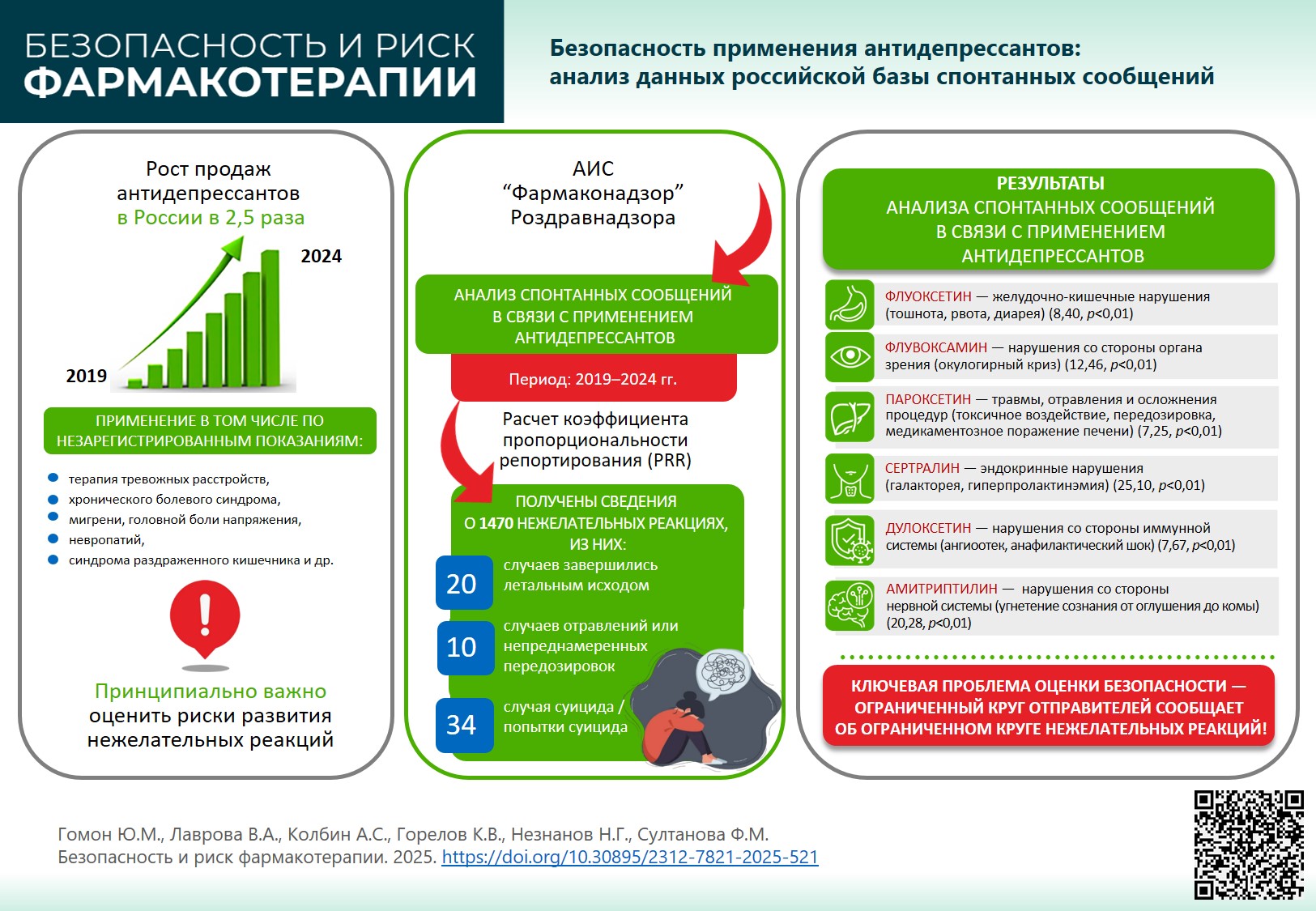
ВВЕДЕНИЕ. На фоне расширения практики применения антидепрессантов по широкому кругу показаний, в том числе вне зарегистрированных показаний, а также в уязвимых группах пациентов, важно обобщить имеющиеся данные о безопасности этих лекарственных препаратов (ЛП).
ЦЕЛЬ. Оценить профиль безопасности антидепрессантов, рекомендованных в Российской Федерации для лечения пациентов с невротическими расстройствами.
МАТЕРИАЛЫ И МЕТОДЫ. Изучены спонтанные сообщения, поступившие в базу данных «Фармаконадзор» Автоматизированной информационной системы Росздравнадзора в период 2019–2024 гг. для ЛП с международными непатентованными наименованиями: флувоксамин, циталопрам/эсциталопрам, пароксетин, флуоксетин, сертралин, венлафаксин, дулоксетин, вортиоксетин, амитриптилин, кломипрамин, миртазапин, имипрамин. Для каждого международного непатентованного названия рассчитаны отношения шансов репортирования (ROR), коэффициент пропорциональности репортирования (PRR) в отношении статистически значимой диспропорциональности.
РЕЗУЛЬТАТЫ. Наиболее часто сообщалось о нежелательных реакциях при применении амитриптилина (n=470), наиболее редко — имипрамина (n=2). Для большинства изученных ЛП общее количество спонтанных сообщений за 5 лет наблюдения не превышало 100. Статистически значимая связь между применением ЛП и развитием НР продемонстрирована для атипичного антидепрессанта вортиоксетина: психические, эндокринные нарушения, нарушения со стороны сердца и репродуктивной системы. Для второго ЛП данной группы агомелатина подтверждена связь с лабораторными и инструментальными нарушениями. В группе селективных ингибиторов обратного захвата серотонина (СИОЗС) статистически значимыми были связи: флуоксетин — желудочно-кишечные нарушения; флувоксамин — нарушения со стороны органа зрения; пароксетин — нарушения системно-органного класса «травмы, отравления и осложнения процедур»; сертралин — эндокринные нарушения. Применение ингибиторов обратного захвата серотонина и норадреналина (ИОЗСН) венлафаксина и дулоксетина статистически значимо связано с нарушениями со стороны иммунной системы. Прием трициклического антидепрессанта амитриптилина ассоциирован с нарушениями со стороны нервной системы. Кроме того, выявлена высокая активность репортирования единичными медицинскими организациями и фармацевтическими компаниями о некоторых ЛП (атипичные антидепрессанты, СИОЗС, ИОЗСН) и нежелательных реакциях (СИОЗС — окулогирный криз).
ВЫВОДЫ. В период с 2019 по 2024 г. количество спонтанных сообщений о случаях развития нежелательных реакций на фоне применения антидепрессантов ежегодно возрастало, но общий уровень репортирования остался низким. Малое количество спонтанных сообщений, не соответствующее реальному уровню потребления ЛП, а также выявленная неравномерность поступления спонтанных сообщений с превалированием данных по отдельным ЛП и нежелательным реакциям не позволяют оценить профиль безопасности всех групп антидепрессантов. Для уточнения профиля безопасности рассмотренных ЛП целесообразно проведение дальнейших исследований с использованием данных реальной клинической практики.
ВВЕДЕНИЕ. Клозапин эффективен при лечении пациентов с терапевтической резистентностью при шизофрении, но его применение может сопровождаться развитием нежелательных реакций, в частности клозапин-индуцированной сиалореей (КИС). Данные о механизме развития КИС ограниченны. Выделение фармакогенетических предикторов КИС позволит оценить вероятность возникновения осложнений до назначения терапии, а также уточнить отдельные звенья патогенетического механизма данной нежелательной реакции.
ЦЕЛЬ. Выявление фармакогенетических предикторов клозапин-индуцированной сиалореи при помощи систематического анализа данных литературы.
ОБСУЖДЕНИЕ. Поиск исследований проводили независимо два соавтора по базам PubMed, Google Scholar, GeneCads, PharmGKB. В общей сложности было найдено 6 исследований, в которых рассматривалось 17 генов-кандидатов. Ассоциация с КИС была выявлена для генов ADRA2A, DRD4. Полиморфизм rs1800544 гена ADRA2A регулирует экспрессию адренорецептора альфа 2А типа (ADRA2A). При этом α2-адренорецепторы участвуют в регуляции секреции слюны, а антагонистическое действие клозапина на них приводит к возникновению КИС. Носительство полиморфизма 120-bp DRD4 приводит к снижению уровня экспрессии дофаминового рецептора 4-го типа (DRD4). Это, в свою очередь, может вызвать развитие КИС за счет повышения степени блокады рецептора клозапином. Однако полученные данные противоречат результатам ряда других исследований. Возможным объяснением данного несоответствия является анализ различных полиморфизмов в указанных работах. Кроме того, проанализированные исследования имели ряд методологических ограничений.
ВЫВОДЫ. Проведенный систематический обзор литературы позволил определить фармакогенетические предикторы КИС. Но для уточнения полученных ассоциаций и разработки фармакогенетической панели с высокой прогностической точностью в отношении КИС необходимо проведение крупных мультицентровых исследований, использующих строгий проспективный дизайн с учетом выявленных ограничений.
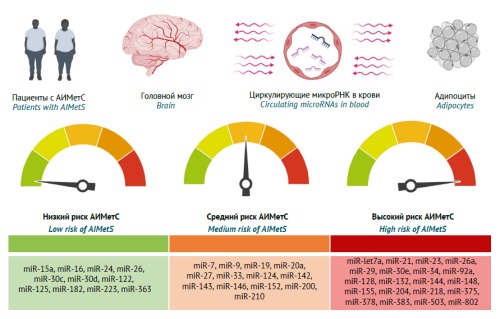
ВВЕДЕНИЕ. В первой части статьи был рассмотрен антипсихотик-индуцированный метаболический синдром (АИМетС) как распространенная нежелательная реакция при фармакотерапии психических расстройств и болезней зависимости. Показаны подходы к спектру и оценке основных и дополнительных клинических и лабораторных маркеров метаболического синдрома (МетС) у пациентов с расстройствами шизофренического спектра в целом и АИМетС в частности. Изменение уровня экспрессии циркулирующих микроРНК в крови может рассматриваться как одна из перспективных методологий прогнозирования и диагностики АИМетС.
ЦЕЛЬ. Рассмотреть роль циркулирующих микроРНК как эпигенетических биомаркеров развития основных звеньев патогенеза АИМетС.
ОБСУЖДЕНИЕ. Проведен анализ и систематизация результатов фундаментальных и клинических исследований роли циркулирующих микроРНК, влияющих на основные звенья патогенеза и прогрессирования АИМетС, опубликованных в период 2012–2024 гг. Проанализированы результаты исследований, отражающих роль микроРНК в ключевых звеньях патогенеза МетС и АИМетС: окислительном стрессе, системном воспалении, регуляции адипогенеза и развитии центрального ожирения, липидного метаболизма, гомеостаза холестерина липопротеинов высокой/низкой плотности, атерогенеза, жировом гепатозе, а также регуляции чувствительности к инсулину, его экспрессии, метаболизма глюкозы, аппетита, экспрессии нейропептида Y, орексина тиреоидных гормонов, паратиреоидного гормона, чувствительности к лептину. Показано, что персонализированная оценка безопасности фармакотерапии может зависеть от паттерна циркулирующих микроРНК, которые индуцируют или ингибируют основные звенья патогенеза АИМетС. Различия в результатах проанализированных исследований микроРНК могут быть обусловлены тем, что фундаментальные (преимущественно) и клинические исследования имели вариабельный дизайн, а также тем, что в них не учитывались другие модифицируемые и немодифицируемые факторы риска АИМетС. Предложена градация микроРНК по степени риска развития АИМетС.
ВЫВОДЫ. Этот обзор демонстрирует, что чувствительность и специфичность эпигенетических биомаркеров АИМетС могут варьировать в широком диапазоне в зависимости от характера их влияния (предиктивного или протективного) на один или несколько основных звеньев патогенеза рассматриваемой распространенной нежелательной реакции психофармакотерапии. Наиболее изученными являются микроРНК — предиктивные биомаркеры окислительного стресса (miR-1, miR-21, miR-23b, miR-27a) и системного воспаления (miR-21, miR-23a, miR-27a) у пациентов с высоким риском развития МетС и АИМетС. Перспективными эпигенетическими биомаркерами АИМетС являются микроРНК, влияющие на уровень экспрессии нейропептидов и чувствительность к ним, включая нейропептид Y (miR-let7b, miR-29b, miR-33 и др.), лептин (miR-let7a, miR-9, miR-30e и др.) и орексин (miR-137, miR-637, miR-654 и др.).
ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
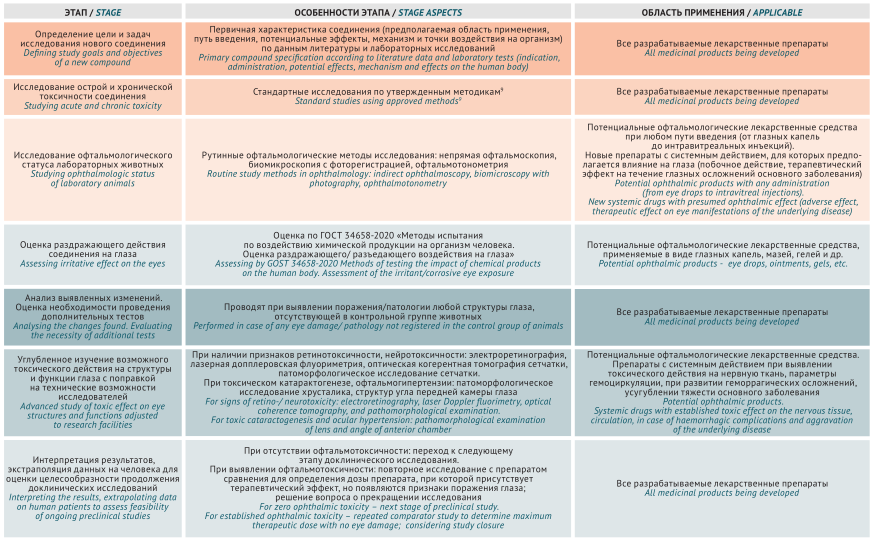
ВВЕДЕНИЕ. Оценка офтальмотоксичности потенциальных лекарственных средств является высокоинформативным элементом доклинических исследований, раскрывающим механизмы действия и фармакологические эффекты химического соединения на орган зрения при местном и системном применении. Однако единый алгоритм оценки офтальмотоксичности в настоящее время отсутствует, что свидетельствует о целесообразности изучения и обобщения российского и зарубежного опыта.
ЦЕЛЬ. Разработка алгоритма оценки офтальмотоксичности лекарственных препаратов в доклинических исследованиях in vivo на основе российских и международных рекомендаций.
ОБСУЖДЕНИЕ. Проведен анализ подходов к изучению офтальмотоксичности химических соединений в российских и международных нормативных документах (Руководство по проведению доклинических исследований лекарственных средств, ГОСТ 34658-2020, Руководство Организации экономического сотрудничества и развития (OECD) № 450 и № 263). Показано, что рекомендуемые методы применимы в доклинических исследованиях лекарственных препаратов и позволяют изучать влияние химических соединений на структуру (офтальмоскопия, биомикроскопия, оптическая когерентная томография) и функциональные параметры (электроретинография) глаза. Представлена основная информация о сравнительной анатомии и физиологии органа зрения мышей, крыс и кроликов, имеющая значение при исследовании раздражающего глаза и ретинотоксического эффектов и трансляции результатов в клинические исследования. Приведено содержательное описание методов исследования офтальмотоксичности и особенностей их практического применения у основных видов лабораторных животных с учетом особенностей их анатомии и физиологии. В результате обобщения изученных данных предложен комплексный дифференциальный подход к исследованию офтальмотоксичности разрабатываемых лекарственных препаратов.
ВЫВОДЫ. Предложенный алгоритм оценки токсического действия на глаза лекарственных препаратов как для офтальмологического, так и системного применения позволяет оптимизировать дизайн и сроки проведения доклинических исследований с использованием лабораторных животных и повысить безопасность применения препаратов у человека.
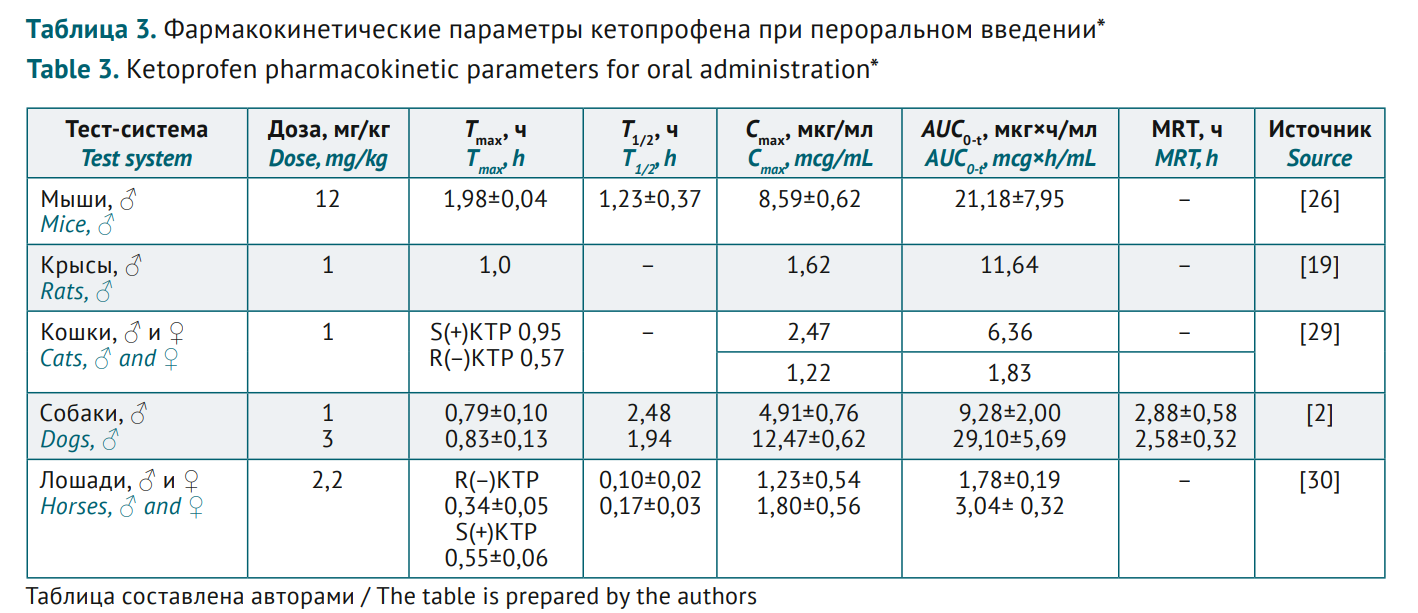
ВВЕДЕНИЕ. Кетопрофен — представитель группы нестероидных противовоспалительных препаратов, обладающий анальгетической, противовоспалительной и жаропонижающей активностью. Фармакокинетика кетопрофена сравнительно хорошо охарактеризована на различных моделях in vivo. Поскольку потенциал создания лекарственных форм кетопрофена не исчерпан и изучение фармакокинетики способствует качественной фармацевтической разработке, актуальна сравнительная оценка соответствующих данных у животных и человека.
ЦЕЛЬ. Выявление релевантных видов животных для доклинических исследований различных лекарственных форм кетопрофена путем обобщения данных о биоаналитических методиках для оценки фармакокинетики препарата и сравнения фармакокинетических параметров на разных тест-системах.
ОБСУЖДЕНИЕ. Для анализа кетопрофена в биоматериале наиболее часто используют метод обращенно-фазовой высокоэффективной жидкостной хроматографии с ультрафиолетовым или масс-спектрометрическим детектированием и элюенты на основе ацетонитрила или метанола и различных буферных растворов. Фармакокинетика кетопрофена изучена на животных разного филогенетического типа и на людях с использованием различных лекарственных форм (растворы для инъекций, таблетки, пастообразные формы и др.) и соответствующих им путей введения (внутривенное, внутримышечное, пероральное, трансдермальное). Отмечена высокая биодоступность препарата при разных путях введения. Сопоставимый диапазон максимальных концентраций (Cmax) при близких дозах и схожие значения временны́х фармакокинетических параметров (времени достижения максимальной концентрации, Tmax, периода полувыведения, T1/2, и среднего времени удержания препарата в организме, MRT) при трех основных путях введения (пероральном, внутривенном и внутримышечном) у человека с соответствующими параметрами у крыс, кошек и собак позволили предположить релевантность этих тест-систем при изучении фармакокинетики препаратов кетопрофена.
ВЫВОДЫ. Результаты проведенного анализа позволили предположить, что релевантными тест-системами при изучении фармакокинетики кетопрофена, по крайней мере при пероральном, внутривенном и внутримышечном путях введения, могут быть грызуны и крупные животные (кошки, собаки). На примере кетопрофена показана целесообразность сбора и обобщения разнородных фармакокинетических данных, а также сложность их сопоставления в связи с вариабельностью тест-систем, объектов исследования, дозировок и путей введения.
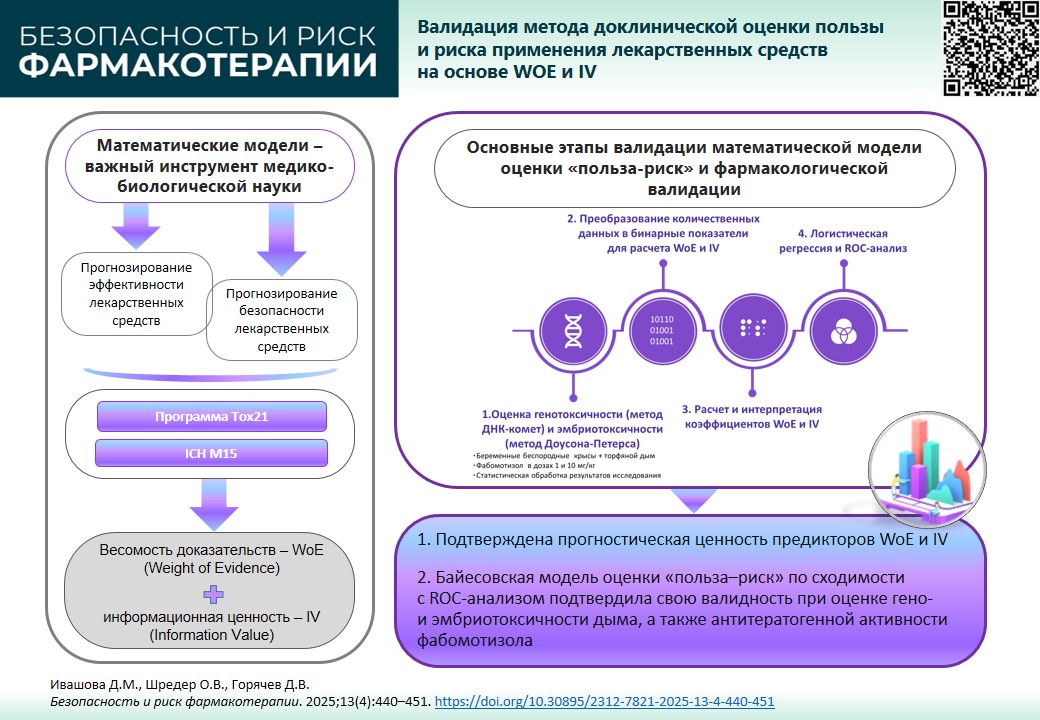
ВВЕДЕНИЕ. Математические модели успешно применяются в медико-биологических исследованиях, в том числе для прогнозирования эффективности и безопасности лекарственных препаратов. В ФГБУ «НЦЭСМП» Минздрава России разработан и внедрен в научную практику метод доклинической оценки соотношения «польза–риск» применения лекарственных средств, основанный на бинарной классификации переменных для расчета предикторов WoE (Weight of Evidence) и IV (Information Value). Алгоритмы расчета коэффициентов WoE и IV основаны на байесовской модели априорной вероятности, что позволяет прогнозировать риски и принимать обоснованные решения о применении фармакологических средств для снижения генотоксических и эмбриотоксических эффектов средовых тератогенов. Однако для подтверждения прогностической способности необходима фармакологическая валидация потенциального корректора и качества вычислений прогностической системы.
ЦЕЛЬ. Валидация метода доклинической оценки соотношения «польза–риск» на примере исследования фармакологической коррекции фабомотизолом репротоксических эффектов торфяного дыма у крыс.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использованы экспериментальные и статистические методы анализа. Для подтверждения прогностической значимости результатов доклинической оценки пользы и риска фармакологической коррекции гено- и эмбриотоксических эффектов торфяного дыма использовали методику, разработанную в ФГБУ «НЦЭСМП» Минздрава России. Для валидации математической модели оценки соотношения «польза–риск» и фармакологической валидации корригирующих свойств фабомотизола (в дозах 1 и 10 мг/кг) на моделях гено- и эмбриотоксичности у белых беспородных крыс, индуцированных торфяным дымом, применены методы логистической регрессии и ROC-анализа.
РЕЗУЛЬТАТЫ. В рамках фармакологической валидации анализ AUC (0,701; 0,617–0,786) показал, что корригирующая способность фабомотизола у крыс прогнозируется в диапазоне от «неудовлетворительной» до «хорошей» (0,500; 0,239–0,761). Это соответствует оценкам WOE/IV: от «низкой» до «умеренной» весомости (0,34; –0,99) и от «слабой» до «сильной» информационной ценности (0,02; 0,45). Проверка качества вычислений для генотоксичности показала следующие значения AUC: 0,554 для предсказанной вероятности и 0,432 для предсказанной группы (уровень случайного угадывания). Для эмбриотоксичности AUC составила, соответственно, 0,701 и 0,782, что указывает на хорошую предсказательную способность модели.
ВЫВОДЫ. Валидационное исследование подтвердило прогностическую ценность WoE и IV. Модель оценки соотношения «польза–риск», основанная на байесовской априорной вероятности, показала высокую сходимость с ROC-анализом в оценке гено- и эмбриотоксичности торфяного дыма, а также корригирующей способности фабомотизола.
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
ВВЕДЕНИЕ. Препарат валсартан+сакубитрил (комбинация ингибитора неприлизина и блокатора рецептора ангиотензина II (БРА)) обеспечивает эффективное снижение артериального давления (АД) и имеет потенциал для улучшения метаболических параметров организма. Однако, несмотря на наличие этого класса лекарственных средств в клинических рекомендациях, конкретные условия назначения данного препарата пациентам с артериальной гипертензией четко не определены, что свидетельствует о необходимости его более детального изучения.
ЦЕЛЬ. Оценить эффективность, безопасность, влияние на общие клинические исходы и качество жизни пациентов комбинации валсартан+сакубитрил, применяемой для лечения артериальной гипертонии в амбулаторных условиях.
МАТЕРИАЛЫ И МЕТОДЫ. Открытое проспективное лонгитюдное исследование с активным контролем «Эффективность комбинации валсартан+сакубитрил в лечении гипертонической болезни: результаты проспективного исследования» проведено на базе ГАУЗ ТО «Городская поликлиника № 12» (г. Тюмень) в период с 01.10.2022 по 31.03.2025. На 1 этапе исследования (n=550) период наблюдения — 3 мес., на 2 этапе (n=160) — 1 год. Контроль показателей АД проводили при включении в исследование, в конце 1 этапа, затем через 3, 6, 12 мес. терапии. На 1 этапе пациенты были разделены на 4 группы: ингибитор ангиотензинпревращающего фермента (иАПФ) + диуретик (n=189), иАПФ + блокатор кальциевых каналов (БКК) (n=121), БРА + диуретик (n=119), БРА+БКК (n=121). На 2 этапе пациенты, не достигшие целевого уровня АД ≤140/90 мм рт. ст. (n=160), были рандомизированы в 2 группы: исследовательская (n=80), терапия препаратами валсартан+сакубитрил + диуретик/БКК, и контрольная (n=80), терапия тройной комбинацией БРА+диуретик+БКК или иАПФ+диуретик+БКК.
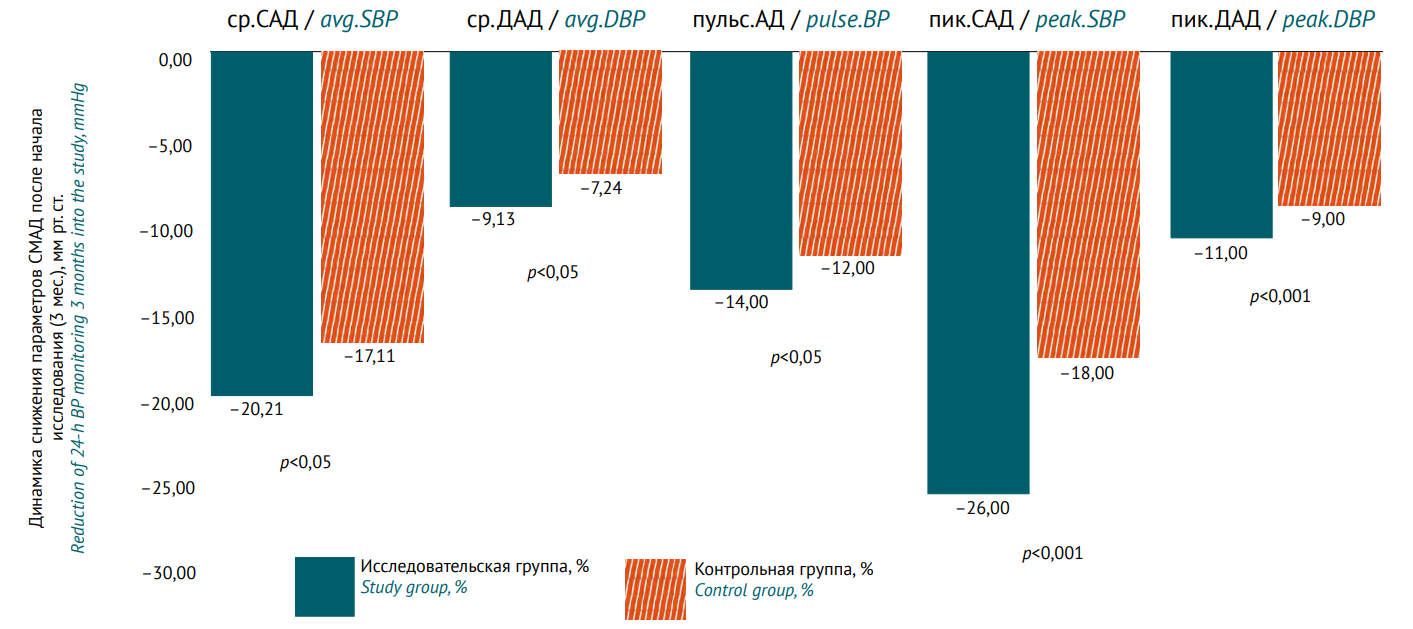
РЕЗУЛЬТАТЫ. На 2 этапе исследования через 3 мес. терапии доля пациентов, достигших целевого уровня АД, составила 93% в исследовательской группе против 83% в контрольной; через 6 мес. — 94 против 88%, через 12 мес. — 99 против 98% соответственно. Среднесуточные уровни систолического и диастолического давления через 3 мес. лечения также были статистически значимо ниже (p<0,05) в исследовательской группе, чем в контрольной. Применение комбинации валсартан+сакубитрил оказало положительное влияние на снижение пиковых систолического, диастолического, пульсового АД и индекса времени гипертензии (p<0,001). Через 6 мес. различия между группами по уровню снижения всех оцениваемых показателей (по данным суточного мониторирования АД) сохранялись (p<0,001). Только через 12 мес. терапии пациенты в контрольной группе достигли сопоставимого с исследовательской группой снижения оцениваемых показателей, статистически значимые различия между группами не были выявлены. Качество жизни пациентов (оценка по опроснику EQ-5D) через 12 мес. наблюдения было выше в исследовательской группе, чем в контрольной: средний балл 0,82±0,08 против 0,69±0,10 (изменение +0,17 против +0,05; p<0,05). Все выявленные нежелательные реакции при применении комбинации валсартан+сакубитрил были предсказуемыми, различия по частоте прекращения лечения между группами не достигали статистической значимости.
ВЫВОДЫ. Комбинация валсартан+сакубитрил продемонстрировала эффективность и безопасность при лечении гипертонической болезни и может быть рекомендована в качестве второй линии терапии при неэффективности двухкомпонентных схем антигипертензивной терапии первой линии.
ВВЕДЕНИЕ. Несмотря на относительно низкую долю в структуре онкологической заболеваемости, меланома кожи относится к одной из самых высокозатратных нозологий в онкологии. Появление новых комбинированных схем лечения требует регулярного фармакоэкономического мониторинга.
ЦЕЛЬ. Оценить структуру, динамику и затраты на лекарственную терапию пациентов с меланомой кожи в Московской области за 2020–2022 гг. на основании фармакоэпидемиологического и фармакоэкономического анализа данных льготного лекарственного обеспечения для выявления его ключевых тенденций на региональном уровне.
МАТЕРИАЛЫ И МЕТОДЫ. Первичные деперсонализированные данные для анализа были получены из медицинских карт пациентов из Единой медицинской информационно-аналитической системы (ЕМИАС). Были проанализированы данные всей совокупности пациентов по основным клиническим характеристикам (пол, возраст, код диагноза) и назначенным препаратам (международное непатентованное наименование (МНН), лекарственная форма, дозировка, количество отпущенных упаковок, суммарные затраты). Оценивали суммарные затраты и затраты для каждого МНН. Дополнительно анализировали динамику затрат в трехлетний период.
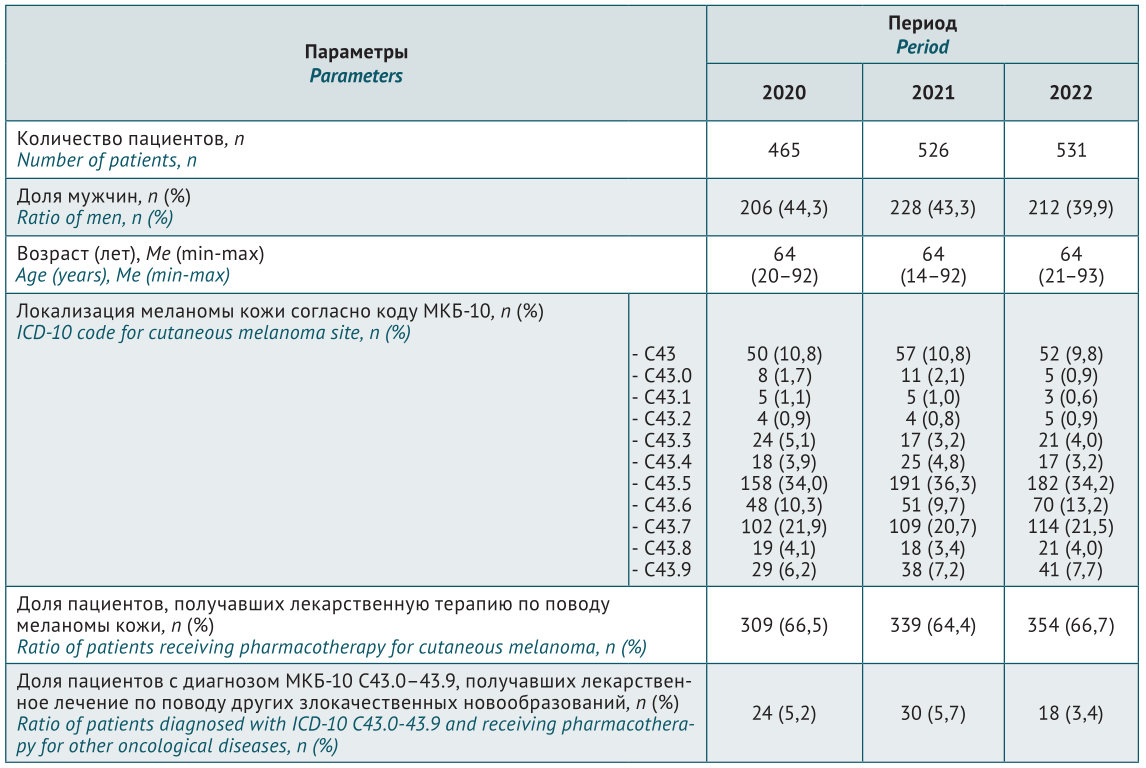
РЕЗУЛЬТАТЫ. Изучены данные 1522 пациентов с диагнозом по МКБ-10 C43.0–43.9 (злокачественная меланома кожи): 465 пациентов в 2020 г., 526 пациентов в 2021 г., 531 пациент в 2022 г. За анализируемый период количество пациентов увеличилось на 14% с постепенным снижением доли мужчин с 44,3 до 39,9%. Среди всех пациентов 2/3 получали лекарственную терапию по поводу основного заболевания. Суммарные затраты в амбулаторных условиях составили от 407,6 млн. руб. в 2020 г. до 615,3 млн. руб. в 2022 г. В структуре общих затрат на долю лекарственной терапии по поводу меланомы кожи приходилось в среднем 98%. За период 2020–2022 гг. наиболее высокие показатели по количеству пациентов, упаковок и уровню затрат были отмечены для комбинации препаратов дабрафениб+траметиниб и вемурафениб+кобиметиниб. На них приходилось в среднем 85% всех пациентов и почти 99% от всех затрат. В динамике за 3 года затраты на препараты дабрафениб и траметиниб увеличились вдвое при сопоставимом снижении в 2 раза затрат на вемурафениб и кобиметиниб.
ВЫВОДЫ. Проведена оценка структуры, динамики и затрат на лекарственную терапию пациентов с меланомой кожи в Московской области за 2020–2022 гг. Полученные результаты могут быть использованы для оптимизации фармакотерапии пациентов с данным заболеванием на региональном уровне за счет внедрения в широкую практику оценки подходов к лечению не только с клинической, но и с фармакоэкономической точки зрения.
Объявления
2025-12-05
На сайте ВОЗ опубликован новый документ «Глобальная стратегия интеллектуального фармаконадзора»
ВОЗ опубликовала документ «Глобальная стратегия интеллектуального фармаконадзора» (The global smart pharmacovigilance strategy). Стратегия ВОЗ задает рамки для построения и усиления национальных систем мониторинга безопасности с учетом разных уровней развития здравоохранения.
| Еще объявления... |
ISSN 2619-1164 (Online)