ГЛАВНАЯ ТЕМА: РАЗУМНАЯ ДОСТАТОЧНОСТЬ КАК ПРИНЦИП ЛЕКАРСТВЕННОЙ ТЕРАПИИ
В статье рассматривается проблема полипрагмазии и необоснованного назначения лекарственных препаратов беременным. Автор, заслуженный деятель науки Российской Федерации, член-корреспондент РАН, доктор медицинских наук, профессор Виктор Евсеевич Радзинский, заведующий кафедрой акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН, критически оценивает устоявшуюся практику госпитализации беременных при отсутствии клинических показаний и назначения им множества лекарственных препаратов, включая антибиотики, гормоны и спазмолитики. В большинстве случаев беременность не требует медикаментозного вмешательства. Широкое применение прогестинов при угрозе невынашивания не имеет достаточной доказательной базы, а использование спазмолитиков, таких как папаверин, при угрозе преждевременных родов неэффективно. Автор призывает к рациональному подходу в назначении препаратов беременным на основе современных клинических рекомендаций и принципа «не навреди». Подчеркивается необходимость следования клиническим протоколам, а также повышения информированности врачей о доказательствах применения лекарственных средств при беременности для предотвращения полипрагмазии и нежелательных последствий.
ВВЕДЕНИЕ. Фармакотерапия пациентов пожилого и старческого возраста сопряжена с полиморбидностью, полипрагмазией и, как следствие, может привести к возникновению нежелательных реакций (НР). Внедрение в клиническую практику критериев Бирса — ключевых рекомендаций по оптимизации назначений лекарственных средств (ЛС) в гериатрической популяции — приобретает все большую актуальность в связи с увеличением во всем мире доли населения в возрасте 60 лет и старше.
ЦЕЛЬ. Обзор истории создания критериев Бирса, основных изменений в обновленной версии в 2023 г., а также опыта использования критериев Бирса в практическом здравоохранении по данным российской и зарубежной литературы.
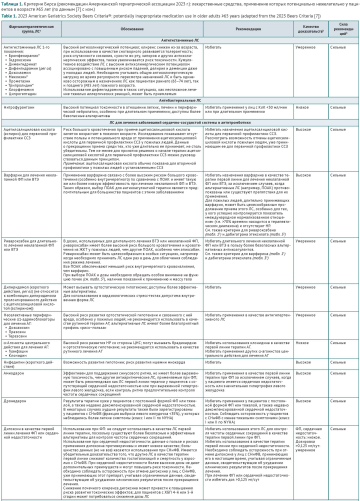
ОБСУЖДЕНИЕ. Критерии оценки рациональности фармакотерапии у пациентов пожилого и старческого возраста, предложенные М. Бирсом в 1991 г., регулярно пересматриваются и обновляются группой экспертов Американского гериатрического общества (American Geriatrics Society). С 2023 г. действует 7-я версия рекомендаций, предназначенных для поддержки принятия решений о лекарственной терапии у пациентов 65 лет и старше во всех амбулаторных, неотложных и стационарных условиях оказания медицинской помощи, за исключением хосписов и учреждений ухода. В обновленной версии критерии распределены на 5 категорий: 1) ЛС, применения которых следует избегать; 2) ЛС, применение которых потенциально нежелательно при определенных заболеваниях или синдромах; 3) ЛС, которые следует применять с осторожностью; 4) ЛС, применение которых потенциально нежелательно в связи с риском возникновения клинически значимых межлекарственных взаимодействий; 5) ЛС, применения которых следует избегать или снижать дозировку при нарушении функции почек. В отдельную группу обобщены ЛС с выраженным антихолинергическим действием. Критерии опираются на разработанную экспертами градацию качества доказательств и силы рекомендаций. Наиболее значимые изменения в обновленной версии критериев Бирса (2023 г.) по сравнению с предыдущей версией (2019 г.) коснулись рекомендаций в отношении ЛС групп антикоагулянтов и сульфонилмочевины. Результаты проведенного анализа показали, что критерии Бирса активно используются в практическом здравоохранении в Российской Федерации и за рубежом с целью снижения нежелательного воздействия потенциально не рекомендованных ЛС на пожилых пациентов за счет оптимизации выбора ЛС и схемы лечения, для обучения врачей и пациентов принципам рациональной фармакотерапии, а также для снижения стоимости фармакотерапии и оценки качества оказания медицинской помощи.
ВЫВОДЫ. Критерии Бирса являются эффективным инструментом для выявления потенциально не рекомендованных ЛС в уже назначенной лекарственной терапии и для подбора наиболее подходящего нового варианта. Применение критериев Бирса в практическом здравоохранении позволяет уменьшить количество НР, снизить частоту госпитализаций и уровень смертности у пациентов пожилого и старческого возраста.
ВВЕДЕНИЕ. Тяжесть течения COVID-19 коррелирует с риском развития поражения печени, однако в настоящее время результаты исследований указывают на связь нарушения функции печени с использованием различных лекарственных средств в комплексной терапии этого заболевания.
ЦЕЛЬ. Изучить годовой объем потребления препаратов с высоким риском развития лекарственного поражения печени (ВР ЛПП), применяющихся в комплексной терапии при COVID-19, и провести выборочный анализ листов назначений для разработки мероприятий по профилактике развития лекарственных поражений печени.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен АТС/DDD-анализ за 2020, 2021 и 2022 гг. и выборочный анализ 1250 медицинских карт стационарного больного и листов назначений пациентов с СOVID-19, находившихся на лечении в стационаре Волгоградской области, перепрофилированном для лечения СOVID-19. Для генно-инженерных биологических препаратов (ГИБП) и циклофосфамида в связи с невозможностью определения количества установленных суточных доз (DDD) при расчетах объема потребления были использованы средние курсовые дозы (СД). Выделены препараты с ВР ЛПП, которые могут вызывать клинически выраженное поражение печени (по данным базы LiverTox и информации российских клинических рекомендаций) и/ или повышение активности печеночных ферментов у ≥1% пациентов (по данным отчетов о безопасности лекарственных средств).
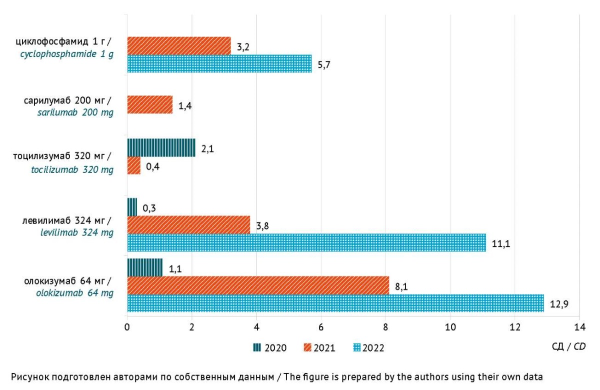
РЕЗУЛЬТАТЫ. Установлено, что 28% лекарственных препаратов, применявшихся в стационаре в комплексной терапии у пациентов с COVID-19, относятся к препаратам с ВР ЛПП. Суммарный объем потребления препаратов ВР ЛПП составил в 2020, 2021 и 2022 годах 342,3, 425,3 и 402,3 DDD/100 койко-дней соответственно. Для ГИБП, вводимых однократно, и циклофосфамида суммарный объем потребления составил в 2020, 2021 и 2022 годах 3,5, 16,9 и 29,7 СД/100 пролеченных пациентов соответственно. По результатам выборочного анализа 1250 медицинских карт выявлено, что 19,8% (247/1250) пациентов получали одновременно 5 и более препаратов ВР ЛПП, и это повысило риск неблагоприятных межлекарственных взаимодействий с развитием ЛПП. Среди препаратов ВР ЛПП в 2022 г. наиболее часто пациентам назначали омепразол (188,7 DDD/100 койко-дней), нестероидные противовоспалительные средства и парацетамол (54,4 DDD/100 койко-дней), аторвастатин (46,2 DDD/100 койко-дней), левофлоксацин (26,4 DDD/100 койко-дней), цефтриаксон (20,5 DDD/100 койко-дней), фавипиравир (17,3 DDD/100 койко-дней), генно-инженерные биологические препараты (24,0 СД/100 пациентов).
ВЫВОДЫ. Для снижения риска развития ЛПП, в том числе вследствие межлекарственного взаимодействия, у госпитализированных в инфекционные отделения с COVID-19 пациентов требуется ограничить применение гепатотоксичных антибактериальных препаратов, ингибиторов протоновой помпы и нестероидных противовоспалительных средств или рассмотреть возможность назначения препаратов с меньшим риском гепатотоксичности.
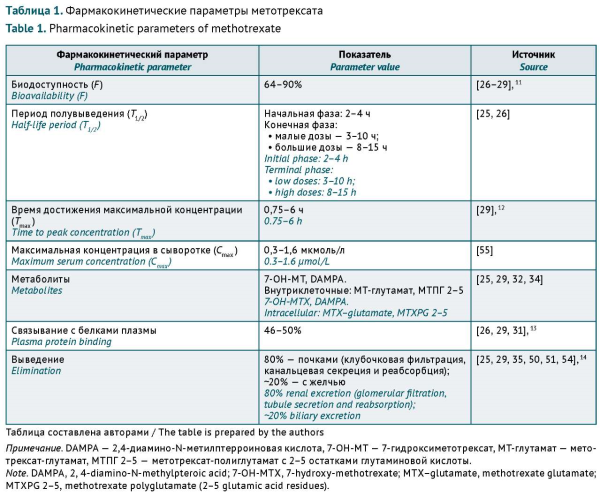
ВВЕДЕНИЕ. Метотрексат (МТ) — базисный противовоспалительный препарат (БПВП) в лечении ревматоидного артрита, является эталоном для оценки эффективности и безопасности биологических, а также таргетных синтетических препаратов. Однако узкий терапевтический диапазон МТ, вариабельность фармакокинетических и фармакодинамических показателей у пациентов, а также потенциальные клинически значимые лекарственные взаимодействия могут явиться причинами неэффективности лечения и повышения риска развития нежелательных реакций (НР).
ЦЕЛЬ. Описать ключевые клинически значимые лекарственные взаимодействия метотрексата при терапии ревматологических заболеваний и определить возможные подходы к решению данной проблемы на основании анализа данных литературы.
ОБСУЖДЕНИЕ. МТ характеризуется фармакокинетическими лекарственными взаимодействиями, происходящими на этапах всасывания, проникновения в клетку и выведения препарата. Показано, что на элиминацию МТ и его терапевтические эффекты могут оказывать влияние некоторые нестероидные противовоспалительные препараты, теофиллин, сульфасалазин, антибактериальные средства и ингибиторы протонной помпы. Основными НР, связанными с приемом МТ, являются гематотоксичность, гепатотоксичность, повреждение легочной ткани (интерстициальный пневмонит, фиброз легких) и нарушение функции почек. Тяжесть НР зависит от дозы МТ, сопутствующих заболеваний и приема других препаратов. Токсичность МТ может усиливаться при одновременном приеме лекарственных препаратов, которым свойственны гематотоксичность и негативное влияние на функцию почек (нарушение путей элиминации лекарственных средств). При совместном назначении МТ и лекарственных препаратов, имеющих описанные в литературе клинически значимые лекарственные взаимодействия, также необходимо учитывать факторы риска конкретного пациента. Среди наиболее значимых факторов риска: среднетяжелые и тяжелые нарушения функции почек и печени, пожилой возраст, полипрагмазия и гипоальбуминемия.
ВЫВОДЫ. Описаны потенциальные клинически значимые лекарственные взаимодействия между МТ и некоторыми нестероидными противовоспалительными препаратами, антибактериальными препаратами, ингибиторами протонной помпы, которые могут привести к повышению токсичности МТ, снижению его эффективности и зависят от индивидуальных особенностей пациентов. Депрескрайбинг, кратковременная отмена и оптимизация дозирования МТ могут рассматриваться как подходы к снижению рисков лекарственного взаимодействия.
ВВЕДЕНИЕ. Произошедшая в России в июне 2024 года вспышка пищевого ботулизма в очередной раз продемонстрировала опасность этого довольно редкого, но тяжелого инфекционного заболевания, вызываемого попаданием в организм ботулинического нейротоксина. Единственной этиотропной терапией ботулизма в настоящее время является введение антитоксинов к различным серотипам ботулотоксина. Однако при применении антитоксина не наблюдается быстрый регресс неврологической симптоматики, что может вызвать сомнения в эффективности проводимого лечения. Оценить возможности специфической терапии невозможно без понимания механизмов действия ботулотоксина и антитоксина.
ЦЕЛЬ. Систематизация информации о механизме повреждающего действия ботулинического нейротоксина, этиотропном лечении антитоксином и процессе восстановления пациентов.
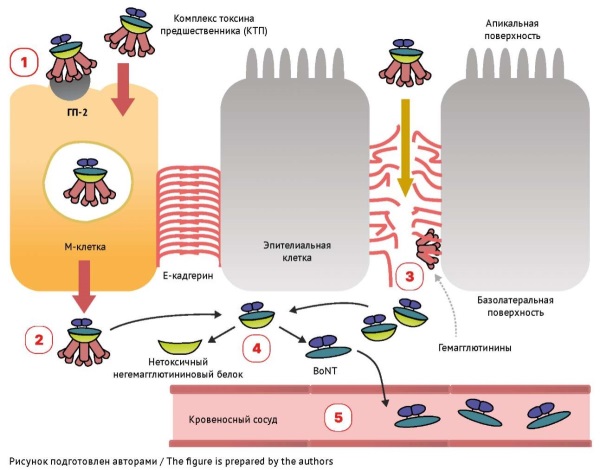
ОБСУЖДЕНИЕ. Показано, что механизм повреждающего действия ботулинического нейротоксина заключается в разрушении белков SNARE в пресинаптических окончаниях холинергических нервов, что приводит к нарушению выделения ацетилхолина в синаптическую щель и прекращению передачи возбуждения между нейронами. Отсутствие ацетилхолина в нервно-мышечном синапсе приводит к характерному стойкому вялому мышечному параличу. Специфический механизм действия ботулотоксина определяет тактику лечения, включающую в себя комплекс мероприятий для поддержания жизнеспособности организма и максимально скорое введение противоботулинической сыворотки. Ботулинический антитоксин при применении в течение 48 ч после появления симптомов связывает свободно циркулирующий в крови ботулотоксин, что останавливает прогрессирование паралича и предотвращает развитие дальнейших нарушений у пациентов. Однако антитоксические антитела не могут нейтрализовать действие уже адсорбированного нейротоксина, в связи с чем в течение 12 ч после введения сыворотки клиническая симптоматика может ухудшаться. Восстановление нормальной нейрональной передачи происходит за счет образования новых аксональных окончаний и может занимать длительное время.
ВЫВОДЫ. Введение антитоксина незаменимо в этиотропной терапии ботулизма и является эффективным, однако продолжительность восстановительного периода зависит от скорости процесса реиннервации нервно-мышечной передачи.
ФАРМАКОНАДЗОР
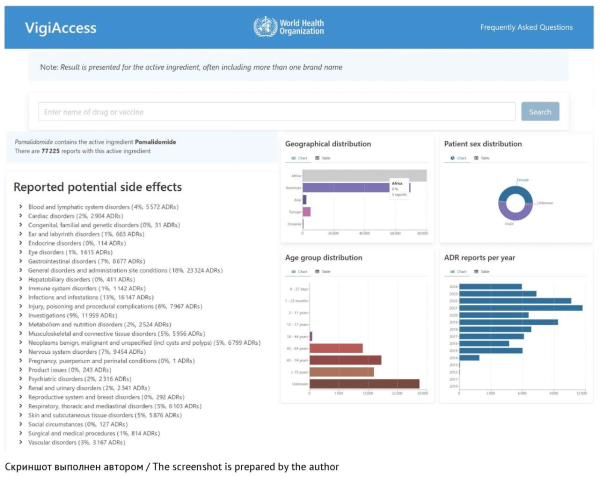
ВВЕДЕНИЕ. Пострегистрационный фармаконадзор — основной механизм мониторинга и оценки безопасности лекарственных препаратов в процессе широкого клинического применения, который позволяет получить актуальную информацию о нежелательных реакциях и принять необходимые меры для профилактики и минимизации рисков фармакотерапии. Держатели регистрационных удостоверений должны регулярно проводить поиск и анализ информации по безопасности лекарственных препаратов во всех доступных источниках данных. Отсутствие практических рекомендаций по выбору релевантных источников информации не позволяет разработать оптимальную стратегию сбора данных по безопасности лекарственных препаратов, необходимую для своевременного выявления изменений в профиле безопасности лекарственного препарата, влияющих на соотношение «польза–риск».
ЦЕЛЬ. Выбор оптимальных подходов к сбору информации по безопасности лекарственных препаратов из открытых источников данных, используемых при проведении мониторинга профиля безопасности и оценки соотношения «польза–риск» зарегистрированных лекарственных препаратов.
ОБСУЖДЕНИЕ. Основными источниками новых сведений по безопасности лекарственных препаратов являются: базы данных по фармаконадзору, интернет-сайты регуляторных органов, публикации в научной медицинской литературе, данные реальной клинической практики. Результаты проведенного анализа показали, что наиболее широко используются базы данных Всемирной организации здравоохранения (VigiBase), Европейского союза (EudraVigilance) и США (FAERS). В статье подробно описаны возможности приложений для работы с данными, условия доступа, представлены интерфейсы этих инструментов. Среди интернет-сайтов зарубежных регуляторных органов наиболее информативными являются сайты Европейского агентства по лекарственным средствам (EMA) и Управления по контролю за качеством продуктов питания и лекарственных средств США (FDA). Представлены подробные инструкции по поиску информации по безопасности на интернет-сайтах этих организаций. Кроме того, обобщены сведения об авторитетных медицинских журналах, в которых с наибольшей вероятностью могут быть опубликованы статьи о нежелательных реакциях при применении лекарственных препаратов, и о библиографических базах данных и поисковых системах, упрощающих поиск научных публикаций. Систематический мониторинг информации в указанных источниках позволит держателям регистрационных удостоверений эффективно оценивать профиль безопасности и соотношение «польза–риск» для зарегистрированных лекарственных препаратов.
ВЫВОДЫ. Использование рекомендованных источников данных позволит оптимизировать процесс мониторинга сведений по безопасности лекарственных препаратов, значительно повысить уровень выявления потенциальных рисков, связанных с их применением, и своевременно разработать меры для их предупреждения. В целом это будет способствовать повышению безопасности пациента и улучшению качества оказываемой медицинской помощи.
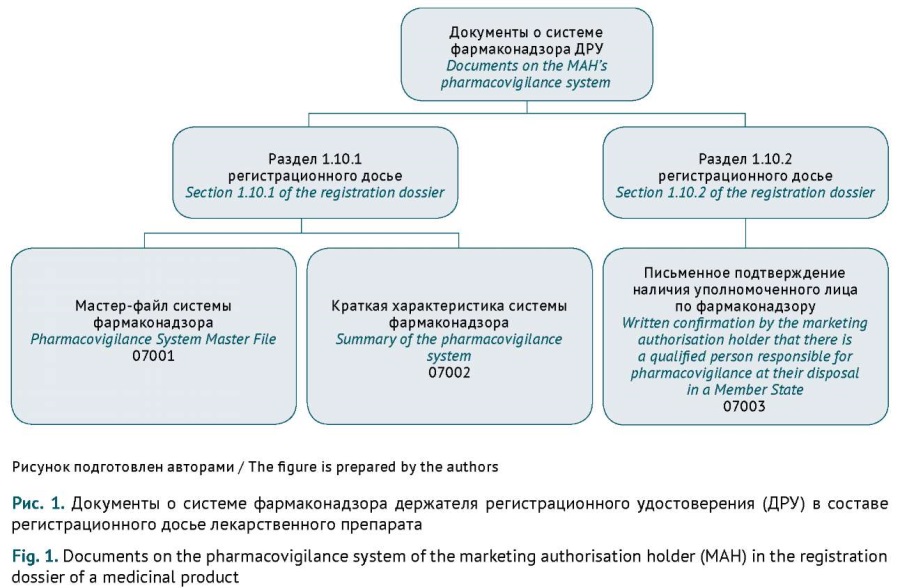
ВВЕДЕНИЕ. Документы о системе фармаконадзора держателя регистрационного удостоверения (ДРУ) — мастер-файл системы фармаконадзора (МФСФ), а также составляемая на его основе краткая характеристика системы фармаконадзора — являются обязательной частью регистрационного досье лекарственного препарата. Заявитель должен представлять и обновлять эти документы строго в соответствии с законодательством Евразийского экономического союза (ЕАЭС). Систематизация требований к оформлению и подаче документов, описывающих систему фармаконадзора, позволит заявителям оптимизировать процессы их подготовки.
ЦЕЛЬ. Анализ требований к представлению МФСФ и краткой характеристики системы фармаконадзора ДРУ в зависимости от регистрационных процедур ЕАЭС, описание типичных ошибок заявителей при представлении этих документов.
ОБСУЖДЕНИЕ. Содержание документов о системе фармаконадзора в составе регистрационного досье регулируется Правилами надлежащей практики фармаконадзора Евразийского экономического союза (Решение Совета Евразийской экономической комиссии (ЕЭК) от 03.11.2016 № 87), представление — Правилами регистрации и экспертизы лекарственных средств для медицинского применения (Решение Совета ЕЭК от 03.11.2016 № 78). ДРУ обязаны поддерживать в актуальном состоянии как сами документы, так и регистрационные досье, в которые они включены. В статье обобщены особенности предоставления МФСФ либо краткой характеристики системы фармаконадзора в зависимости от процедуры, заявленной на экспертизу, и типичные ошибки ДРУ при подготовке документов о системе фармаконадзора. При подаче заявления на регистрацию по Правилам надлежащей практики фармаконадзора ЕАЭС лекарственного препарата, который является первым для ДРУ на фармацевтическом рынке ЕАЭС, в регистрационное досье включают МФСФ. При последующих заявках на регистрацию лекарственных препаратов данного ДРУ в составе регистрационного досье подается краткая характеристика системы фармаконадзора. Изменения в документы по фармаконадзору вносятся в соответствии с классификатором (Решение Совета ЕЭК от 03.11.2016 № 78).
ВЫВОДЫ. Проведенный экспертами анализ требований к подаче МФСФ и краткой характеристики системы фармаконадзора ДРУ при различных регистрационных процедурах будет способствовать соблюдению заявителями требований законодательных актов ЕАЭС, корректному представлению необходимых документов о системе фармаконадзора и позволит уменьшить количество запросов со стороны регуляторных органов о представлении недостающей информации и отказов в регистрации лекарственного препарата.
ERRATUM
Исправление к статье Вельц Н.Ю. и соавт. «Представление документов о системе фармаконадзора в составе регистрационного досье в рамках процедур ЕАЭС: анализ требований и типичных ошибок»
https://www.risksafety.ru/jour/article/view/476
ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
ВВЕДЕНИЕ. Фторхинолоны — антибактериальные средства, применение которых ограничивается рис ком нежелательных реакций, в том числе риском поражения аорты. Повреждение других соединительнотканных структур (хрящей, сухожилий) при терапии фторхинолонами ассоциируется с дефицитом магния.
ЦЕЛЬ. Анализ влияния оротата магния на состояние грудной аорты лабораторных кроликов при терапии левофлоксацином.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование было включено 3 группы кроликов по 10 животных. В контрольной группе животные получали перорально раствор-носитель, в группе левофлоксацина — левофлоксацин 150 мг/кг/сут, группа левофлоксацина/магния — левофлоксацин 150 мг/кг/сут и магния оротат 140 мг/кг/сут. Препараты вводили в течение 14 сут, после чего у животных производили отбор венозной крови для определения сывороточных уровней матриксной металлопротеиназы 9, тканевого ингибитора матриксных металлопротеиназ 1, их соотношения, концентрации магния. Аутоптат грудного отдела аорты подвергали морфологическому исследованию и механическому испытанию на одноосное растяжение. Данные представлены в формате среднее ± стандартное отклонение.
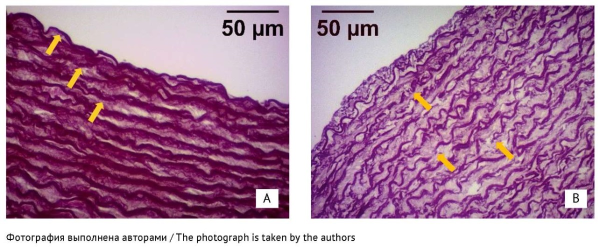
РЕЗУЛЬТАТЫ. Не выявлено изменения уровней сывороточного содержания матриксной металлопротеиназы 9, тканевого ингибитора матриксных металлопротеиназ 1, их соотношения и концентрации магния. Обнаружены фокусы умеренной фрагментации эластических волокон средней оболочки аорты в 5 из 10 образцов животных группы левофлоксацина, в 1 из 10 образцов — группы левофлоксацина/магния и ни у одного кролика из контрольной группы (р=0,013). У получавших левофлоксацин животных доля эластических мембран в средней оболочке аорты была значимо ниже, чем у остальных кроликов (p=0,015; сравнение с контролем: р=0,022), а сами мембраны были тоньше в среднем на 1,4 мкм (16%) (p=0,010, сравнение с контролем: p=0,022, сравнение с группой левофлоксацина/магния: p=0,019). Ковариационный анализ подтвердил различие характера зависимости прочности аорты от количества эластических мембран средней оболочки между тремя группами.
ВЫВОДЫ. Применение левофлоксацина в дозе 150 мг/кг/сут в течение 14 сут уменьшает содержание эластина в средней оболочке сосуда, снижает толщину, прочность мембран и повышает степень их фрагментации, что сопровождается падением предела прочности сосуда. Дополнительное применение оротата магния в дозе 140 мг/кг/сут сохраняет структуру эластических элементов средней оболочки аорты и предотвращает снижение прочности аорты. Полученный результат свидетельствует о роли дефицита магния в повреждении аорты, индуцированном фторхинолонами.
КАЧЕСТВО ЛЕКАРСТВЕННЫХ СРЕДСТВ
ВВЕДЕНИЕ. Данная работа является продолжением исследования по оценке контаминации желатиновых капсул элементными примесями, по результатам которого авторами был предложен перечень рекомендованных к нормированию элементов. Для обеспечения безопасности применения лекарственных препаратов в указанной лекарственной форме следует разработать критерии количественной оценки рисков негативного воздействия элементных примесей в желатиновых капсулах на организм человека.
ЦЕЛЬ. Определить значения предельно допустимых суточных концентраций элементных примесей (permitted daily concentration, PDC) в желатиновых капсулах с позиции риск-ориентированной стратегии контроля качества лекарственных средств.
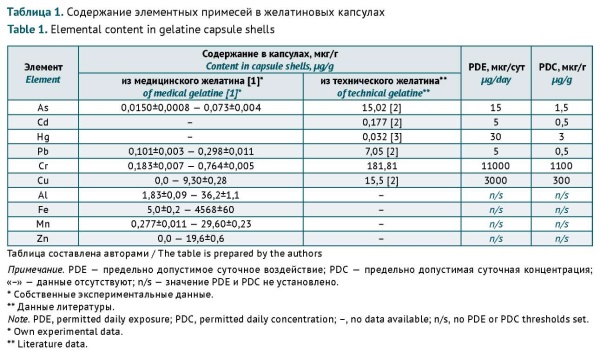
МАТЕРИАЛЫ И МЕТОДЫ. Проанализированы полученные ранее собственные экспериментальные данные, нормативные требования российского государственного стандарта, Государственной фармакопеи Российской Федерации (ГФ РФ), ведущих зарубежных фармакопей (США, Великобритании, Европейского союза, Китая, Японии, Индии) и данные научной литературы (без ограничения по дате и типу публикации) по содержанию Al, As, Cd, Cu, Cr, Fe, Hg, Mn, Pb, Zn в желатиновых капсулах и медицинском желатине.
РЕЗУЛЬТАТЫ. Установлено, что при нормировании содержания элементных примесей в желатиновых капсулах необходимо учитывать не только их токсичность, но и способность ухудшать качество желатина. Для элементов-комплексообразователей Cd, Cu, Hg, Cr, Zn, оказывающих влияние на качество желатина на уровне концентраций ниже порога токсичности, рекомендовано в качестве пределов их содержания в желатиновых капсулах использовать нормы, закрепленные в ГОСТ 23058-89 «Желатин-сырье для медицинской промышленности» (Сd, Cu, Hg) и в ФС 2.1.0099.18 «Желатин» ГФ РФ XIV издания (Cr и Zn). Для Pb, влияющего на качество желатина при концентрациях, превышающих порог токсичности, и для As, не вызывающего кластеризацию молекул желатина, рекомендовано в качестве норм содержания в желатиновых капсулах использовать PDC, закрепленные в ОФС 1.1.0040 «Элементные примеси» ГФ РФ XV издания. Для определения предела содержания Al в желатиновых капсулах предложен коэффициент пересчета, позволяющий учесть способность элемента к комплексообразованию. Риск негативного воздействия Mn на организм человека рекомендовано оценивать опосредованно, путем добавления в перечень показателей качества медицинского желатина суммарного содержания тяжелых металлов. Содержание Fe также допустимо нормировать только в исходном медицинском желатине.
ВЫВОДЫ. Рекомендованы следующие пределы содержания элементных примесей в желатиновых капсулах: Al – 45, As – 1,5, Cd – 0,03, Cr – 10, Cu – 15, Hg – 0,05, Pb – 0,5, Zn – 30 мкг/г. Нормирование содержания этих элементов в желатиновых капсулах позволит предотвратить их негативное воздействие на организм человека и на качество желатиновой оболочки.
НОВОСТИ КОКРЕЙН (COCHRANE)
Эта статья представляет собой переведенное резюме на простом языке Кокрейновского обзора, ранее опубликованного в Кокрейновской базе данных систематических обзоров. Оригинальная публикация: Palacios C, Kostiuk LL, Cuthbert A, Weeks J. Vitamin D supplementation for women during pregnancy. Cochrane Database Syst Rev. 2024;7(7):CD008873. https://doi.org/10.1002/14651858.CD008873.pub5
ISSN 2619-1164 (Online)