Перейти к:
Циркулирующие микроРНК — перспективные биомаркеры для оценки риска развития антипсихотик-индуцированного метаболического синдрома (обзор): часть 1
https://doi.org/10.30895/2312-7821-2025-478
Резюме
ВВЕДЕНИЕ. Антипсихотик-индуцированный метаболический синдром (АИМетС) является распространенной нежелательной реакцией при фармакотерапии психических расстройств и болезней зависимости. Однако чувствительность и специфичность известных биохимических биомаркеров в крови могут быть недостаточными для оценки безопасности психофармакотерапии и риска развития АИМетС в связи с индивидуальными различиями метаболизма антипсихотиков у пациентов c расстройствами шизофренического спектра. Циркулирующие микроРНК в крови рассматриваются как новые перспективные эпигенетические биомаркеры АИМетС.
ЦЕЛЬ. Оценить возможность использования циркулирующих микроРНК как эпигенетических биомаркеров для прогнозирования и ранней диагностики АИМетС.
ОБСУЖДЕНИЕ. Проведен анализ результатов фундаментальных и клинических исследований роли циркулирующих микроРНК, влияющих на основные звенья патогенеза и прогрессирования АИМетС, опубликованных в период 2012–2024 гг. Представлены новые международные подходы к использованию основных и дополнительных клинических и биохимических биомаркеров АИМетС, показаны преимущества использования микроРНК в качестве эпигенетических биомаркеров АИМетС. Приведены обобщенные данные о роли микроРНК в механизмах развития АИМетС, включая окислительный стресс, системное воспаление, дифференцировку адипоцитов, метаболизм липидов и глюкозы, регуляцию аппетита, изменение экспрессии нейропептида Y, чувствительности к лептину, экспрессии орексина, уровней тестостерона, тиреоидных гормонов и паратиреоидного гормона.
ВЫВОДЫ. Выявление изменений уровня экспрессии циркулирующих микроРНК в доступных образцах (кровь, слюна, моча) перспективно как одна из альтернативных методологий прогнозирования и диагностики АИМетС. Во второй части обзора будет рассмотрена роль циркулирующих микроРНК как эпигенетических биомаркеров развития основных проявлений МетС, АИМетС, а также распределение сигнатур микроРНК в зависимости от риска развития АИМетС.
Ключевые слова
Для цитирования:
Шнайдер Н.А., Насырова Р.Ф., Пекарец Н.А., Гречкина В.В., Петрова М.М. Циркулирующие микроРНК — перспективные биомаркеры для оценки риска развития антипсихотик-индуцированного метаболического синдрома (обзор): часть 1. Безопасность и риск фармакотерапии. 2025;13(3):344-356. https://doi.org/10.30895/2312-7821-2025-478
For citation:
Shnayder N.A., Nasyrova R.F., Pekarets N.A., Grechkina V.V., Petrova M.M. Circulating MicroRNAs Are Promising Biomarkers for Assessing the Risk of Antipsychotic-Induced Metabolic Syndrome (Review): Part 1. Safety and Risk of Pharmacotherapy. 2025;13(3):344-356. https://doi.org/10.30895/2312-7821-2025-478
ВВЕДЕНИЕ
Антипсихотики (АП) относятся к препаратам первого выбора для лечения расстройств шизофренического спектра (РШС), но их применение сопряжено с высоким риском развития АП-индуцированного метаболического синдрома (АИМетС) [1]. Метаболический синдром (МетС) представляет собой кластер патологических состояний, включающий центральное (абдоминальное) ожирение, высокое артериальное давление (АД), гипергликемию натощак, триглицеридемию, снижение холестерина липопротеинов высокой плотности (ХС-ЛПВП) в сыворотке крови [2]. Увеличение распространенности МетС во многих странах [3] способствует росту показателей смертности населения [4] и экономического бремени заболевания [5]. По оценкам экспертов Международной федерации сахарного диабета (International Diabetes Federation, IDF), у 20–25% взрослого населения мира наблюдается МетС, а вероятность преждевременной смерти пациентов с МетС в 3 раза выше, чем при его отсутствии1.
Распространенность АИМетС высокая и варьирует от 37 до 63%, включая его основные компоненты: увеличение массы тела / окружности талии, дислипидемия, инсулинорезистентность / сахарный диабет 2 типа, артериальная гипертензия [6]. АИМетС играет определяющую роль в повышении риска преждевременной смертности у пациентов с РШС — преимущественно от сердечно-сосудистых заболеваний [7]. Негативные метаболические последствия применения АП поражают более половины пациентов психиатрического профиля с самым высоким риском для детей и подростков, являясь серьезным препятствием для длительного лечения социально значимых заболеваний, включая РШС [8][9].
Поскольку длительный (более 3-х мес.) прием АП может способствовать возникновению АИМетС, в международных клинических рекомендациях указана необходимость первоначального (исходного) физического и лабораторного обследования наивных пациентов (до назначения АП), а также последующий мониторинг клинических и лабораторных (биохимических, гормональных) маркеров для раннего выявления и лечения этой нежелательной реакции [10]. Расширение знаний об индивидуальном профиле переносимости хорошо зарекомендовавших себя типичных и атипичных АП и поиск новых биомаркеров АИМетС может способствовать повышению безопасности фармакотерапии РШС и минимизировать риск развития лекарственно-индуцированного метаболического расстройства [11][12].
Механизмы, лежащие в основе развития АИМетС, пока недостаточно ясны, а психиатрам доступно лишь несколько смягчающих (снижение дозы АП или завершение этапа активной терапии РШС с использованием АП, вызвавшего это состояние) или альтернативных (оптимизация образа жизни пациента с РШС, коррекция диеты) вариантов коррекции этой АП-индуцированной нежелательной реакции [13]. Это определяет важность поиска новых путей прогнозирования и ранней диагностики АИМетС, в том числе с использованием эпигенетических биомаркеров, позволяющих прогнозировать риск развития нежелательных реакций психофармакотерапии с более высокой чувствительностью, чем при использовании классических подходов [14]. К таким перспективным эпигенетическим биомаркерам относятся циркулирующие малые некодирующие рибонуклеиновые кислоты (микроРНК) [15–17], которые играют важную роль в регуляции различных физиологических и патологических процессов.
Цель работы — оценить возможность использования циркулирующих микроРНК как эпигенетических биомаркеров для прогнозирования и ранней диагностики АИМетС.
Проведен анализ фундаментальных и клинических исследований, посвященных циркулирующим микроРНК как эпигенетическим биомаркерам основных механизмов развития МетС и АИМетС, поступивших в базы данных Google Scholar, PubMed, Scopus, eLIBRARY.RU в период 2014–2024 гг. Ключевые слова для поиска: «метаболический синдром», «антипсихотик», «антипсихотик-индуцированный метаболический синдром», «эпигенетический биомаркер», «микроРНК», «metabolic syndrome», «antipsychotic», «antipsychotic-induced metabolic syndrome», «epigenetic biomarker», «microRNAs». Критерии включения: тип доступа — открытый доступ к полнотекстовой версии публикации на русском или английском языке; тип публикации — оригинальная статья, систематический обзор, метаанализ, Кокрейновский обзор. Критерии исключения: дублирующие публикации, диссертации и авторефераты диссертаций, опубликованные на правах рукописи.
В проанализированных нами публикациях изменение уровней экспрессии циркулирующих микроРНК оценивалось исследователями в крови (плазме, сыворотке, экзосомах, мононуклеарах).
ОСНОВНАЯ ЧАСТЬ
Диагностические критерии антипсихотик-индуцированного метаболического синдрома
Согласно новому определению IDF2 (2023 г.) для постановки диагноза МетС у пациента должно быть: центральное ожирение (увеличение окружности талии (табл. 1, опубликована на сайте журнала3) по сравнению с этническими нормами) плюс любые два из следующих маркеров: уровень триглицеридов (ТГ) в сыворотке крови ≥150 мг/дл (1,7 ммоль/л) или специфическое лечение триглицеридемии; уровень ХС-ЛПВП в сыворотке крови <40 мг/дл (1,03 ммоль/л) у мужчин и <50 мг/дл (1,29 ммоль/л) у женщин или специфическое лечение этого нарушения липидного обмена; повышение систолического АД ≥130 мм рт. ст., повышение диастолического АД ≥85 мм рт. ст. или лечение ранее диагностированной артериальной гипертензии; уровень глюкозы в плазме крови натощак ≥100 мг/дл (5,6 ммоль/л) или ранее диагностированный сахарный диабет 2 типа (если >100 мг/дл (5,6 ммоль/л), то настоятельно рекомендуется проведение теста на толерантность к глюкозе). В 2023 г. экспертами IDF также разработаны дополнительные клинические и лабораторные (биохимические, гормональные) маркеры МетС (табл. 2, опубликована на сайте журнала4, при составлении использованы также материалы [14][18][19]).
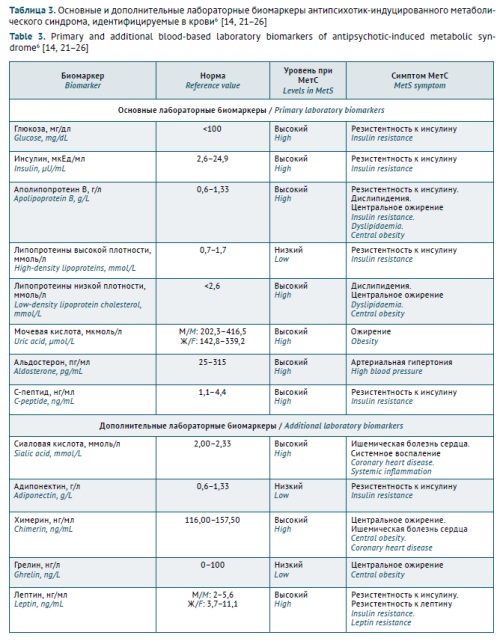
Биомаркеры могут использоваться не только для классификации, оценки индивидуального риска развития и прогрессирования психических расстройств и коморбидных заболеваний у конкретного пациента, но и для оценки безопасности и риска классических и новых терапевтических стратегий [20], включая риск развития МетС у пациентов с РШС: как первичного, так и вторичного (лекарственно-индуцированного), как в случае с АИМетС [8]. В последние годы паттерн лабораторных биомаркеров АИМетC значительно расширился в результате проведения российских и зарубежных фундаментальных и клинических исследований (табл. 3).
Таблица 3. Основные и дополнительные лабораторные биомаркеры антипсихотик-индуцированного метаболического синдрома, идентифицируемые в крови6 [14][21–26]
Table 3. Primary and additional blood-based laboratory biomarkers of antipsychotic-induced metabolic syndrome6 [14][21–26]
Биомаркер Biomarker | Норма Reference value | Уровень при МетС Levels in MetS | Симптом МетС MetS symptom |
Основные лабораторные биомаркеры / Primary laboratory biomarkers | |||
Глюкоза, мг/дл Glucose, mg/dL | <100 | Высокий High | Резистентность к инсулину Insulin resistance |
Инсулин, мкЕд/мл Insulin, µU/mL | 2,6–24,9 | Высокий High | Резистентность к инсулину Insulin resistance |
Аполипопротеин B, г/л Apolipoprotein B, g/L | 0,6–1,33 | Высокий High | Резистентность к инсулину. Дислипидемия. Центральное ожирение Insulin resistance. |
Липопротеины высокой плотности, ммоль/л High-density lipoproteins, mmol/L | 0,7–1,7 | Низкий Low | Резистентность к инсулину Insulin resistance |
Липопротеины низкой плотности, ммоль/л Low-density lipoprotein cholesterol, mmol/L | <2,6 | Высокий High | Дислипидемия. Центральное ожирение Dyslipidaemia. |
Мочевая кислота, мкмоль/л Uric acid, µmol/L | M/M: 202,3–416,5 Ж/F: 142,8–339,2 | Высокий High | Ожирение Obesity |
Альдостерон, пг/мл Aldosterone, pg/mL | 25–315 | Высокий High | Артериальная гипертония High blood pressure |
С-пептид, нг/мл C-peptide, ng/mL | 1,1–4,4 | Высокий High | Резистентность к инсулину Insulin resistance |
Дополнительные лабораторные биомаркеры / Additional laboratory biomarkers | |||
Сиаловая кислота, ммоль/л Sialic acid, mmol/L | 2,00–2,33 | Высокий High | Ишемическая болезнь сердца. Системное воспаление Coronary heart disease. |
Адипонектин, г/л Adiponectin, g/L | 0,6–1,33 | Низкий Low | Резистентность к инсулину Insulin resistance |
Химерин, нг/мл Chimerin, ng/mL | 116,00–157,50 | Высокий High | Центральное ожирение. Ишемическая болезнь сердца Central obesity. |
Грелин, нг/л Ghrelin, ng/L | 0–100 | Низкий Low | Центральное ожирение Central obesity |
Лептин, нг/мл Leptin, ng/mL | M/M: 2–5,6 Ж/F: 3,7–11,1 | Высокий High | Резистентность к инсулину. Резистентность к лептину Insulin resistance. |
Оментин, нг/мл Omentin, ng/mL | M/M (18–29 лет/years): 200–960 M/M (30–39 лет/years): 252–712 M/M (40–49 лет/years): 272–784 Ж/F (15–29 лет/years): 242–764 Ж/F (30–37 лет/years): 236–560 Ж/F (38–49 лет/years): 220–600 | Низкий Low | Центральное ожирение. Эндотелиальная дисфункция. Ишемическая болезнь сердца Central obesity. |
Паратиреоидный гормон, пг/мл Parathyroid hormone, pg/mL | 15,0–65,0 | Высокий High | Сердечно-сосудистые заболевания Cardiovascular diseases |
Тестостерон, нмоль/л Testosterone, nmol/L | M/M (18–55 лет/years): 8,64–29,0 Ж/F (18–55 лет/years): 0,29–1,67 | Низкий Low | Центральное ожирение Central obesity |
Тиреотропный гормон, мкМЕ/мл Thyroid-stimulating hormone, µIU/mL | 0,27–4,2 | Высокий High | Сердечно-сосудистые заболевания Cardiovascular diseases |
Общий билирубин, мкмоль/л Total bilirubin, µmol/L | <21 | Низкий Low | Окислительный стресс Oxidative stress |
Белок, связывающий жирные кислоты в адипоцитах, нг/мл Adipocyte fatty acid-binding protein, ng/mL | <6,2 | Высокий High | Центральное ожирение. Кардиометаболические заболевания Central obesity. |
Растворимый сывороточный лиганд CD40, нг/мл Serum soluble ligand CD40, ng/mL | <3,5 | Высокий High | Системное воспаление. Ишемическая болезнь сердца Systemic inflammation. |
Цистатин С, мг/л Cystatin C, mg/L | 0,5–1,2 | Высокий High | Артериальная гипертония High blood pressure |
Ферритин, мкг/л Ferritin, µg/L | M/M: 20–250 Ж/F: 10–120 | Противоречивые Contradictory | Окислительный стресс Oxidative stress |
Фибриноген, г/л Fibrinogen, g/L | 1,8–3,5 | Высокий High | Артериальная гипертония. Ишемическая болезнь сердца High blood pressure. |
Фактор роста фибробластов 21, пг/мл Fibroblast growth factor 21, pg/mL | M/M: 3,6–1021,4 Ж/F: 65,3–1209,8 | Высокий High | Центральное ожирение. Атеросклероз Central obesity. |
Моноцитарный хемотаксический протеин-1, пг/мл Monocytic chemotactic protein-1, pg/mL | 4,7–300,0 | Высокий High | Ишемическая болезнь сердца Coronary artery disease |
Ингибитор активатора плазминогена-1, нг/мл Plasminogen activator inhibitor-1, ng/mL | 5,0–40,0 | Высокий High | Резистентность к инсулину. Ишемическая болезнь сердца Insulin resistance. |
Ретинол-связывающий белок 4, мкг/мл Retinol-binding protein 4, µg/mL | 11,0–40,0 | Высокий High | Центральное ожирение. Резистентность к инсулину. Сердечно-сосудистые заболевания Central obesity. |
Фактор некроза опухоли альфа, пг/мл Tumour necrosis factor alpha, pg/mL | <8,1 | Высокий High | Ишемическая болезнь сердца Coronary artery disease |
Окисленный липопротеин низкой плотности, МЕ/л Oxidised low-density lipoprotein, IU/L | 26,0–117,0 | Высокий High | Окислительный стресс. Системное воспаление Oxidative stress. |
Аполипопротеин А1, г/л Apolipoprotein A1, g/L | M/M: >1,2 Ж/F: >1,4 | Низкий Low | Резистентность к инсулину. Дислипидемия. Центральное ожирение Insulin resistance. |
Свободные жирные кислоты, нг/мл Free fatty acids, ng/mL | M/M: 8,3–10,9 Ж/F: 11,4–13,6 | Высокий High | Резистентность к инсулину Insulin resistance |
Супероксиддисмутаза 1 типа (в эритроцитах), Ед/г Superoxide dismutase type 1 (in red blood cells), U/g | 1200,0–2000,0 | Низкий Low | Окислительный стресс. Системное воспаление Oxidative stress. |
Гамма-глутамилтрансфераза, Ед/л Gamma-glutamyl transferase, U/g | M/M: 10,0–71,0 Ж/F: 6,0–42,0 | Высокий High | Окислительный стресс. Системное воспаление Oxidative stress. |
Липопротеин-ассоциированная фосфолипаза А, нг/мл Lipoprotein-associated phospholipase A, ng/mL | <200,0 | Высокий High | Сердечно-сосудистые заболевания Cardiovascular diseases |
25-Гидроксивитамин D, нг/мл Vitamin D (25-hydroxycholecalciferol), ng/mL | 30,0–100,0 | Низкий Low | Сердечно-сосудистые заболевания Cardiovascular diseases |
Витамин Е (токоферол), мкг/мл Vitamin E (tocopherol), µg/mL | 5,0–18,0 | Низкий Low | Окислительный стресс Oxidative stress |
Таблица составлена авторами / The table is prepared by the authors
Примечание. МетС — метаболический синдром; M — мужчина, Ж — женщина.
Note. MetS, metabolic syndrome; M, male; F, female.
На основе результатов исследования указанных лабораторных биомаркеров предложено диагностировать три варианта АИМетС у пациентов с РШС, получающих АП в течение 3 мес. и более: определенный, возможный и вероятный [14].
Определенный АИМетС характеризуется наличием ≥3 клинических критериев МетС в соответствии с действующими международными критериями IDF или Отчета по лечению взрослых III Национальной образовательной программы по холестерину (National Cholesterol Education Program Adult Treatment Panel III — ATP III / National Cholesterol Education Program Adult Treatment Panel III-advanced — ATP III-A)5 на фоне приема АП в течение ≥3 мес. в режиме моно- или политерапии; ≥3 дополнительных биомаркеров АИМетС в крови (плазме и сыворотке) и ≥3 маркеров АИМетС в моче.
Возможный АИМетС характеризуется наличием от 1 до 3 клинических критериев МетС в соответствии с действующими международными критериями (ATP III, ATP III-A или IDF) на фоне приема АП в течение ≥3 мес. в режиме моно- или политерапии; от 1 до 3 биомаркеров в крови (плазме и сыворотке) или от 1 до 3 биомаркеров в моче.
Вероятный АИМетС характеризуется отсутствием клинических критериев МетС (в соответствии с критериями ATP III, ATP III-A или IDF) после ≥3 мес. приема АП в режиме моно- или политерапии; наличием отдельных (единичных) биомаркеров MeтC в крови (плазме и сыворотке) и/или единичных биомаркеров в моче.
Тем не менее отсутствие вышеуказанных клинических и лабораторных биомаркеров МетС у пациентов с психическими расстройствами в течение 3 мес. от старта АП терапии не исключает вероятность развития АИМетС в будущем, если прием АП продолжается. Важен динамический контроль этих биомаркеров у пациентов с возможным АИМетС — 1 раз в 3 мес., с вероятным АИМетС — 1 раз в 6 мес. [14].
Чувствительность и специфичность лабораторных (биохимических и гормональных) биомаркеров АИМетС могут варьировать в широком диапазоне в зависимости от влияния факторов внешней среды (климатогеографических, социокультурных, пищевых), возраста и пола пациентов с психическими расстройствами, влияние могут оказывать также условия забора и хранения образцов. Это побуждает исследователей к поиску новых биомаркеров АИМетС, которые обладали бы лучшим профилем стабильности в образцах крови, а также хорошей воспроизводимостью результатов исследования в различных лабораториях. Циркулирующие микроРНК являются перспективными эпигенетическими биомаркерами [15–17], которые могут содержать информацию о влиянии окружающей среды и образа жизни на здоровье пациента с РШС, а также позволяют отслеживать эффективность применяемых методов лечения этого психического расстройства [27–30].
Эпигенетические биомаркеры антипсихотик-индуцированного метаболического синдрома
Достижения в области эпигеномики открыли новые возможности, позволяя диагностировать и контролировать РШС и прогнозировать неблагоприятный ответ на психофармакотерапию более точно, эффективно и быстро [30][31], чем при использовании классических подходов, основанных на оценке ранее предложенных клинических и биохимических маркеров МетС и АИМетС [15][16]. Кандидаты в эпигенетические биомаркеры отбираются из огромного количества молекул, вырабатываемых клетками и тканями при МетС и АИМетС в ходе доклинических и клинических исследований, включая микроРНК и посттрансляционные модификации гистонов, которые можно анализировать в широком спектре биологических образцов (плазме крови, сыворотке, слюне, моче, грудном молоке, свежих и замороженных тканях, парафиновых блоках, фиксированных формалином, и др.). МикроРНК стабильны и воспроизводимы при обработке образцов, могут использоваться для прогнозирования развития МетС и АИМетС и их ранней диагностики (идентификации) у пациентов с РШС, а также с целью уточнения информации о естественном течении и исходе [30].
МикроРНК — это короткие некодирующие одноцепочечные РНК (19–25 нуклеотидов), которые участвуют в транскрипционной и посттранскрипционной регуляции экспрессии генов посредством специфических взаимодействий с генами-мишенями [32]. МикроРНК играют важную роль в регуляции различных физиологических и патологических процессов, задействованных в механизмах развития МетС и АИМетС, включая окислительный (оксидативный) стресс [33][34], системное воспаление [35][36], дифференцировку адипоцитов и центральное ожирение [35–37], метаболизм липидов и глюкозы [35][38–50], регуляцию аппетита [51–54][56], изменение экспрессии нейропептида Y (NPY) [51][55-57], изменение чувствительности к лептину [36][56][57], изменение экспрессии орексина [58][59], изменение уровней тестостерона [60], тиреоидных гормонов [61] и паратиреоидного гормона [62] (табл. 4). Сигнатура циркулирующих микроРНК в крови у пациентов, получающих АП и имеющих АИМетС, отличается от таковой у наивных пациентов (до назначения АП) и у здоровых людей [33–56][58–62].
Таблица 4. Роль циркулирующих микроРНК в механизмах патогенеза антипсихотик-индуцированного метаболического синдрома
Table 4. Roles of circulating microRNAs in the mechanisms of antipsychotic-induced metabolic syndrome pathogenesis
Механизм патогенеза Pathogenetic mechanism | Роль циркулирующих микроРНК Role of circulating microRNAs | Источник References |
Окислительный стресс Oxidative stress | Ингибирование окислительного стресса / Inhibition of oxidative stress: miR-19b, miR-20a, miR-24, miR-99a, miR-125b, miR-141, miR-152, miR-200a, miR-200c, miR-210, miR-221, miR-455, miR-601, miR-626 | [33][34] |
Индукция окислительного стресса / Induction of oxidative stress: miR-1, miR-21, miR-23b, miR-27a, miR-28, miR-29, miR-34a, miR-92a, miR-93, miR-101, miR-106b, miR-128, miR-129, miR-140, miR-142, miR-144, miR-146, miR-148, miR-153, miR-155, miR-181c, miR-193b, miR-320, miR-365, miR-375, miR-383, miR-495, miR-503, miR-802 | ||
Системное воспаление Systemic inflammation | Противовоспалительное действие / Anti-inflammatory effect: miR-7, miR-9, miR-10a, miR-15a, miR-16, miR-24, miR-31, miR-124, miR-125, miR-126, miR-142, miR-143, miR-146, miR-149, miR-150, miR-210, miR-223, miR-363 | [35][36] |
Провоспалительное действие / Pro-inflammatory effect: miR-21, miR-23a, miR-27a, miR-29a, miR-34a, miR-34c, miR-92a, miR-132, miR-138, miR-155, miR-200, miR-let7a | ||
Регуляция адипогенеза и развитие центрального ожирения Regulation of adipogenesis, development of central obesity | Ингибирование адипогенеза и препятствие развитию центрального ожирения / Inhibition of adipogenesis and prevention of central obesity: miR-27, miR-27a, miR-30c, miR-33a, miR-33b, miR-130, miR-145, miR-146a, miR-155, miR-181, miR-182, miR-200b, miR-236, miR-363, miR-344, miR-448, miR-4429 | [35][37–39] |
Индукция адипогенеза и центрального ожирения / Induction of adipogenesis and central obesity: miR-17, miR-20a, miR-21, miR-103, miR-128-1, miR-143, miR-144, miR-146b, miR-148a, miR-194, miR-210, miR-322, miR-375, intronic miR-378 | ||
Изменение липидного метаболизма Changes in lipid metabolism | Ингибирование липидного метаболизма / Inhibition of lipid metabolism: miR-30c, miR-33a, miR-33b, miR-34a, miR-128-1, miR-144, miR-148a, miR-223, miR-246b | [38][60] |
Индукция липидного метаболизма / Induction of lipid metabolism: miR-7, miR-27a, miR-27b, miR-122 | ||
Изменение гомеостаза липопротеинов высокой плотности Changes in high-density lipoprotein cholesterol homeostasis | Повышение уровня липопротеинов высокой плотности / Upregulation of high-density lipoprotein levels: нет данных / no data | [38][40][41] |
Снижение уровня липопротеинов высокой плотности / Downregulation of high-density lipoprotein levels: miR-33a, miR-33b, miR-128-1, miR-144, miR-148b | ||
Изменение гомеостаза липопротеинов низкой плотности Changes in low-density lipoprotein cholesterol homeostasis | Повышение уровня липопротеинов низкой плотности / Upregulation of low-density lipoprotein levels: miR-128-1, miR-148a | [40][42] |
Снижение уровня липопротеинов низкой плотности / Downregulation of low-density lipoprotein levels: miR-30c | ||
Изменение процессов атерогенеза Changes in atherogenesis | Ингибирование атерогенеза / Inhibition of atherogenesis: miR-30c | [38][41][42] |
Индукция атерогенеза / Induction of atherogenesis: miR-33, miR-144 | ||
Развитие жирового гепатоза (жировой болезни печени) Development of fatty hepatosis (fatty liver disease) | Усиление развития жирового гепатоза / Contribution to fatty hepatosis development: miR-34a | [38] |
Предотвращение развития жирового гепатоза / Prevention of fatty hepatosis development: miR-27a, miR-122, miR-223 | ||
Изменение чувствительности к инсулину Changes in insulin sensitivity | Снижение чувствительности к инсулину / Reduction of insulin sensitivity: miR-let7 (мышечная ткань / muscle tissue), miR-15b, miR-19, miR-29, miR-33a/b (печень/liver), miR-103 (жировая ткань / adipose tissue), miR-107 (жировая ткань / adipose tissue), miR-143, miR-155, miR-223 miR-378 (печень/liver), miR-451-1, miR-802 (печень/liver) | [35][38][43–45] |
Повышение чувствительности к инсулину / Improvement of insulin sensitivity: нет данных / no data | ||
Изменение экспрессии и секреции инсулина B-клетками островков Лангерганса поджелудочной железы Changes in insulin expression and secretion by B-cells in the islets of Langerhans | Ингибирование экспрессии и секреции инсулина / Inhibition of insulin expression and secretion: miR-7a, miR-26a, miR-29, miR-124a, miR-130a, miR-130b, miR-152, miR-187, miR-200, miR-204, miR-375, miR-802 | [38][46–50] |
Активизация экспрессии и секреции инсулина / Activation of insulin expression and secretion: miR-24, miR-26, miR-30d, miR-148, miR-182 | ||
Изменение метаболизма глюкозы Changes in glucose metabolism | Ингибирование гликонеогенеза и метаболизма глюкозы / Inhibition of gluconeogenesis and glucose metabolism: miR-7a, miR-26a, miR-27, miR-29, miR-33b, miR-103, miR-107, miR-124, miR-130a, miR-130b, miR-143, miR-152, miR-155, miR-187, miR-200, miR-204, miR-336, miR-375, miR-378, miR-451-1, miR-466b, miR-802 | [38][43–50] |
Индукция гликогенеза и метаболизма глюкозы / Induction of glycogenesis and glucose metabolism: miR-19, miR-24, miR-26, miR-27a, miR-30d, miR-33, miR-148, miR-182 | ||
Изменение регуляции аппетита Changes in appetite regulation | Подавление аппетита / Suppression of appetite: miR-33, miR-103 | [51–54][56] |
Возбуждение аппетита / Stimulation of appetite: miR-let7a, miR-7a, miR-9, miR-30e, miR-100, miR-132, miR-141, miR-145, miR-200a, miR-218, miR-342, miR-383, miR-384-3p, miR-429, miR-488 | ||
Изменение экспрессии нейропептида Y Changes in neuropeptide Y expression | Повышение экспрессии нейропептида Y / Increased of the neuropeptide Y expression: miR-708, miR-2137 | [51][55] |
Снижение экспрессии нейропептида Y / Downregulation of neuropeptide Y expression: miR-let7b, miR-29b, miR-33, miR-140- miR-143, miR-503 | ||
Изменение чувствительности к лептину Changes in leptin sensitivity | Повышение чувствительности к лептину / Improvement of leptin sensitivity: miR-let7a, miR-9, miR-30e, miR-132, miR-145, miR-218, miR-342 | [35][56] |
Снижение чувствительности к лептину / Reduction of leptin sensitivity: miR-15a, miR-16, miR-33, miR-200a, miR-200b, miR-223, miR-363, miR-429, miR-532 | ||
Изменение экспрессии орексина Changes in orexin expression | Повышение экспрессии орексина / Upregulation of orexin expression: нет данных / no data | [58][59] |
Снижение экспрессии орексина / Downregulation of orexin expression: miR-137, miR-637, miR-654, miR-665 | ||
Изменение экспрессии тестостерона Changes in testosterone expression | Повышение экспрессии тестостерона / Upregulation of testosterone expression: miR-15a, miR-320 | [60] |
Снижение экспрессии тестостерона / Downregulation of testosterone expression: miR-150 | ||
Изменение экспрессии тиреоидных гормонов Changes in thyroid hormones expression | Повышение экспрессии тиреоидных гормонов / Upregulation of thyroid hormone expression: miR-21, miR-146, miR-214 | [61] |
Снижение экспрессии тиреоидных гормонов / Downregulation of thyroid hormone expression: miR-27, miR-155, miR-181, miR-200a, miR-221, miR-224, miR-246, miR-383, miR-425 | ||
Изменение экспрессии паратиреоидного гормона Changes in parathyroid hormone expression | Повышение экспрессии паратиреоидного гормона / Upregulation of parathyroid hormone expression: miR-27b, miR-136b, miR-146b, miR-503 | [62] |
Снижение экспрессии паратиреоидного гормона / Downregulation of parathyroid hormone expression: miR-24 |
Таблица составлена авторами / The table is prepared by the authors
Примечание. miR — микроРНК.
Note. miR, microRNA.
Последние годы активно обсуждается гипотеза, суть которой в том, что циркулирующие микроРНК могут принимать участие в инициации и модификации развития и тяжести течения АИМетС [36][63][64], а также МетС, ассоциированного с самим РШС [65–67]. Кроме того, полиморфные варианты в кодирующих микроРНК генах и/или в сайтах связывания генов-мишеней и микроРНК могут изменять уровни экспрессии циркулирующих микроРНК в крови, что также ассоциировано с риском развития и тяжестью течения МетС и АИМетС у пациентов с психическими расстройствами [68][69].
Циркулирующие микроРНК являются перспективными биомаркерами развития и тяжести АИМетС у пациентов с РШС из-за простоты и доступности получения биологических образцов. Российские и зарубежные исследования последних 10 лет продемонстрировали, что циркулирующие микроРНК, а также опосредованная ими регуляция метаболического ответа на АП, могут рассматриваться как базовый уровень эпигенетического контроля различных патогенетических механизмов развития АИМетС и индивидуальной вариабельности безопасности АП в целом, включая риск развития терапевтической резистентности к АП [70].
ЗАКЛЮЧЕНИЕ
Проблема ранней диагностики АИМетС, несмотря на высокую частоту его встречаемости при психофармакотерапии, далека от разрешения. В первой части настоящего обзора представлены подходы к спектру и оценке основных и дополнительных клинических и лабораторных маркеров МетС у пациентов с РШС в целом и АИМетС в частности. Используемые ранее классические биомаркеры (биохимические, гормональные) имеют индивидуальную вариабельность и подвержены влиянию как факторов внешней среды, так и особенностей пробоподготовки и хранения биообразцов, что влияет на их стабильность ex vivo.
Циркулирующие микроРНК участвуют в инициации и модификации развития всех проявлений АИМетС, включая окислительный стресс, системное воспаление, дифференцировку адипоцитов, метаболизм липидов и глюкозы, регуляцию аппетита, изменение экспрессии нейропептида Y, чувствительности к лептину, экспрессии орексина, уровней тестостерона, тиреоидных гормонов и паратиреоидного гормона. МикроРНК перспективны в качестве прогностических и диагностических биомаркеров АИМетС, так как определяются в легкодоступных образцах (кровь, слюна, моча), характеризуются большей стабильностью при хранении биообразцов (в том числе при многократных циклах замораживания и оттаивания), лучшей воспроизводимостью и более высокой чувствительностью определения у отдельных пациентов по сравнению с классическими биомаркерами.
Во второй части обзора будет рассмотрена роль конкретных циркулирующих микроРНК как эпигенетических биомаркеров основных доменов АИМетС. Также будут представлены предложения авторов по градации сигнатур микроРНК у пациентов с РШС в зависимости от риска развития АИМетС (низкий, средний, высокий) и обсуждение перспектив их использования в клинической практике психиатра.
Дополнительная информация. Таблицы 1 и 2 размещены на сайте журнала «Безопасность и риск фармакотерапии».
https://doi.org/10.30895/2312-7821-2025-478-tabl1-2
Additional information. Tables 1–2 are posted on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2025-478-tabl1-2
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.А. Шнайдер — написание текста рукописи и его доработка по результатам рецензирования; Р.Ф. Насырова — общая концепция, руководство проектом, утверждение окончательной версии рукописи для публикации; Н.А. Пекарец — работа с базами данных, написание текста рукописи; В.В. Гречкина — работа с базами данных, подготовка графических материалов; М.М. Петрова — дизайн исследования, редактирование текста рукописи.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Natalia А. Shnayder drafted the manuscript and revised it based on the peer-review results. Regina F. Nasyrova developed the general concept of the study, managed the project, and approved the final version of the manuscript for publication. Nikolai A. Pekarets worked with databases and drafted the manuscript. Violetta V. Grechkina worked with databases and prepared illustrations. Marina M. Petrova designed the study and edited the manuscript.
1. The IDF consensus worldwide definition of the metabolic syndrome. IDF; 2006. https://idf.org/media/uploads/2023/05/attachments-30.pdf
2. The IDF consensus worldwide definition of the metabolic syndrome. IDF; 2006. https://idf.org/media/uploads/2023/05/ attachments-30.pdf
3. https://doi.org/10.30895/2312-7821-2025-478-tabl1-2
4. https://doi.org/10.30895/2312-7821-2025-478-tabl1-2
5. National Cholesterol Education Program High Blood Cholesterol ATP III Guidelines At-A-Glance: Quick Desk Reference. https://www.nhlbi.nih.gov/files/docs/guidelines/atglance.pdf
6. https://www.biovendor.com/file/5881/PDS_67_HOME_ENG.004.A_EV.pdf?version=202303080807
https://www.abcam.com/products/elisa-kits/human-mcp-1-elisa-kit-ab179886.html
https://practical-haemostasis.com/Fibrinolysis/pai_1.html
https://www.athensresearch.com/products/human-proteins/retinol-binding-protein-human-plasma-rbp-4
https://www.randox.com/superoxide-dismutase-ransod/
Список литературы
1. Pillinger T, McCutcheon RA, Vano L, Mizuno Y, Arumuham A, Hindley G, et al. Comparative effects of 18 antipsychotics on metabolic function in patients with schizophrenia, predictors of metabolic dysregulation, and association with psychopathology: A systematic review and network meta-analysis. Lancet Psychiatry. 2020;7(1):64–77. https://doi.org/10.1016/S2215-0366(19)30416-X
2. Шпилевская ЮР, Штонда МВ. Метаболический синдром: современные аспекты диагностики и лечения. Медицинские новости. 2021;(5):4–8. EDN: HCJBZE
3. Ferrari CKB. Chapter 6. Epidemiology of metabolic syndrome: Glo bal scenario. In: Mukhopadhyay S, Mondal S, eds. Metabolic syndrome: From mechanisms to interventions. Academic Press; 2024. P. 59–71. https://www.doi.org/10.1016/B978-0-323-85732-1.00038-4
4. Li W, Qiu X, Ma H, Geng Q. Incidence and long-term specific mortality trends of metabolic syndrome in the United States. Front Endocrinol (Lausanne). 2023;13:1029736. https://www.doi.org/10.3389/fendo.2022.1029736
5. Chong KS, Chang YH, Yang CT, Chou CK, Ou HT, Kuo S. Longitudinal economic burden of incident complications among metabolic syndrome populations. Cardiovasc Diabetol. 2024;23(1):246.
6. Akinola PS, Tardif I, Leclerc J. Antipsychotic-induced metabolic syndrome: A review. Metab Syndr Relat Disord. 2023;21(6):294–305. https://doi.org/10.1089/met.2023.0003
7. Penninx BWJH, Lange SMM. Metabolic syndrome in psychiatric patients: Overview, mechanisms, and implications. Dialog Clin Neurosci. 2018;20(1):63–73. https://doi.org/10.31887/DCNS.2018.20.1/bpenninx
8. Libowitz MR, Nurmi EL. The burden of antipsychotic-induced weight gain and metabolic syndrome in children. Front Psychiatry. 2021;12:623681. https://doi.org/10.3389/fpsyt.2021.623681
9. Correll CU, Manu P, Olshanskiy V, Napolitano B, Kane JM, Malhotra AK. Cardiometabolic risk of second-generation antipsychotic medications during first-time use in children and adolescents. JAMA. 2009;302(16):1765–73. https://doi.org/10.1001/jama.2009.1549
10. Keepers GA, Fochtmann LJ, Anzia JM, Benjamin S, Lyness JM, Mojtabai R, et al. The American Psychiatric Association Practice Guideline for the treatment of patients with schizophrenia. Am J Psychiatry. 2020;177(9):868–72. https://doi.org/10.1176/appi.ajp.2020.177901
11. Bernardo M, Rico-Villademoros F, García-Rizo C, Rojo R, Gómez-Huelgas R. Real-world data on the adverse metabolic effects of second-generation antipsychotics and their potential determinants in adult patients: A systematic review of population-based studies. Adv Ther. 2021;38(5):2491–512. https://doi.org/10.1007/s12325-021-01689-8
12. Limankin OV. Personalized psychiatry: Achievements and prospects. Personalized Psychiatry and Neurology. 2021;1(2):126–7. https://doi.org/10.52667/2712-9179-2021-1-2-126-127
13. Castellani LN, Costa-Dookhan KA, McIntyre W B, Wright DC, Flowers SA, Hahn MK, Ward KM. Preclinical and clinical sex differences in antipsychotic-induced metabolic disturbances: A narrative review of adiposity and glucose metabolism. J Psychiatr Brain Sci. 2019;4:e190013. https://doi.org/10.20900/jpbs.20190013
14. Khasanova AK, Dobrodeeva VS, Shnayder NA, Petrova MM, Pronina EA, Bochanova EN, et al. Blood and urinary biomarkers of antipsychotic-induced metabolic syndrome. Metabolites. 2022;12(8):726. https://doi.org/10.3390/metabo12080726
15. Миронова ОЮ, Бердышева МВ, Елфимова ЕМ. МикроРНК: взгляд клинициста на состояние проблемы. Часть 2. МикроРНК в качестве биомаркера. Евразийский кардиологический журнал. 2023;(2):64–71. https://doi.org/10.38109/2225-1685-2023-2-64-71
16. Dexheimer PJ, Cochella L. MicroRNAs: From mechanism to organ ism. Front Cell Dev Biol. 2020;8:409. https://www.doi.org/10.3389/fcell.2020.00409
17. Pozniak T, Shcharbin D, Bryszewska M. Circulating microRNAs in medicine. Int J Mol Sci. 2022;23(7):3996. https://www.doi.org/10.3390/ijms23073996
18. Gayoso-Diz P, Otero-González A, Rodriguez-Alvarez MX, Gude F, García F, De Francisco A, Quintela AG. Insulin resistance (HOMA-IR) cut-off values and the metabolic syndrome in a general adult population: Effect of gender and age: EPIRCE cross-sectional study. BMC Endocr Disord. 2013;13:47. https://doi.org/10.1186/1472-6823-13-47
19. Карпельев ВА, Филиппов ЮИ, Тарасов ЮВ, Боярский МД, Майоров АЮ, Шестакова МВ, Дедов ИИ. Математическое моделирование системы регуляции гликемии у пациентов с сахарным диабетом. Вестник Российской академии медицинских наук. 2015;70(5):549–60. https://doi.org/10.15690/vramn.v70.i5.1441
20. Bethesda M. Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: Preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69(3):89–95. https://doi.org/10.1067/mcp.2001.113989
21. Вульф МА, Шунькина (Скуратовская) ДА, Ву Х, Комар АА, Затолокин ПА, Кириенкова ЕВ и др. Химерин участвует в регуляции контроля качества митохондрий у больных ожирением. Медицинская иммунология. 2021;23(4):881–6. https://doi.org/10.15789/1563-0625-CAA-2227
22. Behnoush AH, Shobeiri P, Bahiraie P, Amirkhani N, Khalaji A, Peiman S. Chemerin levels in chronic kidney disease: A systematic review and meta-analysis. Front Endocrinol (Lausanne). 2023;14:1120774. https://www.doi.org/10.3389/fendo.2023.1120774
23. Алиева АМ, Теплова НВ, Резник ЕВ, Байкова ИЕ, Макеева ЛМ, Котикова ИА и др. Диагностические и прогностические аспекты оментина при сердечно-сосудистой патологии. Кардиологический вестник. 2024;19(1):16–22. https://doi.org/10.17116/Cardiobulletin20241901116
24. Побожева ИА, Пантелеева АА, Полякова ЕА, Драчева КВ, Разгильдина НД, Галкина ОВ и др. Оментин-1 подкожной жировой ткани при ишемической болезни сердца. Медицинская генетика. 2020;19(11):21–30. https://doi.org/10.25557/2073-7998.2020.11.21-30
25. Lorente L, Martín MM, Varo N, Borreguero-León JM, Solé-Violán J, Blanquer J, et al. Association between serum soluble CD40 ligand levels and mortality in patients with severe sepsis. Crit Care. 2011;15(2):R97. https://www.doi.org/10.1186/cc10104
26. Wang MN, Han YB, Li Q, Guo L, Yang YM, Wang W, Zhang JC. Higher serum retinol binding protein 4 may be a predictor of weak metabolic control in Chinese patients with type 2 diabetes mellitus. J Int Med Res. 2012;40(4):1317–24. https://www.doi.org/10.1177/147323001204000410
27. Brandão-Lima PN, de Carvalho GB, Payolla TB, Sarti FM, Fisberg RM, Malcomson FC, et al. Circulating microRNAs showed specific responses according to metabolic syndrome components and sex of adults from a population-based study. Metabolites. 2022;13(1):2. https://www.doi.org/10.3390/metabo13010002
28. Solís-Toro D, Mosquera Escudero M, García-Perdomo HA. Association between circulating microRNAs and the metabolic syndrome in adult populations: A systematic review. Diabetes Metab Syndr. 2022;16(1):102376. https://www.doi.org/10.1016/j.dsx.2021.102376
29. Xavier G, Mauer J, Ota VK, Santoro ML, Belangero SI. Influence of antipsychotic drugs on microRNA expression in schizophrenia patients — a systematic review. J Psychiatr Res. 2024;176:163–72. https://doi.org/10.1016/j.jpsychires.2024.06.010
30. García-Giménez JL, Seco-Cervera M, Tollefsbol TO, Romá-Mateo C, Peiró-Chova L, Lapunzina P, Pallardó FV. Epigenetic biomarkers: Current strategies and future challenges for their use in the clinical laboratory. Crit Rev Clin Lab Sci. 2017;54(7–8):529–50. https://doi.org/10.1080/10408363.2017.1410520
31. Neznanov NG. A paradigm shift to treat psychoneurological disorders. Personalized Psychiatry and Neurology. 2021;1(1):1–2.
32. O’Brien J, Hayder H, Zayed Y, Peng C. Overview of MicroRNA biogenesis, mechanisms of actions, and circulation. Front Endocrinol (Lausanne). 2018;9:402. https://www.doi.org/10.3389/fendo.2018.00402
33. Saha S. Role of microRNA in oxidative stress. Stresses. 2024;4(2):269–81. https://doi.org/10.3390/stresses4020016
34. Włodarski A, Strycharz J, Wróblewski A, Kasznicki J, Drzewoski J, Śliwińska A. The role of microRNAs in metabolic syndrome-related oxidative stress. Int J Mol Sci. 2020;21(18):6902. https://www.doi.org/10.3390/ijms21186902
35. Carvalho GB, Brandão-Lima PN, Payolla TB, Lucena SEF, Sarti FM, Fisberg RM, Rogero MM. Circulating miRNAs are associated with low-grade systemic inflammation and leptin levels in older adults. Inflammation. 2023;46(6):2132–46. https://www.doi.org/10.1007/s10753-023-01867-6
36. Das K, Rao LVM. The role of microRNAs in inflammation. Int J Mol Sci. 2022;23(24):15479. https://www.doi.org/10.3390/ijms232415479
37. Engin AB, Engin A. Adipogenesis-related microRNAs in obesity. ExRNA. 2022;4:16. https://www.doi.org/10.21037/exrna-22-4
38. Agbu P, Carthew RW. MicroRNA-mediated regulation of glucose and lipid metabolism. Nat Rev Mol Cell Biol. 2021;22(6):425–38. https://www.doi.org/10.1038/s41580-021-00354-w
39. Dong M, Ye Y, Chen Z, Xiao T, Liu W, Hu F. MicroRNA 182 is a novel negative regulator of adipogenesis by targeting CCAAT/enhancer-binding protein α. Obesity (Silver Spring). 2020;28(8):1467–76. https://doi.org/10.1002/oby.22863
40. Wagschal A, Najafi-Shoushtari SH, Wang L, Goedeke L, Sinha S, deLemos AS, et al. Genome-wide identification of microRNAs regulating cholesterol and triglyceride homeostasis. Nat Med. 2015;21(11):1290–7. https://www.doi.org/10.1038/nm.3980
41. Cheng J, Cheng A, Clifford BL, Wu X, Hedin U, Maegdefessel L, et al. MicroRNA-144 silencing protects against atherosclerosis in male, but not female mice. Arterioscler Thromb Vasc Biol. 2020;40(2):412–25. https://www.doi.org/10.1161/ATVBAHA.119.313633
42. Irani S, Iqbal J, Antoni WJ, Ijaz L, Hussain MM. MicroRNA-30c reduces plasma cholesterol in homozygous familial hypercholesterolemic and type 2 diabetic mouse models. J Lipid Res. 2018;59(1):144–54. https://doi.org/10.1194/jlr.M081299
43. Trajkovski M, Hausser J, Soutschek J, Bhat B, Akin A, Zavolan M, et al. MicroRNAs 103 and 107 regulate insulin sensitivity. Nature. 2011;474(7353):649–53. https://doi.org/10.1038/nature10112
44. Liu W, Cao H, Ye C, Chang C, Lu M, Jing Y, et al. Hepatic miR-378 targets p110α and controls glucose and lipid homeostasis by modulating hepatic insulin signalling. Nat Commun. 2014;5:5684. https://doi.org/10.1038/ncomms6684
45. Kornfeld JW, Baitzel C, Könner AC, Nicholls HT, Vogt MC, Herr manns K, et al. Obesity-induced overexpression of miR- 802 impairs glucose metabolism through silencing of Hnf1b. Nature. 2013;494(7435):111–5. https://doi.org/10.1038/nature11793
46. Xu H, Du X, Xu J, Zhang Y, Tian Y, Liu G, et al. Pancreatic β cell microRNA-26a alleviates type 2 diabetes by improving peripheral insulin sensitivity and preserving β cell function. PLoS Biol. 2020;18(2):e3000603. https://doi.org/10.1371/journal.pbio.3000603
47. Ofori JK, Salunkhe VA, Bagge A, Vishnu N, Nagao M, Mulder H, et al. Elevated miR-130a/miR130b/miR-152 expression reduces intracellular ATP levels in the pancreatic beta cell. Sci Rep. 2017;7:44986. https://doi.org/10.1038/srep44986
48. Belgardt BF, Ahmed K, Spranger M, Latreille M, Denzler R, Kondratiuk N, et al. The microRNA-200 family regulates pancreatic beta cell survival in type 2 diabetes. Nat Med. 2015;21(6):619–27. https://doi.org/10.1038/nm.3862
49. Zhang F, Ma D, Zhao W, Wang D, Liu T, Liu Y, et al. Obesity-induced overexpression of miR-802 impairs insulin transcription and secretion. Nat Commun. 2020;11(1):1822. https://doi.org/10.1038/s41467-020-15529-w
50. Melkman-Zehavi T, Oren R, Kredo-Russo S, Shapira T, Mandelbaum AD, Rivkin N, et al. miRNAs control insulin content in pancreatic β-cells via downregulation of transcriptional repressors. EMBO J. 2011;30(5):835–45. https://doi.org/10.1038/emboj.2010.361
51. Price NL, Fernández-Tussy P, Varela L, Cardelo MP, Shanabrough M, Aryal B, et al. microRNA-33 controls hunger signaling in hypothalamic AgRP neurons. Nat Commun. 2024;15(1):2131. https://www.doi.org/10.1038/s41467-024-46427-0
52. Taouis M. MicroRNAs in the hypothalamus. Best Pract Res Clin Endocrinol Metab. 2016;30(5):641–51. https://www.doi.org/10.1016/j.beem.2016.11.006
53. Zhang D, Yamaguchi S, Zhang X, Yang B, Kurooka N, Sugawara R, et al. Upregulation of mir342 in diet-induced obesity mouse and the hypothalamic appetite control. Front Endocrinol (Lausanne). 2021;12:727915. https://www.doi.org/10.3389/fendo.2021.727915
54. Sangiao-Alvarellos S, Pena-Bello L, Manfredi-Lozano M, Tena-Sempere M, Cordido F. Perturbation of hypothalamic microRNA expression patterns in male rats after metabolic distress: Impact of obesity and conditions of negative energy balance. Endocrinology. 2014;155(5):1838–50. https://www.doi.org/10.1210/en.2013-1770
55. Mak KWY, He W, Loganathan N, Belsham DD. Bisphenol A alters the levels of miRNAs that directly and/or indirectly target neuropeptide Y in murine hypothalamic neurons. Genes (Basel). 2023;14(9):1773. https://www.doi.org/10.3390/genes14091773
56. Derghal A, Djelloul M, Azzarelli M, Degonon S, Tourniaire F, Landrier JF, et al. MicroRNAs are involved in the hypothalamic leptin sensitivity. Epigenetics. 2018;13(10–11):1127–40. https://doi.org/10.1080/15592294.2018.1543507
57. Dobrodeeva VS, Abdyrahmanova AK, Nasyrova RF. Personalized approach to antipsychotic-induced weight gain prognosis. Personalized Psychiatry and Neurology. 2021;1(1):3–10. https://doi.org/10.52667/2712-9179-2021-1-1-3-10
58. Holm A, Possovre ML, Bandarabadi M, Moseholm KF, Justinussen JL, Bozic I, et al. The evolutionarily conserved miRNA-137 targets the neuropeptide hypocretin/orexin and modulates the wake to sleep ratio. Proc Natl Acad Sci USA. 2022;119(17):e2112225119. https://www.doi.org/10.1073/pnas.2112225119
59. Siegert S, Seo J, Kwon EJ, Rudenko A, Cho S, Wang W, et al. The schizophrenia risk gene product miR-137 alters presynaptic plasticity. Nat Neurosci. 2015;18(7):1008–16. https://www.doi.org/10.1038/nn.4023
60. Azhar S, Dong D, Shen WJ, Hu Z, Kraemer FB. The role of miRNAs in regulating adrenal and gonadal steroidogenesis. J Mol Endocrinol. 2020;64(1):R21–R43. https://www.doi.org/10.1530/JME-19-0105
61. Aranda A. MicroRNAs and thyroid hormone action. Mol Cell Endocrinol. 2021;525:111175. https://www.doi.org/10.1016/j.mce.2021.111175
62. Vaira V, Verdelli C, Forno I, Corbetta S. MicroRNAs in parathyroid physiopathology. Mol Cell Endocrinol. 2017;456:9–15. https://www.doi.org/10.1016/j.mce.2016.10.035
63. Martinez B, Peplow PV. MicroRNAs as potential biomarkers for diagnosis of schizophrenia and influence of antipsychotic treatment. Neural Regen Res. 2024;19(7):1523–31. https://doi.org/10.4103/1673-5374.387966
64. Zhang HC, Du Y, Chen L, Yuan ZQ, Cheng Y. MicroRNA schizophrenia: Etiology, biomarkers and therapeutic targets. Neurosci Bio behav Rev. 2023;146:105064. https://doi.org/10.1016/j.neubiorev.2023.105064
65. Zaki MB, Abulsoud AI, Ashraf A, Abdelmaksoud NM, Sallam AM, Aly SH, et al. The potential role of miRNAs in the pathogenesis of schizophrenia — a focus on signaling pathways interplay. Pathol Res Pract. 2024;254:155102. https://doi.org/10.1016/j.prp.2024.155102
66. Chan YL, Ho CSH, Tay GWN, Tan TWK, Tang TB. MicroRNA classification and discovery for major depressive disorder diagnosis: Towards a robust and interpretable machine learning approach. J Affect Disord. 2024;360:326–35. https://doi.org/10.1016/j.jad.2024.05.066
67. Ding R, Su D, Zhao Q, Wang Y, Wang JY, Lv S, Ji X. The role of micro RNAs in depression. Front Pharmacol. 2023;14:1129186. https://doi.org/10.3389/fphar.2023.1129186
68. Elfaki I, Mir R, Mir MM, AbuDuhier FM, Babakr AT, Barnawi J. Potential impact of microRNA gene polymorphisms in the pathogenesis of diabetes and atherosclerotic cardiovascular disease. J Pers Med. 2019;9(4):51. https://doi.org/10.3390/jpm9040051
69. Gottmann P, Ouni M, Zellner L, Jähnert M, Rittig K, Walther D, et al. Polymorphisms in miRNA binding sites involved in metabolic diseases in mice and humans. Sci Rep 2020;10:7202. https://doi.org/10.1038/s41598-020-64326-4
70. Villanova F, Di Meglio P, Nestle FO. Biomarkers in psoriasis and psoriatic arthritis. Ann Rheum Dis. 2013;72(S2):ii104–10. https://doi.org/10.1136/annrheumdis-2012-203037
Об авторах
Н. А. ШнайдерРоссия
Шнайдер Наталья Алексеевна, д-р мед. наук, профессор
ул. Бехтерева, д. 3, Санкт-Петербург, 192019;
ул. Партизана Железняка, д. 1, г. Красноярск, 660022
Р. Ф. Насырова
Россия
Насырова Регина Фаритовна, д-р мед. наук
ул. Бехтерева, д. 3, Санкт-Петербург, 192019;
пр. Ленина, д. 92, г. Тула, 300012
Н. А. Пекарец
Россия
Пекарец Николай Александрович
ул. Бехтерева, д. 3, Санкт-Петербург, 192019
В. В. Гречкина
Россия
Гречкина Виолетта Владимировна
ул. Бехтерева, д. 3, Санкт-Петербург, 192019
М. М. Петрова
Россия
Петрова Марина Михайловна, д-р мед. наук, профессор
ул. Партизана Железняка, д. 1, г. Красноярск, 660022
Дополнительные файлы

|
1. Таблицы 1 и 2 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(187KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Шнайдер Н.А., Насырова Р.Ф., Пекарец Н.А., Гречкина В.В., Петрова М.М. Циркулирующие микроРНК — перспективные биомаркеры для оценки риска развития антипсихотик-индуцированного метаболического синдрома (обзор): часть 1. Безопасность и риск фармакотерапии. 2025;13(3):344-356. https://doi.org/10.30895/2312-7821-2025-478
For citation:
Shnayder N.A., Nasyrova R.F., Pekarets N.A., Grechkina V.V., Petrova M.M. Circulating MicroRNAs Are Promising Biomarkers for Assessing the Risk of Antipsychotic-Induced Metabolic Syndrome (Review): Part 1. Safety and Risk of Pharmacotherapy. 2025;13(3):344-356. https://doi.org/10.30895/2312-7821-2025-478