АВТОРИТЕТНОЕ МНЕНИЕ
Выявление генетических особенностей человека, определяющих индивидуальный ответ пациента на применение лекарственного препарата, и предоставление этой информации врачу позволяет прогнозировать эффективность терапии и риск развития нежелательных реакций. О важности персонализированного подхода к выбору лекарственного препарата и методов контроля его эффективности и безопасности рассказывает академик Российской академии наук, доктор медицинских наук, профессор, ректор ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России Дмитрий Алексеевич Сычев.
ГЛАВНАЯ ТЕМА: ГЕНЕТИКА И ФАРМАКОЛОГИЯ: ИССЛЕДОВАНИЯ И ДОСТИЖЕНИЯ
ВВЕДЕНИЕ. Фармакогенетическое тестирование (ФГТ) играет важную роль в прогнозировании риска развития нежелательных реакций при применении препаратов вальпроевой кислоты (ВК), которые являются одними из наиболее часто назначаемых в неврологии и психиатрии. Однако чувствительность и специфичность скрининговых панелей ФГТ может быть недостаточной в связи с межиндивидуальными различиями метаболизма вальпроатов у пациентов различных этнических/расовых групп.
ЦЕЛЬ. Выявить направления для реализации персонализированного подхода к разработке панелей ФГТ для оценки безопасности и риска фармакотерапии вальпроатами в различных этнических и расовых группах популяции Российской Федерации.
ОБСУЖДЕНИЕ. Проведен анализ результатов популяционных исследований частот нефункциональных и низкофункциональных аллелей генов, кодирующих ключевые изоферменты Р-окисления ВК в печени, опубликованных в период 2012–2022 гг. и размещенных в базах данных eLIBRARY.RU, PubMed, Scopus, Google Scholar. Критерии отбора публикаций: наличие полнотекстовой версии на русском или английском языках, тип публикации — оригинальная статья, систематический обзор, метаанализ, Кокрейновский обзор, клинический случай. Показано, что персонализированная оценка риска и безопасности ВК может зависеть от частоты аллелей риска замедления P-окисления ВК в печени в различных расовых и этнических группах в мире в целом и в России в частности. Определены новые направления для реализации персонализированного подхода к разработке панелей ФГТ для оценки безопасности и риска фармакотерапии вальпроатами с учетом скорости Р-окисления ВК в печени у представителей различных этнических и расовых групп. Однако результаты проведенного обзора популяционных ассоциативных генетических исследований в мире демонстрируют, что прямая трансляция результатов зарубежных исследований в реальную клиническую практику в Российской Федерации путем разработки панелей ФГТ пока недостаточно ясна ввиду этнической и расовой неоднородности популяции и большой территориальной протяженности страны.
ВЫВОДЫ. Для повышения чувствительности и специфичности российских панелей ФГТ требуется проведение «мостовых» исследований, чтобы реплицировать полученные на других этнических группах ассоциации наиболее распространенных аллелей риска нарушения Р-окисления ВК для конкретной популяции регионов России.
ВВЕДЕНИЕ. Лекарственные поражения печени или лекарственно-индуцированные заболевания (ЛИЗ) печени у детей, развивающиеся в том числе при применении антибиотиков, могут стать причиной острой печеночной недостаточности и привести к летальному исходу. Однако в литературе практически не представлены данные о возможности дифференцировки характера поражения ткани печени у детей для своевременной диагностики потенциально жизнеугрожающего состояния — ЛИЗ печени.
ЦЕЛЬ. Описать фенотип ассоциированного с применением антибактериальных препаратов впервые возникшего лекарственного поражения печени у детей в критических состояниях с нозокомиальной инфекцией.
МАТЕРИАЛЫ И МЕТОДЫ. В проспективном наблюдательном исследовании в ГБУЗ «Морозовская ДГКБ ДЗМ» в период с 01.02.2020 по 01.09.2021 проведена оценка распространенности ЛИЗ печени, связанной с применением антибактериальных препаратов, методом глобальных триггеров. В исследование было включено 100 детей в критических состояниях с нозокомиальной инфекцией в возрасте от 0 до 17 лет (44 мальчика, 56 девочек), находившихся на лечении в отделениях реанимации и интенсивной терапии.
РЕЗУЛЬТАТЫ. Проявления гепатотоксичности были выявлены у 19 пациентов, из них у 8 наблюдали отклонения биохимических показателей сыворотки крови, характеризующих функцию печени, а у 11 эти отклонения сопровождались клиническими проявлениями нарушений со стороны печени. Распространенность впервые возникшей гепатотоксичности при применении антибиотиков составила 12,9 случая на 100 000 пациентов детского возраста, а ЛИЗ печени — 7,5 случая на 100 000 детей. На основе анализа медицинской документации и биохимических показателей, определения связи событий по времени появления с клинической картиной у 11 детей был описан фенотип идиосинкразического холестатического гепатита. При применении антибиотиков у детей в критических состояниях было отмечено повышение активности аланиновой трансаминазы до 10 высших пороговых норм (ВПН), уровня билирубина — до 4,45 ВПН, активности гамма-глутамилтрансферазы — до 5 ВПН. Шансы развития впервые возникающего ЛИЗ печени были наиболее высокими при применении тигециклина (OR: 4,07; 95% CI: 1,32–12,50) и меропенема (OR: 1,84; 95% CI: 1,01–3,36). Клинические проявления идиосинкразического холестатического гепатита у 5 пациентов были сопряжены с развитием летального исхода, у 6 пациентов разрешились в течение нескольких недель.
ВЫВОДЫ. Описан фенотип холестатического идиосинкразического поражения печени у детей в критических состояниях, связанного с применением антибиотиков. Требуются дальнейшие исследования для оценки роли фармакогенетических маркеров в развитии ЛИЗ печени, ассоциированного с антибиотиками у детей в критических состояниях, для реализации риск-ориентированного подхода и возможности предотвращения рисков возникновения этого состояния.
Исследование зарегистрировано на платформе ClinicalTrials.gov, идентификатор NCT04141657, дата регистрации 24.10.2019.
ВВЕДЕНИЕ. Механизмы развития лекарственно-индуцированного заболевания (ЛИЗ) печени у детей, ассоциированного с применением антибиотиков, в настоящее время изучены недостаточно. Наличие у пациентов определенных генотипов повышает вероятность развития ЛИЗ печени, в связи с чем актуальной задачей является выявление у детей ассоциированных с этим заболеванием фармакогенетических маркеров.
ЦЕЛЬ. Выявление фармакогенетических биомаркеров при впервые возникающем лекарственном поражении печени у детей, связанном с применением тигециклина и меропенема.
МАТЕРИАЛЫ И МЕТОДЫ. В проспективном наблюдательном исследовании в ГБУЗ «Морозовская ДГКБ ДЗМ» в период с 01.02.2020 по 01.09.2021 оценена частота и изучена структура нежелательных реакций (НР), связанных с применением антибиотиков, у 100 детей в возрасте от 0 до 17 лет (44 мальчика, 56 девочек) в критических состояниях. Пациентам, у которых были выявлены НР (n=30), проведено фармакогенетическое тестирование для изучения возможного механизма их развития. ДНК выделяли из соскоба буккального эпителия с помощью панели iPLEX Pro PGx (Agena Bioscience) в модификации «VeriDose® Core Panel». Исследовано 68 однонуклеотидных полиморфизмов (single nucleotide polymorphisms, SNPs) и коротких инсерционно-делеционных полиморфизмов (short insertions and deletions, INDELs), включавших в себя 5 анализов вариаций числа копий (copy number variant, CNV).
РЕЗУЛЬТАТЫ. Шансы развития ЛИЗ печени, ассоциированного с применением меропенема и тигециклина, были выше у носителей гомозиготного генотипа цитохрома CYP3A5*3/*3 (ОШ: 12,6; 95% ДИ: 1,9–79,4, r=6,54, р=0,011) по сравнению с пациентами с гетерозиготным генотипом CYP3A5*1А/*3. В отсутствие гетерозиготного генотипа CYP3A5*1А/*3 шансы развития ЛИЗ печени на фоне применения меропенема и тигециклина были еще более высокими (ОШ: 17,14; 95% ДИ: 1,79–16,3, r=6,24, р=0,013). Точность прогностического значения выявления генотипа CYP3A5*3/*3 для прогнозирования риска развития ЛИЗ печени, ассоциированного с применением этих антибиотиков, составила 76,7%, чувствительность — 82% и специфичность — 74%. У детей с ЛИЗ печени на фоне применения меропенема и тигециклина чаще, чем у детей с иными НР, выявлялось гетерозиготное носительство полиморфизма rs4149056 генотипа SLCO1B1*1/*5 (r=9,8, р=0,002).
ВЫВОДЫ. Показана прогностическая значимость выявления гомозиготного генотипа цитохрома CYP3A*3/*3 как индикатора потенциального риска развития ЛИЗ печени, ассоциированного с применением меропенема и тигециклина у детей в критических состояниях.
Исследование зарегистрировано на платформе ClinicalTrials.gov, идентификатор NCT04141657, дата регистрации 24.10.2019.
ВВЕДЕНИЕ. Вариабельность ответа на применение нестероидных противовоспалительных препаратов (НПВП) у пациентов может быть обусловлена носительством генетических полиморфизмов, среди которых важную роль играют медленные аллельные варианты гена СYP2C9, а также изучается роль полиморфизмов генов PTGS-1, PTGS-2, кодирующих мишени НПВП, — циклооксигеназу (ЦОГ) 1 и 2 типов.
ЦЕЛЬ. На примере клинических случаев продемонстрировать вклад фармакогенетических особенностей пациента в развитие нежелательных реакций при приеме нестероидных противовоспалительных препаратов.
МАТЕРИАЛЫ И МЕТОДЫ. Рассмотрены два клинических случая, наблюдавшиеся на базе многопрофильного стационара г. Москвы. В первом случае у пациентки нейрохирургического отделения с диагнозом спондилодисцит возникли признаки снижения функции почек на фоне назначения кеторолака в течение 13 суток стационарного лечения. Во втором случае у пациентки, госпитализированной по поводу желудочно-кишечного кровотечения в связи с самостоятельным приемом кеторолака в течение 3 недель, потребовалось хирургическое вмешательство в объеме резекции желудка. У пациентов методом полимеразной цепной реакции в режиме реального времени выявлены однонуклеотидные полиморфизмы генов CYP2C9*2 rs179985, CYP2C9*3 rs1057910, PTGS1 rs10306135 и rs12353214, PTGS2 rs20417.
РЕЗУЛЬТАТЫ. Фармакогенетические особенности пациентов в совокупности с другими факторами (превышение рекомендованной длительности терапии кеторолаком, сопутствующие заболевания, межлекарственные взаимодействия, пожилой возраст) способствовали развитию нежелательных реакций при приеме кеторолака. У пациентки с нефротоксическими осложнениями были обнаружены генотип CYP2C9*1/*2, ассоциированный с замедленным метаболизмом НПВП, а также генотип CT по PTGS1 rs12353214, что может вызывать изменение активности фермента ЦОГ-1 и таким образом приводить к повышению риска развития нежелательных реакций при приеме НПВП. У пациентки с желудочно-кишечным кровотечением также были обнаружены генетические особенности ответа на НПВП — генотип CYP2C9*1/*3, ассоциированный с выраженным замедлением метаболизма НПВП, при наличии которого рекомендуется принимать минимальные дозы НПВП либо альтернативно метаболизирующиеся препараты этой группы.
ВЫВОДЫ. Для снижения риска развития нефротоксических осложнений и желудочно-кишечных кровотечений при назначении кеторолака необходимо строго соблюдать режим дозирования препарата, учитывать наличие у пациентов сопутствующих заболеваний, возможные межлекарственные взаимодействия, потенциирующие нежелательные реакции, а также проводить фармакогенетическое тестирование, включая определение медленных аллельных вариантов гена CYP2C9 и полиморфизма rs12353214 гена PTGS1.
РАЦИОНАЛЬНАЯ ФАРМАКОТЕРАПИЯ И ФАРМАКОНАДЗОР
ВВЕДЕНИЕ. Остеопороз занимает ведущее место в структуре заболеваемости, причин инвалидности, снижения качества жизни и преждевременной смертности лиц пожилого возраста. Деносумаб применяют для лечения остеопороза, однако при отмене этого препарата может развиться тяжелая нежелательная реакция — синдром рикошета, при которой повышена потеря костной массы. Изучение механизма развития синдрома рикошета и возможностей его коррекции позволит повысить безопасность терапии деносумабом.
ЦЕЛЬ. Систематизация актуальной информации о механизме развития синдрома рикошета и возможностях предотвращения потери костной массы при отмене деносумаба.
ОБСУЖДЕНИЕ. Нарушение баланса между процессами ремоделирования костной ткани приводит к развитию остеопороза. Результаты современных исследований показали, что зрелые остеокласты способны делиться на остеоморфы, которые отделяются от поликариона и сливаются с соседними остеокластами или с другими остеоморфами (рециркуляция остеокластов). В основе механизма действия деносумаба лежит ингибирование процесса рециркуляции остеокластов, что вызывает накопление преостеокластов и остеоморфов. Изучение процессов, происходящих в костной ткани, показало, что во время терапии деносумабом создается пул индуцированных клеток, из которых при отмене препарата достаточно быстро и в большом количестве образуются остеокласты, обеспечивающие резорбцию кости (синдром рикошета), что увеличивает риск переломов. Для повышения минеральной плотности костей и предупреждения переломов после отмены деносумаба целесообразно использовать антирезорбтивные препараты группы бисфосфонатов, которые накапливаются в костной ткани, концентрируясь в местах активного костного обмена.
ВЫВОДЫ. Дальнейшее изучение механизма возникновения синдрома рикошета, в том числе более глубокое понимание роли остеоморфов в процессе остеогенеза, позволит повысить эффективность мер профилактики переломов при отмене деносумаба. Для оценки влияния терапии антирезорбтивными препаратами на предотвращение потери костной массы после отмены деносумаба необходимо продолжение исследований.
ВВЕДЕНИЕ. План управления рисками (ПУР) — важный документ для оценки и управления рисками при применении лекарственного препарата (ЛП) в составе регистрационного досье ЛП. Требования к представлению ПУР и объему информации в каждом разделе этого документа зависят от вида процедуры регистрации и типа ЛП. Экспертная систематизация требований к предоставлению этого документа, изложенных в Правилах регистрации и экспертизы лекарственных средств для медицинского применения (Решение Совета Евразийской экономической комиссии (ЕЭК) от 03.11.2016 № 78) и Правилах надлежащей практики фармаконадзора Евразийского экономического союза (Решение Совета ЕЭК от 03.11.2016 № 87), будет способствовать корректному составлению ПУР держателями регистрационных удостоверений ЛП.
ЦЕЛЬ. Анализ требований к представлению частей и модулей плана управления рисками в зависимости от типа регистрируемого лекарственного препарата в рамках регистрационных процедур Евразийского экономического союза.
РЕЗУЛЬТАТЫ. Проанализированы и систематизированы требования к разработке ПУР, к представлению/непредставлению в составе ПУР основных частей (I–VI) и модулей части II (CI–CVIII) в зависимости от типа ЛП и процедуры регистрации. Описаны принципы представления информации в трех основных разделах ПУР: спецификация по безопасности (часть II); план по фармаконадзору (часть III); план по минимизации рисков (часть V). Информация о мероприятиях по фармаконадзору и мерах по минимизации рисков для ПУР обобщена в виде графических схем. Систематизированы данные об условиях, которые необходимо учитывать при анализе и оценке информации в основных частях (I–VI) и модулях части II (CI–CVIII) ПУР.
ВЫВОДЫ. Систематизация требований Решения Совета ЕЭК от 03.11.2016 № 78 и Решения Совета ЕЭК от 03.11.2016 № 87 к представлению ПУР в составе регистрационного досье и комментарии экспертов по поводу специфики подготовки этого документа в зависимости от типа ЛП и вида регистрационной процедуры позволят повысить качество разрабатываемых ПУР и в целом уровень безопасности ЛП, разрешенных к применению на территории государств — членов Евразийского экономического союза.
ВВЕДЕНИЕ. Синдром поликистозных яичников (СПЯ) — основная причина женского бесплодия. Комбинированные оральные контрацептивы (КОК) позиционируются в клинических рекомендациях по СПЯ как препараты первой линии медикаментозного лечения. Учитывая ассоциацию СПЯ с такими клиническими нарушениями, как ожирение, сахарный диабет 2 типа, метаболический синдром, тревожные и депрессивные расстройства, повышенный риск рака эндометрия, сердечно-сосудистые заболевания, важно описать и систематизировать данные о пользе и рисках применения КОК при данном синдроме.
ЦЕЛЬ. Обзор современных данных по применению комбинированных оральных контрацептивов при СПЯ с фокусом на рациональность назначения этих препаратов, основные риски при их применении и меры минимизации этих рисков.
ОБСУЖДЕНИЕ. Гирсутизм является наиболее заметным клиническим проявлением гиперандрогении, его распространенность при СПЯ составляет 65–75%. По данным литературы, КОК, содержащие прогестагены с антиандрогенными свойствами, эффективны в лечении гирсутизма и имеют преимущество при этом состоянии по сравнению с применением только антиандрогенных препаратов. При СПЯ повышен риск рака эндометрия за счет удлинения эстроген-зависимой пролиферативной фазы. Нормализующее влияние на менструальный цикл и действие прогестагенового компонента КОК может снизить этот риск. Данные литературы о связи применения КОК с возникновением или усугублением психических расстройств при СПЯ, а также с нарушением толерантности к глюкозе, артериальной гипертензией и другими рисками развития сердечно-сосудистых заболеваний неоднозначны. В связи с тем что основной проблемой безопасности применения КОК является тромбогенность, требуется особая осторожность при назначении препаратов этой группы женщинам с СПЯ. Данные о влиянии КОК на фертильность у женщин с СПЯ ограниченны, но в литературе имеются сведения о неблагоприятном влиянии длительного приема КОК на результаты вспомогательных репродуктивных технологий.
ВЫВОДЫ. Основная польза неконтрацептивного приема КОК при СПЯ — лечение гиперандрогении, в основном гирсутизма. Для достижения эффекта длительность терапии КОК, содержащими прогестагены с антиандрогенными свойствами, должна быть не менее 6 месяцев. КОК могут также применяться для контрацепции при СПЯ. Назначение КОК при СПЯ должно быть индивидуализированным с учетом цели лечения и всех возможных рисков их применения.
КАЧЕСТВО ЛЕКАРСТВЕННЫХ СРЕДСТВ
ВВЕДЕНИЕ. Желатиновые капсулы являются незаменимой лекарственной формой для многих препаратов. Контроль качества желатиновых капсул проводят в соответствии с требованиями общей фармакопейной статьи «Капсулы» Государственной Фармакопеи Российской Федерации. В ней не предусмотрено нормирование содержания элементных примесей, поскольку по этому показателю контролируют качество исходного сырья. Однако дополнительными источниками примесей могут быть используемые при производстве желатиновых капсул оборудование и вспомогательные компоненты. Предварительный скрининг содержания элементов в желатиновой оболочке позволит оценить необходимость нормирования в них элементных примесей.
ЦЕЛЬ. Определение методом масс-спектрометрии с индуктивно-связанной плазмой элементов, вносящих наибольший вклад в контаминацию желатиновых капсул, для формирования перечня нормируемых элементов и установления пределов их содержания с позиции риск-ориентированной стратегии контроля качества лекарственных средств.
МАТЕРИАЛЫ И МЕТОДЫ. В качестве объектов исследования использованы 18 образцов твердых капсул из желатина российских и зарубежных производителей. Элементный анализ был проведен методом масс-спектрометрии с индуктивно-связанной плазмой на приборе Agilent 7900 (Agilent Technologies).
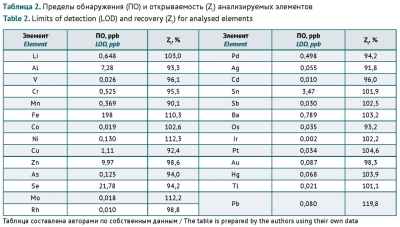
РЕЗУЛЬТАТЫ. Содержание As, Ba, Co, Cr, Cu, Li, Mo, Ni, Pb, Sb, V не превышало установленные в отечественной фармакопее значения суточных предельно допустимых концентраций элементов при пероральном поступлении лекарственного средства в организм. Элементы Ag, Au, Cd, Hg, Ir, Os, Pd, Pt, Rh, Se, Sn, Tl не были обнаружены ни в одном из образцов в установленных пределах обнаружения. Содержание Fe в 67% образцов желатиновых капсул превышало основанную на принципе безвредности предельно допустимую концентрацию этого элемента в медицинском желатине.
ВЫВОДЫ. Наибольший вклад в контаминацию желатиновых капсул вносят Al, Fe, Mn, Zn, что целесообразно учитывать при формировании перечня нормируемых элементов. Для этих элементов не установлены значения предельно допустимого суточного воздействия, что затрудняет оценку рисков их негативного воздействия при попадании в организм вместе с желатиновыми капсулами.
ISSN 2619-1164 (Online)